| dc.contributor.author | Beck, Alain | - |
| dc.contributor.author | Wagner-Rousset, Elsa | - |
| dc.contributor.author | Wurch, Thierry | - |
| dc.contributor.author | Corvaia, Nathalie | - |
| dc.date.accessioned | 2015-04-29T07:35:37Z | |
| dc.date.available | 2015-04-29T07:35:37Z | |
| dc.date.issued | 2009 | fr_FR |
| dc.identifier.citation | Beck, Alain ; Wagner-Rousset, Elsa ; Wurch, Thierry ; Corvaia, Nathalie ; Anticorps thérapeutiques et dérivés : une palette de structures pour une pléthore d’indications, Med Sci (Paris), 2009, Vol. 25, N° 12; p. 1024-1032 ; DOI : 10.1051/medsci/200925121024 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/6747 | |
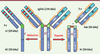
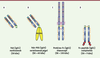
| dc.description.abstract | Les anticorps monoclonaux (Acm) et dérivés constituent la classe de principes actifs qui connaît le plus fort taux de développement actuel dans les domaines biotechnologique et pharmaceutique. En un peu plus de vingt ans, plus de 30 immunoglobulines (IgG) et dérivés ont obtenu une autorisation de mise sur le marché (AMM) dans des indications thérapeutiques très variées (oncologie, inflammation et auto-immunité, transplantation, angioplastie, hématologie, ophtalmologie, infections virales, allergie). La palette de structures comporte des anticorps murins, chimériques, humanisés et humains d’isotypes différents (IgG1, 2 et 4), ainsi que des dérivés d’IgG (immunoconjugués, radio-immunoconjugués, fragments Fab, protéines et peptides de fusion Fc, bispécifiques souris/rat). De plus, du point de vue structural, leur glycosylation dépend du système de production et peut influencer les fonctions effectrices et l’immunogénicité. À partir des connaissances actuelles des relations structure-fonction, quels formats d’anticorps est-il préférable de choisir ? Avec quels types de glycosylation ? Pour quelles indications ? | fr |
| dc.description.abstract | Monoclonal antibodies (mAb) and related-products represent the fastest growing class of therapeutics in the biotechnological and pharmaceutical industry. In just as short as 20 years, more than 30 immunoglobulins (IgG) and derivatives have been approved in a wide range of indications (oncology, inflammation and auto-immunity, transplantation, angioplasty, hematology, ophthalmology, viral infections, allergy). The mAb structure toolbox contains mouse, chimeric, humanized and human antibodies from different isotypes (IgG1, 2 and 4), as well as IgG-related products (immunoconjugates, radio-immunoconjugates, Fab fragments, Fc-fusion proteins and peptides, bispecifics). Furthermore from a structural point of view, mAb glycosylation is linked to their production systems and may impact on their effector functions and immunogenicity. Based on the current knowledge, choosing the right antibody format, isotype and glycosylation profile are some of the key issues to address early during the lead selection. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | M/S revues : Synthèse : De la conception à la production | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2009, Vol. 25, N° 12; p. 1024-1032 | fr_FR |
| dc.subject.mesh | Animaux | fr |
| dc.subject.mesh | Anticorps monoclonaux | fr |
| dc.subject.mesh | Diversité des anticorps | fr |
| dc.subject.mesh | Systèmes de délivrance de médicaments | fr |
| dc.subject.mesh | Glycosylation | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Immunoconjugués | fr |
| dc.subject.mesh | Fragments d'immunoglobuline | fr |
| dc.subject.mesh | Immunoglobuline G | fr |
| dc.subject.mesh | Souris | fr |
| dc.subject.mesh | Conformation des protéines | fr |
| dc.subject.mesh | Ingénierie des protéines | fr |
| dc.subject.mesh | Maturation post-traductionnelle des protéines | fr |
| dc.subject.mesh | Protéines de fusion recombinantes | fr |
| dc.subject.mesh | Spécificité d'espèce | fr |
| dc.subject.mesh | Relation structure-activité | fr |
| dc.title | Anticorps thérapeutiques et dérivés : une palette de structures pour une pléthore d’indications : Quel format et quelle glycosylation choisir ? Pour quelles applications ? | fr |
| dc.title.alternative | Therapeutic antibodies and related products: choosing the right structure for success | en |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Centre d’immunologie Pierre Fabre (www.cipf.com), 5, avenue Napoléon III, 74160 Saint-Julien-en-Genevois, France | fr_FR |
| dc.identifier.doi | 10.1051/medsci/200925121024 | fr_FR |
| dc.identifier.pmid | 20035674 | fr_FR |