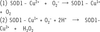| dc.contributor.author | Laliberté, Julie | - |
| dc.contributor.author | Labbé, Simon | - |
| dc.date.accessioned | 2014-08-13T07:19:14Z | |
| dc.date.available | 2014-08-13T07:19:14Z | |
| dc.date.issued | 2008 | fr_FR |
| dc.identifier.citation | Laliberté, Julie ; Labbé, Simon ; Les bases moléculaires de l’approvisionnement en cuivre, Med Sci (Paris), 2008, Vol. 24, N° 3; p. 277-283 ; DOI : 10.1051/medsci/2008243277 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/6403 | |
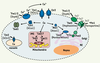
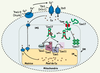
| dc.description.abstract | Le cuivre existe sous deux formes, réduite (Cu1+) ou oxydée (Cu2+), pouvant respectivement donner ou accepter un électron. En tant que cofacteur, il sert de noyau catalytique à plusieurs enzymes indispensables. Au cours des dernières années, des recherches ont clairement démontré que la levure constituait un excellent modèle pour clarifier les mécanismes moléculaires régissant l’acquisition et la distribution cellulaires du cuivre. Dans plusieurs cas, il a été établi que les protéines de cellules de mammifères ont la capacité de se substituer aux protéines de la levure, dévoilant ainsi le haut degré de conservation de ces protéines. Ces travaux ont permis d’apprendre que les transporteurs de cuivre de la famille Ctr jouent un rôle déterminant dans l’assimilation du cuivre. Une fois à l’intérieur des cellules, le cuivre est acheminé vers différentes protéines ou compartiments cellulaires. La répartition intracellulaire du cuivre s’effectue à l’aide de molécules chaperonnes qui servent d’escortes. Les protéines Ccs1, Cox17 et Atx1 assurent cette fonction. | fr |
| dc.description.abstract | Copper exists in two oxidation states, cuprous (Cu1+) and cupric (Cu2+), which, respectively, can donate or accept electrons. The fact that copper has two readily interconvertible redox states makes it a catalytic co-factor for many important enzymes. Over the past years, work in a number of laboratories has clearly demonstrated that studies in yeast have served as a springboard for identifying cellular components and processes involved in copper uptake and distribution. In several cases, it has been shown that mammalian proteins are capable of functionally replacing yeast proteins, thereby revealing their remarkable functional conservation. For highaffinity copper transport into cells, it has been shown that copper transporters of the Ctr family are required. Upon entering the cell, copper is partitioned to different proteins and into different compartments within the cell. Given the potential toxicity of copper, specialized proteins bind copper after it enters the cell and subse- quently donate the bound copper to their corresponding recipient proteins. Three copper-binding proteins, Ccs1, Cox17, and Atx1, have been identified that serve as “copper chaperones” to deliver copper. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | M/S revues | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2008, Vol. 24, N° 3; p. 277-283 | fr_FR |
| dc.subject.mesh | Adenosine triphosphatases | fr |
| dc.subject.mesh | Animaux | fr |
| dc.subject.mesh | Transport biologique | fr |
| dc.subject.mesh | Protéines de transport | fr |
| dc.subject.mesh | Transporteurs de cations | fr |
| dc.subject.mesh | Compartimentation cellulaire | fr |
| dc.subject.mesh | Cuivre | fr |
| dc.subject.mesh | Complexe IV de la chaîne respiratoire | fr |
| dc.subject.mesh | Appareil de Golgi | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Mammifères | fr |
| dc.subject.mesh | Maladie de Menkès | fr |
| dc.subject.mesh | Mitochondries | fr |
| dc.subject.mesh | Oxydoréduction | fr |
| dc.subject.mesh | Saccharomyces cerevisiae | fr |
| dc.subject.mesh | Protéines de Saccharomyces cerevisiae | fr |
| dc.subject.mesh | Schizosaccharomyces | fr |
| dc.subject.mesh | Protéines de Schizosaccharomyces pombe | fr |
| dc.subject.mesh | Superoxide dismutase | fr |
| dc.title | Les bases moléculaires de l’approvisionnement en cuivre : Leçons tirées de la levure | fr |
| dc.title.alternative | The molecular bases for copper uptake and distribution: lessons from yeast | en |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Département de Biochimie, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, 3001, 12e Avenue Nord, Sherbrooke (Québec), J1H 5N4 Canada | fr_FR |
| dc.identifier.doi | 10.1051/medsci/2008243277 | fr_FR |
| dc.identifier.pmid | 18334176 | fr_FR |