| dc.contributor.author | Foufelle, Fabienne | - |
| dc.contributor.author | Ferré, Pascal | - |
| dc.date.accessioned | 2014-08-13T07:14:36Z | |
| dc.date.available | 2014-08-13T07:14:36Z | |
| dc.date.issued | 2007 | fr_FR |
| dc.identifier.citation | Foufelle, Fabienne ; Ferré, Pascal ; La réponse UPR, Med Sci (Paris), 2007, Vol. 23, N° 3; p. 291-296 ; DOI : 10.1051/medsci/2007233291 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/6124 | |
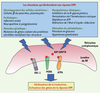
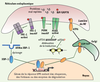
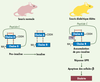
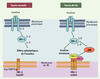
| dc.description.abstract | Le réticulum endoplasmique est le compartiment par lequel transitent obligatoirement les protéines sécrétées. Les protéines y subissent un contrôle de qualité qui les conduira soit vers l’appareil de Golgi pour être sécrétées, soit vers la dégradatio nen cas de mauvaise conformation. L’accumulation de protéines dans la lumière du réticulum endoplasmique,de nature physiologique (cellules sécrétrices) ou physiopathologique (protéines malrepliées) entraîne l’apparition d’une réponse UPR(unfolded protein response). Celle-ci se met en place à partir de l’activation de trois protéines transmembranaires du réticulum endoplasmique : PERK (PKR-like ER protein kinase), ATF6 (activatingtranscription factor 6) et IRE-1 (inositol requiring enzyme 1), et a pour but d’augmenter les capacités de repliement, de maturation, voire de dégradation du réticulum endoplasmique. La réponse UPR est une réponse physiologique qui joue un rôle majeur dans les cellules à forte capacité sécrétrice comme les plasmocytes ou les cellules β du pancréas. Des altérations dans sa qualité ou dans son intensité sont à l’origine de nombreuses pathologies humaines comme certains types de diabète ou des maladies neurodégénératives. | fr |
| dc.description.abstract | The endoplasmic reticulum (ER) is the first compartment in the secretory pathway. In the ER, proteins fold into their native configuration and are modifiedby post-translational modifications. Perturbations that alter ER homeostasis therefore disrupt folding and lead to the accumulation of unfolded proteins.These perturbations include modifications of Ca2+ homeostasis, increased demand for protein folding due to elevated synthesis of proteins in specialized cells or expression of a mutant misfolded protein. To limit accumulation of unfolded proteins, the cells have developed a specialized pathway : the unfolded protein response (UPR). UPR involves the activation of three transmembrane proteins of the ER : the PKR-like ER protein kinase (PERK), the activating transcription factor 6 (ATF6) and the inositol requiring enzyme 1 (IRE-1). The activation of all three components of the UPR depends on the dissociation of the luminal chaperone BiP/GRP78 from the luminal part of these proteins.Once activated, these pathways down-regulate protein synthesis through the phosphorylation of eiF2 (eucaryotic translation initiation factor 2) and up-regulate the transcription of genes which encode ER chaperones, protein folding enzymes and components of the ER–associated degradation system (ERAD). Growing evidences indicate that UPR signaling plays critical roles in nutrient sensing, differentiation of secretory cells such as pancreatic β cell and antibody producing plasma cells, glucose homeostasis and in the development of pathologies linked to accumulation of aggregated proteins. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | M/S revues | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2007, Vol. 23, N° 3; p. 291-296 | fr_FR |
| dc.subject.mesh | Facteur de transcription ATF-6 | fr |
| dc.subject.mesh | Animaux | fr |
| dc.subject.mesh | Apoptose | fr |
| dc.subject.mesh | Lymphocytes B | fr |
| dc.subject.mesh | Diabète | fr |
| dc.subject.mesh | Réticulum endoplasmique | fr |
| dc.subject.mesh | Endoribonucleases | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Mammifères | fr |
| dc.subject.mesh | Souris | fr |
| dc.subject.mesh | Souris knockout | fr |
| dc.subject.mesh | Modèles biologiques | fr |
| dc.subject.mesh | Chaperons moléculaires | fr |
| dc.subject.mesh | Maladies neurodégénératives | fr |
| dc.subject.mesh | Conformation des protéines | fr |
| dc.subject.mesh | Dénaturation des protéines | fr |
| dc.subject.mesh | Pliage des protéines | fr |
| dc.subject.mesh | Maturation post-traductionnelle des protéines | fr |
| dc.subject.mesh | Protein-Serine-Threonine Kinases | fr |
| dc.subject.mesh | Stress physiologique | fr |
| dc.subject.mesh | Transcription génétique | fr |
| dc.subject.mesh | eIF-2 Kinase | fr |
| dc.title | La réponse UPR : Son rôle physiologique et physiopathologique | fr |
| dc.title.alternative | Unfolded protein response: its role in physiology and physiopathology | en |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Inserm U671, Université Pierre et Marie Curie-Paris 6,UMR S671,Centre biomédical des Cordeliers, 15, rue de l’école de médecine,75270 Paris Cedex 06, France | fr_FR |
| dc.identifier.doi | 10.1051/medsci/2007233291 | fr_FR |
| dc.identifier.pmid | 17349291 | fr_FR |