| dc.contributor.author | Foretz, Marc | - |
| dc.contributor.author | Taleux, Nellie | - |
| dc.contributor.author | Guigas, Bruno | - |
| dc.contributor.author | Horman, Sandrine | - |
| dc.contributor.author | Beauloye, Christophe | - |
| dc.contributor.author | Andreelli, Fabrizio | - |
| dc.contributor.author | Bertrand, Luc | - |
| dc.contributor.author | Viollet, Benoît | - |
| dc.date.accessioned | 2014-07-03T06:50:34Z | |
| dc.date.available | 2014-07-03T06:50:34Z | |
| dc.date.issued | 2006 | fr_FR |
| dc.identifier.citation | Foretz, Marc ; Taleux, Nellie ; Guigas, Bruno ; Horman, Sandrine ; Beauloye, Christophe ; Andreelli, Fabrizio ; Bertrand, Luc ; Viollet, Benoît ; Régulation du métabolisme énergétique par l’AMPK, Med Sci (Paris), 2006, Vol. 22, N° 4; p. 381-388 ; DOI : 10.1051/medsci/2006224381 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/5761 | |
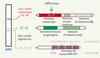
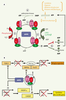
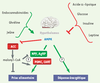
| dc.description.abstract | L’ensemble du monde vivant a développé les mécanismes nécessaires à son adaptation métabolique en réponse à des contraintes externes variables, condition essentielle de survie. Que ce soit au niveau de l’organisme entier, où toute une série de mécanismes hormonaux et neuronaux peuvent agir, ou au niveau cellulaire, siège d’une régulation métabolique fine, il est impératif de répondre de manière adéquate aux modifications de l’environnement qui visent à modifier l’équilibre énergétique. Les stress énergétiques sont variés et incluent des déficits en apport énergétique (déficit en glucose, en acides aminés, en oxygène…) et/ou des augmentations en demande énergétique (croissance, exercice sportif…). L’organisme dispose de nombreux moyens pour répondre à ces changements parmi lesquels figure la protéine kinase activée par l’AMP (AMPK, AMP-activated protein kinase), caractérisée depuis peu comme un senseur métabolique. Enzyme ubiquitaire, l’AMPK participe à la régulation coordonnée du métabolisme énergétique, de la prise alimentaire et de la sensibilité des tissus en réponse à de nombreux signaux métaboliques et hormonaux. Ces propriétés lui confèrent donc un rôle de cible pharmacologique potentielle à visée métabolique (diabète, insulinorésistance, obésité) et cardiologique (ischémie cardiaque, complications liées au diabète). | fr |
| dc.description.abstract | The 5’ AMP-activated protein kinase (AMPK) is a sensor of cellular energy homeostasis well conserved in all eukaryotic cells. AMPK is activated by rising AMP and falling ATP, either by inhibiting ATP production or by accelerating ATP consumption, by a complex mechanism that results in an ultrasensitive response. AMPK is a heterotrimeric enzyme complex consisting of a catalytic subunit α and two regulatory subunits β and γ. AMP activates the system by binding to the γ subunit that triggers phosphorylation of the catalytic α subunit by the upstream kinases LKB1 and CaMKKβ. Once activated, it switches on catabolic pathways (such as fatty acid oxidation and glycolysis) and switches off ATP-consuming pathways (such as lipogenesis) both by short-term effect on phosphorylation of regulatory proteins and by long-term effect on gene expression. Dominant mutations in the regulatory γ subunit isoforms cause hypertrophy of cardiac and skeletal muscle providing a link in human diseases caused by defects in energy metabolism. As well as acting at the level of the individual cell, the system also regulates food intake and energy expenditure at the whole body level, in particular by mediating the effects of adipokines such as leptin and adiponectin. Moreover, the AMPK system is one of the probable target for the anti-diabetic drug metformin and rosiglitazone. The relationship between AMPK activation and beneficial metabolic effects provides the rationale for the development of new therapeutic strategies. Thus, pharmacological AMPK activation may, through signaling, metabolic and gene expression effects, reduce the risk of Type 2 diabetes, metabolic syndrome and cardiac diseases. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | M/S revues | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2006, Vol. 22, N° 4; p. 381-388 | fr_FR |
| dc.subject.mesh | AMP-Activated Protein Kinases | fr |
| dc.subject.mesh | AMP | fr |
| dc.subject.mesh | Adénosine triphosphate | fr |
| dc.subject.mesh | Adipogenèse | fr |
| dc.subject.mesh | Régulation allostérique | fr |
| dc.subject.mesh | Animaux | fr |
| dc.subject.mesh | Maladies cardiovasculaires | fr |
| dc.subject.mesh | Cholestérol | fr |
| dc.subject.mesh | Diabète de type 2 | fr |
| dc.subject.mesh | Conception de médicament | fr |
| dc.subject.mesh | Ration calorique | fr |
| dc.subject.mesh | Métabolisme énergétique | fr |
| dc.subject.mesh | Activation enzymatique | fr |
| dc.subject.mesh | Acides gras | fr |
| dc.subject.mesh | Glucose | fr |
| dc.subject.mesh | Homéostasie | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Hypothalamus | fr |
| dc.subject.mesh | Lipogenèse | fr |
| dc.subject.mesh | Mammifères | fr |
| dc.subject.mesh | Metformine | fr |
| dc.subject.mesh | Modèles biologiques | fr |
| dc.subject.mesh | Complexes multienzyme | fr |
| dc.subject.mesh | Myocarde | fr |
| dc.subject.mesh | Obésité | fr |
| dc.subject.mesh | Phosphorylation | fr |
| dc.subject.mesh | Maturation post-traductionnelle des protéines | fr |
| dc.subject.mesh | Structure tertiaire des protéines | fr |
| dc.subject.mesh | Sous-unités protéine | fr |
| dc.subject.mesh | Protein-Serine-Threonine Kinases | fr |
| dc.subject.mesh | Thiazolidinediones | fr |
| dc.title | Régulation du métabolisme énergétique par l’AMPK : Une nouvelle voie thérapeutique pour le traitement des maladies métaboliques et cardiaques | fr |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Inserm U567, CNRS URM8104, Université Paris5, Institut Cochin, Département Endocrinologie, Métabolisme et Cancer, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France | fr_FR |
| dc.contributor.affiliation | Unité Hormones et Métabolisme, Institut Christian de Duve de Pathologie Cellulaire (ICP), Université catholique de Louvain 7529, avenue Hippocrate 75, 1200 Bruxelles, Belgique | fr_FR |
| dc.contributor.affiliation | Unité de Pathologie Cardio-Vasculaire, École de Médecine, Université catholique de Louvain, CARD 5550, avenue Hippocrate 55, 1200 Bruxelles, Belgique | fr_FR |
| dc.contributor.affiliation | Service d’Endocrinologie, Diabétologie, Maladies Métaboliques, Hôpital Bichat-Claude Bernard, 16, rue Henri Huchard, 75877 Paris Cedex 18, France | fr_FR |
| dc.identifier.doi | 10.1051/medsci/2006224381 | fr_FR |
| dc.identifier.pmid | 16597407 | fr_FR |