| dc.contributor.author | Capeau, Jacqueline | - |
| dc.date.accessioned | 2014-01-09T12:13:16Z | |
| dc.date.available | 2014-01-09T12:13:16Z | |
| dc.date.issued | 2003-08 | fr_FR |
| dc.identifier.citation | Capeau, Jacqueline ; Voies de signalisation de l’insuline : mécanismes affectés dans l’insulino-résistance, Med Sci (Paris), 2003, Vol. 19, N° 8-9; p. 834-839 ; DOI : 10.1051/medsci/20031989834 | fr_FR |
| dc.identifier.issn | 1958-5381 | fr_FR |
| dc.identifier.uri | http://hdl.handle.net/10608/4809 | |
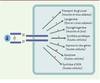
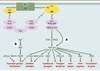
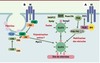
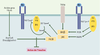
| dc.description.abstract | L’insuline joue un rôle anabolique majeur dans la mise en réserve des substrats glucidiques et lipidiques. Ses effets résultent de sa liaison à un récepteur membranaire spécifique exprimé en priorité sur ses trois tissus cibles, le foie, le muscle et le tissu adipeux. Ce récepteur possède une activité tyrosine-kinase qui permet une autophosphorylation du récepteur puis la phosphorylation sur des résidus tyrosine des protéines substats, protéines IRS (insulin receptor substrates) en priorité, et la création de complexes macromoléculaires d’activation à proximité du récepteur. Les deux voies majeures d’activation sont celles de la phosphatidylinositol-3 kinase, activant la protéine kinase B et impliquée en priorité dans les effets métaboliques, et la voie des MAP (mitogenactivated protein)-kinases, impliquée en priorité dans les effets nucléaires, la croissance et la différenciation. Cependant, l’activation d’un effet spécifique de l’insuline met fréquemment en jeu une conjonction de ces deux voies ainsi que d’autres voies intracellulaires, rendant ainsi compte de la pléiotropie et de la spécificité du signal. Le contrôle négatif du signal de l’insuline peut venir de la dégradation de l’hormone ou de la déphosphorylation du récepteur. Surtout, il va provenir de la phosphorylation de résidus sérine/thréonine sur le récepteur et les protéines IRS. Cette phosphorylation peut être activée par de nombreux acteurs impliqués en pathologie dans la résistance à l’insuline, comme un hyperinsulinisme, le TNFα (tumor necrosis factor α) ou les acides gras libres libérés en excès par le tissu adipeux et transformés dans la cellule en acylCoA (acyl coenzyme A). Un rôle délètère des molécules libérées par le tissu adipeux est proposé dans la genèse de l’insulinorésistance hépatique et musculaire présente dans le diabète de type 2, l’obésité et le syndrome métabolique. | fr |
| dc.description.abstract | Insulin has a major anabolic function leading to storage of lipidic and glucidic substrates. All its effects result from insulin binding to a specific membrane receptor which is expressed at a high level on the 3 insulin target tissues: liver, adipose tissue and muscles. The insulin receptor exhibits a tyrosine-kinase activity which leads, first, to receptor autophosphorylation and then to tyrosine phosphorylation of substrates proteins, IRS proteins in priority. This leads to the formation of macromolecular complexes close to the receptor. The two main transduction pathways are the phosphatidylinositol 3 kinase pathway activating protein kinase B which is involved in priority in metabolic effects, and the MAP kinase pathway involved in nuclear effects, proliferation and differentiation. However, in most cases, a specific effect of insulin requires the participation of the two pathways in a complex interplay which could explain the pleiotropy and the specificity of the insulin signal. The negative control of the insulin signal can result from hormone degradation or receptor dephosphorylation. However, the major negative control results from phosphorylation of serine/threonine residues on the receptor and/or IRS proteins. This phosphorylation is activated in response to different signals involved in insulin resistance, hyperinsulinism, TNFα or increased free fatty acids from adipose tissue, which are transformed inside the cell in acyl-CoA. A deleterious role for molecules issued from the adipose tissue is postulated in the resistance to insulin of the liver and muscles present in type 2 diabetes, obesity and metabolic syndrome. | en |
| dc.language.iso | fr | fr_FR |
| dc.publisher | EDK | fr_FR |
| dc.relation.ispartof | M/S Revues | fr_FR |
| dc.rights | Article en libre accès | fr |
| dc.rights | Médecine/Sciences - Inserm - SRMS | fr |
| dc.source | M/S. Médecine sciences [ISSN papier : 0767-0974 ; ISSN numérique : 1958-5381], 2003, Vol. 19, N° 8-9; p. 834-839 | fr_FR |
| dc.subject.mesh | Adipocytes | fr |
| dc.subject.mesh | Glucose | fr |
| dc.subject.mesh | Humains | fr |
| dc.subject.mesh | Insuline | fr |
| dc.subject.mesh | Insulinorésistance | fr |
| dc.subject.mesh | Mitogen-Activated Protein Kinases | fr |
| dc.subject.mesh | Muscles squelettiques | fr |
| dc.subject.mesh | Phosphatidylinositol 3-kinases | fr |
| dc.subject.mesh | Phosphorylation | fr |
| dc.subject.mesh | Récepteur à l'insuline | fr |
| dc.subject.mesh | Transduction du signal | fr |
| dc.title | Voies de signalisation de l’insuline : mécanismes affectés dans l’insulino-résistance | fr |
| dc.type | Article | fr_FR |
| dc.contributor.affiliation | Inserm U.402 et Service de Biochimie et hormonologie, Hôpital Tenon, Faculté de médecine Saint-Antoine, Université Pierre-et-Marie- Curie, 27, rue Chaligny, 75571 Paris Cedex 12, Paris, France | fr_FR |
| dc.identifier.doi | 10.1051/medsci/20031989834 | fr_FR |
| dc.identifier.pmid | 14593614 | fr_FR |