Polyhandicap
2024
II-
Clinique et prise en soins du polyhandicap
6-
Troubles de la motricité
et autres comorbidités motrices
Les troubles de la motricité (du mouvement et/ou du tonus et/ou de la posture) appartiennent à l’entité même du tableau de polyhandicap (voir chapitre « Notion de polyhandicap, mise en perspective historique et internationale »). À ce titre, la motricité de la personne polyhandicapée, à toutes les périodes de sa vie, mérite une attention particulière dans la prise en soins de réadaptation, afin de compenser les déficits moteurs primaires (pour augmenter la fonction motrice), d’éviter les déficits secondaires inhérents et de favoriser la motricité. Il s’agit souvent, dans la petite enfance, pour les parents, notamment au moment où le polyhandicap est nommé (voir chapitre « Petite enfance »), d’un enjeu thérapeutique majeur, la rééducation motrice apparaissant en effet comme essentielle pour « guérir » les troubles moteurs. Les rééducations motrices sont alors investies (voire surinvesties) par les familles, les thérapeutes, pour permettre à l’enfant de « récupérer » une fonction motrice la plus normale possible, ou tout du moins de gagner au maximum en autonomie motrice. La petite enfance et l’enfance sont alors marquées par des propositions nombreuses et diverses de thérapies motrices (à visée d’amélioration de la fonction motrice et dont toutes n’ont pas fait la preuve de leur rationnel scientifique) en lien avec le reste de la prise en soins et les différents lieux de vie. L’adolescence est, quant à elle, une période où la réalisation d’interventions thérapeutiques à visée motrice a plus à voir avec des aides à la motricité (adaptation d’aides techniques…) et des compensations (corrections de la fonction, interventions neuro-orthopédiques…), qu’avec véritablement des interventions à visée de rééducation de la fonction motrice. La rééducation motrice est alors moins fréquente, ce que déplorent parfois certains parents. La transition vers l’âge adulte est marquée par une proposition encore moins importante de thérapies motrices, et le plus souvent peu (voire pas) de rééducations à visée motrice, sont proposées à l’adulte en situation de polyhandicap.
Motricité et lésion cérébrale
Le terme motricité sous-tend « l’ensemble des fonctions biologiques qui assurent le mouvement, chez l’homme et les animaux. »
1
Dictionnaire Larousse 2005
. Le terme « mouvement » est pris ici selon son sens commun, à savoir comme une « action ou manière de se mouvoir, de déplacer le corps, une partie du corps… »
2
Dictionnaire Larousse 2005
. Un déplacement de tout ou partie du corps qui est généré par une force externe (hors gravité terrestre) à l’organisme (mouvement passivement imposé au sujet) est appelé mouvement passif. À l’inverse, un mouvement, de tout ou partie du corps, initié par une décision interne et exécuté par le sujet lui-même est appelé mouvement volontaire ou actif. Un mouvement actif peut être déclenché par un stimulus soit externe (par exemple le passage du feu au vert [stimulus] entraîne l’action de démarrer la voiture), soit interne à l’organisme. Pour générer un mouvement actif, efficace, un être humain doit maintenir une motricité posturale adéquate, développer assez de force musculaire, sélectionner les contractions volontaires des muscles, impliqués dans le mouvement, selon un schéma temporel et spatial bien établi, et permettre le relâchement des muscles antagonistes au mouvement.
En cas de lésion cérébrale ou pathologie cérébrale (quelle que soit l’origine), ces propriétés peuvent être partiellement ou totalement déficitaires (défaut de posture et/ou déficit moteur et/ou perte de sélectivité du mouvement et/ou hypertonie musculaire [spasticité]) et l’activité motrice volontaire d’un individu est alors très pénalisée, voire impossible. De plus, la tenue debout (voire assise), contre la pesanteur, peut être impossible, entraînant pour l’individu une immobilité relative, voire l’équivalent d’une apesanteur subie du fait de l’alitement important. Si la lésion cérébrale intervient tôt dans la vie de l’enfant (comme dans le cas du polyhandicap ; voir chapitre « Notion de polyhandicap, mise en perspective historique et internationale »), la croissance et le développement musculo-squelettique de ce dernier pourront être pénalisés (par l’absence de mouvement, l’immobilité, l’absence de pesanteur, la faiblesse musculaire, l’hypertonie…) avec des anomalies osseuses, musculaires, articulaires, et des déformations orthopédiques, etc. pénalisant alors la motricité et le fonctionnement de l’individu.
Le polyhandicap via le prisme de la Classification internationale du fonctionnement, du handicap
et de la santé
Cadre conceptuel
La Classification internationale du fonctionnement (CIF), initialement décrite en 2001 par l’Organisation mondiale de la santé (OMS), est un cadre conceptuel, via une approche bio-psychosociale, décrivant le fonctionnement humain, et définissant le handicap comme la résultante des interactions entre les caractéristiques mentales, physiques et fonctionnelles propres à l’individu, et les caractéristiques de l’environnement dans lequel celui-ci vit (OMS, 2001

). Ce cadre a été développé en 2007 pour les enfants et les adolescents (CIF-EA). Depuis 2012, le même cadre est utilisé pour les enfants et les adultes (OMS, 2012

).
Ce cadre définit notamment les notions : « – [de] déficiences [qui] désignent des problèmes dans la fonction organique ou la structure anatomique, tels qu’un écart ou une perte importante ; – [d’] activité [qui] désigne l’exécution d’une tâche ou d’une action par une personne ; – [de] limitations d’activité [qui] désignent les difficultés que rencontre une personne dans l’exécution d’activités ; – [de] participation [qui] désigne l’implication d’une personne dans une situation de vie réelle ; – [de] restrictions de participation [qui] désignent les problèmes qu’une personne peut rencontrer dans son implication dans une situation de vie réelle ; – [de] facteurs environnementaux [qui] désignent l’environnement physique, social et attitudinal dans lequel les gens vivent et mènent leur vie. » (OMS, 2001

). On peut ajouter deux notions importantes pour la suite de ce chapitre, à savoir, la notion de déficit primaire qui est directement lié au problème de santé (ex. : le déficit moteur après une lésion cérébrale est un déficit primaire) et la notion de déficit secondaire qui est la conséquence du déficit primaire (ex. : une déformation articulaire dans les suites d’un déficit moteur primaire).
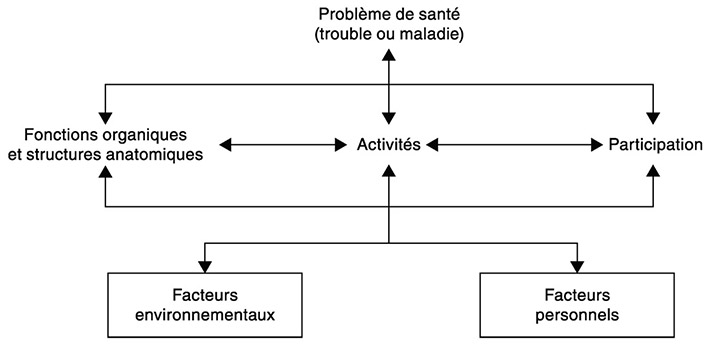
À partir de ce cadre, et selon la figure 6.1

, emprunté de l’OMS (OMS, 2001

) « le fonctionnement d’une personne dans un domaine particulier est déterminé par l’interaction […] entre le problème de santé de la personne et les facteurs contextuels (c’est-à-dire les facteurs environnementaux et personnels). Il y a interaction dynamique entre ces entités : des interventions sur l’une d’elles peuvent modifier une ou plusieurs autres. ».
Aussi, le handicap peut être perçu : i) soit comme une conséquence directe d’un problème de santé, et à ce titre nécessitant des soins visant la guérison (c’est-à-dire la récupération) ou l’adaptation de l’individu handicapé (modèle médical du handicap). Les soins médicaux ou de rééducations apparaissent alors comme prioritaires pour traiter le handicap ; ii) soit comme généré par la société (modèle social du handicap) et l’environnement social de l’individu. Des mesures en termes d’action sociale, de changements environnementaux sont alors nécessaires pour que les personnes en situation de handicap participent à la vie sociale dans tous ses aspects. Loin d’opposer ces deux visions apparemment antagonistes, la CIF permet d’intégrer ces deux visions qui offrent un cadre de lecture pour la prise en soins du polyhandicap, notamment ici dans ce chapitre sur le versant de la motricité.
En rapportant le périmètre du polyhandicap tel que les contours ont été précisés dans ce présent rapport (voir chapitre « Notion de polyhandicap, mise en perspective historique et internationale ») à ce cadre de lecture proposé par la CIF (figure 6.1

), et en lien avec le domaine moteur, le problème de santé initial est le « désordre, anomalie ou lésion survenue sur un cerveau en développement ou immature » alors que le déficit primaire est une « déficience motrice évaluée comme sévère » directement lié à l’anomalie cérébrale (défaut de force, perte de sélectivité, spasticité…). L’enfant grandissant autour de ces déficits moteurs sévères (immobilité relative), en l’absence relative de pesanteur, des déficits secondaires peuvent se rencontrer comme des déformations neuro-orthopédiques (scoliose, luxation de hanches, douleurs…). Ces déficits secondaires peuvent se surajouter aux déficits moteurs primaires et pénaliser ainsi la motricité volontaire. Aussi, les limitations d’activités (en lien avec la motricité) ici concernent une « réduction extrême de l’autonomie et de la mobilité » et une dépendance à une tierce personne pour les activités motrices (déplacements, actes moteurs de la vie quotidienne).
Principes et leviers de la prise en soins à visée motrice du polyhandicap dans le cadre conceptuel de la Classification internationale du fonctionnement, du handicap et de la santé
La prise en soins devrait avoir pour objectif de permettre à la personne polyhandicapée (enfant/adulte) et à sa famille d’atteindre ses/leurs objectifs « réalistes » (en conformité avec l’évaluation médicale/paramédicale des activités de la personne et de ses objectifs), afin de permettre une participation sociale et une qualité de vie liée à la santé aussi bonne que possible pendant l’enfance et à l’âge adulte. Sur le versant moteur, les interventions thérapeutiques devraient avoir pour objectifs de favoriser le mouvement (pour une amélioration de l’activité motrice) et la motricité volontaire (amélioration des déficits primaires), tout en évitant l’immobilité (pour éviter/prévenir les déficits secondaires).
Les thérapies pourraient ainsi se décliner, sans lien de causalité ni lien hiérarchique, sur plusieurs niveaux d’interventions. Dans un premier niveau interviendraient les traitements curatifs (thérapie génique, cellules souches…) de la lésion cérébrale (agent causal du tableau de polyhandicap), tandis qu’un deuxième niveau serait la rééducation des déficits moteurs primaires (déficit musculaire, spasticité…) pour diminuer ces déficits via un apprentissage moteur. Un troisième niveau serait la prévention de la survenue des déficits secondaires (rétraction musculaire, déformation squelettique, douleurs, limitations d’amplitudes articulaires…). Enfin, un quatrième niveau représenterait un niveau d’intervention directe sur les activités motrices (déplacements, actes de la vie quotidienne…) via des adaptations, des aides techniques et autres innovations technologiques. Ces interventions prennent en compte et impliquent les facteurs d’environnement de la personne polyhandicapée.
Ces interventions proposées, à chaque niveau, doivent être les plus rationnelles possibles scientifiquement parlant. L’analyse de la littérature scientifique sur la motricité et le polyhandicap sera l’objet de la suite de ce chapitre.
Méthodologie d’analyse de la littérature
En se limitant à des mots clés trop restrictifs (ex. :
multiple disabilities, PIMD), il est apparu rapidement qu’un pan entier de la littérature sur les interventions motrices n’était pas disponible et nous avons ajouté les mots clés suivants : «
Severe Cerebral Palsy » et «
interventionAND cerebral palsy [evidence based] ». En effet, le champ des interventions motrices dans la paralysie cérébrale (définie comme un trouble moteur permanent liée à la présence d’une lésion cérébrale non progressive, intervenue avant l’âge de 2 ans, sur un cerveau en cours de développement ; Chabrier et coll., 2020

) est plus développé (Novak et coll., 2020

) et peut par certains aspects être pertinent dans le cadre de la rééducation motrice du polyhandicap, notamment pour les enfants (personnes) avec polyhandicap. Les personnes avec paralysie cérébrale se voient caractérisées, notamment, selon leur possibilité motrice globale en 5 niveaux (appelés
Gross Motor Function Classification System : GMFCS) (Palisano et coll., 1997

). Les niveaux IV et V sont les niveaux où les enfants sont les plus dépendants dans leur motricité globale. Les enfants (et adultes) caractérisés par le niveau GMFCS IV sont dépendants d’aides techniques motorisées pour se déplacer. Les enfants caractérisés par le niveau GMFCS V n’ont pas d’autonomie de déplacement et sont dépendants totalement d’une aide humaine (tierce personne) pour les actes moteurs. Aussi, lors de notre analyse des interventions motrices chez la personne avec paralysie cérébrale, nous avons particulièrement été attentifs aux interventions réalisées pour les personnes caractérisées par les niveaux GMFCS IV et V, se rapprochant plus de la situation motrice de la personne polyhandicapée.
Après l’analyse de la littérature disponible, nous avons pu classer les différentes actions thérapeutiques ainsi : les interventions pour améliorer/favoriser la motricité (rééducation du déficit moteur primaire) et/ou l’activité de locomotion/préhension, les interventions pour prévenir et/ou traiter les déficits secondaires notamment neuro-orthopédiques, et les interventions pour « traiter » la lésion cérébrale et/ou la maladie causale au tableau de polyhandicap.
Déficit primaire
Comment favoriser la motricité ?
Programmes de thérapie motrice
Les programmes de thérapie motrice peuvent être définis comme des programmes qui comportent des stratégies ou actions visant à favoriser, faciliter, l’engagement actif des participants dans des actes moteurs (
motor activation). Toutefois, ces actions sont parfois peu proposées aux personnes polyhandicapées et van der Putten (van der Putten et coll., 2017

) a montré chez 58 personnes (de 11 à 63 ans) que plus de la moitié d’entre elles n’étaient même pas engagées dans une seule activité motrice par jour en semaine (par exemple encourager quelqu’un à jouer avec un mobile, manipuler des objets…) et que peu de propositions d’engagement actif dans les activités motrices leur étaient proposées (en moyenne 1,5 activité par jour). Lorsque des activités motrices sont proposées, ce sont plutôt des activités dites passives (sans participation d’une motricité active de la personne) comme des stimulations multi-sensorielles ou des massages (alors même qu’il n’existe aucune preuve scientifique sur l’intérêt des massages pour favoriser la motricité ; Chan et Chien, 2017

). Aussi, les activités d’engagement moteur sont peu intégrées dans le quotidien des personnes avec polyhandicap, et les activités de loisirs sont surtout passives comme regarder la télévision ou écouter de la musique. Quand les programmes moteurs sont intégrés dans le quotidien, il apparaît que les interventions motrices réalisées ont peu (voire pas) de rationnel scientifique (il s’agit le plus souvent d’interventions non fondées sur les preuves d’efficacité [
evidence-based medicine]).
Dans une étude, Bossink et collaborateurs (2017

) ont cherché à montrer l’effet d’une rééducation motrice via des exercices moteurs assistés (
power-assisted exercice) chez des personnes polyhandicapées (moyenne d’âge de 32 ans, allant de 4 à 60 ans, 25 hommes) (Bossink et coll., 2017

). Le programme comprenait des exercices moteurs assistés trois fois par semaine pendant 20 semaines chez 19 sujets, les résultats étaient comparés avec un groupe contrôle (n = 18 sujets) qui recevait des soins dit habituels. Les résultats de cette recherche illustrent bien notre propos : en effet, les auteurs montrent qu’un protocole de recherche clinique de bonne qualité méthodologique est faisable/réalisable chez des personnes polyhandicapées, que des exercices musculaires assistés sont réalisables dans cette population (s’ils sont bien adaptés aux capacités de l’individu). Les participants ont ainsi validé au moins 81,5 % des sessions de rééducation. De façon surprenante, le seul résultat, statistiquement significatif, d’amélioration après un tel programme, était l’amélioration de la saturation, mesurée par un oxymètre, en oxygène du sang de 90,9 % à 96,3 % à la fin de l’intervention, sans que l’on trouve de réelles explications à cela. Pour les auteurs, d’autres études de plus grande échelle sont nécessaires pour généraliser et recommander ce type d’intervention.
D’autre part, en 2017, a été publié au Québec (Canada) un rapport (Lehoux, 2017

) visant à évaluer les interventions, notamment motrices, ayant démontré un effet auprès des enfants polyhandicapés (de 0 à 21 ans). Vingt-huit articles scientifiques, à propos d’interventions diverses (incluant de 1 à 44 participants polyhandicapés, âgés de 1 an à 52 ans) ont été retenus dans ce rapport. Dix-huit articles étaient à propos de 1 cas rapporté (
single case study). Seules 7 études (participants âgés de 1 à 20 ans) ciblent spécifiquement l’amélioration de la motricité (manipulation ou locomotion), et décrivent 6 interventions différentes. Brièvement, parmi ces interventions, on note, qu’une vise à l’utilisation d’une souris d’ordinateur adaptée à l’enfant (et dans une autre étude par la même équipe, une manette de console de jeux Wii à la place de la souris) pour pointer une cible dans l’écran et/ou corriger la posture de tête (Shih et Shih, 2009

; Shih et Shih, 2010

; Shih et coll., 2011

). Une autre étude (Su et coll., 2013

) vise à l’évaluation d’un protocole de marche sur tapis roulant utilisant un harnais pour soutenir le poids du corps (30 % du poids du corps) sur des séances de 25 minutes, deux fois par semaine. Les auteurs n’ont pas pu conclure à l’efficacité d’un tel entraînement. Par ailleurs, à la lecture de l’article, et concernant les 10 sujets inclus dans cette étude, on peut se poser légitiment la question de la représentativité des personnes polyhandicapées (selon le périmètre de cette expertise) dans cet échantillon. Il apparaît que les sujets inclus ne semblent pas correspondre aux critères du polyhandicap que nous retenons, aussi ce dispositif ne semble pas adapté aux personnes polyhandicapées dans le but d’améliorer la locomotion via la marche. Un autre programme d’intervention à visée motrice est analysé dans ce rapport, il s’agit d’un programme de plusieurs interventions nommé
Mobility Opportunities Via Education (MOVE) (van der Putten et coll., 2005

) dont l’objectif est d’améliorer l’autonomie des enfants (via des habiletés fonctionnelles). Les interventions motrices sont intégrées à la routine quotidienne de l’enfant et le rôle des professionnels encadrant celui-ci, est d’encourager l’enfant polyhandicapé à être le plus actif possible sur le plan de ces mouvements. Ce programme semble pouvoir améliorer pour certains enfants la capacité à réaliser des mouvements de façon indépendante (ce qui représente un résultat clinique pertinent), mais les auteurs notent que les enfants ne répondent pas tous de la même façon à ce programme. De plus, une seule étude a évalué l’efficacité clinique du programme MOVE, ce qui ne permet pas d’étendre et de généraliser ce type de programme de rééducation motrice aux enfants avec polyhandicap. Les preuves scientifiques ne sont pas suffisantes pour recommander ce programme et d’autres expérimentations et développements sont nécessaires. Un autre programme (projet
Driving to learn)
3
Nilsson L. Driving to Learn. 2015. Tiré de http://www.lisbethnilsson.se/en/publications/
(Nilsson et Nyberg, 2003

) que nous décrivons ici, vise la manipulation autonome d’un fauteuil roulant motorisé adapté à chaque participant en situation de polyhandicap. L’étude longitudinale rapporte que 8 participants sur 45 ont atteint un niveau de contrôle indépendant de la direction du fauteuil roulant et que 33 ont atteint un certain contrôle. Cette étude démontre que l’efficacité du programme est favorisée avec la présence permanente d’un thérapeute aux côtés de l’enfant pour l’apprentissage du contrôle du fauteuil roulant donnant des rétrocontrôles réguliers (
feedback) ainsi que des séances d’entraînement de plus de 30 minutes échelonnées sur plusieurs mois.
D’autres équipes (Stasolla et Caffò, 2013

) utilisent des micro-rupteurs (ou commutateurs miniatures), dans des programmes de thérapie motrice, pour faciliter la locomotion ou la manipulation d’objets. Ces micro-rupteurs sont utilisés soit comme des aides techniques facilitant la manipulation ou comme donnant un
feedback lors de l’acte moteur ou encore comme incitation à interagir. Ainsi, ces derniers permettent d’encourager la personne à s’engager dans l’acte moteur en apportant des éléments motivationnels potentiels. Les données, disponibles dans la littérature, concernant l’utilisation de micro-rupteurs chez les personnes polyhandicapées, sont rares et concernent surtout des études de cas unique, mais on peut souligner que l’intérêt de ces dispositifs réside dans l’incitation ou la stimulation pour l’individu à s’engager dans un acte moteur en permettant la production d’incitations et de
feedback (ou rétrocontrôle) à l’action engagée, gratifiant ainsi l’action du sujet. Il est intéressant ici de mentionner un cas rapporté dans la littérature (Shih et Shih, 2009

) à propos d’un enfant polyhandicapé de 10 ans qui a bénéficié de 3 séances réalisées à la maison de 30 minutes d’entraînement à la manipulation de trois souris d’ordinateurs modifiées et adaptées spécifiquement aux capacités motrices de l’enfant. Lors des séances, un thérapeute (aide humaine) accompagne, soutient physiquement les différents mouvements de l’enfant pour permettre à celui-ci de manipuler, d’interagir avec les souris, pendant que l’écran d’ordinateur incite verbalement l’enfant à s’engager dans l’activité de pointage. Pendant l’action, un
feedback sur l’écran est aussi produit. Au bout d’une longue période de pratique, et à l’issue de cette intervention, l’enfant a amélioré significativement ses performances de pointage. À partir d’un cas, il est difficile de retenir et de généraliser cette intervention, mais les différents cas rapportés dans la littérature (via l’utilisation de micro-rupteurs ou de souris adaptées) illustrent que l’entraînement selon les principes de l’apprentissage moteur (répétition du geste, du plus simple au plus complexe, avec la présence de
feedback implicite et explicite, sur une longue période) peut s’appliquer chez l’individu avec polyhandicap, en tenant compte des capacités motrices et cognitives du sujet.
Quelles conditions pour une efficacité des programmes
de thérapie motrice ?
En lien avec les études disponibles et analysées, il est difficile de diffuser et recommander largement les programmes de rééducation motrice spécifiquement décrits pour les personnes polyhandicapées, du fait d’un manque de preuve formelle. Toutefois, les interventions motrices décrites ci-dessus, montrent que le déficit moteur primaire n’est pas uniquement travaillé per se, mais bien dans des activités motrices plus globales (manipulation par exemple) avec des objectifs précis et intégrés dans un quotidien. Il existe une intrication forte entre travail de la motricité (activité) et travail de l’activité motrice (déficit) qui est (ou doit être) l’objectif d’une rééducation motrice de la personne polyhandicapée. Les points communs aux différentes interventions proposées, et qui semblent pertinents pour permettre une amélioration de la fonction motrice (en lien avec l’apprentissage moteur) sont : i) une adaptation des outils aux capacités réelles de chaque individu, notamment une adaptation des outils technologiques (nécessitant donc une expertise technologique) ; ii) la présence de rétrocontrôle permanent lors de l’action, impliquant que ce feedback soit donné par un outil technologique, soit par le thérapeute ; iii) la présence en permanence lors de l’acte moteur d’un ou deux thérapeutes pour favoriser le geste ; iv) l’expertise du thérapeute par rapport aux principes de la rééducation motrice (et apprentissage moteur) ; v) l’engagement actif de l’individu polyhandicapé ; vi) la réalisation de séances de 30 minutes (ou 10 à 30 minutes) 3 à 5 fois par semaine sur une longue période (parfois plusieurs mois). Les conditions de « succès » de la thérapie motrice semblent être en lien avec la motivation du thérapeute à engager l’individu dans la tâche motrice, mais aussi la motivation et la capacité d’engagement de l’individu polyhandicapé dans la tâche, le plaisir qu’il a à faire l’action (gratification de l’action), son endurance, sa capacité à comprendre (notamment les liens de causalités motrices), sa capacité à maintenir son attention.
Il faut noter que le « dosage » et le calendrier optimal de thérapies spécifiques sont un domaine de recherche émergent.
Au regard des éléments qui devraient constituer les « ingrédients » scientifiquement validés d’une rééducation motrice, et en lien avec la médecine fondée sur les preuves (
evidence-based), van Alphen et collaborateurs (2019

) proposent une revue critique, via un questionnaire en ligne distribué aux professionnels prenant en soin des personnes polyhandicapées, de ce qui est proposé comme intervention motrice aux Pays-Bas (van Alphen et coll., 2019

). Cent dix-huit interventions ont été décrites par les thérapeutes comme « interventions motrices », 17 ont été retenues par les auteurs comme de véritables interventions motrices, parmi lesquelles 4 programmes moteurs ont été identifiés comme potentiellement bénéfiques : exercices moteurs actifs assistés (
power-assisted exercices) (Bossink et coll., 2017

), exercices moteurs aquatiques (balnéothérapie), des thérapies par le mouvement rythmique, et des programmes quotidiens intégrant des activités motrices où un engagement actif, même minime, de l’individu est répertorié. Toutefois, les auteurs soulignent que les 17 interventions retenues sont peu décrites dans leur contenu et que seules 12 interventions semblent avoir un rationnel théorique à l’utilisation de telle intervention motrice (notamment à la lumière des « ingrédients » de l’apprentissage moteur nécessaire à une rééducation motrice). Aucune intervention sur les 17 n’a pu fournir la preuve de son efficacité clinique (en termes d’amélioration de la fonction motrice) dans la littérature disponible.
De façon générale, il apparaît que les interventions motrices proposées aux personnes polyhandicapées, sont le plus souvent les mêmes, voire dérivées, de ce qui est proposé aux personnes avec paralysie cérébrale, notamment pour les enfants. Ainsi en élargissant la recherche bibliographique aux preuves des interventions chez les personnes avec paralysie cérébrale de niveaux GMFCS IV-V, il apparaît aussi un manque criant de recherche spécifique à cette population avec une paralysie cérébrale sévère (et c’est d’autant plus vrai qu’il s’agit d’adultes) (Lai et coll., 2021

). Très peu d’études sont donc disponibles, alors que l’on peut penser que ce type d’interventions pourraient avoir un effet bénéfique chez l’individu polyhandicapé par analogie avec les effets retrouvés de telles thérapies chez les personnes caractérisées par les niveaux GMFCS I-III. Des revues de la littérature systématiques (Novak et coll., 2013

) (remises à jour régulièrement) existent bien quant à l’efficience de telles interventions motrices. Mais depuis 2013, il apparaît que, et malgré les conclusions de chaque étude qui poussent à développer la recherche chez les personnes sévèrement handicapées («
severe cerebral palsy »), peu, voire pas d’études cliniques, ont été réalisées spécifiquement chez les enfants caractérisés par les niveaux GMFCS IV-V, rendant difficiles les conclusions quant à l’efficience des interventions motrices chez ces derniers. Toutefois, à partir de ces revues de la littérature, quelques conclusions peuvent être tirées, et il est possible de conclure à l’inefficience (dans le but de l’amélioration de la fonction motrice) de certaines interventions comme les thérapies neurodéveloppementales (celles du type Bobath, Wojta, Padovan ou autres thérapies conductives…) ou les thérapies de type oxygénothérapie hyperbare. De façon générale, les interventions motrices avec peu voire pas d’engagement actif du participant dans la rééducation motrice, sans objectif précis, doivent être abandonnées. Ces éléments ont été repris dans les recommandations récentes de l’HAS (HAS, 2021

). Ainsi, certaines thérapies à visée d’amélioration de la fonction motrice pourraient/devraient être abandonnées pour la rééducation motrice de la personne polyhandicapée.
Devant l’absence d’étude clinique de grande ampleur quant à l’efficience des interventions motrices, certains auteurs (Jackman et coll., 2022

), en lien avec des arguments existants quant à la plasticité cérébrale (et les moyens de la favoriser) et aux éléments d’apprentissage moteur, proposent, pour qu’une intervention ait une probabilité d’être efficace sur le plan de l’amélioration de la fonction motrice, que celle-ci soit dirigée vers un objectif précis, atteignable/réalisable (par exemple appuyer sur un contacteur), avec un engagement actif du participant et la présence de thérapeutes pour apporter des
feedbacks et de la gratification. Ces interventions doivent s’inscrire dans le temps et être régulières.
Critères d’efficacité potentielle des interventions motrices
Les interventions motrices potentiellement efficientes se définissent donc ainsi :
1. Des objectifs concrets sont fixés avec la famille et le patient si possible ;
2. Les cliniciens déterminent les facteurs qui limitent la personne dans l’accomplissement de l’objectif (spasticité, faiblesse musculaire, troubles cognitifs…) ;
3. Les interventions proposées sont dirigées directement vers le but à atteindre ;
4. Elles sont motivantes, plaisantes, ludiques, adaptées au contexte du polyhandicap ;
5. La mise en pratique des objectifs a lieu dans l’environnement habituel de l’enfant (familial ou communautaire) ;
6. Les interventions sont centrées sur les besoins de l’individu polyhandicapé et quand il s’agit d’un enfant aussi en lien avec les besoins des parents ;
7. Elles sont suffisamment longues en termes de temps et suffisamment fréquente en termes de périodicité pour atteindre les objectifs (séances de 30 minutes [ou 10 à 30 minutes] 3 à 5 fois par semaine sur plusieurs mois) ;
8. Elles sont accompagnées par de l’innovation technologique ;
9. Elles sont menées par des thérapeutes connaissant les principes de la rééducation motrice et le polyhandicap.
Il semble important de signaler que chaque individu polyhandicapé doit pouvoir être considéré comme capable d’apprentissage moteur, même avec des objectifs jugés comme minimes. Aussi, il doit être proposé des thérapies motrices, intégrées dans la vie quotidienne de la personne pour favoriser, tant que faire se peut, les habiletés motrices, avec comme objectifs prioritaires la manipulation ou la locomotion. Doivent être mises en œuvre des stratégies favorisant l’engagement actif des individus polyhandicapés, en permettant à ceux-ci d’avoir des feedbacks par les thérapeutes mais aussi par les outils technologiques. Pour proposer de telles interventions, une évaluation personnalisée des capacités (pas uniquement motrice) de l’individu polyhandicapé par une équipe clinicienne pluri-professionnelle experte dans le polyhandicap et l’accès aux technologies innovantes, individualisées à la personne, sont primordiaux. Dans ce sens, chaque individu doit pouvoir bénéficier d’une évaluation individuelle, régulière, par des équipes expertes dans la rééducation motrice mais aussi ayant une expertise en technologie. Les programmes d’interventions motrices doivent être pensés, conçus, sur les principes d’apprentissage moteur et via les adaptations technologiques existantes et/ou à développer spécifiquement pour le polyhandicap, par des équipes de cliniciens mais aussi d’ingénieurs. Enfin, des études en recherche clinique, de grande ampleur, doivent pouvoir être mises en place pour évaluer l’impact fonctionnel des thérapies motrices et/ou des aides technologiques proposées, spécifiquement chez l’individu polyhandicapé.
Comment lutter contre les mouvements anormaux
et/ou la spasticité ?
Comme dit en introduction de ce chapitre, et comme rappelé dans la partie ci-dessus, la fonction motrice d’un individu polyhandicapé peut être pénalisée par une faiblesse musculaire, mais aussi par une difficulté à détendre les muscles antagonistes (spasticité) ou par des mouvements parasites ou anormaux, compliquant alors la réalisation par l’individu d’actes moteurs. Aussi, il apparaît important pour certains individus polyhandicapés, et comme adjuvant aux thérapies à visée motrice pure (voir ci-dessus), de traiter conjointement ces mouvements anormaux (intitulés ici sous le vocable dyskinésie) ou cette spasticité, dans l’objectif de faciliter l’exécution du mouvement (Bekteshi et coll., 2023

). Les modalités des traitements de ces anomalies motrices ne sont pas spécifiques à la personne polyhandicapée, et certaines données dans la littérature hors polyhandicap peuvent être utiles pour renseigner sur les traitements possibles qu’ils soient médicamenteux ou chirurgicaux.
Aussi, concernant la spasticité, en fonction du critère diffus (spasticité généralisée) ou focal (distribué à peu de muscle) de celle-ci, plusieurs traitements peuvent être proposés (Novak et coll., 2020

; Kudva et coll., 2021

). Il est important de noter ici que la spasticité sera traitée si et seulement si elle apparaît comme gênante pour la fonction motrice ou comme pénalisante pour la croissance de l’appareil locomoteur (cf. ci-dessous, prévention des déficits secondaires) ou pénalisant la qualité de vie (par des douleurs notamment). Cette partie n’est pas une revue exhaustive de ce qui peut être proposé. Toutefois, on notera que dans le cadre du polyhandicap, et en cas de spasticité focale, l’injection intramusculaire de toxine botulique permet la diminution de la spasticité (Bekteshi et coll., 2023

). Il paraît aussi intéressant de mentionner et de discuter des traitements chirurgicaux de la spasticité généralisée, qui ces dernières années, ont beaucoup animé la communauté médicale mais aussi les familles. La radicellectomie (ou en anglais
Single Root Dorsal Rhizotomy) des voies sensitives postérieures peut être proposée aux enfants polyhandicapés. Cette intervention neurochirurgicale, définitive, de la spasticité diffuse des membres inférieurs, a montré, dans une revue de la littérature de 1 016 patients (non uniquement polyhandicapés) (Kudva et coll., 2021

), une relative efficacité quant à la diminution de la spasticité de 0,12 à 2,6 points (SD
4
± 1,3) sur l’échelle d’Ashworth avec une amélioration des performances motrices mesurée sur une échelle de motricité globale (GMFM-66 :
Gross Motor Function Measure-66) de plus de 6,5 points (SD ± 5,9) à 12,1 points (SD ± 18,9). Si la radicellectomie semble efficace pour le traitement de la spasticité, il reste à bien définir l’âge optimal d’intervention, la technique neurochirurgicale à préconiser, et le programme de rééducation à l’issue de cette intervention. Les effets bénéfiques de cette intervention ont été décrits dans le cadre de la spasticité, et non dans le cas des dyskinésies. Une autre intervention neurochirurgicale, consistant à la mise en place d’un dispositif à libération intrathécale de baclofène (dit pompe à baclofène), existe pour lutter contre la spasticité avec un effet sur la spasticité des membres inférieurs et supérieurs. Ce dispositif est un traitement non définitif de la spasticité. Sur 321 patients (non exclusivement polyhandicapés) traités par baclofène intrathécal, une revue de la littérature (Kudva et coll., 2021

) montre une efficacité sur la spasticité allant de moins 1,2 point (SD ± 0,72) à 2,32 points (SD ± 0,39) sur l’échelle d’Ashworth, avec une amélioration des performances motrices globales mesurée sur l’échelle GMFM-66 de 1,2 point (SD ± 2,3) à 4,6 points (SD ± 10,6). Cette amélioration s’accompagne de celle de l’atteinte des objectifs personnels notamment de soins de
nursing et autres soins (faciliter l’habillage, positionnement, diminution des douleurs…). Il faut noter que 95 % des individus traités par baclofène intrathécal sont caractérisés par les niveaux GMFCS IV et V (82 % avec une forme spastique bilatérale) et que 3 à 4 % des enfants avec paralysie cérébrale (0,4 à 4,7 % selon les pays) ont un traitement par ce dispositif (Motta et coll., 2007

). Concernant ce traitement, une question existe quant à la décompensation potentielle de scoliose après implantation d’une pompe à baclofène chez les individus caractérisés par les niveaux GMFCS IV et V (Lee et coll., 2023

), cet élément doit être surveillé et évalué.
Les stratégies thérapeutiques de la spasticité (traitement médicamenteux, implantation de pompe à baclofène intrathécal, ou encore réalisation de radicellectomie… voire abstention de traitement de la spasticité) nécessitent que les équipes prenant en soin les personnes polyhandicapées soient expertes dans le maniement des médicaments ou dans la procédure du geste à réaliser (expertise neurochirurgicale notamment) mais aussi dans l’évaluation de la spasticité et son traitement. Plus généralement, les équipes doivent pouvoir évaluer la fonction motrice (dans l’ensemble de ces composantes naturellement intriquées : force motrice, sélectivité du mouvement, spasticité et autres dyskinésies, état de l’appareil locomoteur…) des personnes polyhandicapées dans l’ensemble de ses aspects. Cette relative complexité d’évaluation, d’analyse et de procédure thérapeutique rend probablement peu accessibles ces traitements à l’ensemble des personnes polyhandicapées. Il en est de même pour le traitement médical ou chirurgical (par stimulation profonde), des mouvements anormaux (dyskinésie), traitements qui ont pourtant montré leur efficacité dans certains cas (Koy et coll., 2016

). En effet, malgré l’existence de nombreuses recommandations pour le traitement de ces anomalies motrices (Koy et coll., 2016

), ces traitements peuvent être méconnus des équipes voire mal utilisés, rendant difficile l’accès à ce type de traitement pour les individus polyhandicapés.
Limitations de l’activité motrice : comment favoriser le mouvement (exemple de la déambulation) ?
Les programmes de thérapie motrice doivent permettre l’accomplissement d’objectifs moteurs précis, préalablement établis (comme manipuler un
joystick…). Le plus souvent, les objectifs moteurs sont fixés en termes d’activité motrice (au sens de la CIF, cf. plus haut) comme la déambulation, ou la préhension, et moins en termes de déficit (comme améliorer la force de préhension). Certains programmes sont alors conçus, orientés vers l’activité motrice plus que vers le déficit moteur. Toutefois, la rééducation motrice de la personne polyhandicapée doit intégrer la motricité dans tous ses aspects (du déficit à l’activité) et dans le programme quotidien de la personne. L’étude de Rosenberg et coll. (2021

) illustre bien ces aspects (Rosenberg et coll., 2021

). Il s’agit d’une étude pilote de faisabilité d’un stage estival de rééducation motrice dont l’objectif est l’apprentissage de la déambulation autonome en fauteuil roulant. Cinq adolescents avec une « paralysie cérébrale sévère » (
severe cerebral palsy) (âgés de 11 à 15 ans) ont bénéficié pendant 3 semaines consécutives (à raison de 5 jours par semaine) d’interventions motrices avec pour objectif l’apprentissage de la déambulation autonome en fauteuil roulant électrique. L’intervention thérapeutique était menée par un ergothérapeute expert en polyhandicap et en apprentissage moteur, assisté de 5 thérapeutes (5 étudiants en ergothérapie) pour permettre un ratio d’un thérapeute pour un enfant. Dans un premier temps, chaque adolescent avait un fauteuil roulant électrique adapté au niveau de l’assise pour garantir le meilleur positionnement possible de l’individu dans le fauteuil. Ensuite, le meilleur mode de manipulation du fauteuil était déterminé, certaines modifications technologiques pouvaient même être apportées à la commande (
joystick à la main pour 3 sujets, une commande au pied, et une commande à la tête) pour chaque enfant. Les entraînements moteurs étaient conçus par les thérapeutes selon l’évaluation fonctionnelle faite chez les patients et en respectant les principes d’apprentissage moteur (
feedback, exercice du plus simple au plus complexe, exercice en contexte, orienté vers un objectif précis, ici la manipulation du
joystick, pour permettre
in fine une déambulation avec le fauteuil). Initialement l’entraînement se faisait via des exercices de manipulation du
joystick sur écran par exemple, puis à terme, en fonction des progrès, en condition de déambulation en intérieur et en extérieur. Cette étude a montré qu’un tel programme d’intervention était faisable et apprécié par les participants, au-delà du seul aspect moteur, potentiellement efficace sur les objectifs à moyen terme que les individus se fixaient en lien avec l’équipe multidisciplinaire. L’évaluation des capacités de l’individu et la fixation des objectifs atteignables sont des clés de succès de telles interventions. Les auteurs concluaient en la nécessité d’une évaluation de ce type de stage (reposant sur les principes d’apprentissage moteur) à plus grande échelle mais encourageaient les équipes de soins à s’engager dans cette voie des thérapies intensives, en groupe, ludiques en lien avec des objectifs d’activité motrice.
En résumé, favoriser les activités motrices des personnes polyhandicapées est donc faisable, atteignable à condition d’une évaluation précise des capacités (notamment d’apprentissage) des individus. Cela nécessite des adaptations et des innovations technologiques sur les outils, pour les adapter aux troubles moteurs sévères mais aussi aux troubles de communication et cognitifs présents chez les individus polyhandicapés. L’acquisition par l’individu polyhandicapé des outils permettant une amélioration de ses activités motrices nécessite, comme pour la rééducation motrice, un entraînement moteur reposant sur les principes de l’apprentissage moteur avec des feedbacks humains et matériels importants, un temps long, des moyens humains et technologiques importants.
Déficits secondaires
Quels sont les déficits secondaires ?
La présence de déficit moteur primaire (faiblesse musculaire, spasticité, dyskinésie…) et l’absence de locomotion, voire de position assise indépendante (limitations d’activité motrice), et ce très tôt dans la vie de l’enfant, entraînent, en lien avec la croissance musculo-squelettique, de potentielles déformations neuro-orthopédiques (déficits secondaires selon la CIF) pouvant pénaliser les activités motrices de l’individu, voire dégrader sa qualité de vie. Aussi, la prévention de ces déficits secondaires est depuis très longtemps une clé de voûte de la prise en soins des personnes polyhandicapées.
La scoliose (déformation du rachis dans les 3 plans de l’espace) est ainsi très fréquemment décrite voire semble être constamment associée à l’individu en situation de polyhandicap. Une prévalence globale de 64 % chez une population de personnes avec un syndrome de Rett a été retrouvée (Bassett et Tolo, 1990

) aux États-Unis, allant de 39 % pour la catégorie de 6 à 10 ans à plus de 66 % après 15 ans. Dans une étude ultérieure en Grande-Bretagne (Kerr et coll., 2003

), il est même décrit une prévalence de la scoliose de 87 % chez les personnes avec un syndrome de Rett, avec une augmentation de la courbure (mesurée par l’angle de Cobb) avec l’âge. De façon intéressante, sur 231 cas de syndrome de Rett, une étude (Ager et coll., 2006

) montre un âge médian d’apparition de scoliose à 9,8 ans, avec 75 % des personnes ayant développé leur scoliose à 13 ans, et cherche à analyser les facteurs de survenue précoce d’un tel déficit secondaire. Il apparaît alors que plus les enfants ont un déficit moteur sévère (les enfants les moins mobiles à 10 mois, les enfants n’ayant jamais marché), plus le risque d’apparition de la scoliose est majeur. De la même manière, selon une revue de la littérature publiée en 2019 (Holmes et coll., 2019

) réalisée chez les adultes présentant une paralysie cérébrale de niveaux GMFCS IV-V, la prévalence globale de la scoliose est estimée entre 77 % et 90 % (Murphy et coll., 1995

; Rodby-Bousquet et coll., 2013

) avec pour certains auteurs, un angle de Cobb moyen de 66° (Senaran et coll., 2007

). Dans une population d’enfants (Willoughby et coll., 2022

) avec paralysie cérébrale, 18 % des enfants caractérisés par le niveau GMFCS IV et 48 % des enfants caractérisés par le niveau GMFCS V ont une scoliose avec un angle de Cobb supérieur à 40°. Aussi, le fait d’avoir une atteinte sévère motrice chez les personnes avec paralysie cérébrale est un facteur de risque majeur de développer une scoliose (
hazard ratio estimé à 15 pour un individu caractérisé par le niveau GMFCS IV de développer une scoliose par rapport à un individu caractérisé par le niveau GMFCS I ou II ;
hazard ratio à 53 pour un individu caractérisé par le niveau GMFCS V) (Hägglund et coll., 2018

). La scoliose apparaît d’autant plus probable chez l’individu avec paralysie cérébrale que la scoliose a débuté tôt dans la vie de l’individu (avant l’âge de 6 ans, ou avec un angle de Cobb au moins à 30° avant 10 ans) et que l’individu a une atteinte motrice sévère (GMFCS V) (Yoshida et coll., 2018

). Il faut noter que dans le cadre du polyhandicap, la scoliose ou cyphoscoliose peut être accompagnée de déformations thoraciques pouvant se développer tôt dans la vie de l’enfant et dont le risque de survenue augmente avec l’âge (Horimoto et coll., 2014

).
Les anomalies et pathologies de hanches sont aussi très souvent associées à l’individu polyhandicapé, voire inhérentes au polyhandicap. La souffrance d’une hanche peut être mesurée entre autres par l’indice de Reimers (ou pourcentage de migration de la tête fémorale) (Pons et coll., 2013

) qui renseigne sur le pourcentage de « découverture » de la hanche (plus l’indice est grand, plus la tête fémorale a migré et plus la hanche « souffre »). Aussi sur 56 enfants ayant un syndrome de Rett (Kanashvili et coll., 2021

), 36 % ont une migration de la tête fémorale de plus de 30 % avec un âge de début à 7,7 ans. Dans cette population, l’absence de marche acquise (reflet de la sévérité de l’atteinte motrice) et la présence d’une scoliose et d’épilepsie (qui pourrait être le reflet de la sévérité de la maladie causale ?) sont associées au risque de développer une pathologie de hanche. Chez l’enfant avec paralysie cérébrale sévère (GMFCS IV et V), 90 % des enfants ont un problème de hanche (Soo et coll., 2006

; Bouwhuis et coll., 2015

; Hägglund et coll., 2016

) dont plus de 25 % ont une migration de la tête fémorale de plus de 30 % (Holmes et coll., 2019

). Par ailleurs, associée aux problèmes de hanche, plus de 40 % des individus avec paralysie cérébrale de niveaux GMFCS IV et V présentent une asymétrie du bassin et des membres inférieurs en « coup de vent » (Holmes et coll., 2019

). Cette prévalence importante des pathologies de hanche a fait recommander une surveillance radiologique au moins annuelle chez l’enfant avec paralysie cérébrale de niveaux GMFCS IV et V entre l’âge de 2 et 8 ans puis tous les 2 ans ensuite (Pruszczynski et coll., 2016

). Si la migration de la tête fémorale est supérieure à 30 %, la surveillance est semestrielle de 2 à 8 ans, puis annuelle à partir de 8 ans. Une intervention thérapeutique est à discuter pour une migration supérieure à 30 % (cf. infra). Concernant les anomalies des membres inférieurs, Holmes et coll. (2019

) décrivent dans leur revue de la littérature, chez des adultes avec paralysie cérébrale non-marchants (GMFCS IV et V), une prévalence, selon les études répertoriées, de 14 à 100 % de rétraction des hanches et de 32 à 87 % de rétraction des genoux (Holmes et coll., 2019

). Devant ces rétractions, des auteurs (Howard et Herzog, 2021

) ont émis l’hypothèse qu’il existait, chez l’individu polyhandicapé (notamment avec paralysie cérébrale sévère), en dehors des effets de l’immobilité, des anomalies du muscle
per se liées à des phénomènes épigénétiques (réduction de la taille du muscle, du tissu contractile, défaut dans les sarcomères) favorisant alors les rétractions. Ces hypothèses doivent être confirmées.
D’autres déficits secondaires, moins décrits dans la littérature, sont aussi fréquemment présents comme la présence de déformation des pieds (
hallux rigiditus / dorsal bunion…). Spécifiquement à la population de personnes polyhandicapées ayant un syndrome de Rett (Hirano et Taniguchi, 2018

), il est noté une prévalence de 41 % de plaies cutanées notamment au niveau des membres supérieurs (19 % mains, 29 % doigts), et des rétractions articulaires des membres supérieurs (épaule 33 %, coude 29 %) associées à l’âge (avec une plus grande probabilité après 10 ans) et à la sévérité du syndrome notamment de l’atteinte motrice.
Il existe chez un même enfant avec une paralysie cérébrale sévère (et aussi chez la personne polyhandicapée) une co-occurrence forte entre la présence de déformations des hanches (migration, déformation en coup de vent des membres inférieurs), d’une scoliose et les anomalies du bassin (obliquité pelvienne) (Sato, 2020

). Ces trois déformations orthopédiques sont plus fréquemment associées à la présence de trouble du tonus axial important ainsi qu’à la sévérité de l’atteinte motrice et la présence de l’épilepsie. De la même façon, chez 99 adultes polyhandicapés, van Timmeren et coll. (2017

) montrent cette même co-occurrence entre les différentes déformations chez un même individu (van Timmeren et coll., 2017

). Ces facteurs sont en fait associés et relatent la gravité de la situation en décrivant des facteurs de risque qui soulignent « le degré d’immobilité » de l’individu. Plus un individu a une atteinte sévère de son polyhandicap, plus celui-ci risque d’être peu mobilisé, peu « verticalisé » et a donc un plus fort risque de déformations orthopédiques à différents niveaux, liées à l’absence de pesanteur relative (défaut de verticalisation dans le champ de gravité) et à la croissance.
La présence de ces déformations orthopédiques complique le positionnement confortable des individus polyhandicapés, qu’ils soient enfants ou adultes. Aussi, selon une étude de Rodby-Bousquet et Agustsson (2021

), 61 à 92 % des adultes avec paralysie cérébrale GMFCS IV et V requièrent un support (matelas) pour être allongés confortablement et « alignés », 100 % requièrent un support adapté pour être « bien » assis dans un fauteuil, et 61 % à 100 % utiliseraient un système de verticalisation (Rodby-Bousquet et Agustsson, 2021

). La mise en place de ces appareillages ou aides techniques de maintien de posture peut entraîner un stress psychologique de l’individu polyhandicapé, voire compliquer la situation médicale (cas de la position ventrale) et le dégagement des voies aériennes (Matsuda et coll., 2022

), et nécessite d’être questionnée au moment des installations.
Peut-on prévenir les déficits secondaires ?
Devant ces déformations orthopédiques importantes quasi inhérentes au polyhandicap, la mise en place d’appareillages dans la pratique clinique est recommandée. Ainsi en 2006, une conférence de consensus d’experts (Gericke, 2006

) sur la posture des enfants avec paralysie cérébrale sévère (GMFCS IV et V) indiquait de mettre en place tôt dans la vie de l’enfant un matelas moulé (matelas sur mesure) avec contrôle de la posture des hanches et du rachis, de proposer une assise adaptée (sur mesure ± sur moulage) dès 6 mois et un appareillage de verticalisation dès 12 mois. Paleg et coll. (2013

) ont conduit en 2013 une revue systématique de la littérature quant à la pertinence de proposer aux enfants avec paralysie cérébrale sévère un programme de verticalisation via l’utilisation de support adapté (
standing, verticalisateur sur mesure…) (Paleg et coll., 2013

). Ce type de programme semble relativement efficace pour permettre une meilleure densité osseuse (et prévenir l’ostéopénie), permettre un maintien des amplitudes articulaires (hanches, genoux, chevilles) et une diminution de la spasticité (-1 point sur l’échelle d’Ashworth). Toutefois, ce programme doit être réalisé quotidiennement (au moins 5 jours par semaine) sur des séances de 30 à 60 minutes. Il nécessite donc de pouvoir installer les personnes polyhandicapées dans ce type d’appareillage via des moyens humains importants. Ce type de programme de verticalisation est à promouvoir chez les personnes polyhandicapées quand l’enfant est théoriquement en âge de se tenir debout. Mais on peut penser que ce type de programme nécessite des professionnels formés pour rendre ces programmes opérationnels notamment dans les structures et lieux de vie des personnes polyhandicapées.
Par ailleurs, il est préconisé de mettre en place des postures des différentes articulations (cheville, genou…) pour entraîner un étirement passif et ainsi éviter/prévenir des rétractions tendineuses et articulaires ainsi que les déformations osseuses (
National Collaborating Centre for Women’s and Children’s Health UK, 2012

). Les orthèses proposées doivent maintenir la symétrie de l’appareil locomoteur sans compromettre la fonction motrice, ni l’état cutané, surtout pour les personnes polyhandicapées incapables de changer de position. L’effet des postures (Novak et coll., 2020

) via le port d’orthèses (le plus souvent sur mesure) diurnes et/ou nocturnes notamment au niveau des membres inférieurs semble avoir montré sa relative efficacité pour prévenir les déformations et garantir un relatif alignement de la statique de l’appareil locomoteur chez les personnes avec paralysie cérébrale. Cependant, les différentes recherches cliniques disponibles dans la littérature, pour évaluer l’efficacité du port des postures et autres orthèses de support sur mesure (dites orthèses de grand appareillage) chez les personnes polyhandicapées, sont réalisées le plus souvent dans des groupes hétérogènes de patients (notamment pour la paralysie cérébrale, elles ne se focalisent pas sur les niveaux GMFCS IV et V), avec un effectif le plus souvent trop petit et des techniques de posture et autres types orthèses aussi très hétérogènes, entre les différentes études et à l’intérieur parfois de la même étude. Il apparaît donc difficile de prouver clairement l’efficacité des postures pour prévenir la survenue des déformations orthopédiques chez la personne polyhandicapée (Robertson et coll., 2018

; Holmes et coll., 2019

). Ces derniers auteurs questionnent alors le bénéfice et la pertinence des installations et postures, notamment celles portées nuit et jour (Robertson et coll., 2018

).
Une étude rétrospective (Pountney et coll., 2002

) montre que la hanche est mieux contenue, et que l’on parvient à prévenir le degré de migration de la tête fémorale, quand l’enfant est positionné dans des orthèses de posture dans les 3 positions (allongé/assis/verticalisé). Une autre étude (Pountney et coll., 2009

), de la même équipe, montre que l’utilisation de posture de hanche prévient les subluxations de hanche à 5 ans du début de la posture comparativement à des enfants ayant peu recours à ce type de traitement. Toutefois, il semble que l’efficience clinique de telles postures bénéficie plus aux enfants les moins sévèrement atteints sur le plan moteur, et que les enfants les plus sévèrement atteints sur le plan moteur semblent avoir moins de bénéfices quant à la prévention neuro-orthopédique par les postures, alors que dans le même temps, ce sont eux qui supportent le moins les postures et subissent le plus d’inconfort lié aux postures (Gough, 2009

). Dans une étude clinique récente, Kim et coll. (2019

) compare chez 42 enfants avec paralysie cérébrale de niveaux GMFCS IV et V l’efficacité d’une assise adaptée (avec maintien de la posture de hanche en abduction) sur le niveau de déformation de la hanche (par mesure radiologique)
versus l’absence de système d’assise adaptée (groupe contrôle n = 34 enfants) (Kim et coll., 2019

). De façon tout à fait surprenante, le degré de migration de la tête fémorale est plus important pour le groupe avec assise adaptée que pour le groupe sans assise. Ici l’assise adaptée avec maintien de l’abduction de hanche semble plus délétère pour la hanche. Les auteurs fournissent une hypothèse, très plausible, quant à ce résultat surprenant et à rebours de ce qui se pratique en routine clinique. Selon ces derniers, en favorisant l’abduction de hanche via un plot d’abduction, on favorise l’étirement des muscles adducteurs de hanche, qui étant spastiques, se contractent en retour contre le plot, favorisant alors une décoaptation de la hanche (d’autant plus favorisée que les muscles abducteurs de hanche sont faibles), favorisant alors la découverture des hanches. À partir de cette étude, l’assise avec plot d’abduction ne semble donc pas efficace, voire semble délétère pour prévenir les pathologies de hanche liées au polyhandicap. Ce résultat a fait employer aux auteurs le titre suivant : « Les systèmes d’assise avec support médial du genou (plot d’abduction) sont-ils vraiment utiles pour la prévention du déplacement de la hanche chez les enfants avec paralysie cérébrale spastique GMFCS IV et V ? » («
Are Seating Systems With a Medial Knee Support Really Helpful for Hip Displacement in Children With Spastic Cerebral Palsy GMFCS IV and V? »). Il est cependant difficile de conclure, après une seule étude, sur le caractère délétère ou non d’un tel positionnement de hanche, alors que celui-ci est pratiqué quasi systématiquement chez la personne polyhandicapée. Toutefois, cette étude a le mérite de souligner la nécessité de réaliser des études cliniques de grande ampleur quant au rationnel et au bien-fondé d’imposer des postures parfois inconfortables dans le but de prévenir d’éventuelles déformations orthopédiques.
Concernant le cas précis des assises adaptées (siège coque et autres assises avec ou sans plot d’abduction), et au-delà de l’objectif de prévention des déformations de hanche (comme discuté plus haut), il est nécessaire de garder à l’esprit que ce type de dispositif pour des personnes polyhandicapées, incapables de réaliser ou maintenir des positions assises symétriques, répond à d’autres objectifs fonctionnels (maintenir la position assise) que la simple prévention orthopédique. Il faut donc savoir dans quels objectifs les supports et autres aides techniques sont prescrits, et ces objectifs doivent être énoncés aux familles, aux personnes et aux équipes.
Quelle efficacité des mesures de prévention neuro-orthopédiques ?
De façon générale, les bénéfices directs de certains supports et aides techniques peuvent clairement être observables sans que des études cliniques de grande ampleur soient nécessaires (Ryan, 2016

). Ainsi la réalité clinique montre qu’en l’absence d’assise adaptée une personne polyhandicapée ne peut tenir assise de façon indépendante, et donc ne peut bénéficier de déplacement aisé pour participer à la vie sociale de la famille, de l’institution… Il en est de même pour les contacteurs ou autres
microswitch. Aussi, refuser ou retarder des aides techniques (ce qui pourrait être le cas aussi des innovations technologiques) pour une personne polyhandicapée, qui présentent des avantages cliniques clairement et directement observables peut être contraire à l’éthique même si l’effet n’est pas prouvé dans de grandes études cliniques (Wang et coll., 2021

).
Aussi, il n’est pas toujours nécessaire de prouver l’évidence clinique quand l’objectif du dispositif est clairement atteint (ici mieux tenir assis). Néanmoins cette approche d’absence de preuve scientifique ne peut être généralisée. En effet, dans le cas des thérapies et aides à la motricité du polyhandicap cette approche peut être problématique et la simple impression clinique ne suffit parfois pas, voire peut faire imposer, à tort, des dispositifs ou autres thérapies (cas des thérapies neurodéveloppementales, cf. plus haut) dont le clinicien ou la famille perçoit un éventuel effet mais qui n’auraient en réalité aucune pertinence clinique à court ou à long terme.
Cette réflexion vaut notamment pour les traitements et postures imposés pour la prévention et le traitement des déformations orthopédiques (hanches, rachis…) depuis l’enfance, et dont on peine à prouver l’efficacité dans le but de prévention et « d’alignement » de l’appareil locomoteur. En effet, certains auteurs et cliniciens soumettent à la réflexion collective un point crucial, qu’il est important de discuter ici (Bekteshi et coll., 2023

). Si les mesures préventives (posture et autres orthèses diurnes et nocturnes) et/ou correctives (traitement chirurgical du rachis, des hanches…), depuis l’enfance, étaient efficaces dans l’apparition ou la correction des déformations (déficits secondaires), alors pourquoi autant d’adultes polyhandicapés et/ou avec paralysie cérébrale de niveaux GMFCS IV et V présentent des déformations ? Un effort de recherche orthopédique (prévention et correction) chez les personnes polyhandicapées est nécessaire et doit être encouragé pour répondre à cette question cruciale.
Devant ces interrogations quant aux mesures de prévention des déformations de hanches, Paleg et Livingstone (2022

) proposent de promouvoir des installations confortables et non préjudiciables à la qualité de vie et à la fonction en position couchée et assise, de favoriser la verticalisation avec 10 à 15° maximum d’abduction de hanche (par hanche, soit 20-30° maximum au total) au moins une heure par jour, de s’assurer que l’enfant a les équipements nécessaires pour permettre les postures tout en garantissant la réalisation d’activité en lien avec son âge, éviter que l’enfant polyhandicapé soit plus de 8 heures dans une même position (sans changement de position) dans un support adapté (Paleg et Livingstone, 2022

).
Comorbidités (facteurs personnels selon la CIF)
en lien avec l’absence de motricité (immobilité)
En lien avec l’immobilité prolongée, la personne polyhandicapée peut présenter, au-delà des déficits secondaires décrits ci-dessus, et en lien avec l’appareil locomoteur et la motricité, une ostéoporose (ostéopénie) et une désadaptation majeure à l’effort (effet de la sédentarité). Ces facteurs individuels de comorbidité constituent alors un obstacle à la situation fonctionnelle motrice de l’individu (au regard de l’analyse des situations selon la CIF).
Concernant le risque osseux, 45,2 % (41,1 à 49,3 %) des adultes polyhandicapés présentent une faible densité osseuse (ostéopénie) (Lohiya et coll., 2004

). Soixante-six pour cent des enfants avec paralysie cérébrale qui présentent une fracture sont non marchants (GMFCS IV et V), et 82 % des fractures se situent au niveau des membres inférieurs (Presedo et coll., 2007

). Dans la grande majorité des cas, ces fractures ne sont pas liées à des traumatismes (seules 32 % des fractures sont liées à des traumatismes) mais sont liées à des évènements dits de basse énergie (Kannikeswaran et coll., 2022

) (c’est-à-dire théoriquement n’amenant pas à une fracture) signant une ostéopénie sévère. Face à cette ostéopénie sévère (voire ostéoporose), des traitements préventifs doivent être entrepris (verticalisation, sortie dehors pour « prendre le soleil », supplémentation en vitamine D et calcium) mais aussi curatifs via un traitement par biphosphonates (Granild-Jensen et coll., 2023

). En effet, des méta-analyses ont montré qu’un an de traitement par bisphosphonates en intraveineux augmentait la densité minérale osseuse de 1,65 en termes de Z-score et de 0,65 après un traitement oral. Par contre, cela n’a pas montré de réduction du risque fracturaire après 2 ans, et des recherches à plus long terme sont nécessaires pour montrer cette efficacité, aujourd’hui suspectée sur le risque fracturaire.
Concernant l’activité physique des personnes polyhandicapées, il existe de très rares études s’intéressant à cette question spécifique (et notamment rapportant le niveau de dépense et d’activité physique quotidiennes). Chez les enfants avec paralysie cérébrale, tous niveaux GMFCS confondus (Carlon et coll., 2013

), le niveau d’activité physique est de 13 à 53 % moins élevé en comparaison avec leurs pairs au développement typique (enfant contrôle). Il y a un lien évident entre niveau de GMFCS et niveau d’activité physique même si cela n’a pas été formellement démontré dans cette étude, du fait d’absence de recherche spécifique sur cette question. Plus l’atteinte motrice est sévère, plus la personne est dépendante d’une tierce personne pour sa motricité et plus son niveau d’activité physique est faible.
Une étude illustre bien l’absence quasi-totale d’activité chez des enfants caractérisés par le niveau GMFCS V (Sato et coll., 2014

). Sur une population de 30 enfants (15 enfants avec paralysie cérébrale et 15 enfants contrôles), le nombre de changement de positions a été comptabilisé sur l’ensemble des 24 heures d’une journée. De façon non surprenante, il était retrouvé que chez les enfants atteints de paralysie cérébrale, le temps moyen passé dans une position était plus long que chez les enfants contrôles pendant le sommeil nocturne. La durée moyenne d’inactivité du corps était plus longue chez les enfants atteints de paralysie cérébrale, que ce soit pendant le sommeil diurne ou nocturne. Une analyse individuelle montrait pour certains enfants avec paralysie cérébrale sévère une absence totale de mouvement (aucun changement de position) pendant le sommeil. Lors des phases d’éveil, le défaut de changement de position chez les enfants avec paralysie cérébrale était moins important comparativement aux enfants typiques. L’explication donnée par les auteurs quant à ses résultats, est que si les enfants atteints de paralysie cérébrale sévère vivant à la maison présentaient une inactivité prolongée (posture immobilisée prolongée sans mouvement enregistré) pendant le sommeil nocturne c’est que les personnes qui s’occupaient d’eux (les aidants) dormaient aussi et qu’ils ne pouvaient les mobiliser. En journée, les aidants étant disponibles ceux-ci mobilisent plus les enfants polyhandicapés. Cette étude illustre l’absence d’activité physique liée aux difficultés motrices sévères, la dépendance des personnes polyhandicapées à une tierce personne pour les mobilisations et la réalisation d’activité physique même minime. Cette étude souligne la nécessité de changements de position des personnes polyhandicapée pendant le sommeil et donc la présence d’aides humaines disponibles à ce moment pour les mobiliser lors du sommeil.
Conclusion
Le développement de la motricité est un aspect important à cibler pour les individus polyhandicapés (favoriser les apprentissages), il est « vital » que les individus polyhandicapés puissent se déplacer pour explorer. Aussi les interventions motrices doivent viser les enjeux de locomotion, manipulation, lutte contre la sédentarité, et changement de position. Les objectifs doivent être centrés sur les familles, enfants, équipes, évaluation. Les interventions ne doivent pas viser uniquement la composante motrice mais bien plusieurs éléments : communication, attention, alimentation… Il faut réduire la passivité des individus polyhandicapés dans les activités afin de développer leurs potentialités de motricité.
Dans le cadre du polyhandicap, la prise en soins des troubles de la motricité doit se faire par une équipe pluridisciplinaire spécialisée pour : évaluer des déficiences, activités et participation ; définir des objectifs ; sélectionner la modalité de traitement la plus adaptée à la situation et sélectionner le plan d’intervention associé (plâtre, orthèse, intervention motrice).
Les déficits secondaires et notamment les troubles musculo-squelettiques doivent faire l’objet d’une évaluation et surveillance par une équipe pluridisciplinaire spécialisée afin de proposer une surveillance adéquate (examen clinique spécialisé, imagerie), un plan de prévention adapté (posture, ostéoporose, sédentarité…) et des traitements curatifs adaptés (médicaments, chirurgies).
Les interventions motrices doivent être des interventions dirigées vers l’objectif et basées sur l’apprentissage moteur. Elles nécessitent la présence de praticiens en thérapie motrice (au moins un pour un individu polyhandicapé). Elles doivent favoriser l’engagement actif de la personne polyhandicapée (technologie, aides humaines…) ; les interventions avec faible engagement actif du sujet doivent être abandonnées. Il doit être considéré que la personne polyhandicapée peut améliorer sa fonction motrice, même sur des petits objectifs. Les interventions doivent être intégrées dans le quotidien et favoriser l’activité physique ; elles doivent faire appel aux orthèses, aides techniques adaptées, et innovations technologiques.
Une personne polyhandicapée doit donc pouvoir bénéficier régulièrement d’évaluations de ses capacités motrices en termes de déficits primaires et secondaires mais aussi d’activité motrice (aides à la locomotion, préhension…) par une équipe pluri-professionnelle experte dans le champ du polyhandicap, de l’apprentissage moteur et de l’innovation technologique. Cette équipe doit pouvoir fixer des objectifs réalistes en lien avec la personne elle-même, la famille, les équipes de proximité et l’évaluation médicale et fonctionnelle. Cette équipe doit pouvoir proposer et appliquer les thérapies « innovantes » en termes de motricité (traitements chirurgicaux, thérapies innovantes…).
L’activité physique, la rééducation motrice, les aides à la mobilité, sont l’affaire de tous dans tous les lieux de vie de la personne, intégrées au quotidien, et nécessitent que chacun (professionnels et personnes polyhandicapées) soit motivé. Les professionnels et aidants doivent être conscients et convaincus que la personne peut faire des acquisitions motrices même minimes.
Des recherches de grande ampleur aussi bien sur la prévention des troubles orthopédiques que sur les innovations technologiques, les rééducations motrices et les traitements géniques et cellules souches pour les sujets polyhandicapés enfants et adultes doivent être favorisées et déployées. Cependant, le caractère hétérogène des étiologies du polyhandicap, la variabilité des différents tableaux cliniques rendent la constitution de cohortes de grande ampleur difficile voire infaisable, bloquant alors une recherche clinique de qualité. De nouvelles méthodologies de recherche clinique existent sur de faibles échantillons, type SCED (single case experimental design), qui devraient être favorisées pour cette population de personnes en situation de polyhandicap.
Références
[1] Ager S, Fyfe S, Christodoulou J, et coll . Predictors of scoliosis in Rett syndrome.
J Child Neurol. 2006;
21:809
-13

[2] Bassett GS, Tolo VT. The incidence and natural history of scoliosis in Rett syndrome.
Dev Med Child Neurol. 1990;
32:963
-6

[3] Bekteshi S, Monbaliu E, McIntyre S, et coll . Towards functional improvement of motor disorders associated with cerebral palsy.
The Lancet Neurology. 2023;
22:229
-43

[4] Bossink LW, van der Putten AA, Waninge A, et coll . A power-assisted exercise intervention in people with profound intellectual and multiple disabilities living in a residential facility: a pilot randomised controlled trial.
Clin Rehabil. 2017;
31:1168
-78

[5] Bouwhuis CB, van der Heijden-Maessen , Hélène C, Boldingh EJK, et coll . Effectiveness of preventive and corrective surgical intervention on hip disorders in severe cerebral palsy: a systematic review.
Disabil Rehabil. 2015;
37:97
-105

[6] Carlon SL, Taylor NF, Dodd KJ, et coll . Differences in habitual physical activity levels of young people with cerebral palsy and their typically developing peers: a systematic review.
Disabil Rehabil. 2013;
35:647
-55

[7] Chabrier S, Pouyfaucon M, Chatelin A, et coll . Development and initial validation of the polyhandicap.
Ann Phys Rehabil Med. 2020;
63:431
-8

[8] Chan JSL, Chien WT. A randomised controlled trial on evaluation of the clinical efficacy of massage therapy in a multisensory environment for residents with severe and profound intellectual disabilities: a pilot study.
J Intellect Disabil Res. 2017;
61:532
-48

[9] Gericke T. Postural management for children with cerebral palsy: consensus statement.
Dev Med Child Neurol. 2006;
48: 244p.

[10] Gough M. Continuous postural management and the prevention of deformity in children with cerebral palsy: an appraisal.
Dev Med Child Neurol. 2009;
51:105
-10

[11] Granild-Jensen JB, Pedersen LK, Langdahl B, et coll . Cerebral Palsy and bisphosphonates – and what can be learned from other types of secondary osteoporosis in children: a scoping review.
Acta Paediatr. 2023;
112:617
-29

[12] Hägglund G, Pettersson K, Czuba T, et coll . Incidence of scoliosis in cerebral palsy.
Acta Orthop. 2018;
89:443
-7

[13] Hägglund G, Lauge-Pedersen H, Persson Bunke M, et coll . Windswept hip deformity in children with cerebral palsy: a population-based prospective follow-up.
J Child Orthop. 2016;
10:275
-9

[14]HAS. Recommandation : Rééducation et réadaptation de la fonction motrice de l’appareil locomoteur des personnes diagnostiquées de paralysie cérébrale.
Recommander les bonnes pratiques. HAS. 21 octobre 2021;
28 pp.

[15] Hirano D, Taniguchi T. Skin injuries and joint contractures of the upper extremities in Rett syndrome.
J Intellect Disabil Res. 2018;
62:53
-9

[16] Holmes C, Brock K, Morgan P. Postural asymmetry in non-ambulant adults with cerebral palsy: a scoping review.
Disabil Rehabil. 2019;
41:1079
-88

[17] Horimoto Y, Osuda Y, Saito C, et coll . Relationship between the degree of thoracic deformity and the angle formed by a line connecting the sternum and the spinous process of the vertebrae in individuals with severe motor and intellectual disorders.
J Phys Ther Sci (Journal of Physical Therapy Science). 2014;
26:21
-3

[18] Howard JJ, Herzog W. Skeletal Muscle in Cerebral Palsy: From Belly to Myofibril.
Front Neurol (Frontiers in Neurology). 2021;
12: 620852p.

[19] Jackman M, Sakzewski L, Morgan C, et coll . Interventions to improve physical function for children and young people with cerebral palsy: international clinical practice guideline.
Dev Med Child Neurol. 2022;
64:536
-49

[20] Kanashvili B, Rogers KJ, Shrader MW, et coll . Hip displacement in MECP2 disorders: Prevalence and risk factors.
J Pediatr Orthop. 2021;
41:e800
-e803

[21] Kannikeswaran S, French ZP, Walsh K, et coll . Fracture characteristics by age, sex, and ambulatory status among individuals with cerebral palsy: a descriptive study.
Disabil Rehabil. 2022;
44:4806
-12

[22] Kerr AM, Webb P, Prescott RJ, et coll . Results of surgery for scoliosis in Rett syndrome.
J Child Neurol. 2003;
18:703
-8

[23] Kim IS, Park D, Ko JY, et coll . Are seating systems with a medial knee support really helpful for hip displacement in children with spastic cerebral palsy GMFCS IV and V?.
Arch Phys Med Rehabil. 2019;
100:247
-53

[24] Koy A, Lin J-P, Sanger TD, et coll . Advances in management of movement disorders in children.
Lancet Neurol. 2016;
15:719
-35

[25] Kudva A, Abraham ME, Gold J, et coll . Intrathecal baclofen, selective dorsal rhizotomy, and extracorporeal shockwave therapy for the treatment of spasticity in cerebral palsy: a systematic review.
Neurosurgical Review. 2021;
44:3209
-28

[26] Lai B, Lee E, Kim Y, et coll . Leisure-time physical activity interventions for children and adults with cerebral palsy: a scoping review.
Dev Med Child Neurol. 2021;
63:162
-71

[27] Lee S, Hyun C, Kim K, et coll . Effect of intrathecal Baclofen pump on scoliosis in children with cerebral palsy: A meta-analysis.
Ann Rehabil Med. 2023;
47:11
-8

[28] Lehoux M-C. Rapport d’évaluation sur les interventions ayant démontré un effet auprès des enfants et des adolescents de 0 à 21 ans présentant un polyhandicap.
Trois-Rivières: (Canada).
Institut Universitaire en Déficience Intellectuelle et en trouble du spectre de l’Autisme;
2017;
110 pp.

[29] Lohiya G-S, Tan-Figueroa L, Iannucci A. Identification of low bone mass in a developmental center: finger bone mineral density measurement in 562 residents.
J Am Med Dir Assoc . 2004;
5:371
-6

[30] Matsuda T, Akezaki Y, Tsuji Y, et coll . Psychological stress induced by prone positioning among adults with severe cerebral palsy.
Acta Med Okayama. 2022;
76:535
-40

[31] Motta F, Buonaguro V, Stignani C. The use of intrathecal baclofen pump implants in children and adolescents: safety and complications in 200 consecutive cases.
Journal of neurosurgery. 2007;
107:32
-5

[32] Murphy KP, Molnar GE, Lankasky K. Medical and functional status of adults with cerebral palsy.
Dev Med Child Neurol. 1995;
37:1075
-84

[33]National Collaborating Centre for Women’s and Children’s Health (UK). Spasticity in Children and Young People with Non-Progressive Brain Disorders: Management of Spasticity and Co-Existing Motor Disorders and Their Early Musculoskeletal Complications.
London.
RCGO Press;
2012;

[34] Nilsson LM, Nyberg PJ. Driving to learn: A new concept for training children with profound cognitive disabilities in a powered wheelchair.
Am J Occup Ther. 2003;
57:229
-33

[35] Novak I, Morgan C, Fahey M, et coll . State of the evidence traffic lights 2019: Systematic review of interventions for preventing and treating children with cerebral palsy.
Curr Neurol Neurosci Rep. 2020;
20: 3p.

[36] Novak I, McIntyre S, Morgan C, et coll . A systematic review of interventions for children with cerebral palsy: state of the evidence.
Dev Med Child Neurol. 2013;
55:885
-910

[37]OMS. Classification internationale du fonctionnement du handicap et de la santé : Version pour enfants et adolescents. CIF – EA.
Presses de l’EHSP;
2012.
369 pp.

[38]OMS. Classification internationale du fonctionnement, du handicap et de la santé : CIF.
Genève:Organisation mondiale de la santé. 2001;
1304

[39] Paleg G, Livingstone R. Evidence-informed clinical perspectives on postural management for hip health in children and adults with non-ambulant cerebral palsy.
J Pediatr Rehabil Med. 2022;
15:39
-48

[40] Paleg GS, Smith BA, Glickman LB. Systematic review and evidence-based clinical recommendations for dosing of pediatric supported standing programs.
Pediatr Phys Ther. 2013;
25:232
-47

[41] Palisano R, Rosenbaum P, Walter S, et coll . Development and reliability of a system to classify gross motor function in children with cerebral palsy.
Dev Med Child Neurol. 1997;
39:214
-23

[42] Pons C, Rémy-Néris O, Médée B, et coll . Validity and reliability of radiological methods to assess proximal hip geometry in children with cerebral palsy: a systematic review.
Dev Med Child Neurol. 2013;
55:1089
-102

[43] Pountney T, Mandy A, Green E, et coll . Management of hip dislocation with postural management.
Child Care Health Dev. 2002;
28:179
-85

[44] Pountney TE, Mandy A, Green E, et coll . Hip subluxation and dislocation in cerebral palsy – a prospective study on the effectiveness of postural management programmes.
Physiother Res Int. 2009;
14:116
-27

[45] Presedo A, Dabney KW, Miller F. Fractures in patients with cerebral palsy.
J Pediatr Orthop. 2007;
27:147
-53

[46] Pruszczynski B, Sees J, Miller F. Risk Factors for Hip Displacement in Children With Cerebral Palsy: Systematic Review.
J Pediatr Orthop. 2016;
36:829
-33

[47] Robertson J, Baines S, Emerson E, et coll . Postural care for people with intellectual disabilities and severely impaired motor function: A scoping review.
J Appl Res Intellect Disabil. 2018;
31:11
-28

[48] Rodby-Bousquet E, Agustsson A. Postural asymmetries and assistive devices used by adults with cerebral palsy in lying, sitting, and standing.
Front Neurol (Frontiers in Neurology). 2021;
12: 758706p.

[49] Rodby-Bousquet E, Czuba T, Hägglund G, et coll . Postural asymmetries in young adults with cerebral palsy.
Dev Med Child Neurol. 2013;
55:1009
-15

[50] Rosenberg L, Maeir A, Gilboa Y. Evaluating a therapeutic powered mobility camp for children with severe cerebral palsy.
Can J Occup Ther. 2021;
88:294
-305

[51] Ryan SE. Lessons learned from studying the functional impact of adaptive seating interventions for children with cerebral palsy.
Dev Med Child Neurol. 2016;
58 Suppl 4:78
-82

[52] Sato H. Postural deformity in children with cerebral palsy: Why it occurs and how is it managed.
Phys Ther Res. 2020;
23:8
-14

[53] Sato H, Iwasaki T, Yokoyama M, et coll . Monitoring of body position and motion in children with severe cerebral palsy for 24 hours.
Disabil Rehabil. 2014;
36:1156
-60

[54] Senaran H, Shah SA, Presedo A, et coll . The risk of progression of scoliosis in cerebral palsy patients after intrathecal baclofen therapy.
Spine (Phila Pa 1976). 2007;
32:2348
-54

[55] Shih C-H, Shih C-J, Shih C-T. Assisting people with multiple disabilities by actively keeping the head in an upright position with a Nintendo Wii Remote Controller through the control of an environmental stimulation.
Res Dev Disabil. 2011;
32:2005
-10

[56] Shih C-H, Shih C-T. Assisting two children with multiple disabilities and minimal motor skills control environmental stimuli with thumb poke through a trackball.
Behav Cogn Psychother. 2010;
38:211
-9

[57] Shih C-H, Shih C-T. Assisting people with multiple disabilities to use computers with multiple mice.
Res Dev Disabil. 2009;
30:746
-54

[58] Soo B, Howard JJ, Boyd RN, et coll . Hip displacement in cerebral palsy.
J Bone Joint Surg Am. 2006;
88:121
-9

[59] Stasolla F, Caffò AO. Promoting adaptive behaviors by two girls with Rett syndrome through a microswitch-based program.
Res Autism Spectr Disord. 2013;
7:1265
-72

[60] Su IYW, Chung KKY, Chow DHK. Treadmill training with partial body weight support compared with conventional gait training for low-functioning children and adolescents with nonspastic cerebral palsy: a two-period crossover study.
Prosthet Orthot Int. 2013;
37:445
-53

[61] van Alphen HJ, Waninge A, Minnaert A, et coll . Content and quality of motor initiatives in the support of people with profound intellectual and multiple disabilities.
J Policy Pract Intellect Disabil. 2019;
16:325
-41

[62] van der Putten A, Vlaskamp C, Reynders K, et coll . Children with profound intellectual and multiple disabilities: the effects of functional movement activities.
Clin Rehabil. 2005;
19:613
-20

[63] van der Putten AAJ, Bossink LWM, Frans N, et coll . Motor activation in people with profound intellectual and multiple disabilities in daily psractice.
J Intellect Dev Disabil. 2017;
42:1
-11

[64] van Timmeren EA, Waninge A, van Schrojenstein Lantman-de H M J, et coll . Patterns of multimorbidity in people with severe or profound intellectual and motor disabilities.
Res Dev Disabil. 2017;
67:28
-33

[65] Wang RH, Kenyon LK, McGilton KS, et coll . The time is now: A FASTER approach to generate research evidence for technology-based interventions in the field of disability and rehabilitation.
Arch Phys Med Rehabil. 2021;
102:1848
-59

[66] Willoughby KL, Ang SG, Thomason P, et coll . Epidemiology of scoliosis in cerebral palsy: A population-based study at skeletal maturity.
J Paediatr Child Health. 2022;
58:295
-301

[67] Yoshida K, Kajiura I, Suzuki T, et coll . Natural history of scoliosis in cerebral palsy and risk factors for progression of scoliosis.
J Orthop Sci. 2018;
23:649
-52

→ Aller vers SYNTHESE
 ). Ce cadre a été développé en 2007 pour les enfants et les adolescents (CIF-EA). Depuis 2012, le même cadre est utilisé pour les enfants et les adultes (OMS, 2012
). Ce cadre a été développé en 2007 pour les enfants et les adolescents (CIF-EA). Depuis 2012, le même cadre est utilisé pour les enfants et les adultes (OMS, 2012 ).
). ). On peut ajouter deux notions importantes pour la suite de ce chapitre, à savoir, la notion de déficit primaire qui est directement lié au problème de santé (ex. : le déficit moteur après une lésion cérébrale est un déficit primaire) et la notion de déficit secondaire qui est la conséquence du déficit primaire (ex. : une déformation articulaire dans les suites d’un déficit moteur primaire).
). On peut ajouter deux notions importantes pour la suite de ce chapitre, à savoir, la notion de déficit primaire qui est directement lié au problème de santé (ex. : le déficit moteur après une lésion cérébrale est un déficit primaire) et la notion de déficit secondaire qui est la conséquence du déficit primaire (ex. : une déformation articulaire dans les suites d’un déficit moteur primaire). , emprunté de l’OMS (OMS, 2001
, emprunté de l’OMS (OMS, 2001 ) « le fonctionnement d’une personne dans un domaine particulier est déterminé par l’interaction […] entre le problème de santé de la personne et les facteurs contextuels (c’est-à-dire les facteurs environnementaux et personnels). Il y a interaction dynamique entre ces entités : des interventions sur l’une d’elles peuvent modifier une ou plusieurs autres. ».
) « le fonctionnement d’une personne dans un domaine particulier est déterminé par l’interaction […] entre le problème de santé de la personne et les facteurs contextuels (c’est-à-dire les facteurs environnementaux et personnels). Il y a interaction dynamique entre ces entités : des interventions sur l’une d’elles peuvent modifier une ou plusieurs autres. ».
 )
) ), et en lien avec le domaine moteur, le problème de santé initial est le « désordre, anomalie ou lésion survenue sur un cerveau en développement ou immature » alors que le déficit primaire est une « déficience motrice évaluée comme sévère » directement lié à l’anomalie cérébrale (défaut de force, perte de sélectivité, spasticité…). L’enfant grandissant autour de ces déficits moteurs sévères (immobilité relative), en l’absence relative de pesanteur, des déficits secondaires peuvent se rencontrer comme des déformations neuro-orthopédiques (scoliose, luxation de hanches, douleurs…). Ces déficits secondaires peuvent se surajouter aux déficits moteurs primaires et pénaliser ainsi la motricité volontaire. Aussi, les limitations d’activités (en lien avec la motricité) ici concernent une « réduction extrême de l’autonomie et de la mobilité » et une dépendance à une tierce personne pour les activités motrices (déplacements, actes moteurs de la vie quotidienne).
), et en lien avec le domaine moteur, le problème de santé initial est le « désordre, anomalie ou lésion survenue sur un cerveau en développement ou immature » alors que le déficit primaire est une « déficience motrice évaluée comme sévère » directement lié à l’anomalie cérébrale (défaut de force, perte de sélectivité, spasticité…). L’enfant grandissant autour de ces déficits moteurs sévères (immobilité relative), en l’absence relative de pesanteur, des déficits secondaires peuvent se rencontrer comme des déformations neuro-orthopédiques (scoliose, luxation de hanches, douleurs…). Ces déficits secondaires peuvent se surajouter aux déficits moteurs primaires et pénaliser ainsi la motricité volontaire. Aussi, les limitations d’activités (en lien avec la motricité) ici concernent une « réduction extrême de l’autonomie et de la mobilité » et une dépendance à une tierce personne pour les activités motrices (déplacements, actes moteurs de la vie quotidienne). ) est plus développé (Novak et coll., 2020
) est plus développé (Novak et coll., 2020 ) et peut par certains aspects être pertinent dans le cadre de la rééducation motrice du polyhandicap, notamment pour les enfants (personnes) avec polyhandicap. Les personnes avec paralysie cérébrale se voient caractérisées, notamment, selon leur possibilité motrice globale en 5 niveaux (appelés Gross Motor Function Classification System : GMFCS) (Palisano et coll., 1997
) et peut par certains aspects être pertinent dans le cadre de la rééducation motrice du polyhandicap, notamment pour les enfants (personnes) avec polyhandicap. Les personnes avec paralysie cérébrale se voient caractérisées, notamment, selon leur possibilité motrice globale en 5 niveaux (appelés Gross Motor Function Classification System : GMFCS) (Palisano et coll., 1997 ). Les niveaux IV et V sont les niveaux où les enfants sont les plus dépendants dans leur motricité globale. Les enfants (et adultes) caractérisés par le niveau GMFCS IV sont dépendants d’aides techniques motorisées pour se déplacer. Les enfants caractérisés par le niveau GMFCS V n’ont pas d’autonomie de déplacement et sont dépendants totalement d’une aide humaine (tierce personne) pour les actes moteurs. Aussi, lors de notre analyse des interventions motrices chez la personne avec paralysie cérébrale, nous avons particulièrement été attentifs aux interventions réalisées pour les personnes caractérisées par les niveaux GMFCS IV et V, se rapprochant plus de la situation motrice de la personne polyhandicapée.
). Les niveaux IV et V sont les niveaux où les enfants sont les plus dépendants dans leur motricité globale. Les enfants (et adultes) caractérisés par le niveau GMFCS IV sont dépendants d’aides techniques motorisées pour se déplacer. Les enfants caractérisés par le niveau GMFCS V n’ont pas d’autonomie de déplacement et sont dépendants totalement d’une aide humaine (tierce personne) pour les actes moteurs. Aussi, lors de notre analyse des interventions motrices chez la personne avec paralysie cérébrale, nous avons particulièrement été attentifs aux interventions réalisées pour les personnes caractérisées par les niveaux GMFCS IV et V, se rapprochant plus de la situation motrice de la personne polyhandicapée. ) a montré chez 58 personnes (de 11 à 63 ans) que plus de la moitié d’entre elles n’étaient même pas engagées dans une seule activité motrice par jour en semaine (par exemple encourager quelqu’un à jouer avec un mobile, manipuler des objets…) et que peu de propositions d’engagement actif dans les activités motrices leur étaient proposées (en moyenne 1,5 activité par jour). Lorsque des activités motrices sont proposées, ce sont plutôt des activités dites passives (sans participation d’une motricité active de la personne) comme des stimulations multi-sensorielles ou des massages (alors même qu’il n’existe aucune preuve scientifique sur l’intérêt des massages pour favoriser la motricité ; Chan et Chien, 2017
) a montré chez 58 personnes (de 11 à 63 ans) que plus de la moitié d’entre elles n’étaient même pas engagées dans une seule activité motrice par jour en semaine (par exemple encourager quelqu’un à jouer avec un mobile, manipuler des objets…) et que peu de propositions d’engagement actif dans les activités motrices leur étaient proposées (en moyenne 1,5 activité par jour). Lorsque des activités motrices sont proposées, ce sont plutôt des activités dites passives (sans participation d’une motricité active de la personne) comme des stimulations multi-sensorielles ou des massages (alors même qu’il n’existe aucune preuve scientifique sur l’intérêt des massages pour favoriser la motricité ; Chan et Chien, 2017 ). Aussi, les activités d’engagement moteur sont peu intégrées dans le quotidien des personnes avec polyhandicap, et les activités de loisirs sont surtout passives comme regarder la télévision ou écouter de la musique. Quand les programmes moteurs sont intégrés dans le quotidien, il apparaît que les interventions motrices réalisées ont peu (voire pas) de rationnel scientifique (il s’agit le plus souvent d’interventions non fondées sur les preuves d’efficacité [evidence-based medicine]).
). Aussi, les activités d’engagement moteur sont peu intégrées dans le quotidien des personnes avec polyhandicap, et les activités de loisirs sont surtout passives comme regarder la télévision ou écouter de la musique. Quand les programmes moteurs sont intégrés dans le quotidien, il apparaît que les interventions motrices réalisées ont peu (voire pas) de rationnel scientifique (il s’agit le plus souvent d’interventions non fondées sur les preuves d’efficacité [evidence-based medicine]). ) ont cherché à montrer l’effet d’une rééducation motrice via des exercices moteurs assistés (power-assisted exercice) chez des personnes polyhandicapées (moyenne d’âge de 32 ans, allant de 4 à 60 ans, 25 hommes) (Bossink et coll., 2017
) ont cherché à montrer l’effet d’une rééducation motrice via des exercices moteurs assistés (power-assisted exercice) chez des personnes polyhandicapées (moyenne d’âge de 32 ans, allant de 4 à 60 ans, 25 hommes) (Bossink et coll., 2017 ). Le programme comprenait des exercices moteurs assistés trois fois par semaine pendant 20 semaines chez 19 sujets, les résultats étaient comparés avec un groupe contrôle (n = 18 sujets) qui recevait des soins dit habituels. Les résultats de cette recherche illustrent bien notre propos : en effet, les auteurs montrent qu’un protocole de recherche clinique de bonne qualité méthodologique est faisable/réalisable chez des personnes polyhandicapées, que des exercices musculaires assistés sont réalisables dans cette population (s’ils sont bien adaptés aux capacités de l’individu). Les participants ont ainsi validé au moins 81,5 % des sessions de rééducation. De façon surprenante, le seul résultat, statistiquement significatif, d’amélioration après un tel programme, était l’amélioration de la saturation, mesurée par un oxymètre, en oxygène du sang de 90,9 % à 96,3 % à la fin de l’intervention, sans que l’on trouve de réelles explications à cela. Pour les auteurs, d’autres études de plus grande échelle sont nécessaires pour généraliser et recommander ce type d’intervention.
). Le programme comprenait des exercices moteurs assistés trois fois par semaine pendant 20 semaines chez 19 sujets, les résultats étaient comparés avec un groupe contrôle (n = 18 sujets) qui recevait des soins dit habituels. Les résultats de cette recherche illustrent bien notre propos : en effet, les auteurs montrent qu’un protocole de recherche clinique de bonne qualité méthodologique est faisable/réalisable chez des personnes polyhandicapées, que des exercices musculaires assistés sont réalisables dans cette population (s’ils sont bien adaptés aux capacités de l’individu). Les participants ont ainsi validé au moins 81,5 % des sessions de rééducation. De façon surprenante, le seul résultat, statistiquement significatif, d’amélioration après un tel programme, était l’amélioration de la saturation, mesurée par un oxymètre, en oxygène du sang de 90,9 % à 96,3 % à la fin de l’intervention, sans que l’on trouve de réelles explications à cela. Pour les auteurs, d’autres études de plus grande échelle sont nécessaires pour généraliser et recommander ce type d’intervention. ) visant à évaluer les interventions, notamment motrices, ayant démontré un effet auprès des enfants polyhandicapés (de 0 à 21 ans). Vingt-huit articles scientifiques, à propos d’interventions diverses (incluant de 1 à 44 participants polyhandicapés, âgés de 1 an à 52 ans) ont été retenus dans ce rapport. Dix-huit articles étaient à propos de 1 cas rapporté (single case study). Seules 7 études (participants âgés de 1 à 20 ans) ciblent spécifiquement l’amélioration de la motricité (manipulation ou locomotion), et décrivent 6 interventions différentes. Brièvement, parmi ces interventions, on note, qu’une vise à l’utilisation d’une souris d’ordinateur adaptée à l’enfant (et dans une autre étude par la même équipe, une manette de console de jeux Wii à la place de la souris) pour pointer une cible dans l’écran et/ou corriger la posture de tête (Shih et Shih, 2009
) visant à évaluer les interventions, notamment motrices, ayant démontré un effet auprès des enfants polyhandicapés (de 0 à 21 ans). Vingt-huit articles scientifiques, à propos d’interventions diverses (incluant de 1 à 44 participants polyhandicapés, âgés de 1 an à 52 ans) ont été retenus dans ce rapport. Dix-huit articles étaient à propos de 1 cas rapporté (single case study). Seules 7 études (participants âgés de 1 à 20 ans) ciblent spécifiquement l’amélioration de la motricité (manipulation ou locomotion), et décrivent 6 interventions différentes. Brièvement, parmi ces interventions, on note, qu’une vise à l’utilisation d’une souris d’ordinateur adaptée à l’enfant (et dans une autre étude par la même équipe, une manette de console de jeux Wii à la place de la souris) pour pointer une cible dans l’écran et/ou corriger la posture de tête (Shih et Shih, 2009 ; Shih et Shih, 2010
; Shih et Shih, 2010 ; Shih et coll., 2011
; Shih et coll., 2011 ). Une autre étude (Su et coll., 2013
). Une autre étude (Su et coll., 2013 ) vise à l’évaluation d’un protocole de marche sur tapis roulant utilisant un harnais pour soutenir le poids du corps (30 % du poids du corps) sur des séances de 25 minutes, deux fois par semaine. Les auteurs n’ont pas pu conclure à l’efficacité d’un tel entraînement. Par ailleurs, à la lecture de l’article, et concernant les 10 sujets inclus dans cette étude, on peut se poser légitiment la question de la représentativité des personnes polyhandicapées (selon le périmètre de cette expertise) dans cet échantillon. Il apparaît que les sujets inclus ne semblent pas correspondre aux critères du polyhandicap que nous retenons, aussi ce dispositif ne semble pas adapté aux personnes polyhandicapées dans le but d’améliorer la locomotion via la marche. Un autre programme d’intervention à visée motrice est analysé dans ce rapport, il s’agit d’un programme de plusieurs interventions nommé Mobility Opportunities Via Education (MOVE) (van der Putten et coll., 2005
) vise à l’évaluation d’un protocole de marche sur tapis roulant utilisant un harnais pour soutenir le poids du corps (30 % du poids du corps) sur des séances de 25 minutes, deux fois par semaine. Les auteurs n’ont pas pu conclure à l’efficacité d’un tel entraînement. Par ailleurs, à la lecture de l’article, et concernant les 10 sujets inclus dans cette étude, on peut se poser légitiment la question de la représentativité des personnes polyhandicapées (selon le périmètre de cette expertise) dans cet échantillon. Il apparaît que les sujets inclus ne semblent pas correspondre aux critères du polyhandicap que nous retenons, aussi ce dispositif ne semble pas adapté aux personnes polyhandicapées dans le but d’améliorer la locomotion via la marche. Un autre programme d’intervention à visée motrice est analysé dans ce rapport, il s’agit d’un programme de plusieurs interventions nommé Mobility Opportunities Via Education (MOVE) (van der Putten et coll., 2005 ) dont l’objectif est d’améliorer l’autonomie des enfants (via des habiletés fonctionnelles). Les interventions motrices sont intégrées à la routine quotidienne de l’enfant et le rôle des professionnels encadrant celui-ci, est d’encourager l’enfant polyhandicapé à être le plus actif possible sur le plan de ces mouvements. Ce programme semble pouvoir améliorer pour certains enfants la capacité à réaliser des mouvements de façon indépendante (ce qui représente un résultat clinique pertinent), mais les auteurs notent que les enfants ne répondent pas tous de la même façon à ce programme. De plus, une seule étude a évalué l’efficacité clinique du programme MOVE, ce qui ne permet pas d’étendre et de généraliser ce type de programme de rééducation motrice aux enfants avec polyhandicap. Les preuves scientifiques ne sont pas suffisantes pour recommander ce programme et d’autres expérimentations et développements sont nécessaires. Un autre programme (projet Driving to learn)3
(Nilsson et Nyberg, 2003
) dont l’objectif est d’améliorer l’autonomie des enfants (via des habiletés fonctionnelles). Les interventions motrices sont intégrées à la routine quotidienne de l’enfant et le rôle des professionnels encadrant celui-ci, est d’encourager l’enfant polyhandicapé à être le plus actif possible sur le plan de ces mouvements. Ce programme semble pouvoir améliorer pour certains enfants la capacité à réaliser des mouvements de façon indépendante (ce qui représente un résultat clinique pertinent), mais les auteurs notent que les enfants ne répondent pas tous de la même façon à ce programme. De plus, une seule étude a évalué l’efficacité clinique du programme MOVE, ce qui ne permet pas d’étendre et de généraliser ce type de programme de rééducation motrice aux enfants avec polyhandicap. Les preuves scientifiques ne sont pas suffisantes pour recommander ce programme et d’autres expérimentations et développements sont nécessaires. Un autre programme (projet Driving to learn)3
(Nilsson et Nyberg, 2003 ) que nous décrivons ici, vise la manipulation autonome d’un fauteuil roulant motorisé adapté à chaque participant en situation de polyhandicap. L’étude longitudinale rapporte que 8 participants sur 45 ont atteint un niveau de contrôle indépendant de la direction du fauteuil roulant et que 33 ont atteint un certain contrôle. Cette étude démontre que l’efficacité du programme est favorisée avec la présence permanente d’un thérapeute aux côtés de l’enfant pour l’apprentissage du contrôle du fauteuil roulant donnant des rétrocontrôles réguliers (feedback) ainsi que des séances d’entraînement de plus de 30 minutes échelonnées sur plusieurs mois.
) que nous décrivons ici, vise la manipulation autonome d’un fauteuil roulant motorisé adapté à chaque participant en situation de polyhandicap. L’étude longitudinale rapporte que 8 participants sur 45 ont atteint un niveau de contrôle indépendant de la direction du fauteuil roulant et que 33 ont atteint un certain contrôle. Cette étude démontre que l’efficacité du programme est favorisée avec la présence permanente d’un thérapeute aux côtés de l’enfant pour l’apprentissage du contrôle du fauteuil roulant donnant des rétrocontrôles réguliers (feedback) ainsi que des séances d’entraînement de plus de 30 minutes échelonnées sur plusieurs mois. ) utilisent des micro-rupteurs (ou commutateurs miniatures), dans des programmes de thérapie motrice, pour faciliter la locomotion ou la manipulation d’objets. Ces micro-rupteurs sont utilisés soit comme des aides techniques facilitant la manipulation ou comme donnant un feedback lors de l’acte moteur ou encore comme incitation à interagir. Ainsi, ces derniers permettent d’encourager la personne à s’engager dans l’acte moteur en apportant des éléments motivationnels potentiels. Les données, disponibles dans la littérature, concernant l’utilisation de micro-rupteurs chez les personnes polyhandicapées, sont rares et concernent surtout des études de cas unique, mais on peut souligner que l’intérêt de ces dispositifs réside dans l’incitation ou la stimulation pour l’individu à s’engager dans un acte moteur en permettant la production d’incitations et de feedback (ou rétrocontrôle) à l’action engagée, gratifiant ainsi l’action du sujet. Il est intéressant ici de mentionner un cas rapporté dans la littérature (Shih et Shih, 2009
) utilisent des micro-rupteurs (ou commutateurs miniatures), dans des programmes de thérapie motrice, pour faciliter la locomotion ou la manipulation d’objets. Ces micro-rupteurs sont utilisés soit comme des aides techniques facilitant la manipulation ou comme donnant un feedback lors de l’acte moteur ou encore comme incitation à interagir. Ainsi, ces derniers permettent d’encourager la personne à s’engager dans l’acte moteur en apportant des éléments motivationnels potentiels. Les données, disponibles dans la littérature, concernant l’utilisation de micro-rupteurs chez les personnes polyhandicapées, sont rares et concernent surtout des études de cas unique, mais on peut souligner que l’intérêt de ces dispositifs réside dans l’incitation ou la stimulation pour l’individu à s’engager dans un acte moteur en permettant la production d’incitations et de feedback (ou rétrocontrôle) à l’action engagée, gratifiant ainsi l’action du sujet. Il est intéressant ici de mentionner un cas rapporté dans la littérature (Shih et Shih, 2009 ) à propos d’un enfant polyhandicapé de 10 ans qui a bénéficié de 3 séances réalisées à la maison de 30 minutes d’entraînement à la manipulation de trois souris d’ordinateurs modifiées et adaptées spécifiquement aux capacités motrices de l’enfant. Lors des séances, un thérapeute (aide humaine) accompagne, soutient physiquement les différents mouvements de l’enfant pour permettre à celui-ci de manipuler, d’interagir avec les souris, pendant que l’écran d’ordinateur incite verbalement l’enfant à s’engager dans l’activité de pointage. Pendant l’action, un feedback sur l’écran est aussi produit. Au bout d’une longue période de pratique, et à l’issue de cette intervention, l’enfant a amélioré significativement ses performances de pointage. À partir d’un cas, il est difficile de retenir et de généraliser cette intervention, mais les différents cas rapportés dans la littérature (via l’utilisation de micro-rupteurs ou de souris adaptées) illustrent que l’entraînement selon les principes de l’apprentissage moteur (répétition du geste, du plus simple au plus complexe, avec la présence de feedback implicite et explicite, sur une longue période) peut s’appliquer chez l’individu avec polyhandicap, en tenant compte des capacités motrices et cognitives du sujet.
) à propos d’un enfant polyhandicapé de 10 ans qui a bénéficié de 3 séances réalisées à la maison de 30 minutes d’entraînement à la manipulation de trois souris d’ordinateurs modifiées et adaptées spécifiquement aux capacités motrices de l’enfant. Lors des séances, un thérapeute (aide humaine) accompagne, soutient physiquement les différents mouvements de l’enfant pour permettre à celui-ci de manipuler, d’interagir avec les souris, pendant que l’écran d’ordinateur incite verbalement l’enfant à s’engager dans l’activité de pointage. Pendant l’action, un feedback sur l’écran est aussi produit. Au bout d’une longue période de pratique, et à l’issue de cette intervention, l’enfant a amélioré significativement ses performances de pointage. À partir d’un cas, il est difficile de retenir et de généraliser cette intervention, mais les différents cas rapportés dans la littérature (via l’utilisation de micro-rupteurs ou de souris adaptées) illustrent que l’entraînement selon les principes de l’apprentissage moteur (répétition du geste, du plus simple au plus complexe, avec la présence de feedback implicite et explicite, sur une longue période) peut s’appliquer chez l’individu avec polyhandicap, en tenant compte des capacités motrices et cognitives du sujet. ) proposent une revue critique, via un questionnaire en ligne distribué aux professionnels prenant en soin des personnes polyhandicapées, de ce qui est proposé comme intervention motrice aux Pays-Bas (van Alphen et coll., 2019
) proposent une revue critique, via un questionnaire en ligne distribué aux professionnels prenant en soin des personnes polyhandicapées, de ce qui est proposé comme intervention motrice aux Pays-Bas (van Alphen et coll., 2019 ). Cent dix-huit interventions ont été décrites par les thérapeutes comme « interventions motrices », 17 ont été retenues par les auteurs comme de véritables interventions motrices, parmi lesquelles 4 programmes moteurs ont été identifiés comme potentiellement bénéfiques : exercices moteurs actifs assistés (power-assisted exercices) (Bossink et coll., 2017
). Cent dix-huit interventions ont été décrites par les thérapeutes comme « interventions motrices », 17 ont été retenues par les auteurs comme de véritables interventions motrices, parmi lesquelles 4 programmes moteurs ont été identifiés comme potentiellement bénéfiques : exercices moteurs actifs assistés (power-assisted exercices) (Bossink et coll., 2017 ), exercices moteurs aquatiques (balnéothérapie), des thérapies par le mouvement rythmique, et des programmes quotidiens intégrant des activités motrices où un engagement actif, même minime, de l’individu est répertorié. Toutefois, les auteurs soulignent que les 17 interventions retenues sont peu décrites dans leur contenu et que seules 12 interventions semblent avoir un rationnel théorique à l’utilisation de telle intervention motrice (notamment à la lumière des « ingrédients » de l’apprentissage moteur nécessaire à une rééducation motrice). Aucune intervention sur les 17 n’a pu fournir la preuve de son efficacité clinique (en termes d’amélioration de la fonction motrice) dans la littérature disponible.
), exercices moteurs aquatiques (balnéothérapie), des thérapies par le mouvement rythmique, et des programmes quotidiens intégrant des activités motrices où un engagement actif, même minime, de l’individu est répertorié. Toutefois, les auteurs soulignent que les 17 interventions retenues sont peu décrites dans leur contenu et que seules 12 interventions semblent avoir un rationnel théorique à l’utilisation de telle intervention motrice (notamment à la lumière des « ingrédients » de l’apprentissage moteur nécessaire à une rééducation motrice). Aucune intervention sur les 17 n’a pu fournir la preuve de son efficacité clinique (en termes d’amélioration de la fonction motrice) dans la littérature disponible. ). Très peu d’études sont donc disponibles, alors que l’on peut penser que ce type d’interventions pourraient avoir un effet bénéfique chez l’individu polyhandicapé par analogie avec les effets retrouvés de telles thérapies chez les personnes caractérisées par les niveaux GMFCS I-III. Des revues de la littérature systématiques (Novak et coll., 2013
). Très peu d’études sont donc disponibles, alors que l’on peut penser que ce type d’interventions pourraient avoir un effet bénéfique chez l’individu polyhandicapé par analogie avec les effets retrouvés de telles thérapies chez les personnes caractérisées par les niveaux GMFCS I-III. Des revues de la littérature systématiques (Novak et coll., 2013 ) (remises à jour régulièrement) existent bien quant à l’efficience de telles interventions motrices. Mais depuis 2013, il apparaît que, et malgré les conclusions de chaque étude qui poussent à développer la recherche chez les personnes sévèrement handicapées (« severe cerebral palsy »), peu, voire pas d’études cliniques, ont été réalisées spécifiquement chez les enfants caractérisés par les niveaux GMFCS IV-V, rendant difficiles les conclusions quant à l’efficience des interventions motrices chez ces derniers. Toutefois, à partir de ces revues de la littérature, quelques conclusions peuvent être tirées, et il est possible de conclure à l’inefficience (dans le but de l’amélioration de la fonction motrice) de certaines interventions comme les thérapies neurodéveloppementales (celles du type Bobath, Wojta, Padovan ou autres thérapies conductives…) ou les thérapies de type oxygénothérapie hyperbare. De façon générale, les interventions motrices avec peu voire pas d’engagement actif du participant dans la rééducation motrice, sans objectif précis, doivent être abandonnées. Ces éléments ont été repris dans les recommandations récentes de l’HAS (HAS, 2021
) (remises à jour régulièrement) existent bien quant à l’efficience de telles interventions motrices. Mais depuis 2013, il apparaît que, et malgré les conclusions de chaque étude qui poussent à développer la recherche chez les personnes sévèrement handicapées (« severe cerebral palsy »), peu, voire pas d’études cliniques, ont été réalisées spécifiquement chez les enfants caractérisés par les niveaux GMFCS IV-V, rendant difficiles les conclusions quant à l’efficience des interventions motrices chez ces derniers. Toutefois, à partir de ces revues de la littérature, quelques conclusions peuvent être tirées, et il est possible de conclure à l’inefficience (dans le but de l’amélioration de la fonction motrice) de certaines interventions comme les thérapies neurodéveloppementales (celles du type Bobath, Wojta, Padovan ou autres thérapies conductives…) ou les thérapies de type oxygénothérapie hyperbare. De façon générale, les interventions motrices avec peu voire pas d’engagement actif du participant dans la rééducation motrice, sans objectif précis, doivent être abandonnées. Ces éléments ont été repris dans les recommandations récentes de l’HAS (HAS, 2021 ). Ainsi, certaines thérapies à visée d’amélioration de la fonction motrice pourraient/devraient être abandonnées pour la rééducation motrice de la personne polyhandicapée.
). Ainsi, certaines thérapies à visée d’amélioration de la fonction motrice pourraient/devraient être abandonnées pour la rééducation motrice de la personne polyhandicapée. ), en lien avec des arguments existants quant à la plasticité cérébrale (et les moyens de la favoriser) et aux éléments d’apprentissage moteur, proposent, pour qu’une intervention ait une probabilité d’être efficace sur le plan de l’amélioration de la fonction motrice, que celle-ci soit dirigée vers un objectif précis, atteignable/réalisable (par exemple appuyer sur un contacteur), avec un engagement actif du participant et la présence de thérapeutes pour apporter des feedbacks et de la gratification. Ces interventions doivent s’inscrire dans le temps et être régulières.
), en lien avec des arguments existants quant à la plasticité cérébrale (et les moyens de la favoriser) et aux éléments d’apprentissage moteur, proposent, pour qu’une intervention ait une probabilité d’être efficace sur le plan de l’amélioration de la fonction motrice, que celle-ci soit dirigée vers un objectif précis, atteignable/réalisable (par exemple appuyer sur un contacteur), avec un engagement actif du participant et la présence de thérapeutes pour apporter des feedbacks et de la gratification. Ces interventions doivent s’inscrire dans le temps et être régulières. ). Les modalités des traitements de ces anomalies motrices ne sont pas spécifiques à la personne polyhandicapée, et certaines données dans la littérature hors polyhandicap peuvent être utiles pour renseigner sur les traitements possibles qu’ils soient médicamenteux ou chirurgicaux.
). Les modalités des traitements de ces anomalies motrices ne sont pas spécifiques à la personne polyhandicapée, et certaines données dans la littérature hors polyhandicap peuvent être utiles pour renseigner sur les traitements possibles qu’ils soient médicamenteux ou chirurgicaux. ; Kudva et coll., 2021
; Kudva et coll., 2021 ). Il est important de noter ici que la spasticité sera traitée si et seulement si elle apparaît comme gênante pour la fonction motrice ou comme pénalisante pour la croissance de l’appareil locomoteur (cf. ci-dessous, prévention des déficits secondaires) ou pénalisant la qualité de vie (par des douleurs notamment). Cette partie n’est pas une revue exhaustive de ce qui peut être proposé. Toutefois, on notera que dans le cadre du polyhandicap, et en cas de spasticité focale, l’injection intramusculaire de toxine botulique permet la diminution de la spasticité (Bekteshi et coll., 2023
). Il est important de noter ici que la spasticité sera traitée si et seulement si elle apparaît comme gênante pour la fonction motrice ou comme pénalisante pour la croissance de l’appareil locomoteur (cf. ci-dessous, prévention des déficits secondaires) ou pénalisant la qualité de vie (par des douleurs notamment). Cette partie n’est pas une revue exhaustive de ce qui peut être proposé. Toutefois, on notera que dans le cadre du polyhandicap, et en cas de spasticité focale, l’injection intramusculaire de toxine botulique permet la diminution de la spasticité (Bekteshi et coll., 2023 ). Il paraît aussi intéressant de mentionner et de discuter des traitements chirurgicaux de la spasticité généralisée, qui ces dernières années, ont beaucoup animé la communauté médicale mais aussi les familles. La radicellectomie (ou en anglais Single Root Dorsal Rhizotomy) des voies sensitives postérieures peut être proposée aux enfants polyhandicapés. Cette intervention neurochirurgicale, définitive, de la spasticité diffuse des membres inférieurs, a montré, dans une revue de la littérature de 1 016 patients (non uniquement polyhandicapés) (Kudva et coll., 2021
). Il paraît aussi intéressant de mentionner et de discuter des traitements chirurgicaux de la spasticité généralisée, qui ces dernières années, ont beaucoup animé la communauté médicale mais aussi les familles. La radicellectomie (ou en anglais Single Root Dorsal Rhizotomy) des voies sensitives postérieures peut être proposée aux enfants polyhandicapés. Cette intervention neurochirurgicale, définitive, de la spasticité diffuse des membres inférieurs, a montré, dans une revue de la littérature de 1 016 patients (non uniquement polyhandicapés) (Kudva et coll., 2021 ), une relative efficacité quant à la diminution de la spasticité de 0,12 à 2,6 points (SD4
± 1,3) sur l’échelle d’Ashworth avec une amélioration des performances motrices mesurée sur une échelle de motricité globale (GMFM-66 : Gross Motor Function Measure-66) de plus de 6,5 points (SD ± 5,9) à 12,1 points (SD ± 18,9). Si la radicellectomie semble efficace pour le traitement de la spasticité, il reste à bien définir l’âge optimal d’intervention, la technique neurochirurgicale à préconiser, et le programme de rééducation à l’issue de cette intervention. Les effets bénéfiques de cette intervention ont été décrits dans le cadre de la spasticité, et non dans le cas des dyskinésies. Une autre intervention neurochirurgicale, consistant à la mise en place d’un dispositif à libération intrathécale de baclofène (dit pompe à baclofène), existe pour lutter contre la spasticité avec un effet sur la spasticité des membres inférieurs et supérieurs. Ce dispositif est un traitement non définitif de la spasticité. Sur 321 patients (non exclusivement polyhandicapés) traités par baclofène intrathécal, une revue de la littérature (Kudva et coll., 2021
), une relative efficacité quant à la diminution de la spasticité de 0,12 à 2,6 points (SD4
± 1,3) sur l’échelle d’Ashworth avec une amélioration des performances motrices mesurée sur une échelle de motricité globale (GMFM-66 : Gross Motor Function Measure-66) de plus de 6,5 points (SD ± 5,9) à 12,1 points (SD ± 18,9). Si la radicellectomie semble efficace pour le traitement de la spasticité, il reste à bien définir l’âge optimal d’intervention, la technique neurochirurgicale à préconiser, et le programme de rééducation à l’issue de cette intervention. Les effets bénéfiques de cette intervention ont été décrits dans le cadre de la spasticité, et non dans le cas des dyskinésies. Une autre intervention neurochirurgicale, consistant à la mise en place d’un dispositif à libération intrathécale de baclofène (dit pompe à baclofène), existe pour lutter contre la spasticité avec un effet sur la spasticité des membres inférieurs et supérieurs. Ce dispositif est un traitement non définitif de la spasticité. Sur 321 patients (non exclusivement polyhandicapés) traités par baclofène intrathécal, une revue de la littérature (Kudva et coll., 2021 ) montre une efficacité sur la spasticité allant de moins 1,2 point (SD ± 0,72) à 2,32 points (SD ± 0,39) sur l’échelle d’Ashworth, avec une amélioration des performances motrices globales mesurée sur l’échelle GMFM-66 de 1,2 point (SD ± 2,3) à 4,6 points (SD ± 10,6). Cette amélioration s’accompagne de celle de l’atteinte des objectifs personnels notamment de soins de nursing et autres soins (faciliter l’habillage, positionnement, diminution des douleurs…). Il faut noter que 95 % des individus traités par baclofène intrathécal sont caractérisés par les niveaux GMFCS IV et V (82 % avec une forme spastique bilatérale) et que 3 à 4 % des enfants avec paralysie cérébrale (0,4 à 4,7 % selon les pays) ont un traitement par ce dispositif (Motta et coll., 2007
) montre une efficacité sur la spasticité allant de moins 1,2 point (SD ± 0,72) à 2,32 points (SD ± 0,39) sur l’échelle d’Ashworth, avec une amélioration des performances motrices globales mesurée sur l’échelle GMFM-66 de 1,2 point (SD ± 2,3) à 4,6 points (SD ± 10,6). Cette amélioration s’accompagne de celle de l’atteinte des objectifs personnels notamment de soins de nursing et autres soins (faciliter l’habillage, positionnement, diminution des douleurs…). Il faut noter que 95 % des individus traités par baclofène intrathécal sont caractérisés par les niveaux GMFCS IV et V (82 % avec une forme spastique bilatérale) et que 3 à 4 % des enfants avec paralysie cérébrale (0,4 à 4,7 % selon les pays) ont un traitement par ce dispositif (Motta et coll., 2007 ). Concernant ce traitement, une question existe quant à la décompensation potentielle de scoliose après implantation d’une pompe à baclofène chez les individus caractérisés par les niveaux GMFCS IV et V (Lee et coll., 2023
). Concernant ce traitement, une question existe quant à la décompensation potentielle de scoliose après implantation d’une pompe à baclofène chez les individus caractérisés par les niveaux GMFCS IV et V (Lee et coll., 2023 ), cet élément doit être surveillé et évalué.
), cet élément doit être surveillé et évalué. ). En effet, malgré l’existence de nombreuses recommandations pour le traitement de ces anomalies motrices (Koy et coll., 2016
). En effet, malgré l’existence de nombreuses recommandations pour le traitement de ces anomalies motrices (Koy et coll., 2016 ), ces traitements peuvent être méconnus des équipes voire mal utilisés, rendant difficile l’accès à ce type de traitement pour les individus polyhandicapés.
), ces traitements peuvent être méconnus des équipes voire mal utilisés, rendant difficile l’accès à ce type de traitement pour les individus polyhandicapés. ) illustre bien ces aspects (Rosenberg et coll., 2021
) illustre bien ces aspects (Rosenberg et coll., 2021 ). Il s’agit d’une étude pilote de faisabilité d’un stage estival de rééducation motrice dont l’objectif est l’apprentissage de la déambulation autonome en fauteuil roulant. Cinq adolescents avec une « paralysie cérébrale sévère » (severe cerebral palsy) (âgés de 11 à 15 ans) ont bénéficié pendant 3 semaines consécutives (à raison de 5 jours par semaine) d’interventions motrices avec pour objectif l’apprentissage de la déambulation autonome en fauteuil roulant électrique. L’intervention thérapeutique était menée par un ergothérapeute expert en polyhandicap et en apprentissage moteur, assisté de 5 thérapeutes (5 étudiants en ergothérapie) pour permettre un ratio d’un thérapeute pour un enfant. Dans un premier temps, chaque adolescent avait un fauteuil roulant électrique adapté au niveau de l’assise pour garantir le meilleur positionnement possible de l’individu dans le fauteuil. Ensuite, le meilleur mode de manipulation du fauteuil était déterminé, certaines modifications technologiques pouvaient même être apportées à la commande (joystick à la main pour 3 sujets, une commande au pied, et une commande à la tête) pour chaque enfant. Les entraînements moteurs étaient conçus par les thérapeutes selon l’évaluation fonctionnelle faite chez les patients et en respectant les principes d’apprentissage moteur (feedback, exercice du plus simple au plus complexe, exercice en contexte, orienté vers un objectif précis, ici la manipulation du joystick, pour permettre in fine une déambulation avec le fauteuil). Initialement l’entraînement se faisait via des exercices de manipulation du joystick sur écran par exemple, puis à terme, en fonction des progrès, en condition de déambulation en intérieur et en extérieur. Cette étude a montré qu’un tel programme d’intervention était faisable et apprécié par les participants, au-delà du seul aspect moteur, potentiellement efficace sur les objectifs à moyen terme que les individus se fixaient en lien avec l’équipe multidisciplinaire. L’évaluation des capacités de l’individu et la fixation des objectifs atteignables sont des clés de succès de telles interventions. Les auteurs concluaient en la nécessité d’une évaluation de ce type de stage (reposant sur les principes d’apprentissage moteur) à plus grande échelle mais encourageaient les équipes de soins à s’engager dans cette voie des thérapies intensives, en groupe, ludiques en lien avec des objectifs d’activité motrice.
). Il s’agit d’une étude pilote de faisabilité d’un stage estival de rééducation motrice dont l’objectif est l’apprentissage de la déambulation autonome en fauteuil roulant. Cinq adolescents avec une « paralysie cérébrale sévère » (severe cerebral palsy) (âgés de 11 à 15 ans) ont bénéficié pendant 3 semaines consécutives (à raison de 5 jours par semaine) d’interventions motrices avec pour objectif l’apprentissage de la déambulation autonome en fauteuil roulant électrique. L’intervention thérapeutique était menée par un ergothérapeute expert en polyhandicap et en apprentissage moteur, assisté de 5 thérapeutes (5 étudiants en ergothérapie) pour permettre un ratio d’un thérapeute pour un enfant. Dans un premier temps, chaque adolescent avait un fauteuil roulant électrique adapté au niveau de l’assise pour garantir le meilleur positionnement possible de l’individu dans le fauteuil. Ensuite, le meilleur mode de manipulation du fauteuil était déterminé, certaines modifications technologiques pouvaient même être apportées à la commande (joystick à la main pour 3 sujets, une commande au pied, et une commande à la tête) pour chaque enfant. Les entraînements moteurs étaient conçus par les thérapeutes selon l’évaluation fonctionnelle faite chez les patients et en respectant les principes d’apprentissage moteur (feedback, exercice du plus simple au plus complexe, exercice en contexte, orienté vers un objectif précis, ici la manipulation du joystick, pour permettre in fine une déambulation avec le fauteuil). Initialement l’entraînement se faisait via des exercices de manipulation du joystick sur écran par exemple, puis à terme, en fonction des progrès, en condition de déambulation en intérieur et en extérieur. Cette étude a montré qu’un tel programme d’intervention était faisable et apprécié par les participants, au-delà du seul aspect moteur, potentiellement efficace sur les objectifs à moyen terme que les individus se fixaient en lien avec l’équipe multidisciplinaire. L’évaluation des capacités de l’individu et la fixation des objectifs atteignables sont des clés de succès de telles interventions. Les auteurs concluaient en la nécessité d’une évaluation de ce type de stage (reposant sur les principes d’apprentissage moteur) à plus grande échelle mais encourageaient les équipes de soins à s’engager dans cette voie des thérapies intensives, en groupe, ludiques en lien avec des objectifs d’activité motrice. ) aux États-Unis, allant de 39 % pour la catégorie de 6 à 10 ans à plus de 66 % après 15 ans. Dans une étude ultérieure en Grande-Bretagne (Kerr et coll., 2003
) aux États-Unis, allant de 39 % pour la catégorie de 6 à 10 ans à plus de 66 % après 15 ans. Dans une étude ultérieure en Grande-Bretagne (Kerr et coll., 2003 ), il est même décrit une prévalence de la scoliose de 87 % chez les personnes avec un syndrome de Rett, avec une augmentation de la courbure (mesurée par l’angle de Cobb) avec l’âge. De façon intéressante, sur 231 cas de syndrome de Rett, une étude (Ager et coll., 2006
), il est même décrit une prévalence de la scoliose de 87 % chez les personnes avec un syndrome de Rett, avec une augmentation de la courbure (mesurée par l’angle de Cobb) avec l’âge. De façon intéressante, sur 231 cas de syndrome de Rett, une étude (Ager et coll., 2006 ) montre un âge médian d’apparition de scoliose à 9,8 ans, avec 75 % des personnes ayant développé leur scoliose à 13 ans, et cherche à analyser les facteurs de survenue précoce d’un tel déficit secondaire. Il apparaît alors que plus les enfants ont un déficit moteur sévère (les enfants les moins mobiles à 10 mois, les enfants n’ayant jamais marché), plus le risque d’apparition de la scoliose est majeur. De la même manière, selon une revue de la littérature publiée en 2019 (Holmes et coll., 2019
) montre un âge médian d’apparition de scoliose à 9,8 ans, avec 75 % des personnes ayant développé leur scoliose à 13 ans, et cherche à analyser les facteurs de survenue précoce d’un tel déficit secondaire. Il apparaît alors que plus les enfants ont un déficit moteur sévère (les enfants les moins mobiles à 10 mois, les enfants n’ayant jamais marché), plus le risque d’apparition de la scoliose est majeur. De la même manière, selon une revue de la littérature publiée en 2019 (Holmes et coll., 2019 ) réalisée chez les adultes présentant une paralysie cérébrale de niveaux GMFCS IV-V, la prévalence globale de la scoliose est estimée entre 77 % et 90 % (Murphy et coll., 1995
) réalisée chez les adultes présentant une paralysie cérébrale de niveaux GMFCS IV-V, la prévalence globale de la scoliose est estimée entre 77 % et 90 % (Murphy et coll., 1995 ; Rodby-Bousquet et coll., 2013
; Rodby-Bousquet et coll., 2013 ) avec pour certains auteurs, un angle de Cobb moyen de 66° (Senaran et coll., 2007
) avec pour certains auteurs, un angle de Cobb moyen de 66° (Senaran et coll., 2007 ). Dans une population d’enfants (Willoughby et coll., 2022
). Dans une population d’enfants (Willoughby et coll., 2022 ) avec paralysie cérébrale, 18 % des enfants caractérisés par le niveau GMFCS IV et 48 % des enfants caractérisés par le niveau GMFCS V ont une scoliose avec un angle de Cobb supérieur à 40°. Aussi, le fait d’avoir une atteinte sévère motrice chez les personnes avec paralysie cérébrale est un facteur de risque majeur de développer une scoliose (hazard ratio estimé à 15 pour un individu caractérisé par le niveau GMFCS IV de développer une scoliose par rapport à un individu caractérisé par le niveau GMFCS I ou II ; hazard ratio à 53 pour un individu caractérisé par le niveau GMFCS V) (Hägglund et coll., 2018
) avec paralysie cérébrale, 18 % des enfants caractérisés par le niveau GMFCS IV et 48 % des enfants caractérisés par le niveau GMFCS V ont une scoliose avec un angle de Cobb supérieur à 40°. Aussi, le fait d’avoir une atteinte sévère motrice chez les personnes avec paralysie cérébrale est un facteur de risque majeur de développer une scoliose (hazard ratio estimé à 15 pour un individu caractérisé par le niveau GMFCS IV de développer une scoliose par rapport à un individu caractérisé par le niveau GMFCS I ou II ; hazard ratio à 53 pour un individu caractérisé par le niveau GMFCS V) (Hägglund et coll., 2018 ). La scoliose apparaît d’autant plus probable chez l’individu avec paralysie cérébrale que la scoliose a débuté tôt dans la vie de l’individu (avant l’âge de 6 ans, ou avec un angle de Cobb au moins à 30° avant 10 ans) et que l’individu a une atteinte motrice sévère (GMFCS V) (Yoshida et coll., 2018
). La scoliose apparaît d’autant plus probable chez l’individu avec paralysie cérébrale que la scoliose a débuté tôt dans la vie de l’individu (avant l’âge de 6 ans, ou avec un angle de Cobb au moins à 30° avant 10 ans) et que l’individu a une atteinte motrice sévère (GMFCS V) (Yoshida et coll., 2018 ). Il faut noter que dans le cadre du polyhandicap, la scoliose ou cyphoscoliose peut être accompagnée de déformations thoraciques pouvant se développer tôt dans la vie de l’enfant et dont le risque de survenue augmente avec l’âge (Horimoto et coll., 2014
). Il faut noter que dans le cadre du polyhandicap, la scoliose ou cyphoscoliose peut être accompagnée de déformations thoraciques pouvant se développer tôt dans la vie de l’enfant et dont le risque de survenue augmente avec l’âge (Horimoto et coll., 2014 ).
). ) qui renseigne sur le pourcentage de « découverture » de la hanche (plus l’indice est grand, plus la tête fémorale a migré et plus la hanche « souffre »). Aussi sur 56 enfants ayant un syndrome de Rett (Kanashvili et coll., 2021
) qui renseigne sur le pourcentage de « découverture » de la hanche (plus l’indice est grand, plus la tête fémorale a migré et plus la hanche « souffre »). Aussi sur 56 enfants ayant un syndrome de Rett (Kanashvili et coll., 2021 ), 36 % ont une migration de la tête fémorale de plus de 30 % avec un âge de début à 7,7 ans. Dans cette population, l’absence de marche acquise (reflet de la sévérité de l’atteinte motrice) et la présence d’une scoliose et d’épilepsie (qui pourrait être le reflet de la sévérité de la maladie causale ?) sont associées au risque de développer une pathologie de hanche. Chez l’enfant avec paralysie cérébrale sévère (GMFCS IV et V), 90 % des enfants ont un problème de hanche (Soo et coll., 2006
), 36 % ont une migration de la tête fémorale de plus de 30 % avec un âge de début à 7,7 ans. Dans cette population, l’absence de marche acquise (reflet de la sévérité de l’atteinte motrice) et la présence d’une scoliose et d’épilepsie (qui pourrait être le reflet de la sévérité de la maladie causale ?) sont associées au risque de développer une pathologie de hanche. Chez l’enfant avec paralysie cérébrale sévère (GMFCS IV et V), 90 % des enfants ont un problème de hanche (Soo et coll., 2006 ; Bouwhuis et coll., 2015
; Bouwhuis et coll., 2015 ; Hägglund et coll., 2016
; Hägglund et coll., 2016 ) dont plus de 25 % ont une migration de la tête fémorale de plus de 30 % (Holmes et coll., 2019
) dont plus de 25 % ont une migration de la tête fémorale de plus de 30 % (Holmes et coll., 2019 ). Par ailleurs, associée aux problèmes de hanche, plus de 40 % des individus avec paralysie cérébrale de niveaux GMFCS IV et V présentent une asymétrie du bassin et des membres inférieurs en « coup de vent » (Holmes et coll., 2019
). Par ailleurs, associée aux problèmes de hanche, plus de 40 % des individus avec paralysie cérébrale de niveaux GMFCS IV et V présentent une asymétrie du bassin et des membres inférieurs en « coup de vent » (Holmes et coll., 2019 ). Cette prévalence importante des pathologies de hanche a fait recommander une surveillance radiologique au moins annuelle chez l’enfant avec paralysie cérébrale de niveaux GMFCS IV et V entre l’âge de 2 et 8 ans puis tous les 2 ans ensuite (Pruszczynski et coll., 2016
). Cette prévalence importante des pathologies de hanche a fait recommander une surveillance radiologique au moins annuelle chez l’enfant avec paralysie cérébrale de niveaux GMFCS IV et V entre l’âge de 2 et 8 ans puis tous les 2 ans ensuite (Pruszczynski et coll., 2016 ). Si la migration de la tête fémorale est supérieure à 30 %, la surveillance est semestrielle de 2 à 8 ans, puis annuelle à partir de 8 ans. Une intervention thérapeutique est à discuter pour une migration supérieure à 30 % (cf. infra). Concernant les anomalies des membres inférieurs, Holmes et coll. (2019
). Si la migration de la tête fémorale est supérieure à 30 %, la surveillance est semestrielle de 2 à 8 ans, puis annuelle à partir de 8 ans. Une intervention thérapeutique est à discuter pour une migration supérieure à 30 % (cf. infra). Concernant les anomalies des membres inférieurs, Holmes et coll. (2019 ) décrivent dans leur revue de la littérature, chez des adultes avec paralysie cérébrale non-marchants (GMFCS IV et V), une prévalence, selon les études répertoriées, de 14 à 100 % de rétraction des hanches et de 32 à 87 % de rétraction des genoux (Holmes et coll., 2019
) décrivent dans leur revue de la littérature, chez des adultes avec paralysie cérébrale non-marchants (GMFCS IV et V), une prévalence, selon les études répertoriées, de 14 à 100 % de rétraction des hanches et de 32 à 87 % de rétraction des genoux (Holmes et coll., 2019 ). Devant ces rétractions, des auteurs (Howard et Herzog, 2021
). Devant ces rétractions, des auteurs (Howard et Herzog, 2021 ) ont émis l’hypothèse qu’il existait, chez l’individu polyhandicapé (notamment avec paralysie cérébrale sévère), en dehors des effets de l’immobilité, des anomalies du muscle per se liées à des phénomènes épigénétiques (réduction de la taille du muscle, du tissu contractile, défaut dans les sarcomères) favorisant alors les rétractions. Ces hypothèses doivent être confirmées.
) ont émis l’hypothèse qu’il existait, chez l’individu polyhandicapé (notamment avec paralysie cérébrale sévère), en dehors des effets de l’immobilité, des anomalies du muscle per se liées à des phénomènes épigénétiques (réduction de la taille du muscle, du tissu contractile, défaut dans les sarcomères) favorisant alors les rétractions. Ces hypothèses doivent être confirmées. ), il est noté une prévalence de 41 % de plaies cutanées notamment au niveau des membres supérieurs (19 % mains, 29 % doigts), et des rétractions articulaires des membres supérieurs (épaule 33 %, coude 29 %) associées à l’âge (avec une plus grande probabilité après 10 ans) et à la sévérité du syndrome notamment de l’atteinte motrice.
), il est noté une prévalence de 41 % de plaies cutanées notamment au niveau des membres supérieurs (19 % mains, 29 % doigts), et des rétractions articulaires des membres supérieurs (épaule 33 %, coude 29 %) associées à l’âge (avec une plus grande probabilité après 10 ans) et à la sévérité du syndrome notamment de l’atteinte motrice. ). Ces trois déformations orthopédiques sont plus fréquemment associées à la présence de trouble du tonus axial important ainsi qu’à la sévérité de l’atteinte motrice et la présence de l’épilepsie. De la même façon, chez 99 adultes polyhandicapés, van Timmeren et coll. (2017
). Ces trois déformations orthopédiques sont plus fréquemment associées à la présence de trouble du tonus axial important ainsi qu’à la sévérité de l’atteinte motrice et la présence de l’épilepsie. De la même façon, chez 99 adultes polyhandicapés, van Timmeren et coll. (2017 ) montrent cette même co-occurrence entre les différentes déformations chez un même individu (van Timmeren et coll., 2017
) montrent cette même co-occurrence entre les différentes déformations chez un même individu (van Timmeren et coll., 2017 ). Ces facteurs sont en fait associés et relatent la gravité de la situation en décrivant des facteurs de risque qui soulignent « le degré d’immobilité » de l’individu. Plus un individu a une atteinte sévère de son polyhandicap, plus celui-ci risque d’être peu mobilisé, peu « verticalisé » et a donc un plus fort risque de déformations orthopédiques à différents niveaux, liées à l’absence de pesanteur relative (défaut de verticalisation dans le champ de gravité) et à la croissance.
). Ces facteurs sont en fait associés et relatent la gravité de la situation en décrivant des facteurs de risque qui soulignent « le degré d’immobilité » de l’individu. Plus un individu a une atteinte sévère de son polyhandicap, plus celui-ci risque d’être peu mobilisé, peu « verticalisé » et a donc un plus fort risque de déformations orthopédiques à différents niveaux, liées à l’absence de pesanteur relative (défaut de verticalisation dans le champ de gravité) et à la croissance. ), 61 à 92 % des adultes avec paralysie cérébrale GMFCS IV et V requièrent un support (matelas) pour être allongés confortablement et « alignés », 100 % requièrent un support adapté pour être « bien » assis dans un fauteuil, et 61 % à 100 % utiliseraient un système de verticalisation (Rodby-Bousquet et Agustsson, 2021
), 61 à 92 % des adultes avec paralysie cérébrale GMFCS IV et V requièrent un support (matelas) pour être allongés confortablement et « alignés », 100 % requièrent un support adapté pour être « bien » assis dans un fauteuil, et 61 % à 100 % utiliseraient un système de verticalisation (Rodby-Bousquet et Agustsson, 2021 ). La mise en place de ces appareillages ou aides techniques de maintien de posture peut entraîner un stress psychologique de l’individu polyhandicapé, voire compliquer la situation médicale (cas de la position ventrale) et le dégagement des voies aériennes (Matsuda et coll., 2022
). La mise en place de ces appareillages ou aides techniques de maintien de posture peut entraîner un stress psychologique de l’individu polyhandicapé, voire compliquer la situation médicale (cas de la position ventrale) et le dégagement des voies aériennes (Matsuda et coll., 2022 ), et nécessite d’être questionnée au moment des installations.
), et nécessite d’être questionnée au moment des installations. ) sur la posture des enfants avec paralysie cérébrale sévère (GMFCS IV et V) indiquait de mettre en place tôt dans la vie de l’enfant un matelas moulé (matelas sur mesure) avec contrôle de la posture des hanches et du rachis, de proposer une assise adaptée (sur mesure ± sur moulage) dès 6 mois et un appareillage de verticalisation dès 12 mois. Paleg et coll. (2013
) sur la posture des enfants avec paralysie cérébrale sévère (GMFCS IV et V) indiquait de mettre en place tôt dans la vie de l’enfant un matelas moulé (matelas sur mesure) avec contrôle de la posture des hanches et du rachis, de proposer une assise adaptée (sur mesure ± sur moulage) dès 6 mois et un appareillage de verticalisation dès 12 mois. Paleg et coll. (2013 ) ont conduit en 2013 une revue systématique de la littérature quant à la pertinence de proposer aux enfants avec paralysie cérébrale sévère un programme de verticalisation via l’utilisation de support adapté (standing, verticalisateur sur mesure…) (Paleg et coll., 2013
) ont conduit en 2013 une revue systématique de la littérature quant à la pertinence de proposer aux enfants avec paralysie cérébrale sévère un programme de verticalisation via l’utilisation de support adapté (standing, verticalisateur sur mesure…) (Paleg et coll., 2013 ). Ce type de programme semble relativement efficace pour permettre une meilleure densité osseuse (et prévenir l’ostéopénie), permettre un maintien des amplitudes articulaires (hanches, genoux, chevilles) et une diminution de la spasticité (-1 point sur l’échelle d’Ashworth). Toutefois, ce programme doit être réalisé quotidiennement (au moins 5 jours par semaine) sur des séances de 30 à 60 minutes. Il nécessite donc de pouvoir installer les personnes polyhandicapées dans ce type d’appareillage via des moyens humains importants. Ce type de programme de verticalisation est à promouvoir chez les personnes polyhandicapées quand l’enfant est théoriquement en âge de se tenir debout. Mais on peut penser que ce type de programme nécessite des professionnels formés pour rendre ces programmes opérationnels notamment dans les structures et lieux de vie des personnes polyhandicapées.
). Ce type de programme semble relativement efficace pour permettre une meilleure densité osseuse (et prévenir l’ostéopénie), permettre un maintien des amplitudes articulaires (hanches, genoux, chevilles) et une diminution de la spasticité (-1 point sur l’échelle d’Ashworth). Toutefois, ce programme doit être réalisé quotidiennement (au moins 5 jours par semaine) sur des séances de 30 à 60 minutes. Il nécessite donc de pouvoir installer les personnes polyhandicapées dans ce type d’appareillage via des moyens humains importants. Ce type de programme de verticalisation est à promouvoir chez les personnes polyhandicapées quand l’enfant est théoriquement en âge de se tenir debout. Mais on peut penser que ce type de programme nécessite des professionnels formés pour rendre ces programmes opérationnels notamment dans les structures et lieux de vie des personnes polyhandicapées. ). Les orthèses proposées doivent maintenir la symétrie de l’appareil locomoteur sans compromettre la fonction motrice, ni l’état cutané, surtout pour les personnes polyhandicapées incapables de changer de position. L’effet des postures (Novak et coll., 2020
). Les orthèses proposées doivent maintenir la symétrie de l’appareil locomoteur sans compromettre la fonction motrice, ni l’état cutané, surtout pour les personnes polyhandicapées incapables de changer de position. L’effet des postures (Novak et coll., 2020 ) via le port d’orthèses (le plus souvent sur mesure) diurnes et/ou nocturnes notamment au niveau des membres inférieurs semble avoir montré sa relative efficacité pour prévenir les déformations et garantir un relatif alignement de la statique de l’appareil locomoteur chez les personnes avec paralysie cérébrale. Cependant, les différentes recherches cliniques disponibles dans la littérature, pour évaluer l’efficacité du port des postures et autres orthèses de support sur mesure (dites orthèses de grand appareillage) chez les personnes polyhandicapées, sont réalisées le plus souvent dans des groupes hétérogènes de patients (notamment pour la paralysie cérébrale, elles ne se focalisent pas sur les niveaux GMFCS IV et V), avec un effectif le plus souvent trop petit et des techniques de posture et autres types orthèses aussi très hétérogènes, entre les différentes études et à l’intérieur parfois de la même étude. Il apparaît donc difficile de prouver clairement l’efficacité des postures pour prévenir la survenue des déformations orthopédiques chez la personne polyhandicapée (Robertson et coll., 2018
) via le port d’orthèses (le plus souvent sur mesure) diurnes et/ou nocturnes notamment au niveau des membres inférieurs semble avoir montré sa relative efficacité pour prévenir les déformations et garantir un relatif alignement de la statique de l’appareil locomoteur chez les personnes avec paralysie cérébrale. Cependant, les différentes recherches cliniques disponibles dans la littérature, pour évaluer l’efficacité du port des postures et autres orthèses de support sur mesure (dites orthèses de grand appareillage) chez les personnes polyhandicapées, sont réalisées le plus souvent dans des groupes hétérogènes de patients (notamment pour la paralysie cérébrale, elles ne se focalisent pas sur les niveaux GMFCS IV et V), avec un effectif le plus souvent trop petit et des techniques de posture et autres types orthèses aussi très hétérogènes, entre les différentes études et à l’intérieur parfois de la même étude. Il apparaît donc difficile de prouver clairement l’efficacité des postures pour prévenir la survenue des déformations orthopédiques chez la personne polyhandicapée (Robertson et coll., 2018 ; Holmes et coll., 2019
; Holmes et coll., 2019 ). Ces derniers auteurs questionnent alors le bénéfice et la pertinence des installations et postures, notamment celles portées nuit et jour (Robertson et coll., 2018
). Ces derniers auteurs questionnent alors le bénéfice et la pertinence des installations et postures, notamment celles portées nuit et jour (Robertson et coll., 2018 ).
). ) montre que la hanche est mieux contenue, et que l’on parvient à prévenir le degré de migration de la tête fémorale, quand l’enfant est positionné dans des orthèses de posture dans les 3 positions (allongé/assis/verticalisé). Une autre étude (Pountney et coll., 2009
) montre que la hanche est mieux contenue, et que l’on parvient à prévenir le degré de migration de la tête fémorale, quand l’enfant est positionné dans des orthèses de posture dans les 3 positions (allongé/assis/verticalisé). Une autre étude (Pountney et coll., 2009 ), de la même équipe, montre que l’utilisation de posture de hanche prévient les subluxations de hanche à 5 ans du début de la posture comparativement à des enfants ayant peu recours à ce type de traitement. Toutefois, il semble que l’efficience clinique de telles postures bénéficie plus aux enfants les moins sévèrement atteints sur le plan moteur, et que les enfants les plus sévèrement atteints sur le plan moteur semblent avoir moins de bénéfices quant à la prévention neuro-orthopédique par les postures, alors que dans le même temps, ce sont eux qui supportent le moins les postures et subissent le plus d’inconfort lié aux postures (Gough, 2009
), de la même équipe, montre que l’utilisation de posture de hanche prévient les subluxations de hanche à 5 ans du début de la posture comparativement à des enfants ayant peu recours à ce type de traitement. Toutefois, il semble que l’efficience clinique de telles postures bénéficie plus aux enfants les moins sévèrement atteints sur le plan moteur, et que les enfants les plus sévèrement atteints sur le plan moteur semblent avoir moins de bénéfices quant à la prévention neuro-orthopédique par les postures, alors que dans le même temps, ce sont eux qui supportent le moins les postures et subissent le plus d’inconfort lié aux postures (Gough, 2009 ). Dans une étude clinique récente, Kim et coll. (2019
). Dans une étude clinique récente, Kim et coll. (2019 ) compare chez 42 enfants avec paralysie cérébrale de niveaux GMFCS IV et V l’efficacité d’une assise adaptée (avec maintien de la posture de hanche en abduction) sur le niveau de déformation de la hanche (par mesure radiologique) versus l’absence de système d’assise adaptée (groupe contrôle n = 34 enfants) (Kim et coll., 2019
) compare chez 42 enfants avec paralysie cérébrale de niveaux GMFCS IV et V l’efficacité d’une assise adaptée (avec maintien de la posture de hanche en abduction) sur le niveau de déformation de la hanche (par mesure radiologique) versus l’absence de système d’assise adaptée (groupe contrôle n = 34 enfants) (Kim et coll., 2019 ). De façon tout à fait surprenante, le degré de migration de la tête fémorale est plus important pour le groupe avec assise adaptée que pour le groupe sans assise. Ici l’assise adaptée avec maintien de l’abduction de hanche semble plus délétère pour la hanche. Les auteurs fournissent une hypothèse, très plausible, quant à ce résultat surprenant et à rebours de ce qui se pratique en routine clinique. Selon ces derniers, en favorisant l’abduction de hanche via un plot d’abduction, on favorise l’étirement des muscles adducteurs de hanche, qui étant spastiques, se contractent en retour contre le plot, favorisant alors une décoaptation de la hanche (d’autant plus favorisée que les muscles abducteurs de hanche sont faibles), favorisant alors la découverture des hanches. À partir de cette étude, l’assise avec plot d’abduction ne semble donc pas efficace, voire semble délétère pour prévenir les pathologies de hanche liées au polyhandicap. Ce résultat a fait employer aux auteurs le titre suivant : « Les systèmes d’assise avec support médial du genou (plot d’abduction) sont-ils vraiment utiles pour la prévention du déplacement de la hanche chez les enfants avec paralysie cérébrale spastique GMFCS IV et V ? » (« Are Seating Systems With a Medial Knee Support Really Helpful for Hip Displacement in Children With Spastic Cerebral Palsy GMFCS IV and V? »). Il est cependant difficile de conclure, après une seule étude, sur le caractère délétère ou non d’un tel positionnement de hanche, alors que celui-ci est pratiqué quasi systématiquement chez la personne polyhandicapée. Toutefois, cette étude a le mérite de souligner la nécessité de réaliser des études cliniques de grande ampleur quant au rationnel et au bien-fondé d’imposer des postures parfois inconfortables dans le but de prévenir d’éventuelles déformations orthopédiques.
). De façon tout à fait surprenante, le degré de migration de la tête fémorale est plus important pour le groupe avec assise adaptée que pour le groupe sans assise. Ici l’assise adaptée avec maintien de l’abduction de hanche semble plus délétère pour la hanche. Les auteurs fournissent une hypothèse, très plausible, quant à ce résultat surprenant et à rebours de ce qui se pratique en routine clinique. Selon ces derniers, en favorisant l’abduction de hanche via un plot d’abduction, on favorise l’étirement des muscles adducteurs de hanche, qui étant spastiques, se contractent en retour contre le plot, favorisant alors une décoaptation de la hanche (d’autant plus favorisée que les muscles abducteurs de hanche sont faibles), favorisant alors la découverture des hanches. À partir de cette étude, l’assise avec plot d’abduction ne semble donc pas efficace, voire semble délétère pour prévenir les pathologies de hanche liées au polyhandicap. Ce résultat a fait employer aux auteurs le titre suivant : « Les systèmes d’assise avec support médial du genou (plot d’abduction) sont-ils vraiment utiles pour la prévention du déplacement de la hanche chez les enfants avec paralysie cérébrale spastique GMFCS IV et V ? » (« Are Seating Systems With a Medial Knee Support Really Helpful for Hip Displacement in Children With Spastic Cerebral Palsy GMFCS IV and V? »). Il est cependant difficile de conclure, après une seule étude, sur le caractère délétère ou non d’un tel positionnement de hanche, alors que celui-ci est pratiqué quasi systématiquement chez la personne polyhandicapée. Toutefois, cette étude a le mérite de souligner la nécessité de réaliser des études cliniques de grande ampleur quant au rationnel et au bien-fondé d’imposer des postures parfois inconfortables dans le but de prévenir d’éventuelles déformations orthopédiques. ). Ainsi la réalité clinique montre qu’en l’absence d’assise adaptée une personne polyhandicapée ne peut tenir assise de façon indépendante, et donc ne peut bénéficier de déplacement aisé pour participer à la vie sociale de la famille, de l’institution… Il en est de même pour les contacteurs ou autres microswitch. Aussi, refuser ou retarder des aides techniques (ce qui pourrait être le cas aussi des innovations technologiques) pour une personne polyhandicapée, qui présentent des avantages cliniques clairement et directement observables peut être contraire à l’éthique même si l’effet n’est pas prouvé dans de grandes études cliniques (Wang et coll., 2021
). Ainsi la réalité clinique montre qu’en l’absence d’assise adaptée une personne polyhandicapée ne peut tenir assise de façon indépendante, et donc ne peut bénéficier de déplacement aisé pour participer à la vie sociale de la famille, de l’institution… Il en est de même pour les contacteurs ou autres microswitch. Aussi, refuser ou retarder des aides techniques (ce qui pourrait être le cas aussi des innovations technologiques) pour une personne polyhandicapée, qui présentent des avantages cliniques clairement et directement observables peut être contraire à l’éthique même si l’effet n’est pas prouvé dans de grandes études cliniques (Wang et coll., 2021 ).
). ). Si les mesures préventives (posture et autres orthèses diurnes et nocturnes) et/ou correctives (traitement chirurgical du rachis, des hanches…), depuis l’enfance, étaient efficaces dans l’apparition ou la correction des déformations (déficits secondaires), alors pourquoi autant d’adultes polyhandicapés et/ou avec paralysie cérébrale de niveaux GMFCS IV et V présentent des déformations ? Un effort de recherche orthopédique (prévention et correction) chez les personnes polyhandicapées est nécessaire et doit être encouragé pour répondre à cette question cruciale.
). Si les mesures préventives (posture et autres orthèses diurnes et nocturnes) et/ou correctives (traitement chirurgical du rachis, des hanches…), depuis l’enfance, étaient efficaces dans l’apparition ou la correction des déformations (déficits secondaires), alors pourquoi autant d’adultes polyhandicapés et/ou avec paralysie cérébrale de niveaux GMFCS IV et V présentent des déformations ? Un effort de recherche orthopédique (prévention et correction) chez les personnes polyhandicapées est nécessaire et doit être encouragé pour répondre à cette question cruciale. ) proposent de promouvoir des installations confortables et non préjudiciables à la qualité de vie et à la fonction en position couchée et assise, de favoriser la verticalisation avec 10 à 15° maximum d’abduction de hanche (par hanche, soit 20-30° maximum au total) au moins une heure par jour, de s’assurer que l’enfant a les équipements nécessaires pour permettre les postures tout en garantissant la réalisation d’activité en lien avec son âge, éviter que l’enfant polyhandicapé soit plus de 8 heures dans une même position (sans changement de position) dans un support adapté (Paleg et Livingstone, 2022
) proposent de promouvoir des installations confortables et non préjudiciables à la qualité de vie et à la fonction en position couchée et assise, de favoriser la verticalisation avec 10 à 15° maximum d’abduction de hanche (par hanche, soit 20-30° maximum au total) au moins une heure par jour, de s’assurer que l’enfant a les équipements nécessaires pour permettre les postures tout en garantissant la réalisation d’activité en lien avec son âge, éviter que l’enfant polyhandicapé soit plus de 8 heures dans une même position (sans changement de position) dans un support adapté (Paleg et Livingstone, 2022 ).
). ). Soixante-six pour cent des enfants avec paralysie cérébrale qui présentent une fracture sont non marchants (GMFCS IV et V), et 82 % des fractures se situent au niveau des membres inférieurs (Presedo et coll., 2007
). Soixante-six pour cent des enfants avec paralysie cérébrale qui présentent une fracture sont non marchants (GMFCS IV et V), et 82 % des fractures se situent au niveau des membres inférieurs (Presedo et coll., 2007 ). Dans la grande majorité des cas, ces fractures ne sont pas liées à des traumatismes (seules 32 % des fractures sont liées à des traumatismes) mais sont liées à des évènements dits de basse énergie (Kannikeswaran et coll., 2022
). Dans la grande majorité des cas, ces fractures ne sont pas liées à des traumatismes (seules 32 % des fractures sont liées à des traumatismes) mais sont liées à des évènements dits de basse énergie (Kannikeswaran et coll., 2022 ) (c’est-à-dire théoriquement n’amenant pas à une fracture) signant une ostéopénie sévère. Face à cette ostéopénie sévère (voire ostéoporose), des traitements préventifs doivent être entrepris (verticalisation, sortie dehors pour « prendre le soleil », supplémentation en vitamine D et calcium) mais aussi curatifs via un traitement par biphosphonates (Granild-Jensen et coll., 2023
) (c’est-à-dire théoriquement n’amenant pas à une fracture) signant une ostéopénie sévère. Face à cette ostéopénie sévère (voire ostéoporose), des traitements préventifs doivent être entrepris (verticalisation, sortie dehors pour « prendre le soleil », supplémentation en vitamine D et calcium) mais aussi curatifs via un traitement par biphosphonates (Granild-Jensen et coll., 2023 ). En effet, des méta-analyses ont montré qu’un an de traitement par bisphosphonates en intraveineux augmentait la densité minérale osseuse de 1,65 en termes de Z-score et de 0,65 après un traitement oral. Par contre, cela n’a pas montré de réduction du risque fracturaire après 2 ans, et des recherches à plus long terme sont nécessaires pour montrer cette efficacité, aujourd’hui suspectée sur le risque fracturaire.
). En effet, des méta-analyses ont montré qu’un an de traitement par bisphosphonates en intraveineux augmentait la densité minérale osseuse de 1,65 en termes de Z-score et de 0,65 après un traitement oral. Par contre, cela n’a pas montré de réduction du risque fracturaire après 2 ans, et des recherches à plus long terme sont nécessaires pour montrer cette efficacité, aujourd’hui suspectée sur le risque fracturaire. ), le niveau d’activité physique est de 13 à 53 % moins élevé en comparaison avec leurs pairs au développement typique (enfant contrôle). Il y a un lien évident entre niveau de GMFCS et niveau d’activité physique même si cela n’a pas été formellement démontré dans cette étude, du fait d’absence de recherche spécifique sur cette question. Plus l’atteinte motrice est sévère, plus la personne est dépendante d’une tierce personne pour sa motricité et plus son niveau d’activité physique est faible.
), le niveau d’activité physique est de 13 à 53 % moins élevé en comparaison avec leurs pairs au développement typique (enfant contrôle). Il y a un lien évident entre niveau de GMFCS et niveau d’activité physique même si cela n’a pas été formellement démontré dans cette étude, du fait d’absence de recherche spécifique sur cette question. Plus l’atteinte motrice est sévère, plus la personne est dépendante d’une tierce personne pour sa motricité et plus son niveau d’activité physique est faible. ). Sur une population de 30 enfants (15 enfants avec paralysie cérébrale et 15 enfants contrôles), le nombre de changement de positions a été comptabilisé sur l’ensemble des 24 heures d’une journée. De façon non surprenante, il était retrouvé que chez les enfants atteints de paralysie cérébrale, le temps moyen passé dans une position était plus long que chez les enfants contrôles pendant le sommeil nocturne. La durée moyenne d’inactivité du corps était plus longue chez les enfants atteints de paralysie cérébrale, que ce soit pendant le sommeil diurne ou nocturne. Une analyse individuelle montrait pour certains enfants avec paralysie cérébrale sévère une absence totale de mouvement (aucun changement de position) pendant le sommeil. Lors des phases d’éveil, le défaut de changement de position chez les enfants avec paralysie cérébrale était moins important comparativement aux enfants typiques. L’explication donnée par les auteurs quant à ses résultats, est que si les enfants atteints de paralysie cérébrale sévère vivant à la maison présentaient une inactivité prolongée (posture immobilisée prolongée sans mouvement enregistré) pendant le sommeil nocturne c’est que les personnes qui s’occupaient d’eux (les aidants) dormaient aussi et qu’ils ne pouvaient les mobiliser. En journée, les aidants étant disponibles ceux-ci mobilisent plus les enfants polyhandicapés. Cette étude illustre l’absence d’activité physique liée aux difficultés motrices sévères, la dépendance des personnes polyhandicapées à une tierce personne pour les mobilisations et la réalisation d’activité physique même minime. Cette étude souligne la nécessité de changements de position des personnes polyhandicapée pendant le sommeil et donc la présence d’aides humaines disponibles à ce moment pour les mobiliser lors du sommeil.
). Sur une population de 30 enfants (15 enfants avec paralysie cérébrale et 15 enfants contrôles), le nombre de changement de positions a été comptabilisé sur l’ensemble des 24 heures d’une journée. De façon non surprenante, il était retrouvé que chez les enfants atteints de paralysie cérébrale, le temps moyen passé dans une position était plus long que chez les enfants contrôles pendant le sommeil nocturne. La durée moyenne d’inactivité du corps était plus longue chez les enfants atteints de paralysie cérébrale, que ce soit pendant le sommeil diurne ou nocturne. Une analyse individuelle montrait pour certains enfants avec paralysie cérébrale sévère une absence totale de mouvement (aucun changement de position) pendant le sommeil. Lors des phases d’éveil, le défaut de changement de position chez les enfants avec paralysie cérébrale était moins important comparativement aux enfants typiques. L’explication donnée par les auteurs quant à ses résultats, est que si les enfants atteints de paralysie cérébrale sévère vivant à la maison présentaient une inactivité prolongée (posture immobilisée prolongée sans mouvement enregistré) pendant le sommeil nocturne c’est que les personnes qui s’occupaient d’eux (les aidants) dormaient aussi et qu’ils ne pouvaient les mobiliser. En journée, les aidants étant disponibles ceux-ci mobilisent plus les enfants polyhandicapés. Cette étude illustre l’absence d’activité physique liée aux difficultés motrices sévères, la dépendance des personnes polyhandicapées à une tierce personne pour les mobilisations et la réalisation d’activité physique même minime. Cette étude souligne la nécessité de changements de position des personnes polyhandicapée pendant le sommeil et donc la présence d’aides humaines disponibles à ce moment pour les mobiliser lors du sommeil.