Pesticides et effets sur la santé
I. Pathologies neurologiques et atteintes
neuropsychologiques
2021
| ANALYSE |
3-
Développement neuropsychologique de l’enfant
 ). Il
n’est pas apparu utile de mettre à jour l’analyse de ces mécanismes dans
cette nouvelle expertise. En résumé, des données sur des modèles murins,
ou in vitro montrent que l’exposition prénatale ou néo-natale à
un organophosphoré, le chlorpyrifos, s’accompagne de modifications des
performances locomotrices ou cognitives (hyperactivité motrice,
apprentissage, mémoire). L’exposition de rates gestantes provoque chez
les descendants des déficits du nombre de cellules cérébrales, des
projections neurales et de la communication synaptique, ou perturbe
l’expression des récepteurs sérotoninergiques et la connexion des
neurones correspondants avec leurs cibles, ce qui est à l’origine de
symptômes évoquant un déficit en sérotonine. Les anomalies provoquées
par le chlorpyrifos au cours de la période prénatale (induction de
l’apoptose neuronale) sont parfois observées à des doses inférieures à
celles nécessaires pour inactiver l’acétylcholine estérase (l’enzyme de
dégradation de l’acétylcholine qui joue un rôle fondamental au niveau
synaptique pour éviter une accumulation du neurotransmetteur et une
sur-stimulation des récepteurs cholinergiques). Plusieurs études
suggèrent donc comme mécanisme d’action du chlorpyrifos, une
perturbation du système sérotoninergique indépendante de son effet sur
l’acétylcholine estérase.
). Il
n’est pas apparu utile de mettre à jour l’analyse de ces mécanismes dans
cette nouvelle expertise. En résumé, des données sur des modèles murins,
ou in vitro montrent que l’exposition prénatale ou néo-natale à
un organophosphoré, le chlorpyrifos, s’accompagne de modifications des
performances locomotrices ou cognitives (hyperactivité motrice,
apprentissage, mémoire). L’exposition de rates gestantes provoque chez
les descendants des déficits du nombre de cellules cérébrales, des
projections neurales et de la communication synaptique, ou perturbe
l’expression des récepteurs sérotoninergiques et la connexion des
neurones correspondants avec leurs cibles, ce qui est à l’origine de
symptômes évoquant un déficit en sérotonine. Les anomalies provoquées
par le chlorpyrifos au cours de la période prénatale (induction de
l’apoptose neuronale) sont parfois observées à des doses inférieures à
celles nécessaires pour inactiver l’acétylcholine estérase (l’enzyme de
dégradation de l’acétylcholine qui joue un rôle fondamental au niveau
synaptique pour éviter une accumulation du neurotransmetteur et une
sur-stimulation des récepteurs cholinergiques). Plusieurs études
suggèrent donc comme mécanisme d’action du chlorpyrifos, une
perturbation du système sérotoninergique indépendante de son effet sur
l’acétylcholine estérase. , voir en fin de ce chapitre).
, voir en fin de ce chapitre).Exposition des femmes enceintes et des enfants
aux insecticides organophosphorés
Conclusion de l’expertise 2013
Nouvelles données épidémiologiques
Résultats complémentaires des trois cohortes initiales
 pour la cohorte CHAMACOSCenter
for the Health Assessment of Mothers and Children of
Salinas et ii) Furlong et coll.,
2014
pour la cohorte CHAMACOSCenter
for the Health Assessment of Mothers and Children of
Salinas et ii) Furlong et coll.,
2014 pour la cohorte multiethnique CEHS
Children’s Environmental Health Study de
l’hôpital Mount Sinaï à New York (tableau 3.I
pour la cohorte multiethnique CEHS
Children’s Environmental Health Study de
l’hôpital Mount Sinaï à New York (tableau 3.I , voir en fin de ce chapitre).
, voir en fin de ce chapitre). ). Par exemple, chez les garçons,
la concentration urinaire de DAP maternelle (nmoles/l ;
échelle log10) était associée à une perte de
13,3 points de QI (IC 95 % [- 19,9 ; - 6,7]) chez les
familles caractérisées par un environnement d’apprentissage
faible, et à un gain, non statistiquement significatif, chez
les familles ayant un meilleur milieu d’apprentissage
(+4,2 points de QI ; IC 95 % [- 4,2 ; 12,5]). L’exposition
pendant l’enfance aux insecticides organophosphorés évaluée
à différents âges n’a pas été associée de façon cohérente
aux performances cognitives de l’enfant suggérant
l’importance particulière de la période d’exposition
(Bouchard et coll., 2011
). Par exemple, chez les garçons,
la concentration urinaire de DAP maternelle (nmoles/l ;
échelle log10) était associée à une perte de
13,3 points de QI (IC 95 % [- 19,9 ; - 6,7]) chez les
familles caractérisées par un environnement d’apprentissage
faible, et à un gain, non statistiquement significatif, chez
les familles ayant un meilleur milieu d’apprentissage
(+4,2 points de QI ; IC 95 % [- 4,2 ; 12,5]). L’exposition
pendant l’enfance aux insecticides organophosphorés évaluée
à différents âges n’a pas été associée de façon cohérente
aux performances cognitives de l’enfant suggérant
l’importance particulière de la période d’exposition
(Bouchard et coll., 2011 ).
). ).
). ). Alors qu’il s’agissait d’une
étude-pilote, à notre connaissance ce résultat n’a encore
jamais été reproduit. Cette même cohorte a plus récemment
suggéré une atteinte de la fonction motrice fine avec la
présence de tremblements graphiques (lors d’un exercice
d’écriture ou de dessin) pour le quart des enfants âgés
entre 9 et 13 ans ayant les niveaux d’exposition prénatale
au chlorpyrifos les plus élevés (Rauh et coll.,
2015
). Alors qu’il s’agissait d’une
étude-pilote, à notre connaissance ce résultat n’a encore
jamais été reproduit. Cette même cohorte a plus récemment
suggéré une atteinte de la fonction motrice fine avec la
présence de tremblements graphiques (lors d’un exercice
d’écriture ou de dessin) pour le quart des enfants âgés
entre 9 et 13 ans ayant les niveaux d’exposition prénatale
au chlorpyrifos les plus élevés (Rauh et coll.,
2015 ).
).Autres cohortes mères-enfants
Cohortes états-uniennes
 ; Donauer et coll.,
2016
; Donauer et coll.,
2016 ; Millenson et coll.,
2017
; Millenson et coll.,
2017 ).
). ). Les femmes incluses étaient
majoritairement d’origine caucasienne (85 %) et le
revenu moyen observé dans cette cohorte correspondait au
niveau de classe moyenne nord-américaine. Cette étude a
observé une diminution des performances motrices en
association avec les niveaux urinaires du métabolite
spécifique au chlorpyrifos (TCPγ) mesurés au
3e trimestre de grossesse. Aucune
association n’était observée avec le développement
cognitif global, ni avec les concentrations urinaires du
métabolite spécifique au diazinon (IMPy).
). Les femmes incluses étaient
majoritairement d’origine caucasienne (85 %) et le
revenu moyen observé dans cette cohorte correspondait au
niveau de classe moyenne nord-américaine. Cette étude a
observé une diminution des performances motrices en
association avec les niveaux urinaires du métabolite
spécifique au chlorpyrifos (TCPγ) mesurés au
3e trimestre de grossesse. Aucune
association n’était observée avec le développement
cognitif global, ni avec les concentrations urinaires du
métabolite spécifique au diazinon (IMPy).Cohortes européennes
 ). Une altération de la
fonction visuelle (diminution de la sensibilité aux
contrastes) chez les garçons à l’âge de 6 ans a été
suggérée en lien avec l’exposition prénatale aux
insecticides organophosphorés (Cartier et coll.,
2018
). Une altération de la
fonction visuelle (diminution de la sensibilité aux
contrastes) chez les garçons à l’âge de 6 ans a été
suggérée en lien avec l’exposition prénatale aux
insecticides organophosphorés (Cartier et coll.,
2018 ). À notre connaissance, ce
résultat n’a pas encore été reproduit par d’autres
études.
). À notre connaissance, ce
résultat n’a pas encore été reproduit par d’autres
études. ). Les femmes de la cohorte
GENERATION R présentaient des concentrations urinaires
de DAP parmi les plus élevées en comparaison aux autres
cohortes nord-américaines et européennes
(tableau 3.I
). Les femmes de la cohorte
GENERATION R présentaient des concentrations urinaires
de DAP parmi les plus élevées en comparaison aux autres
cohortes nord-américaines et européennes
(tableau 3.I ,
voir en fin de chapitre).
,
voir en fin de chapitre). ). Les femmes étaient invitées
à remplir plusieurs questionnaires pendant la grossesse
et pendant les premiers mois et années de vie de
l’enfant renseignant par exemple le type d’allaitement
et sa durée. Elles étaient en majorité non fumeuses
(95 %) et avait moins de 30 ans pour la moitié d’entre
elles, et un niveau d’études > bac pour 70 % d’entre
elles. À l’âge de 2,5 ans de l’enfant, les familles
étaient invitées à remplir en ligne un questionnaire
standardisé mesurant les troubles de déficits
attentionnels, d’hyperactivité et d’impulsivité des
enfants (TDAH). Parmi les 948 familles participantes
avec une mesure de TCPγ réalisée dans les urines
maternelles prénatales, aucune association n’a été
observée entre les concentrations urinaires et le score
de TDAH.
). Les femmes étaient invitées
à remplir plusieurs questionnaires pendant la grossesse
et pendant les premiers mois et années de vie de
l’enfant renseignant par exemple le type d’allaitement
et sa durée. Elles étaient en majorité non fumeuses
(95 %) et avait moins de 30 ans pour la moitié d’entre
elles, et un niveau d’études > bac pour 70 % d’entre
elles. À l’âge de 2,5 ans de l’enfant, les familles
étaient invitées à remplir en ligne un questionnaire
standardisé mesurant les troubles de déficits
attentionnels, d’hyperactivité et d’impulsivité des
enfants (TDAH). Parmi les 948 familles participantes
avec une mesure de TCPγ réalisée dans les urines
maternelles prénatales, aucune association n’a été
observée entre les concentrations urinaires et le score
de TDAH.Autres cohortes
 ; Liu et coll.,
2016
; Liu et coll.,
2016 ; Silver et coll.,
2017
; Silver et coll.,
2017 ; Wang et coll.,
2017
; Wang et coll.,
2017 ; Silver et coll.,
2018
; Silver et coll.,
2018 ) ou un score plus élevé de
troubles de l’attention et d’hyperactivité entre
6-11 ans (Fortenberry et coll.,
2014
) ou un score plus élevé de
troubles de l’attention et d’hyperactivité entre
6-11 ans (Fortenberry et coll.,
2014 ). Une cohorte chinoise n’a pas
reproduit l’association pour le TCPγ, métabolite
spécifique du chlorpyrifos, malgré des niveaux
d’exposition plus élevés que ceux observés en Europe et
Amérique du Nord (Guo et coll.,
2019
). Une cohorte chinoise n’a pas
reproduit l’association pour le TCPγ, métabolite
spécifique du chlorpyrifos, malgré des niveaux
d’exposition plus élevés que ceux observés en Europe et
Amérique du Nord (Guo et coll.,
2019 ).
).Autres études sur l’exposition pendant l’enfance aux insecticides organophosphorés
 ; Cartier et coll.,
2016
; Cartier et coll.,
2016 ), alors que l’étude CHAMACOS
n’observait pas d’altération des performances cognitives à
l’âge de 7 ans en lien avec les expositions actuelles et
antérieures mesurées pendant l’enfance (Bouchard et coll.,
2011
), alors que l’étude CHAMACOS
n’observait pas d’altération des performances cognitives à
l’âge de 7 ans en lien avec les expositions actuelles et
antérieures mesurées pendant l’enfance (Bouchard et coll.,
2011 ).
). ; Marks et coll., 2010
; Marks et coll., 2010 ) et une étude taïwanaise (Yu et
coll., 2016
) et une étude taïwanaise (Yu et
coll., 2016 ) ont suggéré un lien entre
l’exposition de l’enfant aux insecticides organophosphorés
et la présence de déficits attentionnels avec ou sans
troubles évoquant une hyperactivité, alors qu’une étude
canadienne de grande envergure (n = 779 enfants de 6-11 ans)
n’a pas reproduit ce résultat (Oulhote et Bouchard,
2013
) ont suggéré un lien entre
l’exposition de l’enfant aux insecticides organophosphorés
et la présence de déficits attentionnels avec ou sans
troubles évoquant une hyperactivité, alors qu’une étude
canadienne de grande envergure (n = 779 enfants de 6-11 ans)
n’a pas reproduit ce résultat (Oulhote et Bouchard,
2013 ).
). ; Engel et coll.,
2016
; Engel et coll.,
2016 ; Sapbamrer et Hongsibsong,
2019
; Sapbamrer et Hongsibsong,
2019 ). Les déficits cognitifs observés
par les premières études jusqu’à l’âge de 7 ans en lien avec
l’exposition prénatale aux insecticides organophosphorés
n’ont pas été observés ni à des âges ultérieurs par ces
mêmes cohortes, ni par deux des quatre études européennes et
nord-américaines plus récentes. Une étude européenne ayant
parmi les niveaux d’exposition les plus élevés a observé une
diminution des performances cognitives des enfants
uniquement lorsque l’exposition a eu lieu en fin de
grossesse.
). Les déficits cognitifs observés
par les premières études jusqu’à l’âge de 7 ans en lien avec
l’exposition prénatale aux insecticides organophosphorés
n’ont pas été observés ni à des âges ultérieurs par ces
mêmes cohortes, ni par deux des quatre études européennes et
nord-américaines plus récentes. Une étude européenne ayant
parmi les niveaux d’exposition les plus élevés a observé une
diminution des performances cognitives des enfants
uniquement lorsque l’exposition a eu lieu en fin de
grossesse. ), une réversibilité possible des
effets par des stimulations cognitives reçues de
l’environnement de l’enfant et/ou la disponibilité de
mécanismes de compensation mis en place lors d’un déficit
cognitif, et une susceptibilité génétique des populations
noires et hispaniques. Aussi, l’usage des insecticides
organophosphorés ayant diminué ces deux dernières décennies
en Europe et Amérique du Nord, les sources d’exposition
et/ou les combinaisons (mélanges) d’insecticides
organophosphorés présents dans les produits agricoles et
domestiques ont varié. Il est possible que les
concentrations urinaires en DAP observées dans les études
les plus récentes soient en majorité d’origine alimentaire
alors que les populations des études initiales,
californiennes et new-yorkaises, étaient selon les auteurs
fortement exposées via les usages agricoles voisins et les
usages domestiques fréquents. Les molécules
organophosphorées peuvent être converties en DAP à la
surface ou à l’intérieur des fruits et légumes par
hydrolyse, photolyse ou les enzymes du métabolisme des
plantes. Les concentrations urinaires de cette forme
dégradée non toxique des insecticides
organophosphorés (DAP) pourraient ainsi représenter pour les
études les plus récentes un moins bon marqueur d’exposition
à des insecticides organophosphorés.
), une réversibilité possible des
effets par des stimulations cognitives reçues de
l’environnement de l’enfant et/ou la disponibilité de
mécanismes de compensation mis en place lors d’un déficit
cognitif, et une susceptibilité génétique des populations
noires et hispaniques. Aussi, l’usage des insecticides
organophosphorés ayant diminué ces deux dernières décennies
en Europe et Amérique du Nord, les sources d’exposition
et/ou les combinaisons (mélanges) d’insecticides
organophosphorés présents dans les produits agricoles et
domestiques ont varié. Il est possible que les
concentrations urinaires en DAP observées dans les études
les plus récentes soient en majorité d’origine alimentaire
alors que les populations des études initiales,
californiennes et new-yorkaises, étaient selon les auteurs
fortement exposées via les usages agricoles voisins et les
usages domestiques fréquents. Les molécules
organophosphorées peuvent être converties en DAP à la
surface ou à l’intérieur des fruits et légumes par
hydrolyse, photolyse ou les enzymes du métabolisme des
plantes. Les concentrations urinaires de cette forme
dégradée non toxique des insecticides
organophosphorés (DAP) pourraient ainsi représenter pour les
études les plus récentes un moins bon marqueur d’exposition
à des insecticides organophosphorés.Exposition des femmes enceintes et des enfants
aux insecticides pyréthrinoïdes
 ). Les auteurs évoquaient plusieurs
hypothèses explicatives : une inhibition de l’activité enzymatique
des cytochromes P450 par le PBO retardant la détoxication des
molécules actives pyréthrinoïdes présentes simultanément ou d’autres
molécules neurotoxiques, donc amplifiant leurs effets toxiques
possibles ; des troubles olfactifs et moteurs en lien avec le PBO
suggérés par une étude chez l’animal (Tanaka,
2003
). Les auteurs évoquaient plusieurs
hypothèses explicatives : une inhibition de l’activité enzymatique
des cytochromes P450 par le PBO retardant la détoxication des
molécules actives pyréthrinoïdes présentes simultanément ou d’autres
molécules neurotoxiques, donc amplifiant leurs effets toxiques
possibles ; des troubles olfactifs et moteurs en lien avec le PBO
suggérés par une étude chez l’animal (Tanaka,
2003 ), ou
la production d’espèces réactives de l’oxygène (ERO) et de stress
oxydatif par le PBO (Muguruma et coll.,
2007
), ou
la production d’espèces réactives de l’oxygène (ERO) et de stress
oxydatif par le PBO (Muguruma et coll.,
2007 ).
). ).
Il s’agissait du comportement évalué par l’échelle du Behavior
Assessment System for Children (BASC) de type externalisé
(par exemple agressivité et hyperactivité ; β = - 4,74 ;
IC 95 % [- 9,37 ; - 0,10]) en lien avec le métabolite
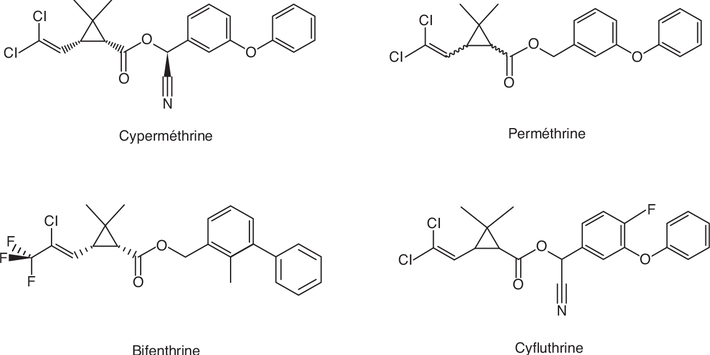
cis-DCCA (métabolite de la perméthrine, cyperméthrine, et la
cyfluthrine), et de type internalisé (par exemple anxiété ;
β = - 4,50 ; IC 95 % [- 8,05 ; - 0,95]) en lien avec le 3-PBA, un
métabolite commun à de nombreux insecticides pyréthrinoïdes.
L’exposition mesurée par la concentration de trois métabolites de
molécules pyréthrinoïdes dans les urines maternelles collectées
pendant la grossesse était considérée de façon binaire (détecté
versus non détecté) limitant la portée de ces
résultats.
).
Il s’agissait du comportement évalué par l’échelle du Behavior
Assessment System for Children (BASC) de type externalisé
(par exemple agressivité et hyperactivité ; β = - 4,74 ;
IC 95 % [- 9,37 ; - 0,10]) en lien avec le métabolite
cis-DCCA (métabolite de la perméthrine, cyperméthrine, et la
cyfluthrine), et de type internalisé (par exemple anxiété ;
β = - 4,50 ; IC 95 % [- 8,05 ; - 0,95]) en lien avec le 3-PBA, un
métabolite commun à de nombreux insecticides pyréthrinoïdes.
L’exposition mesurée par la concentration de trois métabolites de
molécules pyréthrinoïdes dans les urines maternelles collectées
pendant la grossesse était considérée de façon binaire (détecté
versus non détecté) limitant la portée de ces
résultats. ).
). ).
En revanche, avec un schéma d’étude transversale, cette cohorte
observait une diminution des scores de compréhension verbale et de
mémoire de travail des enfants à 6 ans en association avec les
concentrations urinaires en 3-PBA (p de tendance = 0,04 et 0,05,
respectivement), et en cis-DBCA, métabolite spécifique de la
deltaméthrine (p de tendance < 0,01 et < 0,01, respectivement)
mesurées dans les urines des enfants le matin du jour de
l’évaluation neuropsychologique (Viel et coll.,
2015
).
En revanche, avec un schéma d’étude transversale, cette cohorte
observait une diminution des scores de compréhension verbale et de
mémoire de travail des enfants à 6 ans en association avec les
concentrations urinaires en 3-PBA (p de tendance = 0,04 et 0,05,
respectivement), et en cis-DBCA, métabolite spécifique de la
deltaméthrine (p de tendance < 0,01 et < 0,01, respectivement)
mesurées dans les urines des enfants le matin du jour de
l’évaluation neuropsychologique (Viel et coll.,
2015 ).
L’ensemble des modèles statistiques tenait compte simultanément des
concentrations urinaires de DAP prénatales et de celles mesurées à
6 ans. Un risque augmenté de troubles élevés de comportement
internalisé évalué à l’âge de 6 ans par l’échelle du Strength and
Difficulties Questionnaire (échelle auto-rapportée par la
mère sur le comportement des six derniers mois de l’enfant), était
associé aux concentrations urinaires prénatales de cis-DCCA
(p de tendance = 0,05 ; β (67-137 ng/l versus
< 67 ng/l) = 1,47 ; IC 95 % [0,50-4,28], β (> 137 ng/l
versus < 67 ng/l) = 2,33 ; IC 95 % [0,76-7,17]) ;
aucune association n’était observée avec le comportement externalisé
(Viel et coll., 2017
).
L’ensemble des modèles statistiques tenait compte simultanément des
concentrations urinaires de DAP prénatales et de celles mesurées à
6 ans. Un risque augmenté de troubles élevés de comportement
internalisé évalué à l’âge de 6 ans par l’échelle du Strength and
Difficulties Questionnaire (échelle auto-rapportée par la
mère sur le comportement des six derniers mois de l’enfant), était
associé aux concentrations urinaires prénatales de cis-DCCA
(p de tendance = 0,05 ; β (67-137 ng/l versus
< 67 ng/l) = 1,47 ; IC 95 % [0,50-4,28], β (> 137 ng/l
versus < 67 ng/l) = 2,33 ; IC 95 % [0,76-7,17]) ;
aucune association n’était observée avec le comportement externalisé
(Viel et coll., 2017 ). Avec les concentrations urinaires
mesurées chez l’enfant, une augmentation des troubles externalisés
rapportés à 6 ans était observée avec le 3-PBA et une diminution
avec le trans-DCCA, sans explication évidente.
). Avec les concentrations urinaires
mesurées chez l’enfant, une augmentation des troubles externalisés
rapportés à 6 ans était observée avec le 3-PBA et une diminution
avec le trans-DCCA, sans explication évidente. ).
Avec un effectif plus important (n = 948) que la cohorte PELAGIE,
elle observait une augmentation des troubles de déficit d’attention
et d’hyperactivité chez l’enfant à 2,5 ans en lien avec les
concentrations urinaires maternelles de 3-PBA, traduite par une
augmentation de 3 % du score de TDAH à chaque doublement du niveau
urinaire (1,03 ; IC 95 % [1,00 ; 1,07]). Une association était
également observée entre la présence du trans-DCCA dans les
urines maternelles et un score de TDAH de l’enfant parmi les 10 %
les plus élevés (OR = 1,76 ; IC 95 % [1,08 ; 2,86]). Malgré la
possibilité d’évaluer les troubles internalisés avec l’échelle CBCL
(Childhood Behavior CheckList) utilisée dans cette
cohorte, ces associations n’ont pas été rapportées.
).
Avec un effectif plus important (n = 948) que la cohorte PELAGIE,
elle observait une augmentation des troubles de déficit d’attention
et d’hyperactivité chez l’enfant à 2,5 ans en lien avec les
concentrations urinaires maternelles de 3-PBA, traduite par une
augmentation de 3 % du score de TDAH à chaque doublement du niveau
urinaire (1,03 ; IC 95 % [1,00 ; 1,07]). Une association était
également observée entre la présence du trans-DCCA dans les
urines maternelles et un score de TDAH de l’enfant parmi les 10 %
les plus élevés (OR = 1,76 ; IC 95 % [1,08 ; 2,86]). Malgré la
possibilité d’évaluer les troubles internalisés avec l’échelle CBCL
(Childhood Behavior CheckList) utilisée dans cette
cohorte, ces associations n’ont pas été rapportées. ). Aucune association n’était observée
pour le développement psychomoteur.
). Aucune association n’était observée
pour le développement psychomoteur. ). Ces résultats tenaient compte de la
présence ou non de symptômes dépressifs maternels. En restreignant
les analyses aux femmes ayant eu une collecte d’urine avant
l’accouchement seulement, dont la mesure a plus de chance de
refléter l’exposition de l’environnement et du domicile occupé
pendant la grossesse, les auteurs ont rapporté des niveaux urinaires
plus élevés mais des résultats d’association similaires.
). Ces résultats tenaient compte de la
présence ou non de symptômes dépressifs maternels. En restreignant
les analyses aux femmes ayant eu une collecte d’urine avant
l’accouchement seulement, dont la mesure a plus de chance de
refléter l’exposition de l’environnement et du domicile occupé
pendant la grossesse, les auteurs ont rapporté des niveaux urinaires
plus élevés mais des résultats d’association similaires. ).
). ),
ii) parmi 1 660 enfants états-uniens de 6-15 ans, aucune
association avec les troubles de comportement externalisés
(Quiros-Alcala et coll., 2014
),
ii) parmi 1 660 enfants états-uniens de 6-15 ans, aucune
association avec les troubles de comportement externalisés
(Quiros-Alcala et coll., 2014 ), et iii) parmi 687 enfants
états-uniens de 8-15 ans une augmentation du risque de déficit
attentionnel avec/sans hyperactivité, plus prononcée chez les
garçons, en lien avec les concentrations urinaires de 3-PBA
(Wagner-Schuman et coll., 2015
), et iii) parmi 687 enfants
états-uniens de 8-15 ans une augmentation du risque de déficit
attentionnel avec/sans hyperactivité, plus prononcée chez les
garçons, en lien avec les concentrations urinaires de 3-PBA
(Wagner-Schuman et coll., 2015 ).
).Exposition des femmes enceintes et des enfants
aux pesticides liée à la proximité résidentielle aux activités
agricoles et aux usages de produits domestiques
 ).
Les auteurs notent que les principaux insecticides contenus dans les
produits sprays étaient ceux de la famille des pyréthrinoïdes.
).
Les auteurs notent que les principaux insecticides contenus dans les
produits sprays étaient ceux de la famille des pyréthrinoïdes. ).
Les auteurs n’émettent aucune hypothèse sur les familles de
pesticides possiblement incriminées dans cette association.
).
Les auteurs n’émettent aucune hypothèse sur les familles de
pesticides possiblement incriminées dans cette association. ).
). ). Les données des 2 961 cas et
35 370 témoins, incluant l’adresse au moment de la naissance, ont
été collectées à partir du registre de santé californien et de
certificats de naissance. L’étude a montré un risque augmenté de
survenue de troubles du spectre autistique chez les enfants en lien
avec une exposition prénatale ou dans la première année de vie à 7
des 11 pesticides d’intérêt appliqués sur des zones agricoles à
moins de 2 000 m de la résidence. Il s’agit de la perméthrine, du
diazinon, du glyphosate, et de l’avermectine, et à la limite de la
significativité statistique, de la bifenthrine, du malathion et du
chlorpyrifos. Ces résultats tiennent compte des usages possiblement
corrélés de ces pesticides entre eux, de facteurs
sociodémographiques et de la pollution liée au trafic routier.
). Les données des 2 961 cas et
35 370 témoins, incluant l’adresse au moment de la naissance, ont
été collectées à partir du registre de santé californien et de
certificats de naissance. L’étude a montré un risque augmenté de
survenue de troubles du spectre autistique chez les enfants en lien
avec une exposition prénatale ou dans la première année de vie à 7
des 11 pesticides d’intérêt appliqués sur des zones agricoles à
moins de 2 000 m de la résidence. Il s’agit de la perméthrine, du
diazinon, du glyphosate, et de l’avermectine, et à la limite de la
significativité statistique, de la bifenthrine, du malathion et du
chlorpyrifos. Ces résultats tiennent compte des usages possiblement
corrélés de ces pesticides entre eux, de facteurs
sociodémographiques et de la pollution liée au trafic routier. ) et 10,5 ans (Gunier et coll.,
2017
) et 10,5 ans (Gunier et coll.,
2017 ) en
association avec, respectivement, i) des applications
agricoles d’insecticides organophosphorés et carbamates à proximité
de la résidence (rayon inférieur à 1 km) pendant la grossesse en
tenant compte des niveaux socio-économiques individuels et
contextuels (pas d’existence d’interaction), et ii) des
applications agricoles d’insecticides organophosphorés, carbamates,
néonicotinoïdes, pyréthrinoïdes et de fongicides-manganèse à
proximité de la résidence (rayon inférieur à 1 km) pendant la
grossesse en tenant compte des concentrations prénatales de DAP
urinaires. En revanche, aucune association n’a été observée entre la
quantité d’insecticides organophosphorés utilisés à proximité de la
résidence prénatale (rayon inférieur à 1 km) et les capacités
sociales des enfants de la cohorte CHAMACOS évalués entre 7 et
14 ans (Sagiv et coll., 2018
) en
association avec, respectivement, i) des applications
agricoles d’insecticides organophosphorés et carbamates à proximité
de la résidence (rayon inférieur à 1 km) pendant la grossesse en
tenant compte des niveaux socio-économiques individuels et
contextuels (pas d’existence d’interaction), et ii) des
applications agricoles d’insecticides organophosphorés, carbamates,
néonicotinoïdes, pyréthrinoïdes et de fongicides-manganèse à
proximité de la résidence (rayon inférieur à 1 km) pendant la
grossesse en tenant compte des concentrations prénatales de DAP
urinaires. En revanche, aucune association n’a été observée entre la
quantité d’insecticides organophosphorés utilisés à proximité de la
résidence prénatale (rayon inférieur à 1 km) et les capacités
sociales des enfants de la cohorte CHAMACOS évalués entre 7 et
14 ans (Sagiv et coll., 2018 ). Il faut noter que contrairement aux
familles de l’étude CHARGE (30 % habitaient à proximité de zones
agricoles traitées), toutes les familles de la cohorte CHAMACOS
résidaient à moins d’1 km des zones traitées.
). Il faut noter que contrairement aux
familles de l’étude CHARGE (30 % habitaient à proximité de zones
agricoles traitées), toutes les familles de la cohorte CHAMACOS
résidaient à moins d’1 km des zones traitées. ; Suarez-Lopez et coll.,
2017
; Suarez-Lopez et coll.,
2017 ).
).Pyréthrinoïdes et neurotoxicité développementale : approche mécanistique
 ). Ils
sont ainsi abondamment utilisés partout dans le monde en
agriculture, pour la protection du bois ou via les pratiques
ménagères (dont celles des hôpitaux) ; ainsi, ils sont retrouvés
dans 88,5 % des habitations. Ils sont aussi beaucoup utilisés comme
antipuces en pratique vétérinaire (Bouvier et coll.,
2005
). Ils
sont ainsi abondamment utilisés partout dans le monde en
agriculture, pour la protection du bois ou via les pratiques
ménagères (dont celles des hôpitaux) ; ainsi, ils sont retrouvés
dans 88,5 % des habitations. Ils sont aussi beaucoup utilisés comme
antipuces en pratique vétérinaire (Bouvier et coll.,
2005 ). En
milieu intérieur, ils sont protégés des UV, des variations de
température et persistent plus longtemps notamment dans les
poussières des habitacles (Leng et coll.,
2005
). En
milieu intérieur, ils sont protégés des UV, des variations de
température et persistent plus longtemps notamment dans les
poussières des habitacles (Leng et coll.,
2005 ).
).Toxicocinétique et métabolisme
 ). Les doses conduisant à une mortalité de 50 % chez les
rongeurs (également connues sous le nom de dose létale 50 ou
DL50) sont très élevées et dépendent de la voie
d’administration (400 mg/kg chez le rat, 650 mg/kg chez la
souris pour la perméthrine par voie orale) (Personne, 2019
). Les doses conduisant à une mortalité de 50 % chez les
rongeurs (également connues sous le nom de dose létale 50 ou
DL50) sont très élevées et dépendent de la voie
d’administration (400 mg/kg chez le rat, 650 mg/kg chez la
souris pour la perméthrine par voie orale) (Personne, 2019 ).
). ).
). ). Ces caractéristiques de distribution sont retrouvées pour
la cyfluthrine, dont l’élimination est plus lente, notamment au
niveau cérébral (Rodriguez et coll.,
2018
). Ces caractéristiques de distribution sont retrouvées pour
la cyfluthrine, dont l’élimination est plus lente, notamment au
niveau cérébral (Rodriguez et coll.,
2018 ).
). ). Or, il a été montré chez des rats
que l’immaturité de la barrière hémato-encéphalique (BHE)
entraîne une plus grande perméabilité aux cis- et
trans-perméthrines et peut ainsi contribuer à
augmenter la susceptibilité aux insecticides chez les rats
pré-sevrés (Mortuza et coll.,
2019
). Or, il a été montré chez des rats
que l’immaturité de la barrière hémato-encéphalique (BHE)
entraîne une plus grande perméabilité aux cis- et
trans-perméthrines et peut ainsi contribuer à
augmenter la susceptibilité aux insecticides chez les rats
pré-sevrés (Mortuza et coll.,
2019 ). De plus, l’immaturité du système de détoxification, avec
une dégradation plus lente des composés parents (dont la
molécule clé est la deltaméthrine ou par extension des
cis- et trans-perméthrines), pouvait entraîner
une toxicité plus importante, les métabolites étant moins
toxiques que les molécules parentes (Anand et coll.,
2006
). De plus, l’immaturité du système de détoxification, avec
une dégradation plus lente des composés parents (dont la
molécule clé est la deltaméthrine ou par extension des
cis- et trans-perméthrines), pouvait entraîner
une toxicité plus importante, les métabolites étant moins
toxiques que les molécules parentes (Anand et coll.,
2006 ;
Hedges et coll., 2019
;
Hedges et coll., 2019 ). Cette immaturité du système de
détoxification pouvait expliquer certains déficits
neurocomportementaux chez le rat (Anand et coll.,
2006
). Cette immaturité du système de
détoxification pouvait expliquer certains déficits
neurocomportementaux chez le rat (Anand et coll.,
2006 ;
Hedges et coll., 2019
;
Hedges et coll., 2019 ; Mortuza et coll.,
2019
; Mortuza et coll.,
2019 ).
).Modes d’action
 , ceux possédant un radical cyano étant
classés en type II). Chez les insectes (leur principale cible),
les modes d’action principaux sont la liaison à des canaux
sodiques voltage-dépendants qui, maintenus ouverts, provoquent
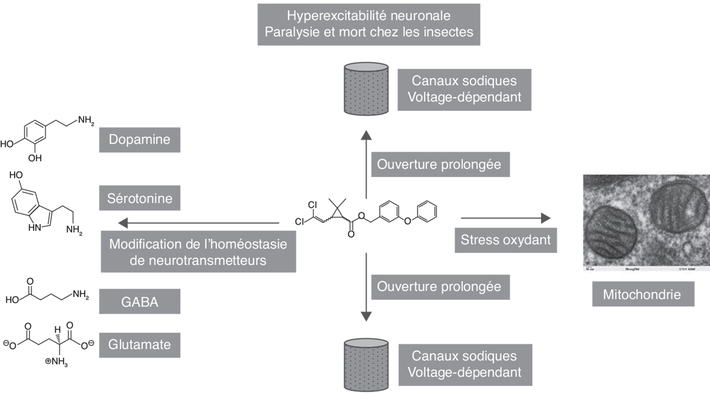
une hyperexcitabilité neuronale (Klaassen,
2002
, ceux possédant un radical cyano étant
classés en type II). Chez les insectes (leur principale cible),
les modes d’action principaux sont la liaison à des canaux
sodiques voltage-dépendants qui, maintenus ouverts, provoquent
une hyperexcitabilité neuronale (Klaassen,
2002 ). Cette dépolarisation permanente est à l’origine d’une
paralysie chez l’insecte (et à sa mort). Une des causes de la
résistance de certains insectes aux pyréthrinoïdes est la
mutation de ces canaux (Hirata,
2016
). Cette dépolarisation permanente est à l’origine d’une
paralysie chez l’insecte (et à sa mort). Une des causes de la
résistance de certains insectes aux pyréthrinoïdes est la
mutation de ces canaux (Hirata,
2016 ).
). ) et affecter la fonction de canaux calciques ou de la
Ca2+-ATPase (Clark et Symington,
2008
) et affecter la fonction de canaux calciques ou de la
Ca2+-ATPase (Clark et Symington,
2008 ).
). )
du fait de nombreux mécanismes d’action alternatifs qui seront
présentés tant sur le plan cellulaire que moléculaire parfois en
association avec des déficits neurocomportementaux.
)
du fait de nombreux mécanismes d’action alternatifs qui seront
présentés tant sur le plan cellulaire que moléculaire parfois en
association avec des déficits neurocomportementaux.Excitabilité neuronale
 ). Les auteurs ont montré que tous
les pyréthrinoïdes, aux plus faibles concentrations,
provoquent une augmentation de la fréquence élevée des
décharges (mean burst rate), ce qui peut être
considéré comme un effet caractéristique des pyréthrinoïdes
sur l’excitabilité neuronale.
). Les auteurs ont montré que tous
les pyréthrinoïdes, aux plus faibles concentrations,
provoquent une augmentation de la fréquence élevée des
décharges (mean burst rate), ce qui peut être
considéré comme un effet caractéristique des pyréthrinoïdes
sur l’excitabilité neuronale. ). En présence de plusieurs types
cellulaires (neurones, cellules gliales), la mesure de la
fréquence des potentiels d’action montre qu’une inhibition
est aussi observée pour des concentrations de différents
pyréthrinoïdes (deltaméthrine, cyperméthrine, β-cyfluthrine
et esfenvalérate) supérieures à 10 µM. Une augmentation de
l’excitabilité est néanmoins observée avec la perméthrine
montrant que les effets des pyréthrinoïdes peuvent être
spécifiques de chaque molécule. En conséquence, peu d’effets
sont observés avec un mélange des 5 composés
(52 % perméthrine, 28,8 % cyperméthrine, 12,9 %
β-cyfluthrine, 3,4 % deltaméthrine et 2,7 % esfenvalérate)
du fait probablement de l’additivité des effets (la
perméthrine ayant un effet contraire aux autres) (Johnstone
et coll., 2017
). En présence de plusieurs types
cellulaires (neurones, cellules gliales), la mesure de la
fréquence des potentiels d’action montre qu’une inhibition
est aussi observée pour des concentrations de différents
pyréthrinoïdes (deltaméthrine, cyperméthrine, β-cyfluthrine
et esfenvalérate) supérieures à 10 µM. Une augmentation de
l’excitabilité est néanmoins observée avec la perméthrine
montrant que les effets des pyréthrinoïdes peuvent être
spécifiques de chaque molécule. En conséquence, peu d’effets
sont observés avec un mélange des 5 composés
(52 % perméthrine, 28,8 % cyperméthrine, 12,9 %
β-cyfluthrine, 3,4 % deltaméthrine et 2,7 % esfenvalérate)
du fait probablement de l’additivité des effets (la
perméthrine ayant un effet contraire aux autres) (Johnstone
et coll., 2017 ).
). ) selon plusieurs mécanismes :
i) une liaison directe provoquant leur ouverture
forcée, ii) une diminution de l’expression des ARNm
codant deux de ces canaux (Magby et Richardson,
2015
) selon plusieurs mécanismes :
i) une liaison directe provoquant leur ouverture
forcée, ii) une diminution de l’expression des ARNm
codant deux de ces canaux (Magby et Richardson,
2015 ). Il est tentant de poser
l’hypothèse que l’ouverture forcée des canaux par le
deltaméthrine provoque une adaptation neuronale limitant cet
effet chronique par la diminution d’expression de ces canaux
(liée à celle de leur ARNm). En plus de la deltaméthrine, la
bifenthrine exerce sur ces mêmes canaux sodiques, un effet
d’ouverture prolongé conduisant également à une
dépolarisation (obtenue avec des doses de 10 µM) (Yang et
Li, 2015
). Il est tentant de poser
l’hypothèse que l’ouverture forcée des canaux par le
deltaméthrine provoque une adaptation neuronale limitant cet
effet chronique par la diminution d’expression de ces canaux
(liée à celle de leur ARNm). En plus de la deltaméthrine, la
bifenthrine exerce sur ces mêmes canaux sodiques, un effet
d’ouverture prolongé conduisant également à une
dépolarisation (obtenue avec des doses de 10 µM) (Yang et
Li, 2015 ).
). ), parfois sur d’autres types
cellulaires que les neurones. Une étude récente de 2018,
montre que 4 pyréthrinoïdes (perméthrine, cyperméthrine,
α-cyperméthrine, bioalléthrine) modifient le fonctionnement
de canaux calciques intracellulaires (libération de calcium
par la fraction microsomiale) probablement par liaison de
haute affinité à la pompe calcique ATPase SERCA
(Sarco/endoplasmic reticulum Ca2+
ATPase) comme le montre la co-utilisation d’un
inhibiteur de cette protéine (thapsigargine) (Dusza et
coll., 2018
), parfois sur d’autres types
cellulaires que les neurones. Une étude récente de 2018,
montre que 4 pyréthrinoïdes (perméthrine, cyperméthrine,
α-cyperméthrine, bioalléthrine) modifient le fonctionnement
de canaux calciques intracellulaires (libération de calcium
par la fraction microsomiale) probablement par liaison de
haute affinité à la pompe calcique ATPase SERCA
(Sarco/endoplasmic reticulum Ca2+
ATPase) comme le montre la co-utilisation d’un
inhibiteur de cette protéine (thapsigargine) (Dusza et
coll., 2018 ). L’utilisation de λ-cyhalothrine,
mélange d’isomères du pyréthrinoïde cyhalothrine, sur des
astrocytes humains (Gibco Human Astrocytes) montre
qu’à des concentrations de 10-15 µM, une cytotoxicité est
observée, associée à une élévation des [Ca2+]i
(concentrations de Ca2+ intracellulaires)
probablement liée à l’ouverture de canaux calciques
membranaires (Hsu et coll.,
2018
). L’utilisation de λ-cyhalothrine,
mélange d’isomères du pyréthrinoïde cyhalothrine, sur des
astrocytes humains (Gibco Human Astrocytes) montre
qu’à des concentrations de 10-15 µM, une cytotoxicité est
observée, associée à une élévation des [Ca2+]i
(concentrations de Ca2+ intracellulaires)
probablement liée à l’ouverture de canaux calciques
membranaires (Hsu et coll.,
2018 ). Les auteurs relient ce phénomène
à une apoptose astrocytaire (comme le montre l’effet
bloquant de chélateurs). Les effets décrits apparaissent
toutefois plus complexes que ceux observés avec les canaux
sodiques. En effet, l’α-cyperméthrine et la cyperméthrine
inhibent des canaux calciques voltage-dépendants à des
concentrations relativement basses (concentration
inhibitrice de 50 % de l’activité des canaux ou
IC50respectivement de 239 et 78 nM en
20 minutes soit inférieures à 1 µM) avec pour conséquence un
blocage de la dépolarisation (Meijer et coll.,
2014
). Les auteurs relient ce phénomène
à une apoptose astrocytaire (comme le montre l’effet
bloquant de chélateurs). Les effets décrits apparaissent
toutefois plus complexes que ceux observés avec les canaux
sodiques. En effet, l’α-cyperméthrine et la cyperméthrine
inhibent des canaux calciques voltage-dépendants à des
concentrations relativement basses (concentration
inhibitrice de 50 % de l’activité des canaux ou
IC50respectivement de 239 et 78 nM en
20 minutes soit inférieures à 1 µM) avec pour conséquence un
blocage de la dépolarisation (Meijer et coll.,
2014 ). Ces concentrations sont plus
faibles que celles précédemment décrites pour d’autres modes
d’action notamment pour la cyperméthrine. L’utilisation de
neurones corticaux murins pour mesurer la perturbation des
potentiels d’action en réponse à une exposition à la
deltaméthrine à seulement 30 nM, montre que
l’α-cyperméthrine et la cyperméthrine sont susceptibles
d’exercer leurs effets via la liaison aux récepteurs de la
ryanodine (RyR) en augmentant globalement leur probabilité
d’ouverture et le passage des ions Ca2+. Les RyR
interviennent dans le passage de l’ion Ca2+ des
stocks du réticulum endoplasmique vers le cytoplasme. Ils
jouent un rôle particulièrement important au niveau
neuronal. De par leur ouverture, la deltaméthrine pourrait
provoquer une augmentation de la [Ca2+]i. Ce
phénomène est associé à une stimulation de la croissance
axonale (là encore à des concentrations faibles de
10-300 nM) et à une complexification de l’arborescence
dendritique (100 nM) (Zheng et coll.,
2019
). Ces concentrations sont plus
faibles que celles précédemment décrites pour d’autres modes
d’action notamment pour la cyperméthrine. L’utilisation de
neurones corticaux murins pour mesurer la perturbation des
potentiels d’action en réponse à une exposition à la
deltaméthrine à seulement 30 nM, montre que
l’α-cyperméthrine et la cyperméthrine sont susceptibles
d’exercer leurs effets via la liaison aux récepteurs de la
ryanodine (RyR) en augmentant globalement leur probabilité
d’ouverture et le passage des ions Ca2+. Les RyR
interviennent dans le passage de l’ion Ca2+ des
stocks du réticulum endoplasmique vers le cytoplasme. Ils
jouent un rôle particulièrement important au niveau
neuronal. De par leur ouverture, la deltaméthrine pourrait
provoquer une augmentation de la [Ca2+]i. Ce
phénomène est associé à une stimulation de la croissance
axonale (là encore à des concentrations faibles de
10-300 nM) et à une complexification de l’arborescence
dendritique (100 nM) (Zheng et coll.,
2019 ). Au niveau neuronal, de faibles
modifications des [Ca2+]i peuvent provoquer des
symptômes marqués (Toescu et Verkhratsky,
2007
). Au niveau neuronal, de faibles
modifications des [Ca2+]i peuvent provoquer des
symptômes marqués (Toescu et Verkhratsky,
2007 ).
).Mitochondrie et stress oxydant
 ). Néanmoins, dans cette étude la
viabilité cellulaire était analysée uniquement avec le
Microculture Tetrazolium Test (MTT) mesurant
l’activité de déshydrogénases mitochondriales et donc
susceptible de révéler une atteinte de la fonction de ces
organites et pas nécessairement de la viabilité cellulaire.
Le traitement était aussi associé à une altération de la
morphologie révélée par microscopie et marquage pour
Glial Fibrillary Acidic Protein, un filament
intermédiaire de l’astrocyte. Ce phénomène observé à très
hautes doses entraîne aussi une altération de
[Ca2+]i mais également une augmentation de la
production d’ERO, des niveaux de phosphorylation de deux
kinases de stress, p38 et JNK (effet rapide entre 10 min et
1 h, 100 µM) et de plusieurs protéines susceptibles
d’intervenir dans la fonction migratoire des astrocytes
comme la métalloproteinase matricielle 2, Disabled-1, la
reeline (une protéine jouant un rôle clé dans les couches
granulaires externe et interne du cervelet) et
l’α3β1-intégrine. Ces résultats
obtenus in vitro sont corroborés in vivo sur
des rats en cours de développement chez lesquels une
altération de la fonction de la BHE est observée (traitement
journalier pendant 3 semaines de 10 mg/kg).
). Néanmoins, dans cette étude la
viabilité cellulaire était analysée uniquement avec le
Microculture Tetrazolium Test (MTT) mesurant
l’activité de déshydrogénases mitochondriales et donc
susceptible de révéler une atteinte de la fonction de ces
organites et pas nécessairement de la viabilité cellulaire.
Le traitement était aussi associé à une altération de la
morphologie révélée par microscopie et marquage pour
Glial Fibrillary Acidic Protein, un filament
intermédiaire de l’astrocyte. Ce phénomène observé à très
hautes doses entraîne aussi une altération de
[Ca2+]i mais également une augmentation de la
production d’ERO, des niveaux de phosphorylation de deux
kinases de stress, p38 et JNK (effet rapide entre 10 min et
1 h, 100 µM) et de plusieurs protéines susceptibles
d’intervenir dans la fonction migratoire des astrocytes
comme la métalloproteinase matricielle 2, Disabled-1, la
reeline (une protéine jouant un rôle clé dans les couches
granulaires externe et interne du cervelet) et
l’α3β1-intégrine. Ces résultats
obtenus in vitro sont corroborés in vivo sur
des rats en cours de développement chez lesquels une
altération de la fonction de la BHE est observée (traitement
journalier pendant 3 semaines de 10 mg/kg). ). Parallèlement, des analyses
transcriptomiques ont permis de révéler que les principaux
processus cellulaires affectés sont la fonction
mitochondriale et l’homéostasie protéique. Ces dérégulations
sont compatibles avec un rôle potentiel pro-oxydant des
pyréthrinoïdes. En effet, une production excessive d’ERO
peut affecter le fonctionnement de la chaîne respiratoire et
la structure des protéines. Ce ciblage de la mitochondrie
est aussi évoqué par Gasmi et coll. dans une étude
intéressante car réalisée à faible dose d’exposition à la
deltaméthrine (0,32 mg/kg/j) sur des rats Wistar ; celle-ci
montre en effet une diminution des défenses anti-oxydantes
mitochondriales, associée à une augmentation de biomarqueurs
pro-oxydants comme le malondialdéhyde dans l’hippocampe et
le striatum (Gasmi et coll.,
2017
). Parallèlement, des analyses
transcriptomiques ont permis de révéler que les principaux
processus cellulaires affectés sont la fonction
mitochondriale et l’homéostasie protéique. Ces dérégulations
sont compatibles avec un rôle potentiel pro-oxydant des
pyréthrinoïdes. En effet, une production excessive d’ERO
peut affecter le fonctionnement de la chaîne respiratoire et
la structure des protéines. Ce ciblage de la mitochondrie
est aussi évoqué par Gasmi et coll. dans une étude
intéressante car réalisée à faible dose d’exposition à la
deltaméthrine (0,32 mg/kg/j) sur des rats Wistar ; celle-ci
montre en effet une diminution des défenses anti-oxydantes
mitochondriales, associée à une augmentation de biomarqueurs
pro-oxydants comme le malondialdéhyde dans l’hippocampe et
le striatum (Gasmi et coll.,
2017 ). Sur le plan métabolique, la
dysfonction mitochondriale est associée à une diminution de
la consommation de dioxygène (O2) et de la
libération de cytochrome C (une molécule dont l’action est
pro-apoptotique, associée à l’augmentation d’activité de la
caspase 3). Sur le plan comportemental, le traitement,
pourtant à une dose relativement basse, conduit à une
altération des capacités d’apprentissage et de mémorisation
ainsi qu’un niveau d’anxiété plus élevé. Ces effets
pro-apoptotiques de la deltaméthrine sont aussi observés à
des doses d’exposition plus fortes comme par exemple sur des
cellules neuronales corticales de rat (12,5 mg/kg, dose
unique) (Khalatbary et coll.,
2015
). Sur le plan métabolique, la
dysfonction mitochondriale est associée à une diminution de
la consommation de dioxygène (O2) et de la
libération de cytochrome C (une molécule dont l’action est
pro-apoptotique, associée à l’augmentation d’activité de la
caspase 3). Sur le plan comportemental, le traitement,
pourtant à une dose relativement basse, conduit à une
altération des capacités d’apprentissage et de mémorisation
ainsi qu’un niveau d’anxiété plus élevé. Ces effets
pro-apoptotiques de la deltaméthrine sont aussi observés à
des doses d’exposition plus fortes comme par exemple sur des
cellules neuronales corticales de rat (12,5 mg/kg, dose
unique) (Khalatbary et coll.,
2015 ).
). ; Sooresh et coll.,
2015
; Sooresh et coll.,
2015 ). Par exemple, la bifenthrine
(1-20 µM, 4-24 h) provoque sur des cellules microgliales
primaires de rats Sprague-Dawley, une augmentation de la
production d’ERO associée à des niveaux élevés de
prostaglandine E2 (liée à une augmentation de l’expression
de la cyclooxygénase 2), de TNF-α (Tumor Necrosis
Factor-α), de la peroxydation lipidique et
d’oxydation protéique, tout en diminuant les défenses
anti-oxydantes (superoxyde dismutase, catalase, glutathion
peroxydase). Il en résulte une activation de l’expression de
marqueurs de défense anti-oxydante (Nrf2, facteur de
transcription régulant l’expression de « défenses »
anti-oxydantes) ou de facteurs pro-inflammatoires (NF-κB,
facteur de transcription activé par des cytokines
pro-inflammatoires). À des doses équivalentes, une
augmentation des caractéristiques de mort cellulaire est
aussi observée sur des cultures organotypiques d’hippocampe
et cet effet est amplifié par l’élimination des astrocytes
de ce type de culture, suggérant que les astrocytes
constituent un rempart de défense efficace contre les
pesticides pour les neurones (Gargouri et coll.,
2018a
). Par exemple, la bifenthrine
(1-20 µM, 4-24 h) provoque sur des cellules microgliales
primaires de rats Sprague-Dawley, une augmentation de la
production d’ERO associée à des niveaux élevés de
prostaglandine E2 (liée à une augmentation de l’expression
de la cyclooxygénase 2), de TNF-α (Tumor Necrosis
Factor-α), de la peroxydation lipidique et
d’oxydation protéique, tout en diminuant les défenses
anti-oxydantes (superoxyde dismutase, catalase, glutathion
peroxydase). Il en résulte une activation de l’expression de
marqueurs de défense anti-oxydante (Nrf2, facteur de
transcription régulant l’expression de « défenses »
anti-oxydantes) ou de facteurs pro-inflammatoires (NF-κB,
facteur de transcription activé par des cytokines
pro-inflammatoires). À des doses équivalentes, une
augmentation des caractéristiques de mort cellulaire est
aussi observée sur des cultures organotypiques d’hippocampe
et cet effet est amplifié par l’élimination des astrocytes
de ce type de culture, suggérant que les astrocytes
constituent un rempart de défense efficace contre les
pesticides pour les neurones (Gargouri et coll.,
2018a ).
). ).
). ). Cet effet est aussi observé en
cas d’administration de la bifenthrine à des rats Wistar
adultes (3,5 ou 7 mg/kg quotidiennement pendant 30 jours) ou
à des souris femelles Swiss ayant reçu de la β-cyfluthrine,
associé dans certains cas à une diminution du niveau de
certains neurotransmetteurs (dopamine, sérotonine, voir plus
loin également) (Syed et coll.,
2018
). Cet effet est aussi observé en
cas d’administration de la bifenthrine à des rats Wistar
adultes (3,5 ou 7 mg/kg quotidiennement pendant 30 jours) ou
à des souris femelles Swiss ayant reçu de la β-cyfluthrine,
associé dans certains cas à une diminution du niveau de
certains neurotransmetteurs (dopamine, sérotonine, voir plus
loin également) (Syed et coll.,
2018 ; Rajawat et coll.,
2019
; Rajawat et coll.,
2019 ). Ces effets sont néanmoins
confirmés avec des doses plus faibles (0,6 et 2,1 mg/kg de
bifenthrine, chroniques car administrées quotidiennement)
conduisant à des syndromes d’anxiété ou de dépression ainsi
qu’à une élévation des marqueurs métaboliques et géniques de
stress oxydant (COX2, NF-κB, TNF-α, ERO) ; l’expression de
l’acétylcholinestérase (AChE) est diminuée ainsi que celle
de la choline acétyltransférase et de certains récepteurs
muscariniques de l’acétylcholine dans le cortex frontal et
le striatum (Syed et coll.,
2016
). Ces effets sont néanmoins
confirmés avec des doses plus faibles (0,6 et 2,1 mg/kg de
bifenthrine, chroniques car administrées quotidiennement)
conduisant à des syndromes d’anxiété ou de dépression ainsi
qu’à une élévation des marqueurs métaboliques et géniques de
stress oxydant (COX2, NF-κB, TNF-α, ERO) ; l’expression de
l’acétylcholinestérase (AChE) est diminuée ainsi que celle
de la choline acétyltransférase et de certains récepteurs
muscariniques de l’acétylcholine dans le cortex frontal et
le striatum (Syed et coll.,
2016 ; Gargouri et coll.,
2018b
; Gargouri et coll.,
2018b ; Gargouri et coll.,
2019
; Gargouri et coll.,
2019 ). Concernant la modulation
d’expression de l’AChE, l’utilisation d’embryons de poissons
zèbres montre que la cyperméthrine pourrait aussi moduler
l’activité de cette enzyme (Stengel et coll.,
2018
). Concernant la modulation
d’expression de l’AChE, l’utilisation d’embryons de poissons
zèbres montre que la cyperméthrine pourrait aussi moduler
l’activité de cette enzyme (Stengel et coll.,
2018 ). Sur le même modèle, la
deltaméthrine (avec des doses très faibles, 0,01 µg/l, 24 h
après fertilisation) retarde le développement des embryons
impactant l’expression de gènes impliqués dans ce processus
comme ntl, shh et krox20. À partir de
doses supérieures à 0,1 µg/l, une hyperactivité est
observée. Au-delà de 10 µg/l, des malformations apparaissent
(Liu et coll., 2018
). Sur le même modèle, la
deltaméthrine (avec des doses très faibles, 0,01 µg/l, 24 h
après fertilisation) retarde le développement des embryons
impactant l’expression de gènes impliqués dans ce processus
comme ntl, shh et krox20. À partir de
doses supérieures à 0,1 µg/l, une hyperactivité est
observée. Au-delà de 10 µg/l, des malformations apparaissent
(Liu et coll., 2018 ).
). ; Abdelhafidh et coll.,
2018
; Abdelhafidh et coll.,
2018 ; Saoudi et coll., 2019
; Saoudi et coll., 2019 ).
).Modulation des niveaux de plusieurs neurotransmetteurs
 ).
).Dopamine
 ). Les doses utilisées (0,3, 1
et 3 mg/kg) ont été basées sur une modélisation des
niveaux d’exposition aux pyréthrinoïdes chez des femmes
enceintes. L’exposition pendant la période prénatale a
conduit à une augmentation dose-dépendante des niveaux
d’expression du transporteur de la dopamine (DAT) dans
le striatum qui était deux fois plus importante chez les
mâles que chez les femelles. Cet effet, qui n’était pas
observé pour d’autres transporteurs, a pour conséquence
une hypersensibilité à d’autres neurotoxiques (comme le
MPTP, un agent qui cause des symptômes parkinsoniens).
Logiquement, une baisse de la concentration synaptique
de dopamine, probablement capturée par le DAT,
spécifiquement chez les mâles, associée à une
hyperactivité et des déficits de mémoire et d’attention,
est observée. Cette étude très complète réalisée selon
un protocole pertinent sur le plan environnemental, se
conclut par une analyse épidémiologique complémentaire
montrant une association entre métabolites urinaires des
pyréthrinoïdes et syndromes de type autistique ou de
déficit de l’attention, corroborant l’étude
mécanistique. La recapture probable de dopamine médiée
par le DAT est aussi démontrée dans d’autres études,
toujours au niveau du striatum selon un protocole assez
similaire (Bloomquist et coll.,
2002
). Les doses utilisées (0,3, 1
et 3 mg/kg) ont été basées sur une modélisation des
niveaux d’exposition aux pyréthrinoïdes chez des femmes
enceintes. L’exposition pendant la période prénatale a
conduit à une augmentation dose-dépendante des niveaux
d’expression du transporteur de la dopamine (DAT) dans
le striatum qui était deux fois plus importante chez les
mâles que chez les femelles. Cet effet, qui n’était pas
observé pour d’autres transporteurs, a pour conséquence
une hypersensibilité à d’autres neurotoxiques (comme le
MPTP, un agent qui cause des symptômes parkinsoniens).
Logiquement, une baisse de la concentration synaptique
de dopamine, probablement capturée par le DAT,
spécifiquement chez les mâles, associée à une
hyperactivité et des déficits de mémoire et d’attention,
est observée. Cette étude très complète réalisée selon
un protocole pertinent sur le plan environnemental, se
conclut par une analyse épidémiologique complémentaire
montrant une association entre métabolites urinaires des
pyréthrinoïdes et syndromes de type autistique ou de
déficit de l’attention, corroborant l’étude
mécanistique. La recapture probable de dopamine médiée
par le DAT est aussi démontrée dans d’autres études,
toujours au niveau du striatum selon un protocole assez
similaire (Bloomquist et coll.,
2002 ). D’autres pyréthrinoïdes ont
été étudiés dans ce contexte (Elwan et coll.,
2006
). D’autres pyréthrinoïdes ont
été étudiés dans ce contexte (Elwan et coll.,
2006 ). Chez des souris C57BL/6 qui
sont exposées selon une large gamme de concentrations
(0,1-200 mg/kg, 1 fois par semaine, pendant 3 semaines)
à la perméthrine, on observe, comme pour la
deltaméthrine, une augmentation de l’expression du DAT
pour la faible dose de 0,8 mg/kg. Point important dans
cette dernière étude, malgré l’arrêt de l’exposition
(28 jours, temps maximal étudié), cette augmentation
persiste dans le temps (Gillette et Bloomquist,
2003
). Chez des souris C57BL/6 qui
sont exposées selon une large gamme de concentrations
(0,1-200 mg/kg, 1 fois par semaine, pendant 3 semaines)
à la perméthrine, on observe, comme pour la
deltaméthrine, une augmentation de l’expression du DAT
pour la faible dose de 0,8 mg/kg. Point important dans
cette dernière étude, malgré l’arrêt de l’exposition
(28 jours, temps maximal étudié), cette augmentation
persiste dans le temps (Gillette et Bloomquist,
2003 ).
). ). Par ailleurs, la
cyfluthrine en exposition orale sur des rats mâles
(1-20 mg/kg/j pendant 6 j) provoque une diminution des
niveaux de dopamine et de ses métabolites (> 5 mg/kg) et
au-delà de 20 mg/kg, une augmentation du renouvellement
du neurotransmetteur, au niveau du striatum et du cortex
préfrontal (Rodriguez et coll.,
2016
). Par ailleurs, la
cyfluthrine en exposition orale sur des rats mâles
(1-20 mg/kg/j pendant 6 j) provoque une diminution des
niveaux de dopamine et de ses métabolites (> 5 mg/kg) et
au-delà de 20 mg/kg, une augmentation du renouvellement
du neurotransmetteur, au niveau du striatum et du cortex
préfrontal (Rodriguez et coll.,
2016 ). Dans cette étude, une
modulation des niveaux de la sérotonine (striatum), est
aussi constatée.
). Dans cette étude, une
modulation des niveaux de la sérotonine (striatum), est
aussi constatée.Sérotonine
 ). Le système sérotoninergique
est une cible majeure dans les traitements
pharmacologiques de la dépression.
). Le système sérotoninergique
est une cible majeure dans les traitements
pharmacologiques de la dépression. ). Or, les liens entre systèmes
dopaminergique et sérotoninergique sont importants comme
l’illustre la forte innervation du striatum par des
neurones à sérotonine (Sourkes et Poirier,
1965
). Or, les liens entre systèmes
dopaminergique et sérotoninergique sont importants comme
l’illustre la forte innervation du striatum par des
neurones à sérotonine (Sourkes et Poirier,
1965 ). Ainsi l’alléthrine
(10 mg/kg) réduit les niveaux extracellulaires de
sérotonine (46 %) tandis que des doses plus élevées (20
et 60 mg/kg) l’augmente franchement (respectivement
177 % et 243 %). La cyhalothrine l’augmente (145-204 %)
tandis que la deltaméthrine la diminue (32-58 %) de
manière dose-dépendante. Tous ces effets sont bloqués
par la tétrodotoxine (qui bloque les canaux sodiques
voltage-dépendants) et ceux de la deltaméthrine
spécifiquement par un antagoniste des canaux calciques
(Hossain et coll., 2013
). Ainsi l’alléthrine
(10 mg/kg) réduit les niveaux extracellulaires de
sérotonine (46 %) tandis que des doses plus élevées (20
et 60 mg/kg) l’augmente franchement (respectivement
177 % et 243 %). La cyhalothrine l’augmente (145-204 %)
tandis que la deltaméthrine la diminue (32-58 %) de
manière dose-dépendante. Tous ces effets sont bloqués
par la tétrodotoxine (qui bloque les canaux sodiques
voltage-dépendants) et ceux de la deltaméthrine
spécifiquement par un antagoniste des canaux calciques
(Hossain et coll., 2013 ).
). ). La deltaméthrine augmente
ces effets chez les rats soumis à un stress
supplémentaire induit par un test de la nage forcée.
D’autres pyréthrinoïdes favorisent l’apparition de ce
type de symptômes ; ainsi, la neurotoxicité de la
λ-cyhalothrine a été investiguée à l’aide de modèles de
stress chez le rat (test d’immobilisation et de la nage
forcée) ; l’association du stress puis du traitement
(3 mg/kg, per os, pendant 3 jours)
comparativement au stress seul ou traitement seul,
conduit à une augmentation élevée des niveaux de
corticostérone, une perturbation de la fonction de la
BHE (pouvant suggérer une possible perte de
perméabilité) et une altération des niveaux d’amines
biogéniques et de leurs métabolites dans l’hypothalamus,
le cortex frontal, l’hippocampe et le striatum (Shukla
et coll., 2017
). La deltaméthrine augmente
ces effets chez les rats soumis à un stress
supplémentaire induit par un test de la nage forcée.
D’autres pyréthrinoïdes favorisent l’apparition de ce
type de symptômes ; ainsi, la neurotoxicité de la
λ-cyhalothrine a été investiguée à l’aide de modèles de
stress chez le rat (test d’immobilisation et de la nage
forcée) ; l’association du stress puis du traitement
(3 mg/kg, per os, pendant 3 jours)
comparativement au stress seul ou traitement seul,
conduit à une augmentation élevée des niveaux de
corticostérone, une perturbation de la fonction de la
BHE (pouvant suggérer une possible perte de
perméabilité) et une altération des niveaux d’amines
biogéniques et de leurs métabolites dans l’hypothalamus,
le cortex frontal, l’hippocampe et le striatum (Shukla
et coll., 2017 ).
).Glutamate et GABA
 ). Une autre étude dédiée
spécifiquement au glutamate montre que la
β-cyperméthrine à des doses assez fortes (20-80 mg/kg,
dose unique mais exposition courte de 4 h seulement)
diminue les niveaux du neurotransmetteur dans le cortex
de souris (à 80 mg/kg) sans affecter les niveaux
d’activité enzymatique impliqués dans son métabolisme
(Cao et coll., 2015
). Une autre étude dédiée
spécifiquement au glutamate montre que la
β-cyperméthrine à des doses assez fortes (20-80 mg/kg,
dose unique mais exposition courte de 4 h seulement)
diminue les niveaux du neurotransmetteur dans le cortex
de souris (à 80 mg/kg) sans affecter les niveaux
d’activité enzymatique impliqués dans son métabolisme
(Cao et coll., 2015 ). Ces traitements sont
associés à des symptômes comportementaux.
). Ces traitements sont
associés à des symptômes comportementaux.Différenciation neuronale et croissance neuritique
 ). Les effets ont été observés chez
la descendance exposée pendant les deux périodes de
développement embryonnaire. De même, chez les souris, la
perméthrine administrée une seule fois à des doses entre 2
et 75 mg/kg au 10e jour de gestation, conduit à
des défauts de développement de l’arbre vasculaire cérébral
(dès 2 mg/kg), de l’épaisseur du néocortex et de
l’hippocampe associés à des défauts comportementaux
(locomoteur, équilibre) chez les souriceaux mâles de
8 semaines, pour certains dès 2 mg/kg (Imanishi et coll.,
2013
). Les effets ont été observés chez
la descendance exposée pendant les deux périodes de
développement embryonnaire. De même, chez les souris, la
perméthrine administrée une seule fois à des doses entre 2
et 75 mg/kg au 10e jour de gestation, conduit à
des défauts de développement de l’arbre vasculaire cérébral
(dès 2 mg/kg), de l’épaisseur du néocortex et de
l’hippocampe associés à des défauts comportementaux
(locomoteur, équilibre) chez les souriceaux mâles de
8 semaines, pour certains dès 2 mg/kg (Imanishi et coll.,
2013 ). Ces résultats ne sont cependant
pas confirmés in vitro par l’utilisation de cellules
de phéochromocytome de rat PC-12, une lignée cellulaire
utilisée pour étudier les effets neurotoxiques in
vitro du fait de leur potentialité à être
différenciées en cellules présentant des caractéristiques
neuronales, comme la présence de neurites (Westerink et
Ewing, 2008
). Ces résultats ne sont cependant
pas confirmés in vitro par l’utilisation de cellules
de phéochromocytome de rat PC-12, une lignée cellulaire
utilisée pour étudier les effets neurotoxiques in
vitro du fait de leur potentialité à être
différenciées en cellules présentant des caractéristiques
neuronales, comme la présence de neurites (Westerink et
Ewing, 2008 ). Après 5 jours d’exposition, la
λ-cyhalothrine, la cyfluthrine, la deltaméthrine et la
perméthrine (1-100 µM) ont peu d’effets (Christen et coll.,
2017
). Après 5 jours d’exposition, la
λ-cyhalothrine, la cyfluthrine, la deltaméthrine et la
perméthrine (1-100 µM) ont peu d’effets (Christen et coll.,
2017 ).
). ).
).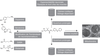 | Figure 3.2 Multiples modes d’action décrits pour les pyréthrinoïdes chez les vertébrés en lien avec des déficits neurocomportementaux |
 ). Cette sensibilité des « jeunes » organismes est
démontrée sur de nombreux modèles expérimentaux (rongeurs en
exposition périnatale, embryons de poissons zèbres) (Liu et
coll., 2018
). Cette sensibilité des « jeunes » organismes est
démontrée sur de nombreux modèles expérimentaux (rongeurs en
exposition périnatale, embryons de poissons zèbres) (Liu et
coll., 2018 ; Stengel et coll.,
2018
; Stengel et coll.,
2018 ).
). ; Huang et coll., 2019
; Huang et coll., 2019 ; Vester et coll.,
2020
; Vester et coll.,
2020 ). Enfin, les pyréthrinoïdes sont
souvent utilisés en mélange et l’analyse des effets des
cocktails de pyréthrinoïdes est une voie de recherche en
développement. À titre d’exemple, un cocktail de
bifenthrine, téfluthrine, α-cyperméthrine et deltaméthrine
sur les fonctions cellulaires a été testé sur des cellules
non neuronales (astrocytome C6). Comparativement aux
molécules seules, les effets du mélange sont potentialisés
et observés pour des concentrations de l’ordre du
nanomolaire (Romero et coll.,
2017b
). Enfin, les pyréthrinoïdes sont
souvent utilisés en mélange et l’analyse des effets des
cocktails de pyréthrinoïdes est une voie de recherche en
développement. À titre d’exemple, un cocktail de
bifenthrine, téfluthrine, α-cyperméthrine et deltaméthrine
sur les fonctions cellulaires a été testé sur des cellules
non neuronales (astrocytome C6). Comparativement aux
molécules seules, les effets du mélange sont potentialisés
et observés pour des concentrations de l’ordre du
nanomolaire (Romero et coll.,
2017b ).
).Conclusion
Tableau 3.I Principales cohortes mères-enfants d’Europe et d’Amérique du Nord, utilisant des marqueurs urinaires ou sanguins d’exposition aux insecticides organophosphorés et pyréthrinoïdes pendant la grossesse
|
Cohortes
Références |
Période et région
d’inclusion
|
Concentrations urinaires
maternelles/prénatales
|
Évaluations neuropsychologiques et
comportementales des enfants
|
|
|---|---|---|---|---|
|
Cohorte CHAMACOS Center for the
Health Assessment of Mothers and Children of
Salinas
|
Vallée de Salinas, Californie,
États-Unis
|
DAP
|
m(g) = 125 nmol/l
m(g) = 144 nmol/g créat |
Comportement social/traits évocateurs
du spectre autistique : Social Responsiveness
Scale Version 2 (SRS-2), auto-rapporté par les
parents à 14 ans de l’enfant pour les 6 derniers
mois
Comportement général dont les capacités
sociales : Behavioral Assessment Scale for
Children Version 2 (BASC-2), auto-rapporté par
les parents et les enseignants à 7 ans, et par les
parents à 10,5 et 14 ans pour les derniers
mois
Performances intellectuelles (QI) :
The Wechsler Intelligence Scale,
4e édition (WISC-IV), par des
psychologues à 7 ans
Perception sociale/capacité à deviner
les émotions des autres : Evaluación
Neuropsicológica Infantil, Facial Expression
Recognition Test, par des psychologues à
9 ans ; et NEPSY-II affect Recognition, par des
psychologues à 12 ans
|
|
1999-2000
|
DMP
|
m(g) = 93 nmol/l
m(g) = 106 nmol/g créat |
||
|
n = 601 (inclusion lors de visite
prénatale)
|
DEP
|
m(g) = 20 nmol/l
m(g) = 24 nmol/g créat |
||
|
Cohorte multiethnique CEHS
Children’s Environmental Health Study de
l’hôpital Mount Sinaï à New York
|
New York, États-Unis
|
DMP
|
m(g) = 37 nmol/l
|
Fonctions exécutives : Behavior
Rating Inventory of Executive Functioning
(BRIEF) auto-rapporté par les parents à 4, 6, 7-9
ans pour les 6 derniers mois
Comportement général : Behavioral
Assessment Scale for Children Version 2
(BASC-2), auto-rapporté par les parents à 4, 6,
7-9 ans pour les derniers mois
Performances intellectuelles (QI) :
Wechsler Preschool and Primary Scales of
Intelligence-III (WPPSI-III) par des
psychologues à 6 ans et Wechsler Intelligence
Scales-IV (WISC-IV) par des psychologues à
7-9 ans
|
|
1998-2001
|
DEP
|
m(g) = 17 nmol/l
|
||
|
n = 404 (inclusion lors de visite
prénatale)
| ||||
|
3-PBA
|
30 % > LOD
|
|||
|
(75e
perc = 0,34 µg/l)
|
||||
|
cis-DCCA
|
14 % > LOD
|
|||
|
trans-DCCA
|
22 % > LOD
|
|||
|
Cohorte CCCEH Columbia Center for
Children’s Environmental Health de
l’Université Columbia
|
New York, États-Unis
|
Sang de
cordon
Chlorpyrifos |
60 % > LOD
|
Développement cognitif et du langage
(Mental Developmental Index) et
moteur (Psychomotor Developmental Index) :
Bayley Scales of Infant Development, Second
Edition (Bayley-II), par des enquêteurs
formés, à 36 mois
Dessins de la spirale d’Archimède, à
l’âge de 11 ans ; avec un codage des tremblements
par un neurologue spécialisé dans les troubles
moteurs
|
|
1998-2006
|
m(a) = 0,36 pg/g
|
|||
|
n = 725 (inclusion lors de visite
prénatale)
|
cis-Perméthrine
|
7 % > LOD
|
||
|
5 % > LOD
|
||||
|
Cohorte HOME Health Outcomes and
Measures of the Environment
|
Cincinnati, États-Unis
|
DAP
|
100 %
> LOD
m(g) = 74 nmol/l m = 97 nmol/g créat |
Réflexes et réactions aux stimuli
sensoriels : NICU Network Neurobehavioral
Scale (NNNS) à 5 semaines de vie
Développement cognitif, du langage
(Mental Developmental Index) et
moteur (Psychomotor Developmental Index) :
Bayley Scales of Infant Development, Second
Edition (Bayley-II), par deux enquêteurs
formés, à 1, 2 et 3 ans
Développement du langage et de la
communication : Clinical Evaluation of Language
Fundamentals-Preschool, Second Édition, par
deux enquêteurs formés, à 4 ans
Performances intellectuelles (QI) :
Wechsler Preschool and Primary Scale of
Intelligence, Third Edition, par deux
enquêteurs formés, à 5 ans
Comportement social/traits évocateurs
du spectre autistique : Social Responsiveness
Scale Version 2 (SRS-2), auto-rapporté par les
parents à 8 ans de l’enfant pour les 6 derniers
mois
|
|
2003-2006
| ||||
|
n = 398 (inclusion lors de visite
prénatale)
|
DMP
|
100 %
> LOD
m(g) = 46 nmol/l m = 64 nmol/g créat |
||
|
DEP
|
93 %
> LOD
m(g) = 9 nmol/l m = 21 nmol/g créat |
|||
|
Cohorte à Central Ohio
|
Central Ohio, États-Unis
|
TCPγ
|
m = 20 ng/kg/j
|
Développement cognitif, du langage
(Mental Developmental Index) et
moteur (Psychomotor Developmental Index) :
Bayley Scales of Infant Development, Second
Edition (Bayley-II) à 3 mois
|
|
2002-2005
|
IMPy
|
15 % > LOD
| ||
|
n = 140 (inclusion lors de visite
prénatale)
|
3-PBA
|
96 % > LOD
m = 8 ng/kg/j (sur valeurs > LOD) | ||
|
cis-DCCA
|
50 %
> LOD
m = 0,01 ng/kg/j (sur valeurs > LOD) | |||
|
trans-DCCA
|
58 % > LOD
m = 5,5 ng/kg/j (sur valeurs > LOD) | |||
|
4F3-PBA, DMCA1/2, CIAA et
DBCA
| ||||
|
< 15 % > LOD
| ||||
|
Cohorte PELAGIE Perturbateurs
endocriniens : étude longitudinale sur les
anomalies de la grossesse, l’infertilité et
l’enfance
|
Bretagne, France
|
DAP
|
91 %
> LOD
m = 44 nmol/l |
Performances intellectuelles (QI) :
Wechsler Intelligence Scales-IV (WISC-IV)
par deux psychologues à 6 ans
|
|
2002-2006
|
DMP
|
90 %
> LOD
m = 34 nmol/l |
Comportement général : Strength and
Difficulties Questionnaire, auto-rapporté par
les parents à 6 ans, pour les derniers
mois
|
|
|
n = 3 421 (inclusion lors de la
1re visite prénatale)
|
DEP
|
40 %
> LOD
75e perc = 13 nmol/l | ||
|
3-PBA
|
30 % > LOD
| |||
|
4F3-PBA
|
9 % > LOD
| |||
|
cis-DCCA
|
65 %
> LOD
m = 0,09 µg/l | |||
|
trans-DCCA
|
98 %
> LOD
m = 0,14 µg/l | |||
|
cis-DBCA
|
68 %
> LOD
m = 0,10 µg/l | |||
|
Cohorte GENERATION R
|
Région de Rotterdam,
Pays-Bas
|
DAP
|
n.r. % > LOD
m = 310 nmol/g créat |
Capacités non verbales visuospatiales
et de raisonnement abstrait : sous-tests
Mosaics et Categories du
Snijders-Oomen Nonverbal Intelligence
TestRevised, test développé aux Pays-Bas
indépendant du langage
|
|
2002-2006
|
DMP
|
n.r. % > LOD
m = 253 nmol/g créat | ||
|
n = 9 778 (inclusion lors de visite
prénatale)
|
DEP
|
n.r. % > LOD
m = 42 nmol/g créat | ||
|
(Pour les urines collectées > 25
semaines de grossesse ; médianes équivalentes pour
les 2 premiers trimestres de
grossesse)
| ||||
|
Cohorte OCC Odense Child
Cohort
|
Région d’Odense, Danemark
|
TCPγ
|
90 %
> LOD
m = 1,61 µg/l |
Comportement de l’enfant, indices
relatifs à des déficits attentionnels, de
l’hyperactivité, et de l’impulsivité : Child
Behavior Check List (CBCL) pour les âges de
1,5 an à 5 ans, auto-rapporté par les parents à
l’âge de 27 mois de leur enfant
|
|
2010-2012
|
3-PBA
|
94 %
> LOD
m = 0,24 µg/l |
||
|
n = 2 500 (inclusion lors de visite
prénatale)
|
4F3-PBA
|
0,1 % > LOD
| ||
|
cis-DCCA
|
2,8 % > LOD
| |||
|
trans-DCCA
|
11,4 % > LOD
| |||
|
cis-DBCA
|
3 % > LOD
| |||
|
Cohorte ELEMENT
Early Life Exposures in Mexico to Environmental Toxicants |
Mexique
|
TCPγ
|
90 % > LOD
m = 1,8 µg/l |
Comportement de l’enfant, indices
relatifs à des déficits attentionnels, de
l’hyperactivité, et de l’impulsivité : Conners’
Parental Rating Scales-Revised (CPRS-R),
Parental Rating Scales (PRS) du Behavior
Assessment System for Children (BASC),
auto-rapportés par les parents et le Continuous
Performance Test (CPT) sur ordinateur pour
l’âge de 6-11 ans de leur enfant
|
|
1997-2005
| ||||
|
n = 187 (inclusion lors de visite
prénatale)
|
3-PBA
|
46 %
> LOD
m(g) = 0,26 µg/l (sur valeurs > LOD) 75e perc = 0,34 µg/l |
||
|
Cohorte VHEMBE Venda Health
Examination of Mothers, Babies and the
Environment
|
Limpopo, Afrique du Sud
|
3-PBA
|
100 %
> LOD
m = 0,7 µg/l |
Développement cognitif et du langage
(Mental Developmental Index) et
moteur (Psychomotor Developmental Index) :
Bayley Scales of Infant Development, Third
Edition (BSID-III), par des enquêteurs formés,
à 1 an (échelle complète) et 2 ans (sans le
domaine socio-émotionnel). Noter que la BSID
prévoit que la sphère socio-émotionnelle est
auto-rapportée par la mère
|
|
2012-2013
|
4F3-PBA
|
12 % > LOD
|
||
|
n = 752 (inclusion à
l’accouchement)
|
cis-DCCA
|
100 % > LOD
m = 0,30 µg/l |
||
|
trans-DCCA
|
100 %
> LOD
m = 0,34 µg/l |
|||
|
cis-DBCA
|
100 %
> LOD
m = 0,22 µg/l |
|||
|
Cohorte LWBC Laizhou Wan Birth
Cohort
|
Shandong, Chine
|
DAP
|
n.r. % > LOD
m = 353 nmol/g créat |
Quatre domaines de développement de
l’enfant (social, langage, adaptative, et
moteur) : Gesell Developmental Schedules,
par des pédiatres formés, à l’âge de 12 et 24 mois
de l’enfant
|
|
2011-2013
|
(DEP, DETP, DMP, DMTP)
|
|||
|
n = 436 (inclusion à
l’accouchement)
| ||||
|
Cohorte de Shenyang
|
Chine
|
DMP
|
n.r. %
> LOD
m = 284 nmol/l |
Comportement et tests de réflexes et
réactions du nouveau-né : Neonatal Behavioral
Neurological Assessment, par deux enquêteurs
formés, aux 3 jours de vie
|
|
2011-2012
|
(DMP, DMTP)
|
|||
|
n = 249 (inclusion à
l’accouchement)
|
DEP
|
n.r. %
> LOD
m = 107 nmol/l |
||
|
Cohorte de Fuyang
|
Région agricole de Zhejiang,
Chine
|
Sang de
cordon
Chlorpyrifos |
37 %
> LOD
75e perc = 0,56 ng/ml |
Capacités motrices : Peabody
Developmental Motor Scales par un enquêteur
formé à l’âge de 6 semaines et 9 mois
Acuité visuelle du jeune enfant :
Teller acuity card, par un enquêteur formé
à l’âge de 6 semaines, 9 et 18 mois
Activité électrique cérébrale autour
des zones de fonction de l’audition : Auditory
brainstem response par un enquêteur formé à
l’âge de 6 semaines, 9 et 18 mois
|
|
2008-2011
| ||||
|
n = 359 (inclusion en visite prénatale
de fin de grossesse)
| ||||
|
Cohorte Sheyang Mini Birth
Cohort
|
Région agricole de Sheyang,
Chine
|
DAP
|
100 %
> LOD
m = 296 nmol/l |
Quatre domaines de développement de
l’enfant (social, langage, adaptative, et
moteur) : Gesell Developmental Schedules,
par des pédiatres formés, à l’âge de 24 et 36 mois
de l’enfant
|
|
2009-2010
|
DMP
|
100 %
> LOD
m = 128 nmol/l |
||
|
n = 1 303 (inclusion à
l’accouchement)
|
DEP
|
100 %
> LOD
m = 135 nmol/l |
||
|
TCPγ
|
100 %
> LOD
m = 5,4 µg/l m = 7,7 µg/g créat |
|||
|
Cohorte à Tokyo
|
Tokyo, Japon
|
3-PBA
|
n.r. %
> LOD
m = 0,39 ng/ml |
Développement (social, langage, moteur)
et comportement de l’enfant : Kinder Infant
Development Scale, auto-rapporté par la mère
avant l’âge de 18 mois
|
|
2009-2011
| ||||
|
n = 194 (inclusion en début de
grossesse)
| ||||
3-PBA : acide 3-phénoxybenzoïque (métabolite de pyréthrinoïdes) ; 4F3-PBA : acide 4-fluoro-3-phénoxybenzoïque (métabolite de pyréthrinoïdes) ; CIAA : acide 4-chlorophényl-2-isopropylacétique (métabolite de pyréthrinoïdes) ; créat : créatinine ; DAP : dialkylphosphates (métabolites des organophosphorés, somme de 6 métabolites de la famille des DEP et DMP ; sauf quand précisé) ; DBCA : acide 3-(2,2-dibromovinyl)-2,2-diméthylcyclopropane-carboxylique (métabolite de la deltaméthrine) ; DCCA : acide 3-(2,2-dichlorovinyl)-2,2-diméthylcyclopropane-carboxylique (métabolite de la perméthrine, cyperméthrine, et la cyfluthrine) ; DEP : diéthylphosphates (somme de 3 métabolites : DEP, DETP, DEDTP) ; DMCA1/2 : acide 3-(2,2-diméthylvinyl)-2,2-diméthylcycplopropane-carboxylique (métabolites de pyréthrinoïdes) ; DMP : diméthylphosphates (somme de 3 métabolites : DMP, DMTP, DMDTP) ; LOD : limite de détection ; m : médiane ; m(a) : moyenne arithmétique ; m(g) : moyenne géométrique ; n.r. : non renseigné dans les articles ; perc : percentile ; TCPγ : 3,5,6-trichloro-2-pyridinol (métabolite du chlorpyrifos) ; IMPy : 2-isopropyl-4-méthyl-6-hydroxypyrimidine (métabolite du diazinon)
Références











 •
•




































































































→ Aller vers SYNTHESE