Pesticides et effets sur la santé
III. Autres pathologies et évènements de santé
2021
| ANALYSE |
17-
Pathologies thyroïdiennes
 ).
Malgré des données toxicologiques positives pour certains pesticides sur
des modèles in vivo (rongeurs) ou in vitro, aucune étude
de cohorte prospective en population générale n’existait à l’époque, et
il était difficile de conclure quant aux effets des pesticides sur la
fonction thyroïdienne à partir de quelques études transversales. Ces
études montraient de faibles associations entre certains composés,
appartenant aux familles des organo-phosphorés ou des organochlorés, et
une modification du taux d’hormones thyroïdiennes (HT) ou une
hypothyroïdie. Depuis, la littérature s’est étoffée tant en
épidémiologie qu’en toxicologie moléculaire avec pour conséquence cette
synthèse des connaissances sur le rôle des pesticides dans la survenue
de pathologies thyroïdiennes.
).
Malgré des données toxicologiques positives pour certains pesticides sur
des modèles in vivo (rongeurs) ou in vitro, aucune étude
de cohorte prospective en population générale n’existait à l’époque, et
il était difficile de conclure quant aux effets des pesticides sur la
fonction thyroïdienne à partir de quelques études transversales. Ces
études montraient de faibles associations entre certains composés,
appartenant aux familles des organo-phosphorés ou des organochlorés, et
une modification du taux d’hormones thyroïdiennes (HT) ou une
hypothyroïdie. Depuis, la littérature s’est étoffée tant en
épidémiologie qu’en toxicologie moléculaire avec pour conséquence cette
synthèse des connaissances sur le rôle des pesticides dans la survenue
de pathologies thyroïdiennes.Physiologie de la thyroïde
Hormones thyroïdiennes
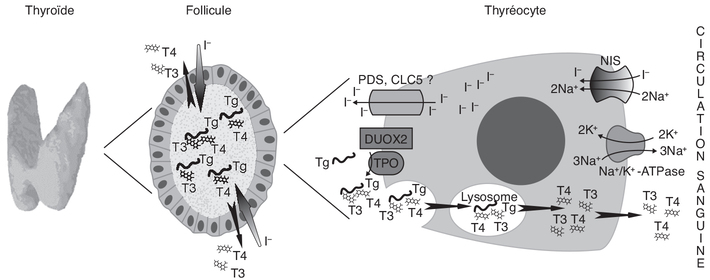
 ). L’iode est un oligo-élément qui est
indispensable à la fabrication des HT. Une dose minimale d’iode
est nécessaire pour un bon fonctionnement de la thyroïde.
Présent en très faible quantité dans le corps, il doit être
fourni par l’alimentation quotidienne (notamment sel iodé de
cuisine, poissons, fruits de mer). La TSH participe à la
captation de l’iode de la circulation sanguine et sa fixation
sur la TG, puis à terme à la libération de T3, T4 et de TG dans
la circulation sanguine.
). L’iode est un oligo-élément qui est
indispensable à la fabrication des HT. Une dose minimale d’iode
est nécessaire pour un bon fonctionnement de la thyroïde.
Présent en très faible quantité dans le corps, il doit être
fourni par l’alimentation quotidienne (notamment sel iodé de
cuisine, poissons, fruits de mer). La TSH participe à la
captation de l’iode de la circulation sanguine et sa fixation
sur la TG, puis à terme à la libération de T3, T4 et de TG dans
la circulation sanguine. ) (figure 17.1
) (figure 17.1 ).
L’activité et l’expression de ce transporteur sont stimulées par
la TSH. L’iode est oxydé en présence
d’H2O2 par la thyroperoxydase (TPO)
localisée sur la membrane en contact avec le colloïde et peut
ainsi se lier aux résidus tyrosine de la TG. Cette réaction
aboutit à la formation du mono-iodotyrosine (MIT) puis avec la
fixation d’un second atome d’iode, au di-iodotyrosine (DIT). Les
molécules de TG iodées sont substrats d’une réaction de couplage
des résidus iodo-tyrosine catalysée par la TPO produisant la T3
(MIT + DIT) et la T4 (DIT + DIT). Cette dernière est une hormone
de réserve, produite en plus grande quantité que la T3 et qui
peut à tout moment être modifiée en T3 par la déiodation qui est
la forme active. La MIT et la DIT sont métabolisées, dans la
thyroïde, en iodure et en tyrosine par une iodotyrosine
déhalogénase (Dehal1). L’iodure ainsi libéré peut alors être
réintroduit dans le processus d’organification. L’activité
Dehal1 est critique pour la synthèse de quantités adéquates d’HT
car elle assure ce recyclage de l’iodure intra-thyroïdien à
partir des formes intermédiaires des HT. La quantité d’iodure
recyclé est 3 à 5 fois plus importante que celle provenant de
l’alimentation au niveau de l’iode utilisé dans la synthèse des
HT (Hichri, 2018
).
L’activité et l’expression de ce transporteur sont stimulées par
la TSH. L’iode est oxydé en présence
d’H2O2 par la thyroperoxydase (TPO)
localisée sur la membrane en contact avec le colloïde et peut
ainsi se lier aux résidus tyrosine de la TG. Cette réaction
aboutit à la formation du mono-iodotyrosine (MIT) puis avec la
fixation d’un second atome d’iode, au di-iodotyrosine (DIT). Les
molécules de TG iodées sont substrats d’une réaction de couplage
des résidus iodo-tyrosine catalysée par la TPO produisant la T3
(MIT + DIT) et la T4 (DIT + DIT). Cette dernière est une hormone
de réserve, produite en plus grande quantité que la T3 et qui
peut à tout moment être modifiée en T3 par la déiodation qui est
la forme active. La MIT et la DIT sont métabolisées, dans la
thyroïde, en iodure et en tyrosine par une iodotyrosine
déhalogénase (Dehal1). L’iodure ainsi libéré peut alors être
réintroduit dans le processus d’organification. L’activité
Dehal1 est critique pour la synthèse de quantités adéquates d’HT
car elle assure ce recyclage de l’iodure intra-thyroïdien à
partir des formes intermédiaires des HT. La quantité d’iodure
recyclé est 3 à 5 fois plus importante que celle provenant de
l’alimentation au niveau de l’iode utilisé dans la synthèse des
HT (Hichri, 2018 ).
).Régulation de la production et de la biodisponibilité des hormones thyroïdiennes
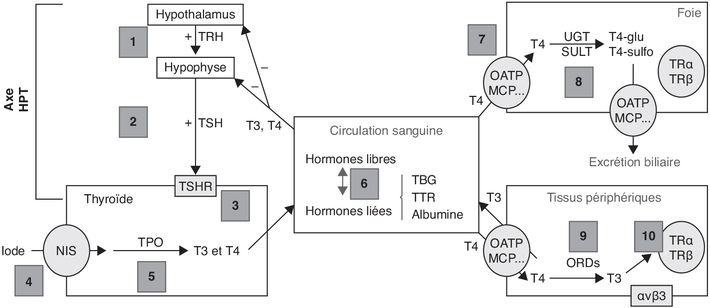
 ). La TRH stimule la synthèse de la
TSH par l’antéhypophyse dont la sécrétion est aussi contrôlée
par les TR (Szkudlinski et coll.,
2002
). La TRH stimule la synthèse de la
TSH par l’antéhypophyse dont la sécrétion est aussi contrôlée
par les TR (Szkudlinski et coll.,
2002 ). La TSH se lie au récepteur de l’hormone stimulant la
thyroïde (TSHR) exprimé au niveau de la membrane basolatérale
des cellules folliculaires de la thyroïde. Ce récepteur couplé à
la protéine G provoque par l’intermédiaire de l’adénylate
cyclase, une augmentation de l’adénosine 3’,5’-monophosphate
cyclique (AMPc) intracellulaire entraînant une production accrue
d’HT dans les cellules folliculaires. Seules les concentrations
circulantes libres (T4L et T3L ; L pour « libre ») participent
au rétrocontrôle négatif sur la TSH hypophysaire et la TRH
hypothalamique.
). La TSH se lie au récepteur de l’hormone stimulant la
thyroïde (TSHR) exprimé au niveau de la membrane basolatérale
des cellules folliculaires de la thyroïde. Ce récepteur couplé à
la protéine G provoque par l’intermédiaire de l’adénylate
cyclase, une augmentation de l’adénosine 3’,5’-monophosphate
cyclique (AMPc) intracellulaire entraînant une production accrue
d’HT dans les cellules folliculaires. Seules les concentrations
circulantes libres (T4L et T3L ; L pour « libre ») participent
au rétrocontrôle négatif sur la TSH hypophysaire et la TRH
hypothalamique. ). Chez l’être humain, la T4 circulante est à 75 % liée à la
TBG, à 15 % à la TTR et à 10 % à l’albumine. La fraction libre
des HT représente en effet moins de 0,5 % de la concentration
sérique totale.
). Chez l’être humain, la T4 circulante est à 75 % liée à la
TBG, à 15 % à la TTR et à 10 % à l’albumine. La fraction libre
des HT représente en effet moins de 0,5 % de la concentration
sérique totale. ). La concentration de T3 est indépendante des variations
physiologiques ou pathologiques des protéines porteuses à
l’inverse de la T4. En effet, une augmentation de T4 peut
résulter d’une élévation de la TBG ou inversement pour une
diminution de T4, variations induites en particulier par des
xénobiotiques dont certains médicaments.
). La concentration de T3 est indépendante des variations
physiologiques ou pathologiques des protéines porteuses à
l’inverse de la T4. En effet, une augmentation de T4 peut
résulter d’une élévation de la TBG ou inversement pour une
diminution de T4, variations induites en particulier par des
xénobiotiques dont certains médicaments. et
17.3
et
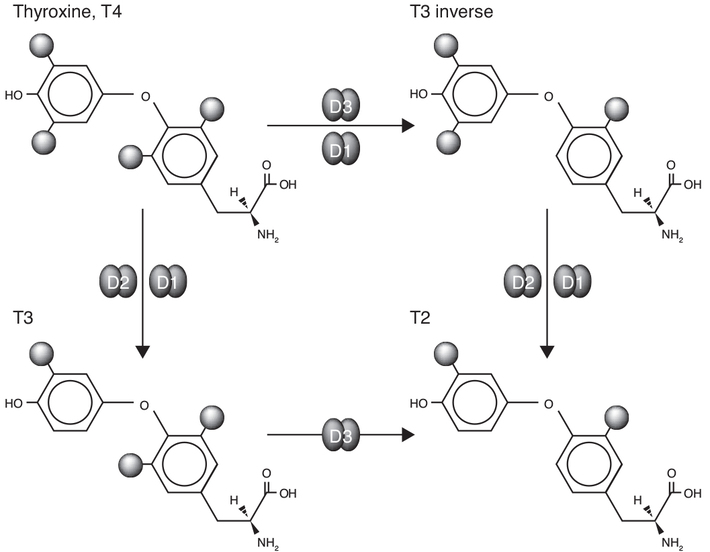
17.3 ). Par ailleurs, T4,
une pré-hormone (qui n’a pas d’action sur les TR), peut aussi
avec T3 être déiodinée en métabolites inactifs ou quasi-inactifs
T3 reverse (rT3), T2 et T1 suite à l’action de D3
(Dentice et coll., 2013
). Par ailleurs, T4,
une pré-hormone (qui n’a pas d’action sur les TR), peut aussi
avec T3 être déiodinée en métabolites inactifs ou quasi-inactifs
T3 reverse (rT3), T2 et T1 suite à l’action de D3
(Dentice et coll., 2013 ; Gereben et coll.,
2015
; Gereben et coll.,
2015 ). L’expression des 5’-déisodases D1, D2 et D3 est variable
dans le temps et selon les organes, ce qui constitue un
mécanisme important de modulation de la signalisation des HT
(Bianco et Kim, 2006
). L’expression des 5’-déisodases D1, D2 et D3 est variable
dans le temps et selon les organes, ce qui constitue un
mécanisme important de modulation de la signalisation des HT
(Bianco et Kim, 2006 ; Bianco,
2011
; Bianco,
2011 ; Gereben et coll., 2015
; Gereben et coll., 2015 ).
).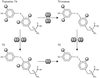 | Figure 17.2 Régulation de l’activité des hormones
thyroïdiennes par la déiodation (d’après Bianco et Kim,
2006 ) ) |
Récepteurs des hormones thyroïdiennes
 ). Chez les vertébrés, T3 est le ligand majoritaire d’une
isoforme (TRa 1) d’un des récepteurs (Tata,
2013
). Chez les vertébrés, T3 est le ligand majoritaire d’une
isoforme (TRa 1) d’un des récepteurs (Tata,
2013 ; Taylor et Heyland, 2017
; Taylor et Heyland, 2017 ; Vella et Hollenberg,
2017
; Vella et Hollenberg,
2017 ). Outre les récepteurs nucléaires, l’intégrine
αvβ3, un récepteur et molécule
d’adhésion transmembranaire liant la vitronectine (une
glycoprotéine sérique), a été identifiée comme récepteur de
nombreux ligands incluant les HT (Bergh et coll.,
2005
). Outre les récepteurs nucléaires, l’intégrine
αvβ3, un récepteur et molécule
d’adhésion transmembranaire liant la vitronectine (une
glycoprotéine sérique), a été identifiée comme récepteur de
nombreux ligands incluant les HT (Bergh et coll.,
2005 ).
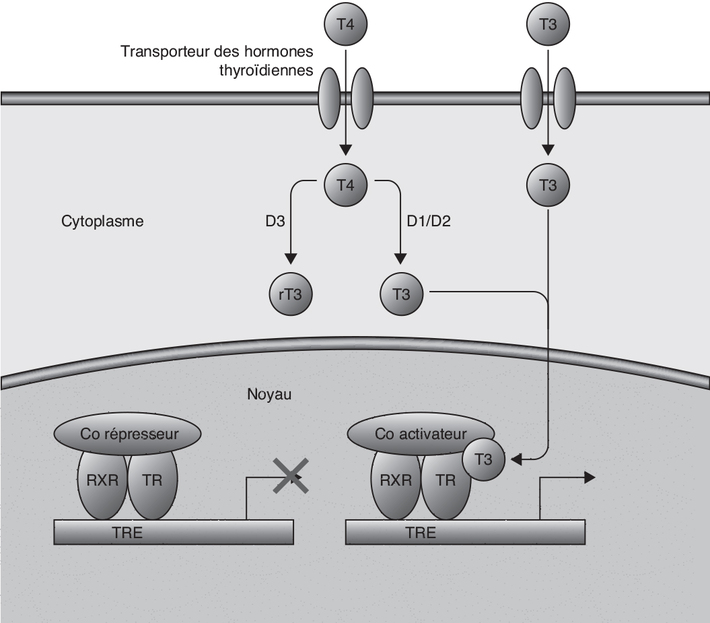
). ) ; ils
forment des hétérodimères avec le récepteur X de rétinoïdes,
inactifs en l’absence de ligands (et recrutant à cet effet, des
corépresseurs transcriptionnels). La liaison des HT aux TR
nucléaires induit l’activation de l’hétérodimère qui échange ces
co-répresseurs avec des coactivateurs, permettant l’activation
transcriptionnelle des gènes cibles. Le récepteur TRβ semble
principalement impliqué dans le rétrocontrôle de la sécrétion
hypophysaire de TSH et dans le développement de l’audition. En
revanche, l’invalidation de TRα conduit à une atrophie
thyroïdienne avec diminution des taux de TSH et des HT. Certains
organes constituent des tissus cibles spécifiques d’un type de
récepteur comme l’oreille interne, l’hypophyse, le cœur, le
foie, l’os ou l’intestin grêle. Cependant, les TRα et TRβ
peuvent coopérer dans certains cas (Flamant et coll.,
2007
) ; ils
forment des hétérodimères avec le récepteur X de rétinoïdes,
inactifs en l’absence de ligands (et recrutant à cet effet, des
corépresseurs transcriptionnels). La liaison des HT aux TR
nucléaires induit l’activation de l’hétérodimère qui échange ces
co-répresseurs avec des coactivateurs, permettant l’activation
transcriptionnelle des gènes cibles. Le récepteur TRβ semble
principalement impliqué dans le rétrocontrôle de la sécrétion
hypophysaire de TSH et dans le développement de l’audition. En
revanche, l’invalidation de TRα conduit à une atrophie
thyroïdienne avec diminution des taux de TSH et des HT. Certains
organes constituent des tissus cibles spécifiques d’un type de
récepteur comme l’oreille interne, l’hypophyse, le cœur, le
foie, l’os ou l’intestin grêle. Cependant, les TRα et TRβ
peuvent coopérer dans certains cas (Flamant et coll.,
2007 ).
). ; Taylor et Heyland,
2017
; Taylor et Heyland,
2017 ). Les données cristallographiques du récepteur
αvβ3 révèlent deux domaines de liaison
S1 et S2 (Lin et coll., 2011
). Les données cristallographiques du récepteur
αvβ3 révèlent deux domaines de liaison
S1 et S2 (Lin et coll., 2011 ). T3 se lie au domaine S1 et active
la PI3K via la kinase Src alors que T3 et T4 se lient au domaine
S2 et activent MAPK1 et 2. Les gènes régulés par la liaison des
HT à l’intégrine αvβ3 incluent ceux codant
pour les récepteurs d’hormones non peptidiques TR et ERα et
d’autres codant pour des protéines qui contrôlent l’angiogenèse
et qui sont associés au développement tumoral (FGF2, MMP2,
HIFIA, COX2) (Davis et coll.,
2016
). T3 se lie au domaine S1 et active
la PI3K via la kinase Src alors que T3 et T4 se lient au domaine
S2 et activent MAPK1 et 2. Les gènes régulés par la liaison des
HT à l’intégrine αvβ3 incluent ceux codant
pour les récepteurs d’hormones non peptidiques TR et ERα et
d’autres codant pour des protéines qui contrôlent l’angiogenèse
et qui sont associés au développement tumoral (FGF2, MMP2,
HIFIA, COX2) (Davis et coll.,
2016 ). Parmi d’autres activités non génomiques des HT, il est
rapporté que i) T4 module la localisation et l’activité
de la désiodase D2, et ainsi la production de T3, en régulant la
dynamique du cytosquelette d’actine des astrocytes (Farwell et
coll., 1990
). Parmi d’autres activités non génomiques des HT, il est
rapporté que i) T4 module la localisation et l’activité
de la désiodase D2, et ainsi la production de T3, en régulant la
dynamique du cytosquelette d’actine des astrocytes (Farwell et
coll., 1990 ) ; ii) T3 participe à la
respiration cellulaire via l’interaction avec le récepteur p43
de la matrice mitochondriale (43-kDa c-ErbAα1) (Casas et coll.,
1999
) ; ii) T3 participe à la
respiration cellulaire via l’interaction avec le récepteur p43
de la matrice mitochondriale (43-kDa c-ErbAα1) (Casas et coll.,
1999 ) avec pour conséquence une contribution à l’intolérance au
glucose et à l’insulino-résistance (Davis et coll.,
2016
) avec pour conséquence une contribution à l’intolérance au
glucose et à l’insulino-résistance (Davis et coll.,
2016 ) ; iii) T2 participe aux régulations métaboliques via
des interactions complexes avec la chaîne respiratoire
mitochondriale (Lanni et coll.,
2005
) ; iii) T2 participe aux régulations métaboliques via
des interactions complexes avec la chaîne respiratoire
mitochondriale (Lanni et coll.,
2005 ; Davis et coll., 2016
; Davis et coll., 2016 ).
).Métabolisme et excrétion
 ) et glucuronyltransférase (Barter et Klaassen,
1992
) et glucuronyltransférase (Barter et Klaassen,
1992 ). Comme des inducteurs d’UGT peuvent augmenter l’élimination
de T4 et non de T3, cette régulation du taux d’hormones libres
repose sur l’activité d’isoenzymes différentes pour UGT ou SULT
(Visser, 1996
). Comme des inducteurs d’UGT peuvent augmenter l’élimination
de T4 et non de T3, cette régulation du taux d’hormones libres
repose sur l’activité d’isoenzymes différentes pour UGT ou SULT
(Visser, 1996 ).
).Pathologies de la thyroïde
 ). Plus généralement, une méta-analyse de 17 études européennes a
rapporté une prévalence des dysthyroïdies (formes cliniques et
sous-cliniques) de 11 %, avec seulement la moitié des patients qui
seraient diagnostiqués (Garmendia Madariaga et coll.,
2014
). Plus généralement, une méta-analyse de 17 études européennes a
rapporté une prévalence des dysthyroïdies (formes cliniques et
sous-cliniques) de 11 %, avec seulement la moitié des patients qui
seraient diagnostiqués (Garmendia Madariaga et coll.,
2014 ).
En ce qui concerne les données françaises, dans le cadre de l’étude
SU.VI.MAX sur la consommation alimentaire et la santé, menée chez
des hommes de 45-60 ans et des femmes de 35-60 ans, l’incidence
annuelle moyenne des dysthyroïdies était de 267 cas pour
100 000 personnes pour l’ensemble de la population, correspondant à
une incidence globale de 2,0 % sur la période de l’étude de 7,5 ans
(Estaquio et coll., 2009
).
En ce qui concerne les données françaises, dans le cadre de l’étude
SU.VI.MAX sur la consommation alimentaire et la santé, menée chez
des hommes de 45-60 ans et des femmes de 35-60 ans, l’incidence
annuelle moyenne des dysthyroïdies était de 267 cas pour
100 000 personnes pour l’ensemble de la population, correspondant à
une incidence globale de 2,0 % sur la période de l’étude de 7,5 ans
(Estaquio et coll., 2009 ). Plus récemment, Barry et coll. ont
constaté une augmentation de l’incidence des hypothyroïdies
congénitales avec glande en place (par opposition aux dysgénésies)
en France durant la période 2002-2012, avec des disparités
régionales (Barry et coll., 2015
). Plus récemment, Barry et coll. ont
constaté une augmentation de l’incidence des hypothyroïdies
congénitales avec glande en place (par opposition aux dysgénésies)
en France durant la période 2002-2012, avec des disparités
régionales (Barry et coll., 2015 ).
). ; Burch,
2019
; Burch,
2019 ;
Lin et coll., 2019
;
Lin et coll., 2019 ). La carence en iode reste la principale
cause d’hypothyroïdie, mais elle est devenue rare dans les pays
développés (Taylor et coll., 2018
). La carence en iode reste la principale
cause d’hypothyroïdie, mais elle est devenue rare dans les pays
développés (Taylor et coll., 2018 ). S’agissant de celles entraînant une
hyperthyroïdie, on peut citer le sexe féminin, des antécédents
familiaux d’hyperthyroïdie, notamment la maladie de Graves-Basedow,
ou des affections auto-immunes (diabète de type 1, anémie
pernicieuse). Le rôle de multiples substances chimiques pouvant
perturber l’homéostasie thyroïdienne est de plus en plus suggéré,
comme par exemple les ions perchlorates (Leux et Guenel,
2010
). S’agissant de celles entraînant une
hyperthyroïdie, on peut citer le sexe féminin, des antécédents
familiaux d’hyperthyroïdie, notamment la maladie de Graves-Basedow,
ou des affections auto-immunes (diabète de type 1, anémie
pernicieuse). Le rôle de multiples substances chimiques pouvant
perturber l’homéostasie thyroïdienne est de plus en plus suggéré,
comme par exemple les ions perchlorates (Leux et Guenel,
2010 ).
).Données des études épidémiologiques
 ). Malgré une hétérogénéité méthodologique entre les 19 études
incluses dans la revue, la plupart montrent des effets sur les
niveaux de T3 et T4, et/ou de TSH, et plusieurs révèlent une
association entre l’exposition aux pesticides et l’hypothyroïdie.
Néanmoins, en raison d’un manque d’ajustement pour les variables
confondantes et des méthodes d’échantillonnage peu rigoureuses
identifiés dans la majorité des études, les auteurs ont conclu que,
dans l’ensemble, la connaissance actuelle restait limitée pour un
effet des pesticides sur la thyroïde.
). Malgré une hétérogénéité méthodologique entre les 19 études
incluses dans la revue, la plupart montrent des effets sur les
niveaux de T3 et T4, et/ou de TSH, et plusieurs révèlent une
association entre l’exposition aux pesticides et l’hypothyroïdie.
Néanmoins, en raison d’un manque d’ajustement pour les variables
confondantes et des méthodes d’échantillonnage peu rigoureuses
identifiés dans la majorité des études, les auteurs ont conclu que,
dans l’ensemble, la connaissance actuelle restait limitée pour un
effet des pesticides sur la thyroïde.Exposition aux pesticides en milieu professionnel
 (voir en fin de ce chapitre).
(voir en fin de ce chapitre).Pathologies de la thyroïde non cancéreuses
Études chez les applicateurs de pesticides – cohorte Agricultural Health Study
 ) ou sous-clinique (Lerro et
coll., 2018b
) ou sous-clinique (Lerro et
coll., 2018b ), ou une hyperthyroïdie
(Shrestha et coll.,
2019
), ou une hyperthyroïdie
(Shrestha et coll.,
2019 ).
). ). Cette mesure d’exposition
par questionnaire était réalisée au moment de
l’inclusion chez 35 150 hommes et femmes avec un suivi
de 20 ans. Des analyses de sensibilité ont été réalisées
pour évaluer l’impact de l’attrition (nombre de sujets
perdus de vue au cours du suivi), qui se sont révélées
sans impact sur la mesure de l’association. Dans cette
étude, après ajustement sur sexe, âge, région et
tabagisme, le risque d’hypothyroïdie était augmenté chez
les participants qui avaient déjà utilisé quatre
insecticides organochlorés parmi les sept étudiés
(aldrine, hepta-chlore et lindane parmi les participants
de plus de 62 ans [âge médian de la population à
l’inclusion] ; chlordane chez l’ensemble des
participants), quatre insecticides organophosphorés
parmi les 9 étudiés (coumaphos chez les plus de 62 ans ;
diazinon, dichlorvos, et malathion chez l’ensemble des
participants) et trois herbicides parmi les 18 étudiés
(dicamba, glyphosate et 2,4-D1
chez l’ensemble des participants). Les
HR allaient de 1,21 ; IC 95 % [1,04-1,41] pour le
chlordane à 1,54 ; IC 95 % [1,23-19,4] pour le lindane
chez les plus de 62 ans. Les insecticides carbamates
(n = 3) et pyréthrinoïdes (n = 2), ainsi que les
fongicides (n = 5) et les fumigants (n = 4) étudiés
n’étaient pas associés au risque d’hypothyroïdie. En
ajustant sur les pesticides corrélés, les associations
sont restées significatives pour le chlordane,
l’heptachlore, le diazinon et le dicamba. Le risque
était le plus important parmi ceux avec la plus forte
intensité d’exposition cumulée avec des tendances
linéaires pour le chlordane, le lindane, le diazinon, et
le coumaphos (chez les plus de 62 ans). Il y avait des
tendances (p ≤ 0,2) pour l’aldrine, le dichlorvos, le
fonofos, et la perméthrine, même si les HR
n’augmentaient pas toujours de façon monotone en
fonction de la catégorie d’exposition aux pesticides.
Pour les herbicides, l’augmentation du risque
d’hypothyroïdie était observée pour le 2,4-D (p de
tendance = 0,01). Il y avait aussi une tendance pour le
2,4,5-T (acide 2,4,5-trichlorophénoxyacetique) parmi les
applicateurs les plus âgés (p de tendance = 0,05), même
si les HR augmentaient faiblement entre les catégories
d’exposition 2 et 3. Même s’il n’y avait pas
d’augmentation dose-réponse pour le glyphosate, les HR
étaient augmentés dans la 2e (1,27 ; IC 95 %
[1,03-1,69]) et 3e catégorie (1,38 ; IC 95 %
[1,12-1,69]) d’exposition cumulée, et un peu moins dans
la dernière catégorie (1,17 ; IC 95 % [0,94-1,45]). Les
résultats de cette étude étaient généralement cohérents
avec les précédentes analyses sur le risque
d’hypothyroïdie en étudiant les cas prévalents de
l’étude AHS ou avec un moindre suivi (Goldner et coll.,
2013
). Cette mesure d’exposition
par questionnaire était réalisée au moment de
l’inclusion chez 35 150 hommes et femmes avec un suivi
de 20 ans. Des analyses de sensibilité ont été réalisées
pour évaluer l’impact de l’attrition (nombre de sujets
perdus de vue au cours du suivi), qui se sont révélées
sans impact sur la mesure de l’association. Dans cette
étude, après ajustement sur sexe, âge, région et
tabagisme, le risque d’hypothyroïdie était augmenté chez
les participants qui avaient déjà utilisé quatre
insecticides organochlorés parmi les sept étudiés
(aldrine, hepta-chlore et lindane parmi les participants
de plus de 62 ans [âge médian de la population à
l’inclusion] ; chlordane chez l’ensemble des
participants), quatre insecticides organophosphorés
parmi les 9 étudiés (coumaphos chez les plus de 62 ans ;
diazinon, dichlorvos, et malathion chez l’ensemble des
participants) et trois herbicides parmi les 18 étudiés
(dicamba, glyphosate et 2,4-D1
chez l’ensemble des participants). Les
HR allaient de 1,21 ; IC 95 % [1,04-1,41] pour le
chlordane à 1,54 ; IC 95 % [1,23-19,4] pour le lindane
chez les plus de 62 ans. Les insecticides carbamates
(n = 3) et pyréthrinoïdes (n = 2), ainsi que les
fongicides (n = 5) et les fumigants (n = 4) étudiés
n’étaient pas associés au risque d’hypothyroïdie. En
ajustant sur les pesticides corrélés, les associations
sont restées significatives pour le chlordane,
l’heptachlore, le diazinon et le dicamba. Le risque
était le plus important parmi ceux avec la plus forte
intensité d’exposition cumulée avec des tendances
linéaires pour le chlordane, le lindane, le diazinon, et
le coumaphos (chez les plus de 62 ans). Il y avait des
tendances (p ≤ 0,2) pour l’aldrine, le dichlorvos, le
fonofos, et la perméthrine, même si les HR
n’augmentaient pas toujours de façon monotone en
fonction de la catégorie d’exposition aux pesticides.
Pour les herbicides, l’augmentation du risque
d’hypothyroïdie était observée pour le 2,4-D (p de
tendance = 0,01). Il y avait aussi une tendance pour le
2,4,5-T (acide 2,4,5-trichlorophénoxyacetique) parmi les
applicateurs les plus âgés (p de tendance = 0,05), même
si les HR augmentaient faiblement entre les catégories
d’exposition 2 et 3. Même s’il n’y avait pas
d’augmentation dose-réponse pour le glyphosate, les HR
étaient augmentés dans la 2e (1,27 ; IC 95 %
[1,03-1,69]) et 3e catégorie (1,38 ; IC 95 %
[1,12-1,69]) d’exposition cumulée, et un peu moins dans
la dernière catégorie (1,17 ; IC 95 % [0,94-1,45]). Les
résultats de cette étude étaient généralement cohérents
avec les précédentes analyses sur le risque
d’hypothyroïdie en étudiant les cas prévalents de
l’étude AHS ou avec un moindre suivi (Goldner et coll.,
2013 ; Lerro et coll.,
2018b
; Lerro et coll.,
2018b ).
). ). Cette étude a été réalisée
chez des sujets ne déclarant pas de trouble de la
thyroïde et ne prenant aucune médication thyroïdienne.
Les auteurs ont montré parmi cinquante pesticides
différents des associations entre le risque d’une
hypothyroïdie sous-clinique (TSH supérieure à 4,5 mIU/l)
et l’exposition cumulée au cours de la vie à l’aldrine
avec une relation exposition-effet (OR = 4,76 ; IC 95 %
[1,53-14,82] pour la catégorie d’exposition la plus
élevée) et à l’herbicide pendiméthaline (OR = 2,78 ;
IC 95 % [1,30-5,95] pour la catégorie d’exposition la
plus élevée). Le captane et
l’éthyl-dipropylthiocarbamate étaient eux associés, à la
limite de la signification statistique, à une
hypothyroïdie sous-clinique (p de tendance
respectivement 0,09 et 0,05) et à une augmentation de
TSH (p de tendance respectivement 0,05 et 0,04). Le
fumigant bromure de méthyle était associé à une
diminution de la TSH et augmentation de T4. Une
association positive et modeste, mais à la limite de la
signification statistique, était observée entre le
glyphosate et la TSH (OR = 1,14 ; IC 95 % [0,99-1,33]),
ainsi que la trifluraline et la TSH (OR = 1,14 ; IC 95 %
[0,97-1,34]) chez les applicateurs dans la catégorie
d’exposition la plus élevée alors que ces substances
n’étaient pas associées à un risque accru
d’hypothyroïdie sous-clinique. Toutes les associations
étaient ajustées sur l’âge, la région, l’IMC, le
tabagisme et sur les autres pesticides associés au
pesticide étudié.
). Cette étude a été réalisée
chez des sujets ne déclarant pas de trouble de la
thyroïde et ne prenant aucune médication thyroïdienne.
Les auteurs ont montré parmi cinquante pesticides
différents des associations entre le risque d’une
hypothyroïdie sous-clinique (TSH supérieure à 4,5 mIU/l)
et l’exposition cumulée au cours de la vie à l’aldrine
avec une relation exposition-effet (OR = 4,76 ; IC 95 %
[1,53-14,82] pour la catégorie d’exposition la plus
élevée) et à l’herbicide pendiméthaline (OR = 2,78 ;
IC 95 % [1,30-5,95] pour la catégorie d’exposition la
plus élevée). Le captane et
l’éthyl-dipropylthiocarbamate étaient eux associés, à la
limite de la signification statistique, à une
hypothyroïdie sous-clinique (p de tendance
respectivement 0,09 et 0,05) et à une augmentation de
TSH (p de tendance respectivement 0,05 et 0,04). Le
fumigant bromure de méthyle était associé à une
diminution de la TSH et augmentation de T4. Une
association positive et modeste, mais à la limite de la
signification statistique, était observée entre le
glyphosate et la TSH (OR = 1,14 ; IC 95 % [0,99-1,33]),
ainsi que la trifluraline et la TSH (OR = 1,14 ; IC 95 %
[0,97-1,34]) chez les applicateurs dans la catégorie
d’exposition la plus élevée alors que ces substances
n’étaient pas associées à un risque accru
d’hypothyroïdie sous-clinique. Toutes les associations
étaient ajustées sur l’âge, la région, l’IMC, le
tabagisme et sur les autres pesticides associés au
pesticide étudié. ), qui a montré que
l’exposition des applicateurs à certains pesticides
organochlorés (heptachlore, lindane, et chlordane),
organophosphorés (diazinon et malathion) ou herbicides
(2,4-D et dicamba) était associée à une augmentation de
risque d’hypothyroïdie. Les études récentes n’ont pas
confirmé les associations mises en évidence précédemment
impliquant le DDT, le toxaphène et le carbofuran, et
elles ont fait ressortir des associations modestes entre
l’exposition au glyphosate ou à la trifluraline et un
risque accru de l’hypothyroïdie.
), qui a montré que
l’exposition des applicateurs à certains pesticides
organochlorés (heptachlore, lindane, et chlordane),
organophosphorés (diazinon et malathion) ou herbicides
(2,4-D et dicamba) était associée à une augmentation de
risque d’hypothyroïdie. Les études récentes n’ont pas
confirmé les associations mises en évidence précédemment
impliquant le DDT, le toxaphène et le carbofuran, et
elles ont fait ressortir des associations modestes entre
l’exposition au glyphosate ou à la trifluraline et un
risque accru de l’hypothyroïdie. ). Parmi les mêmes
35 150 applicateurs de l’étude présentée ci-dessus
(Shrestha et coll.,
2018b
). Parmi les mêmes
35 150 applicateurs de l’étude présentée ci-dessus
(Shrestha et coll.,
2018b ), 271 ont développé une
hyperthyroïdie au cours du suivi. L’analyse par modèle
de Cox ajusté sur sexe, éducation, région et tabagisme a
mis en évidence que plusieurs pesticides (malathion,
manèbe/mancozèbe, dicamba, métolachlore, et atrazine
dans l’échantillon complet et le chlorimuron-éthyle chez
les moins de 62 ans) étaient associés à une diminution
de risque d’hyperthyroïdie. L’association négative la
plus forte était observée avec le manèbe/mancozèbe
(HR = 0,50 ; IC 95 % [0,30-0,83]). Le risque
d’hyperthyroïdie était également plus faible parmi les
agriculteurs qui avaient une exposition au cours de la
vie pondérée par l’intensité plus importante au
carbofuran et chlorpyrifos.
), 271 ont développé une
hyperthyroïdie au cours du suivi. L’analyse par modèle
de Cox ajusté sur sexe, éducation, région et tabagisme a
mis en évidence que plusieurs pesticides (malathion,
manèbe/mancozèbe, dicamba, métolachlore, et atrazine
dans l’échantillon complet et le chlorimuron-éthyle chez
les moins de 62 ans) étaient associés à une diminution
de risque d’hyperthyroïdie. L’association négative la
plus forte était observée avec le manèbe/mancozèbe
(HR = 0,50 ; IC 95 % [0,30-0,83]). Le risque
d’hyperthyroïdie était également plus faible parmi les
agriculteurs qui avaient une exposition au cours de la
vie pondérée par l’intensité plus importante au
carbofuran et chlorpyrifos.Études chez les femmes d’agriculteurs – cohorte Agricultural Health Study
 ). Les participantes étaient
classées comme cas lorsqu’elles rapportaient un
diagnostic médical. L’exposition était évaluée par
questionnaire, avec des questions sur le fait que les
épouses elles-mêmes avaient déjà mélangé ou appliqué les
pesticides étudiés. Les OR étaient calculés par
régression logistique poly-tomique (absence de
pathologie de la thyroïde, hypothyroïdie, hyperthyroïdie
ou autres), ajustés sur le niveau d’éducation (études
supérieures oui/non), l’âge à l’inclusion (< 45,
46-55, 56-65, > 66 ans), le statut tabagique (jamais,
passé, actuel), l’indice de masse corporelle (IMC :
< 25 ; 25-29,9 ; > 30 kg/m2), et la prise
de traitement hormonal substitutif (jamais, déjà). Une
augmentation du risque d’hypothyroïdie a été mise en
évidence en lien avec l’utilisation de pesticides
organochlorés sans distinction (OR = 1,2 ; IC 95 %
[1,0-1,6]), ainsi que des fongicides sans distinction
(OR = 1,4 ; IC 95 % [1,1-1,8]). Les associations étaient
plus particulièrement observées avec le chlordane, les
fongicides bénomyl, manèbe et mancozèbe et l’herbicide
paraquat. Concernant les hyperthyroïdies, le manèbe et
mancozèbe, membres de la famille des dithiocarbamates,
étaient les seuls également associés avec un risque
augmenté d’hyperthyroïdie (OR = 2,3 ; IC 95 %
[1,2-4,4]). Il n’y avait pas d’association avec
l’utilisation par le passé d’herbicides, de fumigants,
ou d’insecticides de la famille des organochlorés,
organophosphorés, carbamates ou pyréthrinoïdes.
). Les participantes étaient
classées comme cas lorsqu’elles rapportaient un
diagnostic médical. L’exposition était évaluée par
questionnaire, avec des questions sur le fait que les
épouses elles-mêmes avaient déjà mélangé ou appliqué les
pesticides étudiés. Les OR étaient calculés par
régression logistique poly-tomique (absence de
pathologie de la thyroïde, hypothyroïdie, hyperthyroïdie
ou autres), ajustés sur le niveau d’éducation (études
supérieures oui/non), l’âge à l’inclusion (< 45,
46-55, 56-65, > 66 ans), le statut tabagique (jamais,
passé, actuel), l’indice de masse corporelle (IMC :
< 25 ; 25-29,9 ; > 30 kg/m2), et la prise
de traitement hormonal substitutif (jamais, déjà). Une
augmentation du risque d’hypothyroïdie a été mise en
évidence en lien avec l’utilisation de pesticides
organochlorés sans distinction (OR = 1,2 ; IC 95 %
[1,0-1,6]), ainsi que des fongicides sans distinction
(OR = 1,4 ; IC 95 % [1,1-1,8]). Les associations étaient
plus particulièrement observées avec le chlordane, les
fongicides bénomyl, manèbe et mancozèbe et l’herbicide
paraquat. Concernant les hyperthyroïdies, le manèbe et
mancozèbe, membres de la famille des dithiocarbamates,
étaient les seuls également associés avec un risque
augmenté d’hyperthyroïdie (OR = 2,3 ; IC 95 %
[1,2-4,4]). Il n’y avait pas d’association avec
l’utilisation par le passé d’herbicides, de fumigants,
ou d’insecticides de la famille des organochlorés,
organophosphorés, carbamates ou pyréthrinoïdes. ). Une validation interne
montrait que la qualité des informations recueillies par
auto-déclaration était meilleure pour l’hypothyroïdie
que pour l’hyperthyroïdie (confirmées par les dossiers
médicaux respectivement pour 91 % et 32 % des cas). Pour
les fongicides sans distinction, les auteurs mettaient
en évidence une augmentation du risque d’hypothyroïdie,
avec un HR (ajusté sur l’éducation, lieu de résidence et
le tabagisme) de 1,26 ; IC 95 % [1,02-1,54]. Des
associations statistiquement significatives ont été
retrouvées en particulier pour le bénomyl, le
manèbe/mancozèbe, et le métalaxyl. Un risque élevé
d’hypothyroïdie était également observé en lien avec la
pendiméthaline après ajustement sur d’autres pesticides
corrélés (HR = 1,77 ; IC 95 % [1,19-2,62]), et parmi les
plus de 60 ans, pour le parathion (HR = 2,44 ; IC 95 %
[1,43-4,16], 14 cas exposés) et la perméthrine
(HR = 1,68 ; IC 95 % [1,01-2,82]). Par ailleurs,
l’insecticide phorate, et les herbicides imazéthapyr et
métolachlore étaient associés à une diminution de risque
d’hypothyroïdie, tandis qu’aucun lien n’a été retrouvé
pour le glyphosate (HR = 1,07 ; IC 95 % [0,95-1,20]).
L’insecticide diazinon (HR = 1,35 ; IC 95 %
[1,05-1,73]), les fongicides manèbe et mancozèbe
(HR = 1,74 ; IC 95 % [1,05-2,88]), et l’herbicide
métolachlore (HR = 2,01 ; IC 95 % [1,17-3,44]) étaient
associés à un risque augmenté d’hyperthyroïdie, tandis
qu’une diminution du risque a été observée pour
l’herbicide trifluraline.
). Une validation interne
montrait que la qualité des informations recueillies par
auto-déclaration était meilleure pour l’hypothyroïdie
que pour l’hyperthyroïdie (confirmées par les dossiers
médicaux respectivement pour 91 % et 32 % des cas). Pour
les fongicides sans distinction, les auteurs mettaient
en évidence une augmentation du risque d’hypothyroïdie,
avec un HR (ajusté sur l’éducation, lieu de résidence et
le tabagisme) de 1,26 ; IC 95 % [1,02-1,54]. Des
associations statistiquement significatives ont été
retrouvées en particulier pour le bénomyl, le
manèbe/mancozèbe, et le métalaxyl. Un risque élevé
d’hypothyroïdie était également observé en lien avec la
pendiméthaline après ajustement sur d’autres pesticides
corrélés (HR = 1,77 ; IC 95 % [1,19-2,62]), et parmi les
plus de 60 ans, pour le parathion (HR = 2,44 ; IC 95 %
[1,43-4,16], 14 cas exposés) et la perméthrine
(HR = 1,68 ; IC 95 % [1,01-2,82]). Par ailleurs,
l’insecticide phorate, et les herbicides imazéthapyr et
métolachlore étaient associés à une diminution de risque
d’hypothyroïdie, tandis qu’aucun lien n’a été retrouvé
pour le glyphosate (HR = 1,07 ; IC 95 % [0,95-1,20]).
L’insecticide diazinon (HR = 1,35 ; IC 95 %
[1,05-1,73]), les fongicides manèbe et mancozèbe
(HR = 1,74 ; IC 95 % [1,05-2,88]), et l’herbicide
métolachlore (HR = 2,01 ; IC 95 % [1,17-3,44]) étaient
associés à un risque augmenté d’hyperthyroïdie, tandis
qu’une diminution du risque a été observée pour
l’herbicide trifluraline.Études transversales chez les agriculteurs ou travailleurs agricoles
 ). Le type et la quantité de
pesticides utilisés étaient demandés à ceux travaillant
dans l’agriculture traditionnelle. Les niveaux de TSH,
T3 libre, T3 et T4 des agriculteurs traditionnels
étaient environ 1,6, 1,2, 1,3 et 1,1 fois plus élevés
que ceux de l’agriculture biologique. Ces résultats
peuvent s’expliquer par les taux d’hormones
thyroïdiennes au-dessous des valeurs de référence chez
les agriculteurs biologiques mais les auteurs ont noté
que ces différences pourraient également s’expliquer par
des effets d’âge ou de genre. En regardant les
associations avec des pesticides spécifiques, les
auteurs ont mis en évidence des associations, uniquement
positives, entre la quantité appliquée de plusieurs
herbicides dans le passé et le niveau d’hormones
thyroïdiennes, après ajustement sur les variables
associées aux hormones thyroïdiennes : sexe, tabagisme
actuel, consommation d’alcool actuelle, utilisation de
pesticides au domicile durant l’année précédente,
niveaux de triglycérides et stress dans les 2 à
4 dernières semaines. Les substances actives analysées
étaient le paraquat (associé à une augmentation de TSH,
T3 libre et T3), l’acétochlore (T4 libre), l’atrazine
(TSH, T3 libre et T3), le glyphosate (T4) ; le diuron
(TSH) et une catégorie « autres herbicides » qui
incluait l’alachlore, le propanil, et le butachlor (FT4
et T3). Les produits les plus utilisés dans cette étude
étaient le glyphosate, le paraquat et le 2,4-D.
). Le type et la quantité de
pesticides utilisés étaient demandés à ceux travaillant
dans l’agriculture traditionnelle. Les niveaux de TSH,
T3 libre, T3 et T4 des agriculteurs traditionnels
étaient environ 1,6, 1,2, 1,3 et 1,1 fois plus élevés
que ceux de l’agriculture biologique. Ces résultats
peuvent s’expliquer par les taux d’hormones
thyroïdiennes au-dessous des valeurs de référence chez
les agriculteurs biologiques mais les auteurs ont noté
que ces différences pourraient également s’expliquer par
des effets d’âge ou de genre. En regardant les
associations avec des pesticides spécifiques, les
auteurs ont mis en évidence des associations, uniquement
positives, entre la quantité appliquée de plusieurs
herbicides dans le passé et le niveau d’hormones
thyroïdiennes, après ajustement sur les variables
associées aux hormones thyroïdiennes : sexe, tabagisme
actuel, consommation d’alcool actuelle, utilisation de
pesticides au domicile durant l’année précédente,
niveaux de triglycérides et stress dans les 2 à
4 dernières semaines. Les substances actives analysées
étaient le paraquat (associé à une augmentation de TSH,
T3 libre et T3), l’acétochlore (T4 libre), l’atrazine
(TSH, T3 libre et T3), le glyphosate (T4) ; le diuron
(TSH) et une catégorie « autres herbicides » qui
incluait l’alachlore, le propanil, et le butachlor (FT4
et T3). Les produits les plus utilisés dans cette étude
étaient le glyphosate, le paraquat et le 2,4-D. ). Dans cette population, le
mancozèbe et le sulfate de cuivre étaient les fongicides
les plus fréquemment utilisés, et le glyphosate et le
paraquat étaient les deux herbicides rapportés comme les
plus fréquemment utilisés. L’exposition au cours de la
vie aux fongicides, herbicides et dithiocarbamates était
associée à l’augmentation de la TSH et la diminution de
la T4 libre, plus particulièrement chez les hommes, avec
une relation exposition-effet monotone. En revanche, le
travail à la ferme et l’exposition globale à tous
pesticides au cours de la vie étaient associés à une
baisse de TSH et respectivement à une augmentation des
T3 totale et T4 libre. Les auteurs retrouvaient peu
d’associations chez les femmes. Les associations avec
les biomarqueurs de pesticides étaient faibles et peu
consistantes. Après ajustement sur le sexe, l’âge,
l’IMC, le tabagisme et la consommation d’alcool, parmi
les nombreux métabolites de pesticides testés, la
détection de γ-chlordane était associée positivement à
la concentration de TSH en log (β = 1,25 [1,01-1,54]) et
au log de la concentration en T3 (β = 1,06 [1,01-1,11]),
la dieldrine négativement au log de la concentration en
T4 libre (β = 0,92 [0,86-0,99]). Des pesticides en
nombre plus important étaient associés au niveau de T3
soit positivement (γ-chlordane, β-HCH, époxyde
d’heptachlore [un métabolite d’heptachlore],
trans-nonachlore, p,p’-DDE, endosulfan II)
soit négativement (endrine, heptachlore).
). Dans cette population, le
mancozèbe et le sulfate de cuivre étaient les fongicides
les plus fréquemment utilisés, et le glyphosate et le
paraquat étaient les deux herbicides rapportés comme les
plus fréquemment utilisés. L’exposition au cours de la
vie aux fongicides, herbicides et dithiocarbamates était
associée à l’augmentation de la TSH et la diminution de
la T4 libre, plus particulièrement chez les hommes, avec
une relation exposition-effet monotone. En revanche, le
travail à la ferme et l’exposition globale à tous
pesticides au cours de la vie étaient associés à une
baisse de TSH et respectivement à une augmentation des
T3 totale et T4 libre. Les auteurs retrouvaient peu
d’associations chez les femmes. Les associations avec
les biomarqueurs de pesticides étaient faibles et peu
consistantes. Après ajustement sur le sexe, l’âge,
l’IMC, le tabagisme et la consommation d’alcool, parmi
les nombreux métabolites de pesticides testés, la
détection de γ-chlordane était associée positivement à
la concentration de TSH en log (β = 1,25 [1,01-1,54]) et
au log de la concentration en T3 (β = 1,06 [1,01-1,11]),
la dieldrine négativement au log de la concentration en
T4 libre (β = 0,92 [0,86-0,99]). Des pesticides en
nombre plus important étaient associés au niveau de T3
soit positivement (γ-chlordane, β-HCH, époxyde
d’heptachlore [un métabolite d’heptachlore],
trans-nonachlore, p,p’-DDE, endosulfan II)
soit négativement (endrine, heptachlore). ), des travailleurs de la
banane aux Philippines (n = 88) exposés aux EBDC et
autres fongicides (chlorothalonil, propanil, et
bitertanol) utilisés en même temps ou en alternance avec
ce dernier (Panganiban et coll.,
2004
), des travailleurs de la
banane aux Philippines (n = 88) exposés aux EBDC et
autres fongicides (chlorothalonil, propanil, et
bitertanol) utilisés en même temps ou en alternance avec
ce dernier (Panganiban et coll.,
2004 ), et travailleurs dans des
serres (n = 108) en Roumanie (Simescu et coll.,
2014
), et travailleurs dans des
serres (n = 108) en Roumanie (Simescu et coll.,
2014 ).
). ). Les auteurs ont montré par
la suite que ces effets sont déterminés par l’activité
de la paraoxonase, une enzyme intervenant dans
l’hydrolyse des organophosphorés (Lacasaña et coll.,
2010b
). Les auteurs ont montré par
la suite que ces effets sont déterminés par l’activité
de la paraoxonase, une enzyme intervenant dans
l’hydrolyse des organophosphorés (Lacasaña et coll.,
2010b ). Blanco-Muñoz et coll. ont
exploré le lien entre les taux sériques de p,p’-DDE et
les hormones thyroïdiennes dans cette même population
(Blanco-Muñoz et coll.,
2016
). Blanco-Muñoz et coll. ont
exploré le lien entre les taux sériques de p,p’-DDE et
les hormones thyroïdiennes dans cette même population
(Blanco-Muñoz et coll.,
2016 ). Une association positive a
été retrouvée entre le p,p’-DDE et les concentrations de
T3 et de T4 totales avec une relation exposition-effet,
mais sans effet sur la TSH.
). Une association positive a
été retrouvée entre le p,p’-DDE et les concentrations de
T3 et de T4 totales avec une relation exposition-effet,
mais sans effet sur la TSH. ). Aux États-Unis,
144 applicateurs de pesticides avaient également des
niveaux de TSH plus élevés que 49 témoins urbains, ainsi
que des variations saisonnières non observées chez ces
derniers (Garry et coll.,
2003
). Aux États-Unis,
144 applicateurs de pesticides avaient également des
niveaux de TSH plus élevés que 49 témoins urbains, ainsi
que des variations saisonnières non observées chez ces
derniers (Garry et coll.,
2003 ).
). ).
). ).
). ). Dans une étude analysant
la fonction de reproduction chez des agriculteurs
vénézuéliens, aucune différence dans les taux sériques
de T4 libres et de TSH n’a été retrouvée entre les
hommes (n = 64) exposés aux organophosphorés et aux
carbamates par rapport à 35 témoins non exposés
(Miranda-Contreras et coll.,
2013
). Dans une étude analysant
la fonction de reproduction chez des agriculteurs
vénézuéliens, aucune différence dans les taux sériques
de T4 libres et de TSH n’a été retrouvée entre les
hommes (n = 64) exposés aux organophosphorés et aux
carbamates par rapport à 35 témoins non exposés
(Miranda-Contreras et coll.,
2013 ).
).Études dans des populations sensibles – exposition in utero
 ).
).Études chez d’autres professionnels
 ). Une augmentation de
100 ng/g lipides de p,p’-DDE correspondait à une
augmentation de 0,03 mU/l (IC 95 % [0,01-0,05]) de TSH,
après ajustement sur l’âge. Lorsque l’exposition était
catégorisée, l’association semblait être liée au dernier
quartile (β = 0,33 ; IC 95 % [- 0,08 ; 0,73]), alors
qu’elle était plutôt négative pour les quartiles 2 et 3.
Chez 56 capitaines de bateaux consommateurs ou non de
poissons des Grands Lacs d’Amérique du Nord, Turyk et
coll. observaient une corrélation négative, mais non
statistiquement significative, entre les taux sériques
de DDE et de T4 (r = - 0,26 ; p = 0,09) ou de TSH
(r = - 0,25 ; p = 0,09) après ajustement sur l’âge,
l’IMC, et la prise de médicaments antilipémiants,
antihypertenseurs, et anti-inflammatoires non
stéroïdiens (Turyk et coll.,
2006
). Une augmentation de
100 ng/g lipides de p,p’-DDE correspondait à une
augmentation de 0,03 mU/l (IC 95 % [0,01-0,05]) de TSH,
après ajustement sur l’âge. Lorsque l’exposition était
catégorisée, l’association semblait être liée au dernier
quartile (β = 0,33 ; IC 95 % [- 0,08 ; 0,73]), alors
qu’elle était plutôt négative pour les quartiles 2 et 3.
Chez 56 capitaines de bateaux consommateurs ou non de
poissons des Grands Lacs d’Amérique du Nord, Turyk et
coll. observaient une corrélation négative, mais non
statistiquement significative, entre les taux sériques
de DDE et de T4 (r = - 0,26 ; p = 0,09) ou de TSH
(r = - 0,25 ; p = 0,09) après ajustement sur l’âge,
l’IMC, et la prise de médicaments antilipémiants,
antihypertenseurs, et anti-inflammatoires non
stéroïdiens (Turyk et coll.,
2006 ). Herin et coll., dans une
étude portant sur 159 travailleurs d’une usine française
de médicaments vétérinaires contenant du fipronil, ont
constaté une corrélation négative entre la concentration
plasmatique en fipronil sulfone et le taux de TSH dans
des analyses non ajustées, mais sans effet sur le taux
de T4 totale ou libre (la T3 n’a pas été analysée)
(Herin et coll., 2011
). Herin et coll., dans une
étude portant sur 159 travailleurs d’une usine française
de médicaments vétérinaires contenant du fipronil, ont
constaté une corrélation négative entre la concentration
plasmatique en fipronil sulfone et le taux de TSH dans
des analyses non ajustées, mais sans effet sur le taux
de T4 totale ou libre (la T3 n’a pas été analysée)
(Herin et coll., 2011 ).
). ). Une étude portant sur des
travailleurs (n = 30) d’une usine de fabrication de
pesticides en Inde a comparé les taux sériques des HT
dans cette population à ceux de 20 sujets en population
générale. Les travailleurs exposés à plusieurs
pesticides (endosulfan, quinalphos, chlorpyrifos,
monocrotophos, lindane, parathion, phorate, fenvalérate)
avaient une baisse de T3 totale et une augmentation non
statistiquement significative de TSH (Zaidi et coll.,
2000
). Une étude portant sur des
travailleurs (n = 30) d’une usine de fabrication de
pesticides en Inde a comparé les taux sériques des HT
dans cette population à ceux de 20 sujets en population
générale. Les travailleurs exposés à plusieurs
pesticides (endosulfan, quinalphos, chlorpyrifos,
monocrotophos, lindane, parathion, phorate, fenvalérate)
avaient une baisse de T3 totale et une augmentation non
statistiquement significative de TSH (Zaidi et coll.,
2000 ). Une étude menée en
Nouvelle-Zélande a montré que des producteurs de
pesticides les plus exposés à la
2,3,7,8-tétrachlorodibenzo-p-dioxine (TCDD) par leur
poste, avait une baisse de la T4 libre (’t Mannetje et
coll., 2018
). Une étude menée en
Nouvelle-Zélande a montré que des producteurs de
pesticides les plus exposés à la
2,3,7,8-tétrachlorodibenzo-p-dioxine (TCDD) par leur
poste, avait une baisse de la T4 libre (’t Mannetje et
coll., 2018 ). Enfin, cette même équipe a
précédemment montré, dans un cadre professionnel
différent, une augmentation de risque non significative
des troubles thyroïdiens (sans précision) en lien avec
l’exposition au pentachlorophénol chez les employés
(n = 293) d’une scierie (McLean et coll.,
2009
). Enfin, cette même équipe a
précédemment montré, dans un cadre professionnel
différent, une augmentation de risque non significative
des troubles thyroïdiens (sans précision) en lien avec
l’exposition au pentachlorophénol chez les employés
(n = 293) d’une scierie (McLean et coll.,
2009 ).
).Cancer de la thyroïde
 ). En Norvège, à partir de
registres recensant 236 646 personnes faisant partie de
familles d’agriculteurs, les auteurs n’ont pas mis en
évidence de lien entre un indicateur d’exposition au
mancozèbe et le risque de cancer de la thyroïde (Nordby et
coll., 2005
). En Norvège, à partir de
registres recensant 236 646 personnes faisant partie de
familles d’agriculteurs, les auteurs n’ont pas mis en
évidence de lien entre un indicateur d’exposition au
mancozèbe et le risque de cancer de la thyroïde (Nordby et
coll., 2005 ). Dans une étude cas-témoins
(près de 500 cas et 500 témoins) sur le cancer de la
thyroïde aux États-Unis, utilisant une matrice
emploi-exposition, aucune association n’était observée en
lien avec l’exposition professionnelle aux pesticides (Zeng
et coll., 2017
). Dans une étude cas-témoins
(près de 500 cas et 500 témoins) sur le cancer de la
thyroïde aux États-Unis, utilisant une matrice
emploi-exposition, aucune association n’était observée en
lien avec l’exposition professionnelle aux pesticides (Zeng
et coll., 2017 ). Enfin, aucun lien robuste
n’était retrouvé entre cancer (tout site, dont thyroïde) et
l’atrazine dans la cohorte AHS qui incluait
57 310 applicateurs de pesticides dont 68 % avaient rapporté
une application de l’atrazine (Freeman et coll.,
2011
). Enfin, aucun lien robuste
n’était retrouvé entre cancer (tout site, dont thyroïde) et
l’atrazine dans la cohorte AHS qui incluait
57 310 applicateurs de pesticides dont 68 % avaient rapporté
une application de l’atrazine (Freeman et coll.,
2011 ), excepté pour le cancer de la
thyroïde, pour les sujets dans les 2e
(RR ajusté = 4,55 [1,27-16,24]) et 4e (RR
ajusté = 4,84 [1,31-17,93]) quartiles d’exposition définie
comme le nombre de jours pondéré par l’intensité
d’exposition, mais le nombre de cas total exposés était
faible (n = 29). En Allemagne, dans une usine d’herbicides,
Nasterlack et coll. n’ont pas trouvé d’association avec le
risque de cancer de la thyroïde parmi 185 sujets d’une étude
de cohorte rétrospective, en comparant selon le poste de
production de benzothiadiazine et en couplant à un suivi
médical additionnel (Nasterlack et coll.,
2007
), excepté pour le cancer de la
thyroïde, pour les sujets dans les 2e
(RR ajusté = 4,55 [1,27-16,24]) et 4e (RR
ajusté = 4,84 [1,31-17,93]) quartiles d’exposition définie
comme le nombre de jours pondéré par l’intensité
d’exposition, mais le nombre de cas total exposés était
faible (n = 29). En Allemagne, dans une usine d’herbicides,
Nasterlack et coll. n’ont pas trouvé d’association avec le
risque de cancer de la thyroïde parmi 185 sujets d’une étude
de cohorte rétrospective, en comparant selon le poste de
production de benzothiadiazine et en couplant à un suivi
médical additionnel (Nasterlack et coll.,
2007 ).
).Exposition aux pesticides en population générale
Études en population : effectifs les plus importants
 ). Après prise en compte du
schéma d’échantillonnage et ajustement sur la concentration
sérique en lipides, l’IMC, l’ethnie, l’âge, le logarithme de
la concentration sérique de cotinine (un métabolite de la
nicotine utilisé comme mesure d’exposition au tabagisme), le
statut ménopausique chez les femmes, et la prise de
médicament (furosémide, VIH, bétabloquants,
normo-glycémiants et autres médicaments), les auteurs ont
rapporté une association entre le logarithme népérien de
p,p’-DDE sérique, et l’augmentation de T4 chez les femmes de
moins de 60 ans (β = 0,33 ; IC 95 % [0,04-0,62], n = 219),
et une diminution de T4 et augmentation de TSH chez les
femmes de plus de 60 ans (respectivement, β = - 0,47
(IC 95 % [- 0,74 ; - 0,20], n = 131 et 0,23 ; IC 95 %
[0,04-0,42], n = 126). Les résultats n’étaient cependant pas
retrouvés dans les deux cycles d’échantillonnage (1999-2000
ou 2001-2002). Chez les hommes, les auteurs ne montraient
pas d’association statistiquement significative. Il est à
noter que dans une population de plus de 1 000 adultes
thaïlandais, aucune association n’était retrouvée entre les
taux sériques de p,p’-DDT ou de p,p’-DDE et les niveaux de
TSH ou de T4 (Teeyapant et coll.,
2014
). Après prise en compte du
schéma d’échantillonnage et ajustement sur la concentration
sérique en lipides, l’IMC, l’ethnie, l’âge, le logarithme de
la concentration sérique de cotinine (un métabolite de la
nicotine utilisé comme mesure d’exposition au tabagisme), le
statut ménopausique chez les femmes, et la prise de
médicament (furosémide, VIH, bétabloquants,
normo-glycémiants et autres médicaments), les auteurs ont
rapporté une association entre le logarithme népérien de
p,p’-DDE sérique, et l’augmentation de T4 chez les femmes de
moins de 60 ans (β = 0,33 ; IC 95 % [0,04-0,62], n = 219),
et une diminution de T4 et augmentation de TSH chez les
femmes de plus de 60 ans (respectivement, β = - 0,47
(IC 95 % [- 0,74 ; - 0,20], n = 131 et 0,23 ; IC 95 %
[0,04-0,42], n = 126). Les résultats n’étaient cependant pas
retrouvés dans les deux cycles d’échantillonnage (1999-2000
ou 2001-2002). Chez les hommes, les auteurs ne montraient
pas d’association statistiquement significative. Il est à
noter que dans une population de plus de 1 000 adultes
thaïlandais, aucune association n’était retrouvée entre les
taux sériques de p,p’-DDT ou de p,p’-DDE et les niveaux de
TSH ou de T4 (Teeyapant et coll.,
2014 ).
). ). Dans cette étude sur plus de
3 000 sujets de plus de 12 ans, les auteurs ont mis en
évidence chez les hommes de moins de 40 ans une relation
entre un interquartile de la mesure du biomarqueur et une
augmentation des T4 en µg/dl (β = 3,00 ; IC 95 % [- 0,81 ;
6,82] chez les 18-40 ans, n = 506) et une diminution de TSH
(β = - 10,7 ; IC 95 % [- 18,7 ; - 2,05] aux mêmes âges),
après ajustement sur la créatinine urinaire, la cotinine
sérique, l’IMC, l’âge, l’ethnie et le revenu. Chez les
femmes, on observait une augmentation de TSH avec
l’exposition à tous les âges, mais plus fortement chez les
plus âgées (β = 21,5 ; IC 95 % [3,37 ; 42,8], n = 218). Les
résultats suggéraient donc des modifications hormonales en
fonction de l’exposition, mais ne semblaient pas homogènes
selon l’âge et le sexe.
). Dans cette étude sur plus de
3 000 sujets de plus de 12 ans, les auteurs ont mis en
évidence chez les hommes de moins de 40 ans une relation
entre un interquartile de la mesure du biomarqueur et une
augmentation des T4 en µg/dl (β = 3,00 ; IC 95 % [- 0,81 ;
6,82] chez les 18-40 ans, n = 506) et une diminution de TSH
(β = - 10,7 ; IC 95 % [- 18,7 ; - 2,05] aux mêmes âges),
après ajustement sur la créatinine urinaire, la cotinine
sérique, l’IMC, l’âge, l’ethnie et le revenu. Chez les
femmes, on observait une augmentation de TSH avec
l’exposition à tous les âges, mais plus fortement chez les
plus âgées (β = 21,5 ; IC 95 % [3,37 ; 42,8], n = 218). Les
résultats suggéraient donc des modifications hormonales en
fonction de l’exposition, mais ne semblaient pas homogènes
selon l’âge et le sexe. ). Cette association était surtout
constatée chez les hommes.
). Cette association était surtout
constatée chez les hommes.Autres études chez des populations d’effectifs plus réduits
 ). Dans une petite population de
sportifs (n = 66), le hexachlorobenzène (HCB) était
également associé négativement (mais non significativement)
avec la concentration en T4 (Bloom et coll.,
2003
). Dans une petite population de
sportifs (n = 66), le hexachlorobenzène (HCB) était
également associé négativement (mais non significativement)
avec la concentration en T4 (Bloom et coll.,
2003 ). Chez 16 obèses ayant perdu du
poids, les augmentations de concentration en DDT et HCB
observées étaient associées négativement au niveau de T3
(Pelletier et coll., 2002
). Chez 16 obèses ayant perdu du
poids, les augmentations de concentration en DDT et HCB
observées étaient associées négativement au niveau de T3
(Pelletier et coll., 2002 ), cela était également observé
pour plusieurs PCB. Dans une étude transversale slovaque
chez 454 adultes, la somme d’organochlorés (PCB, DDE et HCB)
était associée sans ajustement à une diminution de TSH
(Langer et coll., 2006
), cela était également observé
pour plusieurs PCB. Dans une étude transversale slovaque
chez 454 adultes, la somme d’organochlorés (PCB, DDE et HCB)
était associée sans ajustement à une diminution de TSH
(Langer et coll., 2006 ).
). ), ainsi qu’une association
négative entre HCB et T3 totale plus forte après prise en
compte du niveau de p,p’-DDE. Dans leur population de plus
de 300 hommes recrutés dans un centre d’infertilité (n = 322
ici), Meeker et coll. ont également exploré le lien entre
les concentrations circulantes en hormones thyroïdiennes et
l’exposition à des insecticides non persistants : le TCPγ
(pour rappel, un métabolite du chlorpyrifos et du
chlorpyrifos-méthyl), et le 1-naphthol (un métabolite du
carbaryl et du naphtalène). Après ajustement sur l’âge,
l’IMC, le tabagisme et la saison, ils ont retrouvé une
association positive entre le TCPγ et la TSH et une relation
négative avec la T4 libre (Meeker et coll.,
2006
), ainsi qu’une association
négative entre HCB et T3 totale plus forte après prise en
compte du niveau de p,p’-DDE. Dans leur population de plus
de 300 hommes recrutés dans un centre d’infertilité (n = 322
ici), Meeker et coll. ont également exploré le lien entre
les concentrations circulantes en hormones thyroïdiennes et
l’exposition à des insecticides non persistants : le TCPγ
(pour rappel, un métabolite du chlorpyrifos et du
chlorpyrifos-méthyl), et le 1-naphthol (un métabolite du
carbaryl et du naphtalène). Après ajustement sur l’âge,
l’IMC, le tabagisme et la saison, ils ont retrouvé une
association positive entre le TCPγ et la TSH et une relation
négative avec la T4 libre (Meeker et coll.,
2006 ). Dans un sous-groupe de cette
même population (n = 161), les auteurs ont également montré
une diminution de la T3 avec une augmentation des
concentrations urinaires de
cis-DCCA2
, métabolite de pyréthrinoïdes (Meeker et
coll., 2009
). Dans un sous-groupe de cette
même population (n = 161), les auteurs ont également montré
une diminution de la T3 avec une augmentation des
concentrations urinaires de
cis-DCCA2
, métabolite de pyréthrinoïdes (Meeker et
coll., 2009 ).
). ).
). ) a rapporté une association
négative en lien avec le DDT et une association positive
pour le chlordane chez les sujets les plus jeunes
(métabolites du chlordane, OR pour 10 ng/g de
lipides = 1,78 ; IC 95 % [1,09-2,93]).
) a rapporté une association
négative en lien avec le DDT et une association positive
pour le chlordane chez les sujets les plus jeunes
(métabolites du chlordane, OR pour 10 ng/g de
lipides = 1,78 ; IC 95 % [1,09-2,93]).Études chez les femmes enceintes et les nouveau-nés
 ). Les concentrations de six
métabolites urinaires de DAP ont été mesurées à 3 reprises
pendant la grossesse (< 18, 18-25, et > 25 semaines de
gestation) et étaient 2 à 3 fois plus importantes que dans
la plupart des autres cohortes de naissance au Canada, aux
États-Unis, et en Europe. La TSH et la T4 libre ont été
mesurées dans le sang maternel et de cordon. La T4 totale et
les anticorps TPO ont également été mesurés chez la mère.
Aucune information n’était disponible sur le moment du
recueil urinaire (premières urines ou échantillons
aléatoires recueillis entre 8 h et 20 h), alors que les
concentrations de substances chimiques, le volume d’urine,
et le taux d’excrétion varient en fonction notamment de la
prise de boissons, du moment de la journée (Boeniger et
coll., 1993
). Les concentrations de six
métabolites urinaires de DAP ont été mesurées à 3 reprises
pendant la grossesse (< 18, 18-25, et > 25 semaines de
gestation) et étaient 2 à 3 fois plus importantes que dans
la plupart des autres cohortes de naissance au Canada, aux
États-Unis, et en Europe. La TSH et la T4 libre ont été
mesurées dans le sang maternel et de cordon. La T4 totale et
les anticorps TPO ont également été mesurés chez la mère.
Aucune information n’était disponible sur le moment du
recueil urinaire (premières urines ou échantillons
aléatoires recueillis entre 8 h et 20 h), alors que les
concentrations de substances chimiques, le volume d’urine,
et le taux d’excrétion varient en fonction notamment de la
prise de boissons, du moment de la journée (Boeniger et
coll., 1993 ; Cornelis et coll.,
1996
; Cornelis et coll.,
1996 ; Barr et coll.,
2005
; Barr et coll.,
2005 ). Si, comme le disent les auteurs,
cela n’est pas susceptible d’entraîner un biais de
confusion, puisque les T4 libres n’ont pas de rythme
circadien et la TSH varie surtout entre le jour et la nuit
(Ehrenkranz et coll., 2015
). Si, comme le disent les auteurs,
cela n’est pas susceptible d’entraîner un biais de
confusion, puisque les T4 libres n’ont pas de rythme
circadien et la TSH varie surtout entre le jour et la nuit
(Ehrenkranz et coll., 2015 ), cela peut en revanche entraîner
un biais de classement non différentiel susceptible de
réduire les associations vers une absence d’association, et
cela n’est pas commenté. À cela s’ajoute que les mesures
urinaires de polluants peu persistants ne reflètent pas
forcément de manière optimale l’exposition, les coefficients
de corrélation intra-classe étant modestes. L’utilisation
d’un nombre plus important d’échantillons par femme pourrait
permettre de pallier cette limite. Enfin, les mêmes auteurs
ont montré précédemment que l’exposition à des pesticides
organophosphorés pendant la grossesse survient probablement
par voie alimentaire, avec l’ingestion de fruits
essentiellement (van den Dries et coll.,
2018
), cela peut en revanche entraîner
un biais de classement non différentiel susceptible de
réduire les associations vers une absence d’association, et
cela n’est pas commenté. À cela s’ajoute que les mesures
urinaires de polluants peu persistants ne reflètent pas
forcément de manière optimale l’exposition, les coefficients
de corrélation intra-classe étant modestes. L’utilisation
d’un nombre plus important d’échantillons par femme pourrait
permettre de pallier cette limite. Enfin, les mêmes auteurs
ont montré précédemment que l’exposition à des pesticides
organophosphorés pendant la grossesse survient probablement
par voie alimentaire, avec l’ingestion de fruits
essentiellement (van den Dries et coll.,
2018 ). Un repas incluant beaucoup de
fruits et légumes, les noisettes et poisson n’est donc pas
seulement une source d’éléments sains comme le sélénium,
l’iode et le fer, mais peut aussi être une source de
pesticides organophosphorés. Ces micronutriments sont
importants pour la fonction thyroïdienne et pourraient
contrecarrer les effets de l’exposition aux pesticides
organophosphorés et atténuer des associations avec ces
substances dans des études épidémiologiques. Cependant, dans
l’étude ci-dessus (Mulder et coll.,
2019
). Un repas incluant beaucoup de
fruits et légumes, les noisettes et poisson n’est donc pas
seulement une source d’éléments sains comme le sélénium,
l’iode et le fer, mais peut aussi être une source de
pesticides organophosphorés. Ces micronutriments sont
importants pour la fonction thyroïdienne et pourraient
contrecarrer les effets de l’exposition aux pesticides
organophosphorés et atténuer des associations avec ces
substances dans des études épidémiologiques. Cependant, dans
l’étude ci-dessus (Mulder et coll.,
2019 ), les résultats n’étaient pas
modifiés après ajustement sur la consommation de fruits
comme proxy d’un repas sain.
), les résultats n’étaient pas
modifiés après ajustement sur la consommation de fruits
comme proxy d’un repas sain. ), celles qui avaient des
concentrations sériques de p,p’-DDE plus élevées étaient
plus souvent celles qui avaient des niveaux élevés de TSH
au-dessus de 2,5 mIU/l (OR = 2,53 ; IC 95 % [1,36-4,73]
p = 0,004), et des niveaux plus faibles de T4 libre
(β = - 0,03 ; IC 95 % [- 0,05-0,00] p = 0,05) après
ajustement sur l’âge maternel et les semaines de gestation
au moment du prélèvement, les lipides totaux et d’autres
variables si elles modifiaient la relation de plus de 10 %
(tabagisme et consommation de caféine pour la TSH et pays de
naissance, statut professionnel, cohabitation, consommation
de caféine pour la T4 libre). Chez 334 femmes enceintes dans
la cohorte prospective CHAMACOS (Center for the Health
Assessment of Mothers and Children of Salinas) les
concentrations de HCB (mais pas de DDT ou de DDE) étaient
associées négativement avec les mesures de T4 totale
(β = - 0,51 ; IC 95 % [- 0,97 ; - 0,04]) et de T4 libre
(β = - 0,08 ; IC 95 % [- 0,15 ; - 0,01]) après prise en
compte de l’âge et de l’IMC maternel préconceptionnel
(Chevrier et coll., 2008
), celles qui avaient des
concentrations sériques de p,p’-DDE plus élevées étaient
plus souvent celles qui avaient des niveaux élevés de TSH
au-dessus de 2,5 mIU/l (OR = 2,53 ; IC 95 % [1,36-4,73]
p = 0,004), et des niveaux plus faibles de T4 libre
(β = - 0,03 ; IC 95 % [- 0,05-0,00] p = 0,05) après
ajustement sur l’âge maternel et les semaines de gestation
au moment du prélèvement, les lipides totaux et d’autres
variables si elles modifiaient la relation de plus de 10 %
(tabagisme et consommation de caféine pour la TSH et pays de
naissance, statut professionnel, cohabitation, consommation
de caféine pour la T4 libre). Chez 334 femmes enceintes dans
la cohorte prospective CHAMACOS (Center for the Health
Assessment of Mothers and Children of Salinas) les
concentrations de HCB (mais pas de DDT ou de DDE) étaient
associées négativement avec les mesures de T4 totale
(β = - 0,51 ; IC 95 % [- 0,97 ; - 0,04]) et de T4 libre
(β = - 0,08 ; IC 95 % [- 0,15 ; - 0,01]) après prise en
compte de l’âge et de l’IMC maternel préconceptionnel
(Chevrier et coll., 2008 ). Une relation négative entre
trois pesticides organochlorés (p,p’-DDE,
cis-nonachlore, et HCB) et T3 dans le sang maternel a
également été retrouvée chez 150 femmes enceintes en bonne
santé au Québec (Takser et coll.,
2005
). Une relation négative entre
trois pesticides organochlorés (p,p’-DDE,
cis-nonachlore, et HCB) et T3 dans le sang maternel a
également été retrouvée chez 150 femmes enceintes en bonne
santé au Québec (Takser et coll.,
2005 ). Aucune association n’a été
retrouvée avec les hormones mesurées dans le sang de cordon.
En revanche, deux autres études retrouvaient des
associations entre l’exposition in utero et les
paramètres thyroïdiens mesurés. Chez 115 nouveau-nés chinois
(Luo et coll., 2017
). Aucune association n’a été
retrouvée avec les hormones mesurées dans le sang de cordon.
En revanche, deux autres études retrouvaient des
associations entre l’exposition in utero et les
paramètres thyroïdiens mesurés. Chez 115 nouveau-nés chinois
(Luo et coll., 2017 ), certains pesticides
organochlorés tendaient à être associés négativement avec
les T4 (HCH, DDE, méthoxychlore) et à une augmentation des
niveaux de TSH (aldrine, dieldrine, DDT) après ajustement
sur âge maternel, niveau d’éducation, revenu du foyer,
parité, et sexe du nouveau-né. L’association la plus nette
étant la relation entre TSH et aldrine. Dans une population
d’un peu moins de 100 nouveau-nés coréens (effectifs
variables selon les associations), les auteurs rapportaient
une association négative entre la T4 totale et l’HCB, une
tendance négative entre T3 et p,p’-DDE et une relation
positive entre TSH et p,p’-DDE (dans le sang 2 jours après
la naissance) et la somme des chlordanes, dans le sang de
cordon (Kim et coll., 2015
), certains pesticides
organochlorés tendaient à être associés négativement avec
les T4 (HCH, DDE, méthoxychlore) et à une augmentation des
niveaux de TSH (aldrine, dieldrine, DDT) après ajustement
sur âge maternel, niveau d’éducation, revenu du foyer,
parité, et sexe du nouveau-né. L’association la plus nette
étant la relation entre TSH et aldrine. Dans une population
d’un peu moins de 100 nouveau-nés coréens (effectifs
variables selon les associations), les auteurs rapportaient
une association négative entre la T4 totale et l’HCB, une
tendance négative entre T3 et p,p’-DDE et une relation
positive entre TSH et p,p’-DDE (dans le sang 2 jours après
la naissance) et la somme des chlordanes, dans le sang de
cordon (Kim et coll., 2015 ).
). ). L’exposition aux
pyréthrinoïdes (par le métabolite 3-PBA) a été mesurée au
1er trimestre de grossesse dans les urines
d’un échantillon de femmes enceintes japonaises (n = 231) ;
aucune association n’était retrouvée avec les concentrations
de TSH et T4 chez les mères (Zhang et coll.,
2013a
). L’exposition aux
pyréthrinoïdes (par le métabolite 3-PBA) a été mesurée au
1er trimestre de grossesse dans les urines
d’un échantillon de femmes enceintes japonaises (n = 231) ;
aucune association n’était retrouvée avec les concentrations
de TSH et T4 chez les mères (Zhang et coll.,
2013a ) comme chez les nouveau-nés
(Zhang et coll., 2014a
) comme chez les nouveau-nés
(Zhang et coll., 2014a ).
). ). Dans une autre étude chinoise,
portant sur 374 femmes enceintes habitant au Shandong, le
3-PBA (un métabolite des pyréthrinoïdes) a été détecté dans
la majorité des échantillons d’urines testés (90,4 %) à une
concentration médiane de 1,14 mg/g de créatinine (Hu et
coll., 2019
). Dans une autre étude chinoise,
portant sur 374 femmes enceintes habitant au Shandong, le
3-PBA (un métabolite des pyréthrinoïdes) a été détecté dans
la majorité des échantillons d’urines testés (90,4 %) à une
concentration médiane de 1,14 mg/g de créatinine (Hu et
coll., 2019 ). Une association négative entre
ce biomarqueur et les niveaux sériques de T3 libres a été
mise en évidence, avec une relation effet-dose, alors
qu’aucune association n’a été constatée avec les autres
hormones thyroïdiennes. Dans une étude coréenne portant sur
59 paires mères-nouveau-nés, les niveaux de fipronil sulfone
dans le sang de cordon à la naissance (qui représentent
l’exposition intra-utérine) étaient inversement associés au
niveaux de T3 totale et libre, y compris après ajustement
sur un grand nombre de facteurs de confusion potentiels (Kim
et coll., 2019
). Une association négative entre
ce biomarqueur et les niveaux sériques de T3 libres a été
mise en évidence, avec une relation effet-dose, alors
qu’aucune association n’a été constatée avec les autres
hormones thyroïdiennes. Dans une étude coréenne portant sur
59 paires mères-nouveau-nés, les niveaux de fipronil sulfone
dans le sang de cordon à la naissance (qui représentent
l’exposition intra-utérine) étaient inversement associés au
niveaux de T3 totale et libre, y compris après ajustement
sur un grand nombre de facteurs de confusion potentiels (Kim
et coll., 2019 ). Les niveaux de T4 totale et
libre et de TSH dans le sang de cordon des nouveau-nés
n’étaient pas corrélés avec le fipronil sulfone. Chez
220 nouveau-nés garçons espagnols (Freire et coll.,
2011
). Les niveaux de T4 totale et
libre et de TSH dans le sang de cordon des nouveau-nés
n’étaient pas corrélés avec le fipronil sulfone. Chez
220 nouveau-nés garçons espagnols (Freire et coll.,
2011 ), sur 17 pesticides organochlorés
mesurés dans le placenta, il y avait également une tendance
à une association négative entre HCB et TSH dans le sang de
cordon, et une association négative également avec
l’endosulfan, tandis que l’endrine et dans une moindre
mesure le p,p’-DDE étaient associés plutôt positivement à la
TSH. Dans le sang de cordon de 198 nouveau-nés belges, on
retrouvait des concentrations réduites de T3 et T4 libres en
fonction du niveau de substances organochlorés (dont HCB,
p,p’-DDE) chez la mère (Maervoet et coll.,
2007
), sur 17 pesticides organochlorés
mesurés dans le placenta, il y avait également une tendance
à une association négative entre HCB et TSH dans le sang de
cordon, et une association négative également avec
l’endosulfan, tandis que l’endrine et dans une moindre
mesure le p,p’-DDE étaient associés plutôt positivement à la
TSH. Dans le sang de cordon de 198 nouveau-nés belges, on
retrouvait des concentrations réduites de T3 et T4 libres en
fonction du niveau de substances organochlorés (dont HCB,
p,p’-DDE) chez la mère (Maervoet et coll.,
2007 ). Plusieurs pesticides
organochlorés (p,p’-DDT, p,p’-DDE, β-HCH et HCB) étaient
associés à une diminution des concentrations d’hormones
thyroïdiennes (T3) également chez des enfants de 4 ans
(n = 259) en Espagne (Alvarez-Pedrerol et coll.,
2008
). Plusieurs pesticides
organochlorés (p,p’-DDT, p,p’-DDE, β-HCH et HCB) étaient
associés à une diminution des concentrations d’hormones
thyroïdiennes (T3) également chez des enfants de 4 ans
(n = 259) en Espagne (Alvarez-Pedrerol et coll.,
2008 ). En revanche, l’association était
retrouvée positive avec de nombreux organochlorés (y compris
β-HCH, HCB, p,p’-DDE, chlordane, dieldrine) chez des enfants
de 0-15 ans (n = 193) au Brésil (Freire et coll.,
2012
). En revanche, l’association était
retrouvée positive avec de nombreux organochlorés (y compris
β-HCH, HCB, p,p’-DDE, chlordane, dieldrine) chez des enfants
de 0-15 ans (n = 193) au Brésil (Freire et coll.,
2012 ), selon les auteurs les
expositions élevées pourraient expliquer ces résultats en
contradiction avec la littérature. Les niveaux de T4 libres
étaient associés positivement également avec p,p’-DDD,
endosulfan I, et dieldrine. Dans une petite étude en
Thaïlande de 39 couples mères-enfants, le niveau de T4 dans
le sang de cordon était associé négativement au DDT et à ses
métabolites p,p’-DDE, p,p’-DDT et o,p’-DDE (Asawasinsopon et
coll., 2006
), selon les auteurs les
expositions élevées pourraient expliquer ces résultats en
contradiction avec la littérature. Les niveaux de T4 libres
étaient associés positivement également avec p,p’-DDD,
endosulfan I, et dieldrine. Dans une petite étude en
Thaïlande de 39 couples mères-enfants, le niveau de T4 dans
le sang de cordon était associé négativement au DDT et à ses
métabolites p,p’-DDE, p,p’-DDT et o,p’-DDE (Asawasinsopon et
coll., 2006 ). Et toujours chez des couples
mères-enfants, à nouveau dans une petite population de
34 cas d’hypothyroïdie congénitale et 102 témoins, au Japon,
les pesticides organochlorés contenus dans le lait (DDT,
HCH, chlordane, HCB et leurs métabolites) ont été mesurés
comme marqueurs d’exposition prénatale (Nagayama et coll.,
2007
). Et toujours chez des couples
mères-enfants, à nouveau dans une petite population de
34 cas d’hypothyroïdie congénitale et 102 témoins, au Japon,
les pesticides organochlorés contenus dans le lait (DDT,
HCH, chlordane, HCB et leurs métabolites) ont été mesurés
comme marqueurs d’exposition prénatale (Nagayama et coll.,
2007 ). Des associations positives en
lien avec le risque de crétinisme étaient montrées avec le
DDT et l’HCB, après ajustement sur la parité et l’âge. Chez
111 jeunes enfants en Guadeloupe, le chlordécone, mesuré
dans le sang de cordon, était associé à une augmentation de
TSH à 3 mois uniquement chez les garçons et sans
modification de la T3 libre ou de la T4 libre. Lorsque le
chlordécone était mesuré dans le lait maternel, une
association positive avec la TSH à 3 mois a été observée
uniquement chez les filles et accompagnée d’une diminution
de T4 libre. Dans tous les cas, les concentrations
circulantes en hormones thyroïdiennes se trouvaient dans le
rang des valeurs attendues à l’âge de 3 mois. De plus, ces
variations hormonales n’expliquaient pas les moins bons
scores estimant la motricité fine à 18 mois d’âge en lien
avec l’exposition prénatale au chlordécone (Cordier et
coll., 2015
). Des associations positives en
lien avec le risque de crétinisme étaient montrées avec le
DDT et l’HCB, après ajustement sur la parité et l’âge. Chez
111 jeunes enfants en Guadeloupe, le chlordécone, mesuré
dans le sang de cordon, était associé à une augmentation de
TSH à 3 mois uniquement chez les garçons et sans
modification de la T3 libre ou de la T4 libre. Lorsque le
chlordécone était mesuré dans le lait maternel, une
association positive avec la TSH à 3 mois a été observée
uniquement chez les filles et accompagnée d’une diminution
de T4 libre. Dans tous les cas, les concentrations
circulantes en hormones thyroïdiennes se trouvaient dans le
rang des valeurs attendues à l’âge de 3 mois. De plus, ces
variations hormonales n’expliquaient pas les moins bons
scores estimant la motricité fine à 18 mois d’âge en lien
avec l’exposition prénatale au chlordécone (Cordier et
coll., 2015 ).
). ). Tous les métabolites de
pyréthrinoïdes étaient positivement associés à la TSH ; le
trans-DCCA et le 3-PBA étaient les plus fortement
associés avec un changement de 12,3 % (IC 95 % [3,0-22,3])
et 14,0 % (IC 95 % [0,50-30,2]) pour chaque augmentation
par 10 des concentrations en biomarqueur. Ces associations
étaient plus élevées chez les enfants de foyers en dessous
du seuil de pauvreté. Les DDT et DDE étaient associés à des
niveaux plus faibles de T4 totale seulement chez les garçons
(β = - 0,27 µg/dl pour une augmentation par 10 de
l’exposition ; IC 95 % [- 0,47 ; - 0,04]).
). Tous les métabolites de
pyréthrinoïdes étaient positivement associés à la TSH ; le
trans-DCCA et le 3-PBA étaient les plus fortement
associés avec un changement de 12,3 % (IC 95 % [3,0-22,3])
et 14,0 % (IC 95 % [0,50-30,2]) pour chaque augmentation
par 10 des concentrations en biomarqueur. Ces associations
étaient plus élevées chez les enfants de foyers en dessous
du seuil de pauvreté. Les DDT et DDE étaient associés à des
niveaux plus faibles de T4 totale seulement chez les garçons
(β = - 0,27 µg/dl pour une augmentation par 10 de
l’exposition ; IC 95 % [- 0,47 ; - 0,04]).Exposition aux pesticides des populations riveraines des zones agricoles ou industrielles
Pathologies de la thyroïde non cancéreuses
 ). Au total, 80 132 individus ont
été diagnostiqués avec des désordres thyroïdiens divers
(goitre, hypothyroïdie, thyrotoxicose et thyroïdite). Les
auteurs ont trouvé une augmentation de 49 % du risque
d’hypothyroïdie dans les zones où les pesticides étaient
davantage utilisés après ajustement sur l’âge et le sexe.
Cette étude a mis en évidence une augmentation modeste du
risque de goitre (11 %) chez les sujets vivant dans les
régions avec une utilisation importante de pesticides. Une
augmentation de 20 % du risque de thyroïdite et de 41 % du
risque de thyrotoxicose a également été trouvée. La quantité
totale de pesticides utilisés et la surface totale des
serres étaient supérieures dans la région avec les
utilisations plus importantes de pesticides. Donc, en dehors
des applicateurs et des agriculteurs, la population vivant
proche des régions d’agriculture intensive est considérée
comme ayant des expositions plus élevées de pesticides que
d’autres populations. Cependant, cette étude pratiquement
écologique dans son approche ne permet pas de tirer de
conclusion forte.
). Au total, 80 132 individus ont
été diagnostiqués avec des désordres thyroïdiens divers
(goitre, hypothyroïdie, thyrotoxicose et thyroïdite). Les
auteurs ont trouvé une augmentation de 49 % du risque
d’hypothyroïdie dans les zones où les pesticides étaient
davantage utilisés après ajustement sur l’âge et le sexe.
Cette étude a mis en évidence une augmentation modeste du
risque de goitre (11 %) chez les sujets vivant dans les
régions avec une utilisation importante de pesticides. Une
augmentation de 20 % du risque de thyroïdite et de 41 % du
risque de thyrotoxicose a également été trouvée. La quantité
totale de pesticides utilisés et la surface totale des
serres étaient supérieures dans la région avec les
utilisations plus importantes de pesticides. Donc, en dehors
des applicateurs et des agriculteurs, la population vivant
proche des régions d’agriculture intensive est considérée
comme ayant des expositions plus élevées de pesticides que
d’autres populations. Cependant, cette étude pratiquement
écologique dans son approche ne permet pas de tirer de
conclusion forte. ). Une diminution des T4 libres
était observée avec le β-HCH et le DDT chez les hommes et
une augmentation des T4 libres avec le HCB, l’heptachlore et
le DDT chez les femmes. Les niveaux de TSH étaient associés
positivement à ceux de β-HCH chez les hommes.
). Une diminution des T4 libres
était observée avec le β-HCH et le DDT chez les hommes et
une augmentation des T4 libres avec le HCB, l’heptachlore et
le DDT chez les femmes. Les niveaux de TSH étaient associés
positivement à ceux de β-HCH chez les hommes. ).
). ). La même équipe a montré
ensuite une augmentation des anticorps anti-TPO, uniquement
chez les jeunes qui avaient été allaités (n = 47) en
relation avec une exposition avec DDT (évalués par la mesure
du DDE), HCB et mirex (Schell et coll.,
2009
). La même équipe a montré
ensuite une augmentation des anticorps anti-TPO, uniquement
chez les jeunes qui avaient été allaités (n = 47) en
relation avec une exposition avec DDT (évalués par la mesure
du DDE), HCB et mirex (Schell et coll.,
2009 ).
). ). Au total, 24 % des sujets
avaient des niveaux bas de thyroxine, et ces niveaux étaient
associés à des faibles niveaux de résidus de pesticides
organochlorés.
). Au total, 24 % des sujets
avaient des niveaux bas de thyroxine, et ces niveaux étaient
associés à des faibles niveaux de résidus de pesticides
organochlorés.Études chez les femmes enceintes ou enfants
 ). Finalement, dans une étude
transversale portant sur 66 enfants indonésiens habitant
en zone agricole (Suhartono et coll.,
2018
). Finalement, dans une étude
transversale portant sur 66 enfants indonésiens habitant
en zone agricole (Suhartono et coll.,
2018 ), la TSH était plus élevée
et on constatait davantage d’hypothyroïdie (définie par
les auteurs comme un taux de TSH > 4,5 µIU/l) chez les
plus exposés (par exemple, ratio de la
prévalence = 2,4 ; IC 95 % [1,4-4,3] avec la détection
de pesticides organophosphorés).
), la TSH était plus élevée
et on constatait davantage d’hypothyroïdie (définie par
les auteurs comme un taux de TSH > 4,5 µIU/l) chez les
plus exposés (par exemple, ratio de la
prévalence = 2,4 ; IC 95 % [1,4-4,3] avec la détection
de pesticides organophosphorés).Pathologies cancéreuses
 ).
).Conclusion – données épidémiologiques
 , voir en
fin de ce chapitre) et 3 études cas-témoins dont une nichée dans une
cohorte.
, voir en
fin de ce chapitre) et 3 études cas-témoins dont une nichée dans une
cohorte. ).
). ).
). ),
étant donné l’utilisation généralisée des pesticides, les recherches
à venir doivent se focaliser sur les effets des substances actives
actuellement utilisées, et reposer sur des études de cohorte qui
évaluent l’exposition en combinant questionnaire et mesure de
biomarqueurs.
),
étant donné l’utilisation généralisée des pesticides, les recherches
à venir doivent se focaliser sur les effets des substances actives
actuellement utilisées, et reposer sur des études de cohorte qui
évaluent l’exposition en combinant questionnaire et mesure de
biomarqueurs.Thyroïde et pesticides : aspects mécanistiques
 ;
Miller et coll., 2009
;
Miller et coll., 2009 ; Tata,
2013
; Tata,
2013 ).
Ces processus sont pour la plupart aussi soumis à d’autres
contrôles, et les régulations croisées par exemple entre les axes
hypothalamo-hypophyso-gonadique
(Hypothalamic-Pituitary-Gonad ; HPG) et
hypothalamo-hypophyso-thyroïdien
(Hypothalamic-Pituitary-Thyroid ; HPT) compliquent encore
davantage ces questions (figure 17.4
).
Ces processus sont pour la plupart aussi soumis à d’autres
contrôles, et les régulations croisées par exemple entre les axes
hypothalamo-hypophyso-gonadique
(Hypothalamic-Pituitary-Gonad ; HPG) et
hypothalamo-hypophyso-thyroïdien
(Hypothalamic-Pituitary-Thyroid ; HPT) compliquent encore
davantage ces questions (figure 17.4 ). Les perturbateurs des hormones
thyroïdiennes (Thyroid Hormone Disrupting Compounds ; THDC)
sont susceptibles d’interagir avec un ou plusieurs acteurs impliqués
dans la fonction thyroïdienne mais aussi avec d’autres systèmes de
régulation, par exemple via la modulation d’expression des UGT par
les ligands du récepteur aryl-hydrocarbone (AhR).
). Les perturbateurs des hormones
thyroïdiennes (Thyroid Hormone Disrupting Compounds ; THDC)
sont susceptibles d’interagir avec un ou plusieurs acteurs impliqués
dans la fonction thyroïdienne mais aussi avec d’autres systèmes de
régulation, par exemple via la modulation d’expression des UGT par
les ligands du récepteur aryl-hydrocarbone (AhR).Quels essais et modèles pour tester les effets perturbateurs de la fonction thyroïdienne ?
 ).
Des tests ont été développés pour évaluer l’action des THDC soit
in vivo, majoritairement chez le rat, soit in
vitro. Parmi les nombreux essais réglementaires,
commercialisés ou développés dans les laboratoires de recherche, le
ciblage est majoritairement orienté vers la synthèse hormonale via
une interaction avec la TPO ou le NIS, et leurs interactions avec
les différents récepteurs, transporteurs ou enzymes périphériques de
conversion de l’axe HPT. Néanmoins, cette revue souligne
l’impossibilité de réaliser une batterie de tests qui permettent de
cribler tous les mécanismes de perturbation de l’axe HPT. Il ressort
également, de ce travail d’inventaire, qu’il n’existe pas à l’heure
actuelle de test réalisable en routine intégrant le criblage de
l’ensemble de ces mécanismes de toxicité.
).
Des tests ont été développés pour évaluer l’action des THDC soit
in vivo, majoritairement chez le rat, soit in
vitro. Parmi les nombreux essais réglementaires,
commercialisés ou développés dans les laboratoires de recherche, le
ciblage est majoritairement orienté vers la synthèse hormonale via
une interaction avec la TPO ou le NIS, et leurs interactions avec
les différents récepteurs, transporteurs ou enzymes périphériques de
conversion de l’axe HPT. Néanmoins, cette revue souligne
l’impossibilité de réaliser une batterie de tests qui permettent de
cribler tous les mécanismes de perturbation de l’axe HPT. Il ressort
également, de ce travail d’inventaire, qu’il n’existe pas à l’heure
actuelle de test réalisable en routine intégrant le criblage de
l’ensemble de ces mécanismes de toxicité. ;
Morvan-Dubois et coll., 2013
;
Morvan-Dubois et coll., 2013 ; Spirhanzlova et coll.,
2019
; Spirhanzlova et coll.,
2019 ).
).Données des études toxicologiques
 ).
Un rapport subséquent a identifié 57 substances actives ayant au
moins un effet sur le système thyroïdien, dont 53 composés affectant
les cellules folliculaires ou les niveaux sériques d’hormones (RIVM,
ICPS, ANSES, 2016
).
Un rapport subséquent a identifié 57 substances actives ayant au
moins un effet sur le système thyroïdien, dont 53 composés affectant
les cellules folliculaires ou les niveaux sériques d’hormones (RIVM,
ICPS, ANSES, 2016 ). Enfin, dans un rapport récent,
128 pesticides étaient identifiés comme pouvant être responsables
d’hypothyroïdie (insuffisance de production d’HT), la pathologie
thyroïdienne la plus fréquemment associée à l’exposition aux
pesticides (Efsa, 2019
). Enfin, dans un rapport récent,
128 pesticides étaient identifiés comme pouvant être responsables
d’hypothyroïdie (insuffisance de production d’HT), la pathologie
thyroïdienne la plus fréquemment associée à l’exposition aux
pesticides (Efsa, 2019 ).
).Organochlorés
In vivo
 ). Des rats exposés pendant 1, 6
ou 10 semaines à une faible dose de DDT (20 µg/l dans l’eau
de boisson) présentent des modifications cytologiques de
l’épithélium folliculaire de la thyroïde et un transport
vésiculaire altéré au niveau apical (Yaglova et Yaglov,
2017
). Des rats exposés pendant 1, 6
ou 10 semaines à une faible dose de DDT (20 µg/l dans l’eau
de boisson) présentent des modifications cytologiques de
l’épithélium folliculaire de la thyroïde et un transport
vésiculaire altéré au niveau apical (Yaglova et Yaglov,
2017 ). De plus, le fonctionnement de
l’appareil de Golgi et la sécrétion de HT est perturbé. Son
métabolite, le DDE, provoque des résultats en partie
similaires : il induit chez les rats mâles exposés pendant 5
ou 10 jours par voie intra-péritonéale une diminution de
T4L, T3L, TSH et de TTR ainsi qu’une augmentation des ARNm
des enzymes hépatiques UGT impliqués dans l’élimination des
HT et de ceux des TR au niveau hypothalamique
(potentiellement responsables de rétrocontrôles) (Liu et
coll., 2011
). De plus, le fonctionnement de
l’appareil de Golgi et la sécrétion de HT est perturbé. Son
métabolite, le DDE, provoque des résultats en partie
similaires : il induit chez les rats mâles exposés pendant 5
ou 10 jours par voie intra-péritonéale une diminution de
T4L, T3L, TSH et de TTR ainsi qu’une augmentation des ARNm
des enzymes hépatiques UGT impliqués dans l’élimination des
HT et de ceux des TR au niveau hypothalamique
(potentiellement responsables de rétrocontrôles) (Liu et
coll., 2011 ; Liu et coll.,
2014
; Liu et coll.,
2014 ). Une diminution de l’expression
de l’ARNm codant la désiodase D2 est constatée alors que
l’expression de D1 et D3 n’est pas altérée (Liu et coll.,
2014
). Une diminution de l’expression
de l’ARNm codant la désiodase D2 est constatée alors que
l’expression de D1 et D3 n’est pas altérée (Liu et coll.,
2014 ).
). ). De plus, le DDE induit
l’expression de CYP3A et PXR dans le foie. Enfin, le DDE est
positif dès 10-12 M et présente une relation
dose-réponse non monotone dans le test Xenopus Embryonic
Thyroid Assay (XETA ; voir addenda en fin de
chapitre) après 3 jours d’exposition, une concentration
retrouvée dans le liquide amniotique (Fini et coll.,
2017
). De plus, le DDE induit
l’expression de CYP3A et PXR dans le foie. Enfin, le DDE est
positif dès 10-12 M et présente une relation
dose-réponse non monotone dans le test Xenopus Embryonic
Thyroid Assay (XETA ; voir addenda en fin de
chapitre) après 3 jours d’exposition, une concentration
retrouvée dans le liquide amniotique (Fini et coll.,
2017 ).
). ). Le HCB peut aussi se lier aux
transporteurs sériques et entrer en compétition avec T4 (van
Raaij et coll., 1993
). Le HCB peut aussi se lier aux
transporteurs sériques et entrer en compétition avec T4 (van
Raaij et coll., 1993 ). Enfin, le HCB est positif dès
10su-9rn M dans l’essai XETA après 3 jours d’exposition
(Fini et coll., 2017
). Enfin, le HCB est positif dès
10su-9rn M dans l’essai XETA après 3 jours d’exposition
(Fini et coll., 2017 ).
). ). L’induction de Nis et Tg peut
être un mécanisme de compensation de la diminution de T4. La
diminution de T4 suite à une augmentation de T3 est
fréquemment observée chez les poissons exposés aux THDC avec
pour conséquence une augmentation d’expression de gènes pour
contrer la diminution de T4 (Wang et coll.,
2013
). L’induction de Nis et Tg peut
être un mécanisme de compensation de la diminution de T4. La
diminution de T4 suite à une augmentation de T3 est
fréquemment observée chez les poissons exposés aux THDC avec
pour conséquence une augmentation d’expression de gènes pour
contrer la diminution de T4 (Wang et coll.,
2013 ). Ainsi, le niveau de T4 joue un
rôle critique majeur suite à une augmentation de T3.
L’exposition au PCP pendant 4 jours à 0,1, 1, 10, 100, 500,
1 000 µg/l régule positivement l’expression des gènes de
l’axe de régulation HPT, tels que les TRα et β,
Nis, Dio1 et Dio2 illustrant la
perturbation de la régulation thyroïdienne (Guo et Zhou,
2013
). Ainsi, le niveau de T4 joue un
rôle critique majeur suite à une augmentation de T3.
L’exposition au PCP pendant 4 jours à 0,1, 1, 10, 100, 500,
1 000 µg/l régule positivement l’expression des gènes de
l’axe de régulation HPT, tels que les TRα et β,
Nis, Dio1 et Dio2 illustrant la
perturbation de la régulation thyroïdienne (Guo et Zhou,
2013 ; Cheng et coll.,
2015
; Cheng et coll.,
2015 ). L’exposition pendant 70 jours
de D. rerio au PCP induit une diminution d’expression
de tshβ et trβ dans le cerveau ainsi qu’une
augmentation d’expression hépatique de ugt1ab et une
diminution de dio1. Un dimorphisme sexuel est observé pour
les niveaux de dio2, sult1 et ttr (Yu et coll.,
2014
). L’exposition pendant 70 jours
de D. rerio au PCP induit une diminution d’expression
de tshβ et trβ dans le cerveau ainsi qu’une
augmentation d’expression hépatique de ugt1ab et une
diminution de dio1. Un dimorphisme sexuel est observé pour
les niveaux de dio2, sult1 et ttr (Yu et coll.,
2014 ). Enfin, cette exposition à
doses environnementales est associée à des perturbations
d’expression de gènes impliqués dans la régulation
thyroïdienne, une altération du taux des HT et des
malformations dans la descendance des mères exposées
correspondant à une perturbation du développement (Yu et
coll., 2014
). Enfin, cette exposition à
doses environnementales est associée à des perturbations
d’expression de gènes impliqués dans la régulation
thyroïdienne, une altération du taux des HT et des
malformations dans la descendance des mères exposées
correspondant à une perturbation du développement (Yu et
coll., 2014 ).
). ). Ce résultat illustre encore
une fois le fait que les métabolites ne doivent pas être
oubliés dans une recherche de toxicité.
). Ce résultat illustre encore
une fois le fait que les métabolites ne doivent pas être
oubliés dans une recherche de toxicité. ). Alors que le taux de T3 est
stable, à faible dose d’exposition (21 et 35 jours),
l’endosulfan induit une baisse du taux de T4 et rT3. Pour
étudier le mécanisme permettant le maintien du taux de T3,
l’activité des désiodases est déterminée dans différents
organes. L’activité hépatique de D1 est diminuée alors que
celle de D3 est augmentée. L’activité hépatique de D2 est
stable ainsi que celle de D1 augmentée au niveau rénal. La
stabilité du taux de T3 est probablement en rapport avec le
rôle majeur joué par la désiodase hépatique D2 et la
compensation par l’activité de D1 rénale. Ce résultat
illustre le fait que le simple dosage des HT pourrait ne pas
être suffisant pour évaluer une perturbation de l’axe HPT
(Coimbra et coll., 2005
). Alors que le taux de T3 est
stable, à faible dose d’exposition (21 et 35 jours),
l’endosulfan induit une baisse du taux de T4 et rT3. Pour
étudier le mécanisme permettant le maintien du taux de T3,
l’activité des désiodases est déterminée dans différents
organes. L’activité hépatique de D1 est diminuée alors que
celle de D3 est augmentée. L’activité hépatique de D2 est
stable ainsi que celle de D1 augmentée au niveau rénal. La
stabilité du taux de T3 est probablement en rapport avec le
rôle majeur joué par la désiodase hépatique D2 et la
compensation par l’activité de D1 rénale. Ce résultat
illustre le fait que le simple dosage des HT pourrait ne pas
être suffisant pour évaluer une perturbation de l’axe HPT
(Coimbra et coll., 2005 ).
). ). Le métolachlore dès 10 µg/l
chez les juvéniles induit l’expression de Trh, Dio2,
Thrα, et Thrβ chez les jeunes poissons et
chez les femelles adultes (100 µg/l) illustrant l’impact sur
la régulation de l’axe HPT et aussi un effet dimorphique
sexuel.
). Le métolachlore dès 10 µg/l
chez les juvéniles induit l’expression de Trh, Dio2,
Thrα, et Thrβ chez les jeunes poissons et
chez les femelles adultes (100 µg/l) illustrant l’impact sur
la régulation de l’axe HPT et aussi un effet dimorphique
sexuel. ). L’expression de trα est
induite chez les larves à faible dose (20 µg/l) alors que
celle de d1 est stable et celles de d2,
nis, et me (enzyme malique ; impliquée
dans le métabolisme des lipides et régulée par les HT) sont
diminuées. À plus forte dose, tous les gènes sont réprimés
indiquant que le développement peut être affecté en
condition environnementale. Chez les adultes, l’expression
des gènes étudiés est diminuée dans le cerveau des poissons
exposés et plus particulièrement chez les femelles. Ces
résultats suggèrent que l’acétochlore perturbe le
développement de SNC de façon plus marquée chez les
femelles.
). L’expression de trα est
induite chez les larves à faible dose (20 µg/l) alors que
celle de d1 est stable et celles de d2,
nis, et me (enzyme malique ; impliquée
dans le métabolisme des lipides et régulée par les HT) sont
diminuées. À plus forte dose, tous les gènes sont réprimés
indiquant que le développement peut être affecté en
condition environnementale. Chez les adultes, l’expression
des gènes étudiés est diminuée dans le cerveau des poissons
exposés et plus particulièrement chez les femelles. Ces
résultats suggèrent que l’acétochlore perturbe le
développement de SNC de façon plus marquée chez les
femelles.In vitro
 ). Le DDT exerce en outre dans
ces cellules CHO, une inhibition de la mobilisation du TSHR
(De Gregorio et coll., 2011
). Le DDT exerce en outre dans
ces cellules CHO, une inhibition de la mobilisation du TSHR
(De Gregorio et coll., 2011 ). Le DDT peut aussi intervenir
dans la formation de vésicules extracellulaires en excluant
le récepteur de la TSH des radeaux lipidiques empêchant son
activation et son internalisation. Ainsi la formation de
vésicules extracellulaires contenant le récepteur de la TSH
induite par le DDT pourrait être impliquée dans le
développement d’une hyperthyroïdie auto-immune dans la
maladie de Basedow (Rossi et coll.,
2018
). Le DDT peut aussi intervenir
dans la formation de vésicules extracellulaires en excluant
le récepteur de la TSH des radeaux lipidiques empêchant son
activation et son internalisation. Ainsi la formation de
vésicules extracellulaires contenant le récepteur de la TSH
induite par le DDT pourrait être impliquée dans le
développement d’une hyperthyroïdie auto-immune dans la
maladie de Basedow (Rossi et coll.,
2018 ).
). ). Ce résultat est en accord avec
la diminution d’activité transcriptionnelle de Dio1,
un gène dépendant de la régulation de T3 dans la lignée GH3
(cellules hypothalamiques de rat) (Guo et Zhou,
2013
). Ce résultat est en accord avec
la diminution d’activité transcriptionnelle de Dio1,
un gène dépendant de la régulation de T3 dans la lignée GH3
(cellules hypothalamiques de rat) (Guo et Zhou,
2013 ).
). ). TGF-β1 est un régulateur
négatif de la croissance des cellules épithéliales
thyroïdiennes. Les niveaux de p27 cytosolique et nucléaire
(un inhibiteur de CDK bloquant le cycle cellulaire) étaient
augmentés dès 5 µM de HCB. Le HCB (5 µM) induit une
diminution concomitante du taux de la protéine cycline D1
dans le noyau. De plus la signalisation du TGF-β1-Smad est
impliquée dans les altérations des taux de protéines p27 et
cycline D1 induites par HCB.
). TGF-β1 est un régulateur
négatif de la croissance des cellules épithéliales
thyroïdiennes. Les niveaux de p27 cytosolique et nucléaire
(un inhibiteur de CDK bloquant le cycle cellulaire) étaient
augmentés dès 5 µM de HCB. Le HCB (5 µM) induit une
diminution concomitante du taux de la protéine cycline D1
dans le noyau. De plus la signalisation du TGF-β1-Smad est
impliquée dans les altérations des taux de protéines p27 et
cycline D1 induites par HCB.Organophosphorés
In vivo
 ). Des larves de soles (S.
senegalensis) sont exposées du 4e jour
post-éclosion jusqu’à un mois au malathion à concentrations
retrouvées dans l’environnement (1,56, 3,12, et 6,25 µg/l)
(Ortiz-Delgado et coll.,
2019
). Des larves de soles (S.
senegalensis) sont exposées du 4e jour
post-éclosion jusqu’à un mois au malathion à concentrations
retrouvées dans l’environnement (1,56, 3,12, et 6,25 µg/l)
(Ortiz-Delgado et coll.,
2019 ). Il est observé des phénotypes
anormaux principalement en rapport avec une perturbation de
la métamorphose (migration des yeux, squelette, augmentation
taille des thyréocytes). La diminution de T3 et T4 sérique
est aussi observée liée dans ce cas à une hypo-activité de
la thyroïde due à une diminution de sécrétion de T4 mais
aussi une inhibition des désiodases. De plus une régulation
négative de l’expression de TRβ est constatée parallèlement
au déclin des HT sériques.
). Il est observé des phénotypes
anormaux principalement en rapport avec une perturbation de
la métamorphose (migration des yeux, squelette, augmentation
taille des thyréocytes). La diminution de T3 et T4 sérique
est aussi observée liée dans ce cas à une hypo-activité de
la thyroïde due à une diminution de sécrétion de T4 mais
aussi une inhibition des désiodases. De plus une régulation
négative de l’expression de TRβ est constatée parallèlement
au déclin des HT sériques. ). Comme dans le cas du malathion,
il est observé une diminution de T4 chez les souris
gestantes mais aussi chez la descendance 150 jours après la
naissance, avec un dimorphisme sexuel, marqué par une
apparente vulnérabilité des mâles ; au niveau
histomorphologique, il est observé des modifications chez
les mères avec une augmentation de la hauteur des cellules
folliculaires et, chez la progénie, une augmentation du
nombre de cellules folliculaires nécrotiques en relation
avec la dose d’exposition. Chez des rates exposées au CPF
entre les jours 17 et 20 de gestation, dans une fenêtre de
temps cruciale pour le processus de neuro-genèse à faible
dose (1 ou 5 mg/kg/j), les femelles de la descendance
(jeunes adultes et adultes) montrent une hyperactivité
locomotrice, une baisse de mémorisation et des fonctions
cognitives, plus marquées à faible dose (1 mg/kg/j) (Levin
et coll., 2002
). Comme dans le cas du malathion,
il est observé une diminution de T4 chez les souris
gestantes mais aussi chez la descendance 150 jours après la
naissance, avec un dimorphisme sexuel, marqué par une
apparente vulnérabilité des mâles ; au niveau
histomorphologique, il est observé des modifications chez
les mères avec une augmentation de la hauteur des cellules
folliculaires et, chez la progénie, une augmentation du
nombre de cellules folliculaires nécrotiques en relation
avec la dose d’exposition. Chez des rates exposées au CPF
entre les jours 17 et 20 de gestation, dans une fenêtre de
temps cruciale pour le processus de neuro-genèse à faible
dose (1 ou 5 mg/kg/j), les femelles de la descendance
(jeunes adultes et adultes) montrent une hyperactivité
locomotrice, une baisse de mémorisation et des fonctions
cognitives, plus marquées à faible dose (1 mg/kg/j) (Levin
et coll., 2002 ). Sur un troisième modèle (A.
triostegus, le chirurgien-bagnard), une exposition
des larves au CPF à dose correspondant à une pollution
environnementale, conduit là aussi, à une diminution du taux
de T3 et des perturbations de la métamorphose du poisson
vivant dans les récifs coralliens (Holzer et coll.,
2017
). Sur un troisième modèle (A.
triostegus, le chirurgien-bagnard), une exposition
des larves au CPF à dose correspondant à une pollution
environnementale, conduit là aussi, à une diminution du taux
de T3 et des perturbations de la métamorphose du poisson
vivant dans les récifs coralliens (Holzer et coll.,
2017 ).
). ).
). ; Zhang et coll.,
2014b
; Zhang et coll.,
2014b ; Zhang et coll.,
2018
; Zhang et coll.,
2018 ). Une réponse compensatoire à la
baisse des taux de T3 est illustrée par une augmentation de
la transcription du gène de la sous-unité β de la TSH. De
plus, le MCP induit une augmentation du taux plasmatique de
17β-œstradiol qui pourrait renforcer l’impact du pesticide
sur l’axe HPT en modulant l’expression des désiodases
hépatiques (Zhang et coll.,
2018
). Une réponse compensatoire à la
baisse des taux de T3 est illustrée par une augmentation de
la transcription du gène de la sous-unité β de la TSH. De
plus, le MCP induit une augmentation du taux plasmatique de
17β-œstradiol qui pourrait renforcer l’impact du pesticide
sur l’axe HPT en modulant l’expression des désiodases
hépatiques (Zhang et coll.,
2018 ).
).In vitro
 ). Le malathion diminue la
synthèse des HT et diminue l’expression des TR, ce qui
pourrait expliquer les résultats quantitatifs obtenus in
vivo (baisse des niveaux sériques de HT).
). Le malathion diminue la
synthèse des HT et diminue l’expression des TR, ce qui
pourrait expliquer les résultats quantitatifs obtenus in
vivo (baisse des niveaux sériques de HT). ). Parmi les gènes dérégulés, il
a été identifié trois gènes, dont l’expression était
diminuée, participant à différents complexes et réseaux de
régulation intervenant dans la prolifération et la survie
des thyréocytes : Egr1 (Early growth response
protein 1), Hmga1 (High-mobility group AT
hook 1) et Zfp36l2 (Zinc Finger
Protein 36, CH3 Type-Like 2).
). Parmi les gènes dérégulés, il
a été identifié trois gènes, dont l’expression était
diminuée, participant à différents complexes et réseaux de
régulation intervenant dans la prolifération et la survie
des thyréocytes : Egr1 (Early growth response
protein 1), Hmga1 (High-mobility group AT
hook 1) et Zfp36l2 (Zinc Finger
Protein 36, CH3 Type-Like 2). ) et des souris (Chatterjee et
coll., 2014
) et des souris (Chatterjee et
coll., 2014 ). Plus généralement, la totalité
des études in vitro et in vivo vont dans le
sens d’une diminution des HT liée à une exposition aux
organophosphorés (à des doses environnementales dans
certains cas). Sur le plan mécanistique, cette diminution
est liée dans certaines études, à une diminution de la
production de celles-ci.
). Plus généralement, la totalité
des études in vitro et in vivo vont dans le
sens d’une diminution des HT liée à une exposition aux
organophosphorés (à des doses environnementales dans
certains cas). Sur le plan mécanistique, cette diminution
est liée dans certaines études, à une diminution de la
production de celles-ci.Carbamates
In vivo
 ). Des effets ont aussi été
constatés chez des rates Wistar exposées par gavage à 50,
100 ou 150 mg/kg/j de mancozèbe (NOAEL = 5 à 10 mg/kg/j) du
7e jour de gestation (Gestational Day
7 ; GD7) au 16e jour post-naissance
(Post-Natal Day 16 ; PND16). Une neurotoxicité
est observée chez les femelles gestantes exposées à
150 mg/kg/j. Aux doses inférieures, le taux de T4 est
diminué dès GD15 alors qu’il n’est pas modifié chez les
nouveau-nés à PND16 (Axelstad et coll.,
2011
). Des effets ont aussi été
constatés chez des rates Wistar exposées par gavage à 50,
100 ou 150 mg/kg/j de mancozèbe (NOAEL = 5 à 10 mg/kg/j) du
7e jour de gestation (Gestational Day
7 ; GD7) au 16e jour post-naissance
(Post-Natal Day 16 ; PND16). Une neurotoxicité
est observée chez les femelles gestantes exposées à
150 mg/kg/j. Aux doses inférieures, le taux de T4 est
diminué dès GD15 alors qu’il n’est pas modifié chez les
nouveau-nés à PND16 (Axelstad et coll.,
2011 ).
). ). La perturbation de la synthèse
des HT par l’ETU, le mancozèbe, et d’autres composés
apparentés peut s’expliquer par une inhibition de l’activité
de la TPO (Doerge et Takazawa,
1990
). La perturbation de la synthèse
des HT par l’ETU, le mancozèbe, et d’autres composés
apparentés peut s’expliquer par une inhibition de l’activité
de la TPO (Doerge et Takazawa,
1990 ; Freyberger et Ahr,
2006
; Freyberger et Ahr,
2006 ), ce qui pourrait conduire à la
baisse de concentration de T4 observée à la fois chez les
rates et le bengali.
), ce qui pourrait conduire à la
baisse de concentration de T4 observée à la fois chez les
rates et le bengali. ). La courbure anormale de la
notocorde4
apparaît comme un marqueur de toxicité du
thirame suite à une exposition à des temps précoces de
développement potentiellement en relation avec la
dérégulation de Dio3 et TPO.
). La courbure anormale de la
notocorde4
apparaît comme un marqueur de toxicité du
thirame suite à une exposition à des temps précoces de
développement potentiellement en relation avec la
dérégulation de Dio3 et TPO.In vitro
 ). Il est observé l’inhibition
d’expression des transcrits Egr1, Hmga1 et
Zfp36l2 mais non spécifiques d’une atteinte de la
thyroïde car ils correspondent à des gènes impliqués dans
des réseaux cycle cellulaire/apoptose de la thyroïde mais
aussi du système hématopoïétique.
). Il est observé l’inhibition
d’expression des transcrits Egr1, Hmga1 et
Zfp36l2 mais non spécifiques d’une atteinte de la
thyroïde car ils correspondent à des gènes impliqués dans
des réseaux cycle cellulaire/apoptose de la thyroïde mais
aussi du système hématopoïétique. ).
).Pyréthrinoïdes
In vivo
 ). Il n’est pas trouvé de
différence du taux de T4 et T3 sérique mais une diminution
d’expression de TRα1 et TRβ1 placentaires dès 0,2 mg/kg. Une
des voies de régulation dépendant des TR pourrait concerner
l’expression du vascular endothelial growth factor
(VEGF), un régulateur clé de l’angiogenèse du placenta.
L’expression du VEGF est stimulée par T3 dans les
trophoblastes de souris (Silva et coll.,
2015a
). Il n’est pas trouvé de
différence du taux de T4 et T3 sérique mais une diminution
d’expression de TRα1 et TRβ1 placentaires dès 0,2 mg/kg. Une
des voies de régulation dépendant des TR pourrait concerner
l’expression du vascular endothelial growth factor
(VEGF), un régulateur clé de l’angiogenèse du placenta.
L’expression du VEGF est stimulée par T3 dans les
trophoblastes de souris (Silva et coll.,
2015a ) et par T4 dans le placenta de
rat (Silva et coll., 2015b
) et par T4 dans le placenta de
rat (Silva et coll., 2015b ). En accord avec cette
hypothèse, il est retrouvé une diminution d’expression de
Igf2 et Vegfα dans le placenta de souris
exposées. De plus, le fenvalérate réduit l’expression des
transporteurs de nutriments CD36, Snat1, et
Snat2. Ainsi, l’exposition de souris gestantes au
fenvalérate perturbe la signalisation dépendante des TR et
impacte le développement fœtal (Wang et coll.,
2017a
). En accord avec cette
hypothèse, il est retrouvé une diminution d’expression de
Igf2 et Vegfα dans le placenta de souris
exposées. De plus, le fenvalérate réduit l’expression des
transporteurs de nutriments CD36, Snat1, et
Snat2. Ainsi, l’exposition de souris gestantes au
fenvalérate perturbe la signalisation dépendante des TR et
impacte le développement fœtal (Wang et coll.,
2017a ).
). ). D’autres expériences, sur une
période plus courte, démontrent un effet du fenvalérate sur
les niveaux sériques des HT. Ainsi, des rats mâles Wistar
exposés pendant une semaine à la dose de 100 mg/kg/j (un
tiers de la DL50) de fenvalérate par voie
intrapéritonéale montrent une augmentation du taux de T3
sans diminution significative de TSH (Giray et coll.,
2010
). D’autres expériences, sur une
période plus courte, démontrent un effet du fenvalérate sur
les niveaux sériques des HT. Ainsi, des rats mâles Wistar
exposés pendant une semaine à la dose de 100 mg/kg/j (un
tiers de la DL50) de fenvalérate par voie
intrapéritonéale montrent une augmentation du taux de T3
sans diminution significative de TSH (Giray et coll.,
2010 ).
). ). Comme dans de nombreuses
expérimentations chez les rongeurs, les causes conduisant à
ces résultats contradictoires peuvent concerner le plan
expérimental, le sexe en raison d’un dimorphisme, l’agent
utilisé et sa pureté, l’espèce ou la souche, la voie et la
durée d’exposition, et surtout la dose utilisée. Des doses
toxiques peuvent induire des modifications des constantes
sériques non spécifiques et signent simplement un
dysfonctionnement global. Cependant, d’après les
expérimentations recherchant les causes de retard de
croissance intra-utérine, le fenvalérate est un candidat
potentiel d’une perturbation de l’axe HPT.
). Comme dans de nombreuses
expérimentations chez les rongeurs, les causes conduisant à
ces résultats contradictoires peuvent concerner le plan
expérimental, le sexe en raison d’un dimorphisme, l’agent
utilisé et sa pureté, l’espèce ou la souche, la voie et la
durée d’exposition, et surtout la dose utilisée. Des doses
toxiques peuvent induire des modifications des constantes
sériques non spécifiques et signent simplement un
dysfonctionnement global. Cependant, d’après les
expérimentations recherchant les causes de retard de
croissance intra-utérine, le fenvalérate est un candidat
potentiel d’une perturbation de l’axe HPT. ). Les doses de 2,5 et 10 nM
correspondent aux concentrations retrouvées dans
l’environnement mais la diminution d’expression de
TRα et TRβ pour les trois composés
correspond à des concentrations supérieures soit au-delà de
25 nM. Dans une autre étude, des embryons (2 hpf) de poisson
zèbre sont exposés à 1, 3 et 10 µg/l de perméthrine
(concentrations retrouvées dans l’environnement) jusqu’à
72 hpf (Tu et coll., 2016b
). Les doses de 2,5 et 10 nM
correspondent aux concentrations retrouvées dans
l’environnement mais la diminution d’expression de
TRα et TRβ pour les trois composés
correspond à des concentrations supérieures soit au-delà de
25 nM. Dans une autre étude, des embryons (2 hpf) de poisson
zèbre sont exposés à 1, 3 et 10 µg/l de perméthrine
(concentrations retrouvées dans l’environnement) jusqu’à
72 hpf (Tu et coll., 2016b ). En rapport avec l’absorption
du composé sur les parois de l’aquarium, les concentrations
réelles d’exposition étaient 0,47, 1,38 et 4,30 µg/l. La
perméthrine à la dose de 4,3 µg/l inhibe le développement
embryonnaire et induit une augmentation des taux de T4 et T3
sans baisse compensatrice de TSH (Tu et coll.,
2016b
). En rapport avec l’absorption
du composé sur les parois de l’aquarium, les concentrations
réelles d’exposition étaient 0,47, 1,38 et 4,30 µg/l. La
perméthrine à la dose de 4,3 µg/l inhibe le développement
embryonnaire et induit une augmentation des taux de T4 et T3
sans baisse compensatrice de TSH (Tu et coll.,
2016b ). La perméthrine à la plus forte
dose augmente l’expression des ARNm codant TRF, TSHβ,
Pax8, Dio1, Dio2 et TPO ainsi que TTR,
TRα et TRβ. La perturbation induite par la
perméthrine est probablement la conséquence de sa liaison à
la TTR qui déplace T3 et T4 de son transporteur.
). La perméthrine à la plus forte
dose augmente l’expression des ARNm codant TRF, TSHβ,
Pax8, Dio1, Dio2 et TPO ainsi que TTR,
TRα et TRβ. La perturbation induite par la
perméthrine est probablement la conséquence de sa liaison à
la TTR qui déplace T3 et T4 de son transporteur. ). Des embryons (2 hpf) de poisson
zèbre sont exposés à 1, 3, et 10 µg/l de bifenthrine ou
λ-cyhalothrine jusqu’à 72 hpf (Tu et coll.,
2016a
). Des embryons (2 hpf) de poisson
zèbre sont exposés à 1, 3, et 10 µg/l de bifenthrine ou
λ-cyhalothrine jusqu’à 72 hpf (Tu et coll.,
2016a ). La majorité des gènes étudiés
reliés à l’axe HPT incluent TRF, TSHβ, TTR, UGT1ab, Pax8,
Dio2 et TRα sont surexprimés suite à l’exposition à la
bifenthrine. La λ-cyhalothrine induit un réseau de gènes un
peu différent incluant TTR, Pax8, Dio2 et TRα avec une
diminution concomitante de Dio1. De plus la bifenthrine se
lie au TRα avec une affinité plus forte que la
λ-cyhalothrine (Tu et coll.,
2016a
). La majorité des gènes étudiés
reliés à l’axe HPT incluent TRF, TSHβ, TTR, UGT1ab, Pax8,
Dio2 et TRα sont surexprimés suite à l’exposition à la
bifenthrine. La λ-cyhalothrine induit un réseau de gènes un
peu différent incluant TTR, Pax8, Dio2 et TRα avec une
diminution concomitante de Dio1. De plus la bifenthrine se
lie au TRα avec une affinité plus forte que la
λ-cyhalothrine (Tu et coll.,
2016a ).
).In vitro
 ). Les profils sont néanmoins
différents : l’effet est observé à 10-8 M pour la
perméthrine, tétraméthrine et deltaméthrine et à
10-7 M pour la cyhalothrine et
étofenprox.
). Les profils sont néanmoins
différents : l’effet est observé à 10-8 M pour la
perméthrine, tétraméthrine et deltaméthrine et à
10-7 M pour la cyhalothrine et
étofenprox.Glyphosate et formulations à base de glyphosate
 ). L’analyse de l’expression génique a été conduite avec comme
résultats pour les groupes exposés : une diminution d’expression
de Dio2, Dio3 et des transporteurs membranaires
Slco1c1 (anciennement Oatp1c1) et
Slc16a2 (anciennement Mct8) au niveau de
l’hypothalamus (dès 5 mg/kg/j), une augmentation d’expression de
Dio2, Thrα1, Thrβ1 et
Slc16a2 et une absence de variation du taux de
Tshβ au niveau de l’hypophyse (5 mg/kg/j), une
augmentation d’expression de Thrα1,
Thrβ1 au niveau du foie (50 mg/kg/j) et au
niveau du myocarde une augmentation de Myh6 et diminution
de Dio2, Mb, Slc2a4. De plus, le profil
d’expression des gènes et les données de métabolomique sont
similaires aux données trouvées pour des rats hypothyroïdiens.
En résumé, l’exposition au Roundup à faible dose induit une
perturbation de l’axe HPT qui mériterait d’être précisée en
testant le glyphosate seul sachant que des données
épidémiologiques sur le Roundup indiquent potentiellement une
association avec une hypothyroïdie. D’autres modèles et
protocoles d’études expérimentales devraient être mis en place
pour confirmer ces observations.
). L’analyse de l’expression génique a été conduite avec comme
résultats pour les groupes exposés : une diminution d’expression
de Dio2, Dio3 et des transporteurs membranaires
Slco1c1 (anciennement Oatp1c1) et
Slc16a2 (anciennement Mct8) au niveau de
l’hypothalamus (dès 5 mg/kg/j), une augmentation d’expression de
Dio2, Thrα1, Thrβ1 et
Slc16a2 et une absence de variation du taux de
Tshβ au niveau de l’hypophyse (5 mg/kg/j), une
augmentation d’expression de Thrα1,
Thrβ1 au niveau du foie (50 mg/kg/j) et au
niveau du myocarde une augmentation de Myh6 et diminution
de Dio2, Mb, Slc2a4. De plus, le profil
d’expression des gènes et les données de métabolomique sont
similaires aux données trouvées pour des rats hypothyroïdiens.
En résumé, l’exposition au Roundup à faible dose induit une
perturbation de l’axe HPT qui mériterait d’être précisée en
testant le glyphosate seul sachant que des données
épidémiologiques sur le Roundup indiquent potentiellement une
association avec une hypothyroïdie. D’autres modèles et
protocoles d’études expérimentales devraient être mis en place
pour confirmer ces observations.Fipronil
 ).
).In vivo
 ). Le processus de cancéro-genèse
chez le rat induit par le fipronil ne repose pas sur un
effet génotoxique comme pour la plupart des pesticides
inducteurs de tumeurs thyroïdiennes folliculaires mais
semble lié à une perturbation de l’homéostasie de l’axe HPT
(Hurley, 1998
). Le processus de cancéro-genèse
chez le rat induit par le fipronil ne repose pas sur un
effet génotoxique comme pour la plupart des pesticides
inducteurs de tumeurs thyroïdiennes folliculaires mais
semble lié à une perturbation de l’homéostasie de l’axe HPT
(Hurley, 1998 ).
). ). Sur la base d’un modèle de rat
thyroïdectomisé et compensé par injection de T3 afin
d’évaluer les clairances de T4T et T4L, le fipronil augmente
de deux fois les clairances ainsi que celle de l’antipyrine
chez les rats thyroïdiens intacts. Ces résultats suggèrent
une augmentation des activités métaboliques hépatiques
facilitant l’élimination des HT. En effet le fipronil induit
l’expression de plusieurs ARNm des enzymes de phase 1
(Cyp2b1, Cyp2b2, Cyp3a1, ces2, ces6), de phase II
(Ugt1a1, Sult1b1, Gst2) et de phase III
(Abcc2, Abcc3, Abcg5, Abcg8, Slco1a1 et Slco1a4)
(Roques et coll., 2013
). Sur la base d’un modèle de rat
thyroïdectomisé et compensé par injection de T3 afin
d’évaluer les clairances de T4T et T4L, le fipronil augmente
de deux fois les clairances ainsi que celle de l’antipyrine
chez les rats thyroïdiens intacts. Ces résultats suggèrent
une augmentation des activités métaboliques hépatiques
facilitant l’élimination des HT. En effet le fipronil induit
l’expression de plusieurs ARNm des enzymes de phase 1
(Cyp2b1, Cyp2b2, Cyp3a1, ces2, ces6), de phase II
(Ugt1a1, Sult1b1, Gst2) et de phase III
(Abcc2, Abcc3, Abcg5, Abcg8, Slco1a1 et Slco1a4)
(Roques et coll., 2013 ). Ainsi, la perturbation de la
fonction thyroïdienne repose sur un métabolisme accru en
fipronil sulfone (Cyp2b1, Cyp2b2, Cyp3a1). D’autre
part ces perturbations participent à un flux augmenté
d’entrée de T4L (Abcc2, Abcc3, Slco1a1 et Slco1a4) et
d’efflux des conjugués glucuronés (Ugt1a1). Les
concentrations plasmatiques de fipronil sulfone sont
retrouvées 20 fois supérieures à celles du fipronil (Leghait
et coll., 2009
). Ainsi, la perturbation de la
fonction thyroïdienne repose sur un métabolisme accru en
fipronil sulfone (Cyp2b1, Cyp2b2, Cyp3a1). D’autre
part ces perturbations participent à un flux augmenté
d’entrée de T4L (Abcc2, Abcc3, Slco1a1 et Slco1a4) et
d’efflux des conjugués glucuronés (Ugt1a1). Les
concentrations plasmatiques de fipronil sulfone sont
retrouvées 20 fois supérieures à celles du fipronil (Leghait
et coll., 2009 ). L’augmentation d’expression de
gènes du métabolisme hépatique suggère une participation des
récepteurs CAR et/ou PXR activés par les xénobiotiques (car
régulateurs par exemple des CYP des familles 2 et 3). En
effet, le fipronil active CAR/PXR (Lemaire et coll.,
2006
). L’augmentation d’expression de
gènes du métabolisme hépatique suggère une participation des
récepteurs CAR et/ou PXR activés par les xénobiotiques (car
régulateurs par exemple des CYP des familles 2 et 3). En
effet, le fipronil active CAR/PXR (Lemaire et coll.,
2006 ) qui régule majoritairement le
profil d’expression des gènes hépatiques (Roques et coll.,
2013
) qui régule majoritairement le
profil d’expression des gènes hépatiques (Roques et coll.,
2013 ).
). ). Chez des brebis
thyroïdectomisées de type euthyroïdienne, l’effet de ce
traitement est limité à une augmentation modérée de la
clairance de T4L. Contrairement au rat, le traitement au
fipronil n’a aucun effet sur la clairance de l’antipyrine,
marqueur de l’activité de CYP hépatique, chez les
brebis.
). Chez des brebis
thyroïdectomisées de type euthyroïdienne, l’effet de ce
traitement est limité à une augmentation modérée de la
clairance de T4L. Contrairement au rat, le traitement au
fipronil n’a aucun effet sur la clairance de l’antipyrine,
marqueur de l’activité de CYP hépatique, chez les
brebis. ). L’absence d’effet inducteur
enzymatique hépatique du fipronil chez les ovins pourrait
s’expliquer par l’absence de liaison du fipronil aux
récepteurs ovins CAR/PXR.
). L’absence d’effet inducteur
enzymatique hépatique du fipronil chez les ovins pourrait
s’expliquer par l’absence de liaison du fipronil aux
récepteurs ovins CAR/PXR.In vitro
 ). Ce résultat souligne à nouveau
la nécessité d’étudier les métabolites des pesticides qui
peuvent se révéler plus actifs que la molécule mère.
). Ce résultat souligne à nouveau
la nécessité d’étudier les métabolites des pesticides qui
peuvent se révéler plus actifs que la molécule mère. ). Ces résultats mériteraient
d’être confirmés.
). Ces résultats mériteraient
d’être confirmés.Néonicotinoïdes
In vivo
 ). Cependant les auteurs ont
utilisé une formulation contenant du 1-méthyl-2-pyrrolidone
qui peut induire des malformations comme une ossification
incomplète chez le rat (Saillenfait et coll.,
2002
). Cependant les auteurs ont
utilisé une formulation contenant du 1-méthyl-2-pyrrolidone
qui peut induire des malformations comme une ossification
incomplète chez le rat (Saillenfait et coll.,
2002 ) et cette formulation est
10 fois plus toxique que le principe actif (imidaclopride)
(Mesnage et coll., 2014
) et cette formulation est
10 fois plus toxique que le principe actif (imidaclopride)
(Mesnage et coll., 2014 ). Les doses toxiques des
formulations et les effets délétères ne correspondent pas à
ceux des principes actifs et si les organismes sont exposés
aux formulations et produits de dégradation dans
l’environnement la réglementation concerne les principes
actifs. L’effet de l’imidaclopride pourrait cependant
refléter une spécificité particulière au sein de la famille
des néonicotinoïdes comme le montrent des résultats in
vitro.
). Les doses toxiques des
formulations et les effets délétères ne correspondent pas à
ceux des principes actifs et si les organismes sont exposés
aux formulations et produits de dégradation dans
l’environnement la réglementation concerne les principes
actifs. L’effet de l’imidaclopride pourrait cependant
refléter une spécificité particulière au sein de la famille
des néonicotinoïdes comme le montrent des résultats in
vitro.In vitro
 ). En revanche, l’imidaclopride
exerce un effet agoniste à très faible dose (2 x
10-10 M) d’après un essai luciférase sur
cellules GH3-TRE exprimant un gène rapporteur sensible à
l’action des TR activés par un ligand (Xiang et coll.,
2017
). En revanche, l’imidaclopride
exerce un effet agoniste à très faible dose (2 x
10-10 M) d’après un essai luciférase sur
cellules GH3-TRE exprimant un gène rapporteur sensible à
l’action des TR activés par un ligand (Xiang et coll.,
2017 ). Ce résultat qui semble en
opposition du précédent, peut en fait provenir du faible
effet agoniste (moins de 2 fois) qui ne se traduirait pas en
réponse physiologique observable ; il pourrait également
refléter un effet agoniste partiel, c’est-à-dire agoniste en
l’absence d’autres ligands mais antagoniste vis-à-vis de
l’action de ligands naturels comme la T3. Ainsi, les
vitesses d’association et dissociation du ligand de TRβ sont
semblables à celles obtenues avec T3 d’après une
expérimentation en résonance plasmonique de surface (Xiang
et coll., 2017
). Ce résultat qui semble en
opposition du précédent, peut en fait provenir du faible
effet agoniste (moins de 2 fois) qui ne se traduirait pas en
réponse physiologique observable ; il pourrait également
refléter un effet agoniste partiel, c’est-à-dire agoniste en
l’absence d’autres ligands mais antagoniste vis-à-vis de
l’action de ligands naturels comme la T3. Ainsi, les
vitesses d’association et dissociation du ligand de TRβ sont
semblables à celles obtenues avec T3 d’après une
expérimentation en résonance plasmonique de surface (Xiang
et coll., 2017 ). Ce résultat démontrerait qu’un
effet de compétition est possible d’autant que la
concentration utilisée pour lier le récepteur est
infra-nanomolaire. L’effet compétiteur semble confirmé par
une analyse in silico de « docking » conduite
sur TRα et TRβ, bien que l’affinité de l’imidaclopride soit
plus faible que celle de la T3 (Bhaskar et Mohanty,
2014
). Ce résultat démontrerait qu’un
effet de compétition est possible d’autant que la
concentration utilisée pour lier le récepteur est
infra-nanomolaire. L’effet compétiteur semble confirmé par
une analyse in silico de « docking » conduite
sur TRα et TRβ, bien que l’affinité de l’imidaclopride soit
plus faible que celle de la T3 (Bhaskar et Mohanty,
2014 ).
).Inhibiteurs de la succinate déshydrogénase
 ). De plus, des souris mâles exposées
à 750 ppm de fluopyram pendant 28 jours montrent une
augmentation d’élimination de la T4-glucuronidé, une baisse de
T4 sérique et une augmentation de TSH. L’évènement moléculaire
initial est une activation de CAR/PXR qui induit les enzymes de
phase I et II dont les UGT (Rouquié et coll.,
2014
). De plus, des souris mâles exposées
à 750 ppm de fluopyram pendant 28 jours montrent une
augmentation d’élimination de la T4-glucuronidé, une baisse de
T4 sérique et une augmentation de TSH. L’évènement moléculaire
initial est une activation de CAR/PXR qui induit les enzymes de
phase I et II dont les UGT (Rouquié et coll.,
2014 ) soulignant que la prise en compte des mécanismes
cataboliques d’élimination des HT au niveau hépatique est
essentielle.
) soulignant que la prise en compte des mécanismes
cataboliques d’élimination des HT au niveau hépatique est
essentielle.Autres dérivés
 ). Des rats mâles exposés à la trifluraline à la même dose
(325 mg/kg/j) dans l’aliment pendant deux semaines montrent une
induction d’UGT avec une élimination accrue de T4 conjuguée
(Saghir et coll., 2008
). Des rats mâles exposés à la trifluraline à la même dose
(325 mg/kg/j) dans l’aliment pendant deux semaines montrent une
induction d’UGT avec une élimination accrue de T4 conjuguée
(Saghir et coll., 2008 ). Les taux sériques de T3 et T4 sont
diminués avec une augmentation de TSH probablement en rapport
avec l’induction d’une hyperplasie de la thyroïde conduisant au
développement tumoral.
). Les taux sériques de T3 et T4 sont
diminués avec une augmentation de TSH probablement en rapport
avec l’induction d’une hyperplasie de la thyroïde conduisant au
développement tumoral.Conclusion – données mécanistiques
 , voir en fin de ce chapitre)
confirment la dérégulation thyroïdienne, très souvent associée à des
signes histopathologiques. D’après les tests chez les rongeurs, le
seul dosage de TSH n’est pas le biomarqueur de choix pour mettre en
évidence une pathologie thyroïdienne et presque toutes les cibles
avec des spécificités de tissus peuvent être touchées. L’exposition
de rats, souvent à forte dose, aboutit généralement à une
augmentation de la conjugaison de T4 (voire T3) et son élimination
biliaire sous forme T4-UDG avec une augmentation compensatrice de
TSH générant une stimulation de la thyroïde qui peut aboutir au
développement tumoral.
, voir en fin de ce chapitre)
confirment la dérégulation thyroïdienne, très souvent associée à des
signes histopathologiques. D’après les tests chez les rongeurs, le
seul dosage de TSH n’est pas le biomarqueur de choix pour mettre en
évidence une pathologie thyroïdienne et presque toutes les cibles
avec des spécificités de tissus peuvent être touchées. L’exposition
de rats, souvent à forte dose, aboutit généralement à une
augmentation de la conjugaison de T4 (voire T3) et son élimination
biliaire sous forme T4-UDG avec une augmentation compensatrice de
TSH générant une stimulation de la thyroïde qui peut aboutir au
développement tumoral.Tableau 17.I Études de cohortes portant sur le lien entre les pathologies thyroïdiennes et l’exposition aux pesticides
|
Référence
Pays |
Type d’étude
|
Population
|
Nombre de sujets
|
Exposition
Pesticides |
Résultats
|
|---|---|---|---|---|---|
|
Exposition
professionnelle
|
|||||
|
Cohorte prospective
|
Applicateurs
|
35 150
|
Environ cinquante pesticides des
familles de OC, OP, carbamates, Pyr
|
Augmentation de risque
d’hypothyroïdie
|
|
|
Idem
|
Épouses des applicateurs
|
24 092
|
Idem
|
Fongicides (bénomyl, manèbe/mancozèbe,
métalaxyl), herbicides (pendiméthaline), et parmi
les plus de 60 ans : insecticides (parathion,
perméthrine) : Hypothyroïdisme : HR
[1,56-2,44]
Insecticides (diazinon), fongicides (manèbe, mancozèbe), herbicides (métolachlore) : Hyperthyroïdisme : HR [1,35-2,01] |
|
|
Idem
|
Applicateurs
|
679
|
Idem
|
Aldrine : Hypothyroïdie sous-clinique,
augmentation de TSH et diminution de
T4
Pendiméthaline : Hypothyroïdie sous-clinique, augmentation de TSH et augmentation anticorps anti-TPO Bromure de méthyl : Augmentation de T4 et diminution de la TSH Captane, EPTC : Augmentation de la TSH |
|
|
Idem
|
Épouses des applicateurs
|
30 003
|
Utilisation de pesticides
OP
|
Malathion associé au risque de cancer
de la thyroïde : RR = 2,04 ; IC 95 %
[1,14-3,63]
|
|
|
Cohorte prospective
|
Applicateurs d’atrazine
|
36 357
|
Utilisation d’atrazine
|
Augmentation de risque de cancer de la
thyroïde dans les 2eet
4equartiles d’exposition cumulée au
cours de la vie
|
|
|
Cohorte rétrospective
|
Employés d’une scierie
|
293
|
Pentachlorophénol
|
Association entre la durée d’emploi et
les désordres thyroïdiens
|
|
|
Cohorte rétrospective
|
Employés d’une usine
d’herbicides
|
185
|
Poste de production de benzothiadiazine
versus registre de cas
|
Pas d’association (mais puissance trop
faible)
|
|
|
Cohorte
|
Travailleurs de serres appliquant
pesticides
|
122
|
Pulvérisation de plus de 60
pesticides
|
Diminution de T4 libre, diminution de
la TSH, augmentation de T3, T3 libre, et T4 libre
dans la période la plus exposée versus la
moins exposée
|
|
|
Cohorte prospective
|
Mélangeurs de pesticides versus
travailleurs de procédés
|
45
|
Usine fabriquant de l’ETU
|
Diminution de T4 chez les mélangeurs,
pas chez les travailleurs
|
|
|
Exposition en population
générale
|
|||||
|
Cohorte prospective
|
Femmes enceintes en population
générale
|
715 sang maternel + 482 sang de
cordon
|
Six métabolites de pesticides
OP
|
Pas d’association
|
|
|
Cohorte prospective
|
Couples mères-enfants
|
717
|
DDT/E sériques et concentrations
urinaires de métabolites de
pyréthrinoïdes
|
Pyréthrinoïdes associés positivement à
la TSH, DDT associé négativement à T4
(garçons)
|
|
|
Cohorte prospective
|
Jeunes enfants (3 mois)
|
111
|
Chlordécone mesuré dans le sang de
cordon et le lait
|
Cordon : augmentation de TSH chez les
garçons ; lait : diminution de T4 (filles) et T3
libres
|
|
|
Cohorte prospective
|
Couples mères-nouveau-nés
|
147
|
3-PBA au
1er trimestre
|
Pas d’association avec la T4 libre et
la TSH
|
|
|
Cohorte rétrospective
|
Enfants nés de femmes travaillant dans
les serres
|
145 dont 90 exposés
|
Exposition prénatale
|
Diminution de la TSH chez les
exposés
|
|
|
Exposition
résidentielle
|
|||||
|
Cohorte rétrospective
|
Femmes résidentes de fermes
|
6 310
|
Résidentes sur une ferme versus
non-résidentes
|
Tendance à l’augmentation des cas de
cancers de la thyroïde
|
|
3-PBA : acide 3-phénoxybenzoïque ; DDE : dichlorodiphényldichloroéthylène ; DDT : dichlorodiphényltrichloroéthane ; EPTC : éthyl-dipropylthiocarbamate ; ETU : éthylène thiourée ; OC : organochlorés ; OP : organophosphorés ; Pyr : pyréthrinoïdes ; TSH : Thyroid-Stimulating Hormone (thyréostimuline ou thyrotropine) ; TPO : thyroperoxydase
Tableau 17.II Récapitulatif des résultats d’études expérimentales sur les effets perturbateurs thyroïdiens des pesticides
|
Pesticide
|
Approche
|
Modèle
|
Paramètres
|
Références
|
|---|---|---|---|---|
|
Organophosphorés
|
||||
|
Chlorpyrifos
|
in vitro
|
PCCl3
|
Thyréocytes : ↓ARNm Egr1, Hmga1,
Zfp36l2
| |
|
in vivo
|
souris
|
T4↓ Thyréocytes : ↑taille
| ||
|
in vivo
|
souris
|
TG↓ T4↓ Thyréocytes : ↓ARNm Egr1,
Hmga1, Zfp36l2
| ||
|
in vivo
|
poisson larve
|
T3↓
| ||
|
Diazinon
|
in vivo
|
poisson
|
TSH↓ T3↓ T4↓
| |
|
Malathion
|
in vitro
|
FRTL-5
|
TSHR↓ TG↓
| |
|
in vivo
|
rat
|
TSH↑ T3↓ T4↓
| ||
|
in vivo
|
poisson larve
|
T3↓ T4↓ TR↓ Thyréocytes :
↑taille
| ||
|
Monocrotophos
|
in vivo
|
poisson
|
TRH↓ TSH↓ T3↓ TTR↑ D2↓, D1 et
D3↑
Thyréocytes : hyperplasie | |
|
Carbamates
|
||||
|
Mancozèbe
|
in vivo
|
oiseau
|
TSH↓ T3↓ T4↓ Hypertrophie thyroïdienne
et altération du colloïde
| |
|
in vivo
|
rat
|
T4↓
| ||
|
Thirame
|
in vivo
|
poisson
|
TPO↓ D3↑
| |
|
Éthylène thiourée
|
in vitro
|
PCCl3
|
Thyréocytes : ↓ARNm Egr1, Hmga1,
Zfp36l2
| |
|
in vivo
|
souris
|
TG↓ T4↓ Thyréocytes : ↓ARNm Egr1,
Hmga1, Zfp36l2
| ||
|
in vivo
|
rat
|
TSH↓ T3↓ T4↓ Thyréocytes :
vacuolisation, ↓colloïde
| ||
|
Organochlorés
|
||||
|
DDT/DDE
|
in vitro
|
CHO
|
TSHR↓
| |
|
in vivo
|
rat
|
TSH↓ T3↓ T4↓ Thyréocytes : ↑taille et
↑transport vésiculaire
| ||
|
in vivo
|
rat
|
TSH↓ T3↓ T4↓
TTR↓ UGT↑ ↓D2 TR↑ | ||
|
in vivo
|
poisson (SNC)
|
TSH↓ TR↑
| ||
|
in vivo
|
batracien XETA
|
TH/bZIP:GFP↑(si T3)
| ||
|
Hexachlorobenzène
|
in vitro
|
FRTL-5
|
Thyréocytes : inhibition de
croissance
| |
|
in vivo
|
rat
|
T4↓ UGT↑ D1↑
| ||
|
in vivo
|
rat
|
TSH↑ T4↓ TTR↑
| ||
|
in vivo
|
batracien XETA
|
TH/bZIP:GFP↑ (si T3)
| ||
|
Pentachlorophénol
|
in vitro
|
CHO
|
TR↓
| |
|
in vitro
|
GH3
|
D1↓
| ||
|
in vivo
|
poisson larve
|
TSH↑ NIS↑ T3↑ T4↓ D1 et D2↑
TR↑
| ||
|
in vivo
|
poisson adulte
|
TSH↓ T3↓ (M) T4↑ TTR↓ (M) ↑(F) SULT↓
(F) ↑ (M) UGT↑ D1↓D2↑(F) ↓(M) TR↓(M)
| ||
|
Endosulfan
|
in vivo
|
poisson
|
T4↓ D1↓ D3↑
| |
|
Métolachlore
|
in vivo
|
poisson juvénile
|
TRH↑ D2↑ TR↑
| |
|
Acétochlore
|
in vivo
|
poisson larve
|
NIS↓ D2 et D1↓ TR↓
| |
|
in vivo
|
poisson adulte
|
NIS↓ (F) T3↓ T4↓ D2↓ TR↑
| ||
|
Pyréthrinoïdes
|
||||
|
l-cyhalothrine
|
in vitro
|
CV-1
|
TR↓
| |
|
in vivo
|
poisson
|
TR↓
| ||
|
in vivo
|
rat
|
TSH↑ T3↓ T4↓
| ||
|
in vivo
|
poisson
|
T3↑ T4↑ TTR↑ UGT↑ D2↑, D1↓
TR↑
| ||
|
Fenvalérate
|
in vitro
|
CV-1
|
TR↓
| |
|
in vivo
|
souris
|
TR↓
| ||
|
in vivo
|
rat
|
T3↑
| ||
|
in vivo
|
souris
|
T3↓ T4↓ Désiodases↓
| ||
|
in vivo
|
poisson
|
TR↓
| ||
|
Perméthrine
|
in vitro
|
CV-1
|
TR↓
| |
|
in vivo
|
poisson
|
TR↓
| ||
|
in vivo
|
poisson
|
TSH↑ TPO↑ T3↑ T4↑ TTR↑ D1 et D2↑
TR↑
| ||
|
Autres
|
||||
|
Chlorothalonil
|
in vitro
|
CHO
|
TR↑
| |
|
Glyphosate
|
in vivo
|
rat
|
TSH↓ OATP↓ D2 et D3↓
| |
|
Trifluraline
|
in vivo
|
rat
|
TSH↑ T3↓ T4↓ UGT↑
| |
|
Fluopyram
|
in vivo
|
souris
|
TSH↑ T4↓ UGT↑ Thyréocytes :
hyperplasie
| |
|
Imidaclopride
|
in vitro
|
GH3
|
TR↑
| |
|
in vivo
|
oiseau
|
TSH↓ T3↓ T4↓ Altération du
colloïde
| ||
|
Fipronil
|
in vitro
|
CHO-K1
|
TR↓
| |
|
in vivo
|
rat
|
TSH↑ T3↓ T4↓
| ||
|
in vivo
|
rat
|
OATP↑ SULT↑ UGT↑
| ||
|
in vivo
|
brebis
|
TSH, T3 et T4 inchangés
| ||
D1, D2, D3 : désiodase de type I, II et III ; Egr1 : Early growth response protein 1 ; F : femelles ; Hmga1 : High-mobility group AT hook 1 ; M : mâles ; OAPT : organic anion transporting polypeptide ; SNC : système nerveux central ; SULT : sulfotransférase ; T3 et T4 : hormones thyroïdiennes ; TRH : Thyrotropin-Releasing Hormone (l’hormone thyréotrope) ; TSH : thyroxine stimulating hormone ; TSHR : récepteur de la TSH ; NIS : symport iode-sodium ; TG : thyroglobuline ; TPO : thyroperoxydase ; TTR : transthyrétine ; TR : récepteur des hormones thyroïdiennes ; UGT : uridine diphospho-glucuronosyltransférase ; Zfp36l2 : Zinc Finger Protein 36, CH3 Type-Like 2
Addenda : Modèles et tests pour analyser l’effet
des perturbateurs de la fonction
thyroïdienne
Tests réglementaires des agences européennes pour identifier les agents perturbateurs endocriniens
 ; OECD, 2018
; OECD, 2018 ). Les tests ciblent les régulations
des voies EATS (Estrogenic, Androgenic, Thyroidal,
Steroidogenic) et sont organisés en 5 niveaux décrits
ci-dessous (les essais réglementaires
européens6
correspondants sont rapportés) :
). Les tests ciblent les régulations
des voies EATS (Estrogenic, Androgenic, Thyroidal,
Steroidogenic) et sont organisés en 5 niveaux décrits
ci-dessous (les essais réglementaires
européens6
correspondants sont rapportés) :Niveau 1 : recueil de données pour trier et prioriser (inclus également (Q)SAR)
Niveau 2 : tests in vitro sur cellules, à visée mécanistique (criblage)
Niveau 3 : tests sur organismes entiers avec un seul agent, reproduisant les mécanismes spécifiques des critères de perturbation
Niveau 4 : tests sur organismes entiers, reproduisant l’effet néfaste spécifique des critères de perturbation
Niveau 5 : tests sur organismes entiers renseignant sur les effets perturbateurs endocriniens et autres mécanismes, sur tout le cycle de vie
Méthodes d’identification des agents perturbateurs de la fonction thyroïdienne
Tests in vivo chez les mammifères
 ) mais non l’hypothalamus très
difficilement prélevable à l’autopsie. En biochimie les
dosages de la TSH (thyroid stimulating hormone)
circulante et des hormones T3 et T4 (totale ou libre) sont
réalisés. Sur la base de ces analyses la différenciation est
cependant difficile entre une action centrale versus
un effet se produisant spécifiquement sur les évènements en
aval de l’axe hypothalamo-hypophyso-thyroïdien
(Hypothalamic-Pituitary-Thyroid ; HPT) (Dallot,
2015
) mais non l’hypothalamus très
difficilement prélevable à l’autopsie. En biochimie les
dosages de la TSH (thyroid stimulating hormone)
circulante et des hormones T3 et T4 (totale ou libre) sont
réalisés. Sur la base de ces analyses la différenciation est
cependant difficile entre une action centrale versus
un effet se produisant spécifiquement sur les évènements en
aval de l’axe hypothalamo-hypophyso-thyroïdien
(Hypothalamic-Pituitary-Thyroid ; HPT) (Dallot,
2015 ).
).Tests in vivo chez les non-mammifères
 ), participe à l’évaluation des
perturbateurs thyroïdiens, d’autres modèles ont été
développés principalement chez les poissons et les
batraciens. Les essais de niveau 3, OECD TG 229 (test de
reproduction court terme chez les poissons) OECD TG 230
(toxicité 21 jours chez les poissons) ne donnent pas
d’information spécifique d’une perturbation de la fonction
thyroïdienne. En revanche un essai, le test de métamorphose
AMA (OECD TG 231) chez les amphibiens intègre
potentiellement tous les mécanismes possibles de
perturbation de la fonction thyroïdienne puisque le
paramètre étudié, la métamorphose, est un effet apical des
HT. Cette approche est intéressante du fait de la grande
conservation de l’axe HPT entre les espèces (Paris et
Laudet, 2008
), participe à l’évaluation des
perturbateurs thyroïdiens, d’autres modèles ont été
développés principalement chez les poissons et les
batraciens. Les essais de niveau 3, OECD TG 229 (test de
reproduction court terme chez les poissons) OECD TG 230
(toxicité 21 jours chez les poissons) ne donnent pas
d’information spécifique d’une perturbation de la fonction
thyroïdienne. En revanche un essai, le test de métamorphose
AMA (OECD TG 231) chez les amphibiens intègre
potentiellement tous les mécanismes possibles de
perturbation de la fonction thyroïdienne puisque le
paramètre étudié, la métamorphose, est un effet apical des
HT. Cette approche est intéressante du fait de la grande
conservation de l’axe HPT entre les espèces (Paris et
Laudet, 2008 ; Buchholz,
2017
; Buchholz,
2017 ). Le test XETA (Fini et coll.,
2007
). Le test XETA (Fini et coll.,
2007 ), validé en 2019 (OECD TG 248),
utilise une lignée transgénique de X. laevis
Tg(thibz :eGFP), qui exprime le gène rapporteur GFP sous le
contrôle d’un élément de réponse aux récepteurs thyroïdiens
(TRE) du promoteur du gène TH/bZIP, un facteur de
transcription hautement régulé par les HT (Furlow et Brown,
1999
), validé en 2019 (OECD TG 248),
utilise une lignée transgénique de X. laevis
Tg(thibz :eGFP), qui exprime le gène rapporteur GFP sous le
contrôle d’un élément de réponse aux récepteurs thyroïdiens
(TRE) du promoteur du gène TH/bZIP, un facteur de
transcription hautement régulé par les HT (Furlow et Brown,
1999 ). Le test est basé sur des
critères physiologiques de perturbation thyroïdienne tels
qu’ils sont définis par l’essai OECD TG 231. Les têtards ont
pour avantage de bénéficier de la grande conservation de la
signalisation thyroïdienne chez les vertébrés et d’autre
part de donner accès au suivi de l’organogenèse, un stade de
développement difficile à suivre pour les modèles
mammifères. La quantification des variations du signal GFP
est indicatrice de l’altération de la biodisponibilité des
HT.
). Le test est basé sur des
critères physiologiques de perturbation thyroïdienne tels
qu’ils sont définis par l’essai OECD TG 231. Les têtards ont
pour avantage de bénéficier de la grande conservation de la
signalisation thyroïdienne chez les vertébrés et d’autre
part de donner accès au suivi de l’organogenèse, un stade de
développement difficile à suivre pour les modèles
mammifères. La quantification des variations du signal GFP
est indicatrice de l’altération de la biodisponibilité des
HT. ; Picou et coll.,
2012
; Picou et coll.,
2012 ; Dezonne et coll.,
2015
; Dezonne et coll.,
2015 ; Préau et coll.,
2015
; Préau et coll.,
2015 ). Les essais reposant sur des
modèles d’embryons de poissons ou d’amphibiens se révèlent
d’un grand intérêt en raison de la conservation de la voie
de signalisation des HT illustrée par i) le domaine
de liaison des TRα et β pour le ligand T3, ii) le
domaine de liaison à l’ADN et iii) la séquence de
liaison des TRE à l’ADN (Paris et Laudet,
2008
). Les essais reposant sur des
modèles d’embryons de poissons ou d’amphibiens se révèlent
d’un grand intérêt en raison de la conservation de la voie
de signalisation des HT illustrée par i) le domaine
de liaison des TRα et β pour le ligand T3, ii) le
domaine de liaison à l’ADN et iii) la séquence de
liaison des TRE à l’ADN (Paris et Laudet,
2008 ). La conservation est également
retrouvée au niveau de la glande thyroïde des vertébrés,
avec l’iodation et l’organification ainsi que les protéines
sériques de liaison et les désiodases.
). La conservation est également
retrouvée au niveau de la glande thyroïde des vertébrés,
avec l’iodation et l’organification ainsi que les protéines
sériques de liaison et les désiodases.Tests in vitro
 ). Dans le cadre du développement
des méthodes d’évaluation d’effets perturbateurs
endocriniens, l’OCDE a publié en 2017 un guide des essais
d’évaluation des THDC (OECD,
2017
). Dans le cadre du développement
des méthodes d’évaluation d’effets perturbateurs
endocriniens, l’OCDE a publié en 2017 un guide des essais
d’évaluation des THDC (OECD,
2017 ). Ces tests présentent les
limitations suivantes, outre la question du rapport entre
les données obtenues in vivo et in vitro :
i) contrairement aux organismes ou aux cellules
spécialisées telles que les hépatocytes, tous les modèles
in vitro ne disposent pas des capacités
métaboliques d’oxydation, de dégradation et/ou de
conjugaison des THDC ; ii) en physiopathologie, un
effet peut être réversible et plusieurs cibles peuvent être
touchées ; iii) parfois le toxique ultime n’est pas
le principe actif utilisé pour l’exposition qui interagit
avec ses cibles, mais un métabolite qui, s’il est connu,
doit être testé. En outre, une batterie de tests est
nécessaire pour caractériser une activité perturbatrice de
la fonction thyroïdienne.
). Ces tests présentent les
limitations suivantes, outre la question du rapport entre
les données obtenues in vivo et in vitro :
i) contrairement aux organismes ou aux cellules
spécialisées telles que les hépatocytes, tous les modèles
in vitro ne disposent pas des capacités
métaboliques d’oxydation, de dégradation et/ou de
conjugaison des THDC ; ii) en physiopathologie, un
effet peut être réversible et plusieurs cibles peuvent être
touchées ; iii) parfois le toxique ultime n’est pas
le principe actif utilisé pour l’exposition qui interagit
avec ses cibles, mais un métabolite qui, s’il est connu,
doit être testé. En outre, une batterie de tests est
nécessaire pour caractériser une activité perturbatrice de
la fonction thyroïdienne. ). La perturbation de la fonction
thyroïdienne est mise en évidence par des essais ciblant la
signalisation HPT, la production des HT (perturbation du
symport Na+/I- (NIS), thyroperoxydase
ou TPO, désiodases), le transport avec la liaison à la
transthyrétine (TTR) ou à la thyroxine-binding
globulin (TBG), la réponse cellulaire (par exemple
des essais de transactivation du récepteur des HT). Une
liste courte et non exhaustive des tests (niveau 2 dans
l’évaluation) illustre la possibilité d’étudier chacune des
cibles potentielles :
). La perturbation de la fonction
thyroïdienne est mise en évidence par des essais ciblant la
signalisation HPT, la production des HT (perturbation du
symport Na+/I- (NIS), thyroperoxydase
ou TPO, désiodases), le transport avec la liaison à la
transthyrétine (TTR) ou à la thyroxine-binding
globulin (TBG), la réponse cellulaire (par exemple
des essais de transactivation du récepteur des HT). Une
liste courte et non exhaustive des tests (niveau 2 dans
l’évaluation) illustre la possibilité d’étudier chacune des
cibles potentielles :Régulation de l’axe hypothalamo-pituitaro-thyroïdien
 ), a pu être reproduite
dans les modèles cellulaires suivants : la lignée de
cellules rénales de singe CV-1 (Ohba et coll.,
2011
), a pu être reproduite
dans les modèles cellulaires suivants : la lignée de
cellules rénales de singe CV-1 (Ohba et coll.,
2011 ) ou la lignée de cellules
placentaires humaines JEG-3 (Flynn et coll.,
1994
) ou la lignée de cellules
placentaires humaines JEG-3 (Flynn et coll.,
1994 ) transfectées avec le TRβ,
la lignée humaine de glioblastome-astrocytome (U-373
MG) et les cultures primaires de neurones
hypothalamiques de poussin (Lezoualc’h et coll.,
1992
) transfectées avec le TRβ,
la lignée humaine de glioblastome-astrocytome (U-373
MG) et les cultures primaires de neurones
hypothalamiques de poussin (Lezoualc’h et coll.,
1992 ) et de rat
(Carreón-Rodríguez et coll.,
2009
) et de rat
(Carreón-Rodríguez et coll.,
2009 ).
). ). Le suivi de production
de la prolactine est un indicateur de la stimulation
du récepteur membranaire TRH-R. La lignée Chem-1 est
utilisée pour mesurer indirectement la stimulation
du récepteur de la TRH humain par les variations de
flux de calcium intracellulaire (test commercial
ChemiScreenTM TRH
Thyrotropin-Releasing Hormone Receptor Stable
Cell Line).
). Le suivi de production
de la prolactine est un indicateur de la stimulation
du récepteur membranaire TRH-R. La lignée Chem-1 est
utilisée pour mesurer indirectement la stimulation
du récepteur de la TRH humain par les variations de
flux de calcium intracellulaire (test commercial
ChemiScreenTM TRH
Thyrotropin-Releasing Hormone Receptor Stable
Cell Line). ; De Gregorio et coll.,
2011
; De Gregorio et coll.,
2011 ) permet d’évaluer
l’activité du récepteur par dosage de la production
d’AMPc. Les lignées CHO, COS-7 et HeLa ont été
transfectées avec le TSH-R pour étudier l’effet de
pesticides sur le mécanisme d’internalisation du
récepteur et ont mis en évidence un effet inhibiteur
de cette réaction par le DDT (De Gregorio et coll.,
2011
) permet d’évaluer
l’activité du récepteur par dosage de la production
d’AMPc. Les lignées CHO, COS-7 et HeLa ont été
transfectées avec le TSH-R pour étudier l’effet de
pesticides sur le mécanisme d’internalisation du
récepteur et ont mis en évidence un effet inhibiteur
de cette réaction par le DDT (De Gregorio et coll.,
2011 ). La lignée HEK293-TSH-R
(utilisée dans le cadre du programme ToxCast de
l’Agence américaine de protection de
l’environnement) est utilisée pour étudier
l’activation ou l’inhibition du TSH-R en utilisant
l’AMPc comme marqueur (Neumann et coll.,
2010
). La lignée HEK293-TSH-R
(utilisée dans le cadre du programme ToxCast de
l’Agence américaine de protection de
l’environnement) est utilisée pour étudier
l’activation ou l’inhibition du TSH-R en utilisant
l’AMPc comme marqueur (Neumann et coll.,
2010 ).
). ). La mesure de
l’incorporation d’iode radiomarqué est également
documentée pour la lignée humaine hNIS-HEK293T-EPA
exprimant le NIS humain (Hallinger et coll.,
2017
). La mesure de
l’incorporation d’iode radiomarqué est également
documentée pour la lignée humaine hNIS-HEK293T-EPA
exprimant le NIS humain (Hallinger et coll.,
2017 ).
). ). Un test plus sensible
sur microsomes de thyroïde, le test AUR-TPO
(Amplex UltraRed TPO Inhibition Assay)
utilise un excès de peroxyde d’hydrogène et de
substrat (Amplex UltraRed), l’activité
peroxydase de la TPO étant mesurée par la perte de
fluorescence du substrat une fois oxydé (Paul et
coll., 2014
). Un test plus sensible
sur microsomes de thyroïde, le test AUR-TPO
(Amplex UltraRed TPO Inhibition Assay)
utilise un excès de peroxyde d’hydrogène et de
substrat (Amplex UltraRed), l’activité
peroxydase de la TPO étant mesurée par la perte de
fluorescence du substrat une fois oxydé (Paul et
coll., 2014 ).
).Liaison et transport sérique des HT
 ) ; la fixation d’un isotope
stable de la T4 (13C6-L-Thyroxine)
est déterminée sur la TBG et/ou la TTR avec un dosage en
LC-MS/MS ; le déplacement d’un marqueur fluorescent (sel
d’ammonium de l’acide 8-anilino naphtalène sulfonique)
des transporteurs est mesuré par spectrofluorométrie
(Cao et coll., 2010
) ; la fixation d’un isotope
stable de la T4 (13C6-L-Thyroxine)
est déterminée sur la TBG et/ou la TTR avec un dosage en
LC-MS/MS ; le déplacement d’un marqueur fluorescent (sel
d’ammonium de l’acide 8-anilino naphtalène sulfonique)
des transporteurs est mesuré par spectrofluorométrie
(Cao et coll., 2010 ).
). ). Les perturbations
thyroïdiennes par augmentation du catabolisme des HT
observées chez le rat sont donc souvent considérées
comme une particularité d’espèce.
). Les perturbations
thyroïdiennes par augmentation du catabolisme des HT
observées chez le rat sont donc souvent considérées
comme une particularité d’espèce.Métabolisme des HT
 ) et métabolisées au niveau
hépatique pour être excrétées après conjugaison ou
sulfatation (Visser,
1994
) et métabolisées au niveau
hépatique pour être excrétées après conjugaison ou
sulfatation (Visser,
1994 ; Visser,
1996
; Visser,
1996 ; Wu et coll.,
2005
; Wu et coll.,
2005 ; Bianco et Kim,
2006
; Bianco et Kim,
2006 ).
). ). Une technique
colorimétrique est proposée pour tester l’activité
des désiodases (Renko et coll.,
2012
). Une technique
colorimétrique est proposée pour tester l’activité
des désiodases (Renko et coll.,
2012 ). L’activité des
désiodases de type I, II ou II peut être suivie en
quantifiant l’expression des gènes dio1, 2, 3 ou les
protéines. L’expression des désiodases est une
source de variabilité des effets physiopathologiques
des perturbateurs de la fonction thyroïdienne entre
espèces, par exemple entre le rat et l’être humain
(Gereben et coll.,
2015
). L’activité des
désiodases de type I, II ou II peut être suivie en
quantifiant l’expression des gènes dio1, 2, 3 ou les
protéines. L’expression des désiodases est une
source de variabilité des effets physiopathologiques
des perturbateurs de la fonction thyroïdienne entre
espèces, par exemple entre le rat et l’être humain
(Gereben et coll.,
2015 ).
).Distribution subcellulaire des HT
 ; Bernal et coll.,
2015
; Bernal et coll.,
2015 ). Les transporteurs MCT8
et 10 ont une activité bidirectionnelle et sont
fortement exprimés dans le foie, le rein et la glande
thyroïde avec pour conséquence un influx et efflux de T3
et T4 assurant le maintien d’un équilibre. Le suivi de
ce transport est réalisé sur des cellules transfectées
(COS, HEK293, MDCK, JEG, HeLa, GH3...) exprimant
spécifiquement MCT8, MCT10, LAT1/2 ou OATP1C1.
). Les transporteurs MCT8
et 10 ont une activité bidirectionnelle et sont
fortement exprimés dans le foie, le rein et la glande
thyroïde avec pour conséquence un influx et efflux de T3
et T4 assurant le maintien d’un équilibre. Le suivi de
ce transport est réalisé sur des cellules transfectées
(COS, HEK293, MDCK, JEG, HeLa, GH3...) exprimant
spécifiquement MCT8, MCT10, LAT1/2 ou OATP1C1.Réponses cellulaires aux HT
 ; Cioffi et coll.,
2013
; Cioffi et coll.,
2013 ). Les essais examinent soit
l’interaction ligand-récepteur, soit l’activité des
promoteurs ou bien l’interaction
récepteurs/corépresseurs ou autres « interactants ». Un
essai de prolifération cellulaire peut aussi détecter
les agonistes ou antagonistes des TR. Il est important
de noter que la liaison de T3 dans la poche de liaison
des TR est hautement spécifique ce qui implique que ce
mécanisme de dérégulation induit par des perturbateurs
thyroïdiens est peu illustré (Gauger et coll.,
2004
). Les essais examinent soit
l’interaction ligand-récepteur, soit l’activité des
promoteurs ou bien l’interaction
récepteurs/corépresseurs ou autres « interactants ». Un
essai de prolifération cellulaire peut aussi détecter
les agonistes ou antagonistes des TR. Il est important
de noter que la liaison de T3 dans la poche de liaison
des TR est hautement spécifique ce qui implique que ce
mécanisme de dérégulation induit par des perturbateurs
thyroïdiens est peu illustré (Gauger et coll.,
2004 ) en rapport avec la diversité
de structures chimiques des THDC (Mughal et coll.,
2018
) en rapport avec la diversité
de structures chimiques des THDC (Mughal et coll.,
2018 ).
). ). Des cellules ont été
transfectées transitoirement par des constructions
qui permettent le suivi de l’activité des récepteurs
par une réaction de luminescence : des cellules HeLa
exprimant les constructions entre le domaine de
liaison du récepteur (LBD : Ligand Binding
Domain) pGAL4-TRα-puro et la luciférase sous
contrôle de GAL4, pGAL4RE-ERE-β Glob-Luc-SVNeo (Fini
et coll., 2012
). Des cellules ont été
transfectées transitoirement par des constructions
qui permettent le suivi de l’activité des récepteurs
par une réaction de luminescence : des cellules HeLa
exprimant les constructions entre le domaine de
liaison du récepteur (LBD : Ligand Binding
Domain) pGAL4-TRα-puro et la luciférase sous
contrôle de GAL4, pGAL4RE-ERE-β Glob-Luc-SVNeo (Fini
et coll., 2012 ) ; des cellules HepG2
exprimant les constructions Gal4-L-TRβ, pUAS-tk-luc
et phRL-tk (Sun et coll.,
2008
) ; des cellules HepG2
exprimant les constructions Gal4-L-TRβ, pUAS-tk-luc
et phRL-tk (Sun et coll.,
2008 ). La séquence du LBD peut
être exprimée en fusion avec la thymidilate
synthétase chez E. coli permettant d’associer la
croissance bactérienne à la liaison d’un agoniste
avec TRα1 ou TRβ 1 (Gierach et coll.,
2012
). La séquence du LBD peut
être exprimée en fusion avec la thymidilate
synthétase chez E. coli permettant d’associer la
croissance bactérienne à la liaison d’un agoniste
avec TRα1 ou TRβ 1 (Gierach et coll.,
2012 ). Des essais utilisent la
transfection stable de constructions TRα ou TRβ en
fusion avec le gène codant pour la luciférase dans
différentes lignées cellulaires : cellules
pituitaires de rat GH3 testant TRα et TRβ (Freitas
et coll., 2011
). Des essais utilisent la
transfection stable de constructions TRα ou TRβ en
fusion avec le gène codant pour la luciférase dans
différentes lignées cellulaires : cellules
pituitaires de rat GH3 testant TRα et TRβ (Freitas
et coll., 2011 ), lignée de cellules de
xénope XL58 testant TRβ (Sugiyama et coll.,
2005
), lignée de cellules de
xénope XL58 testant TRβ (Sugiyama et coll.,
2005 ), lignée de
phéochromocytome de rat PC12 testant TRα1 (Jugan et
coll., 2007
), lignée de
phéochromocytome de rat PC12 testant TRα1 (Jugan et
coll., 2007 ).
). ) incluant les HT (Bergh et
coll., 2005
) incluant les HT (Bergh et
coll., 2005 ). L’activation de
l’intégrine αvβ3 par les HT
initie un signal qui induit différentes réponses
cellulaires impliquées dans l’angiogenèse, la
prolifération cellulaire (Stenzel et coll.,
2014
). L’activation de
l’intégrine αvβ3 par les HT
initie un signal qui induit différentes réponses
cellulaires impliquées dans l’angiogenèse, la
prolifération cellulaire (Stenzel et coll.,
2014 ) et l’entrée du glucose
intracellulaire (Incerpi et coll.,
2014
) et l’entrée du glucose
intracellulaire (Incerpi et coll.,
2014 ). Un essai peut être
conduit sur la lignée CV-1 qui exprime l’intégrine
αvβ3 mais pas les récepteurs
nucléaires aux HT.
). Un essai peut être
conduit sur la lignée CV-1 qui exprime l’intégrine
αvβ3 mais pas les récepteurs
nucléaires aux HT. ).
). ). Cependant, de nombreux
faux positifs par un mécanisme indépendant de
l’effet prolifératif des HT représentent une limite
de cet essai.
). Cependant, de nombreux
faux positifs par un mécanisme indépendant de
l’effet prolifératif des HT représentent une limite
de cet essai.Conclusion
 ; Hammes et Davis, 2015
; Hammes et Davis, 2015 ; Little,
2018
; Little,
2018 ). Ces actions non génomiques des HT sont initiées au niveau
de récepteurs membranaires, du cytoplasme ou d’organelles qui
peuvent être les récepteurs classiques TR ou de leurs variants
ou bien l’intégrine αvβ3 (Hammes et Davis,
2015
). Ces actions non génomiques des HT sont initiées au niveau
de récepteurs membranaires, du cytoplasme ou d’organelles qui
peuvent être les récepteurs classiques TR ou de leurs variants
ou bien l’intégrine αvβ3 (Hammes et Davis,
2015 ). Au niveau du système nerveux central, celui-ci pourrait
moduler le traitement de l’information reçue par les tissus
périphériques induisant une régulation des actions locales
dépendantes des HT. Enfin, une perturbation d’un niveau de
régulation peut être compensée via des actions à un autre niveau
(Di Cosmo et coll., 2013
). Au niveau du système nerveux central, celui-ci pourrait
moduler le traitement de l’information reçue par les tissus
périphériques induisant une régulation des actions locales
dépendantes des HT. Enfin, une perturbation d’un niveau de
régulation peut être compensée via des actions à un autre niveau
(Di Cosmo et coll., 2013 ).
). ). Ces différences complexifient la relation entre les
changements de taux sérique des HT, y compris ceux induits par
les différences de métabolisme. En outre, les capacités
métaboliques d’une espèce et les différences de sensibilité dues
à l’âge, doivent être prises en considération. En conséquence,
la différence entre espèces quant à la sensibilité à certaines
maladies du développement induites par des modifications des
niveaux d’HT ne peut pas être exclue.
). Ces différences complexifient la relation entre les
changements de taux sérique des HT, y compris ceux induits par
les différences de métabolisme. En outre, les capacités
métaboliques d’une espèce et les différences de sensibilité dues
à l’âge, doivent être prises en considération. En conséquence,
la différence entre espèces quant à la sensibilité à certaines
maladies du développement induites par des modifications des
niveaux d’HT ne peut pas être exclue. ) ont conclu, premièrement, que les
substances induisant des modifications histopathologiques de la
thyroïde (hypertrophie des cellules folliculaires, hyperplasie,
néoplasie...), avec ou sans modification des niveaux circulants
de HT, posent un risque d’insuffisance d’HT chez l’être humain
adulte, ainsi que sur le développement neurologique pré- et
post-natal de sa progéniture. De plus, les substances qui
modifient les niveaux circulants de T3 et/ou T4, sans signes
histopathologiques, présentent une préoccupation potentielle
pour le neurodéveloppement. Finalement, en absence de données
spécifiques sur la substance prouvant le contraire, les êtres
humains et les rongeurs sont considérés comme étant également
sensibles à la perturbation de la thyroïde (y compris dans les
cas où l’induction hépatique est responsable de la clairance
accrue de la HT).
) ont conclu, premièrement, que les
substances induisant des modifications histopathologiques de la
thyroïde (hypertrophie des cellules folliculaires, hyperplasie,
néoplasie...), avec ou sans modification des niveaux circulants
de HT, posent un risque d’insuffisance d’HT chez l’être humain
adulte, ainsi que sur le développement neurologique pré- et
post-natal de sa progéniture. De plus, les substances qui
modifient les niveaux circulants de T3 et/ou T4, sans signes
histopathologiques, présentent une préoccupation potentielle
pour le neurodéveloppement. Finalement, en absence de données
spécifiques sur la substance prouvant le contraire, les êtres
humains et les rongeurs sont considérés comme étant également
sensibles à la perturbation de la thyroïde (y compris dans les
cas où l’induction hépatique est responsable de la clairance
accrue de la HT).Références



































 •
•
































 •
•

















































































 •
•






















 •
•
 •
•






























































→ Aller vers SYNTHESE