Pesticides et effets sur la santé
II. Pathologies cancéreuses
2021
| ANALYSE |
12-
Cancer de la prostate
 ;
Packer et coll., 2016
;
Packer et coll., 2016 ).
).Cancer de la prostate : de l’épidémiologie à la biologie
Incidence et mortalité
 ). Cela pourrait correspondre à la
conjonction de deux phénomènes : la plus grande partie des
cancers avancés ont déjà été diagnostiqués après plusieurs
années de dépistage, et des stratégies plus attentistes de la
part des soignants et de la population vis-à-vis du dépistage
avec la prise de conscience d’un risque de « sur-diagnostic »
(Schröder et coll., 2014
). Cela pourrait correspondre à la
conjonction de deux phénomènes : la plus grande partie des
cancers avancés ont déjà été diagnostiqués après plusieurs
années de dépistage, et des stratégies plus attentistes de la
part des soignants et de la population vis-à-vis du dépistage
avec la prise de conscience d’un risque de « sur-diagnostic »
(Schröder et coll., 2014 ). En France, avec un taux
d’incidence de 81,5 pour 100 000 personnes-années soit environ
50 000 nouveaux cas par an en 2015, le cancer de la prostate est
le plus fréquent, à la fois chez l’homme et dans l’ensemble de
la population (Defossez et coll.,
2019
). En France, avec un taux
d’incidence de 81,5 pour 100 000 personnes-années soit environ
50 000 nouveaux cas par an en 2015, le cancer de la prostate est
le plus fréquent, à la fois chez l’homme et dans l’ensemble de
la population (Defossez et coll.,
2019 ). Il est très rare avant 50 ans et son incidence augmente
progressivement avec l’âge.
). Il est très rare avant 50 ans et son incidence augmente
progressivement avec l’âge. ; Defossez et coll.,
2019
; Defossez et coll.,
2019 ).
). ).
).Étiologie et facteurs de risque
 ).
). ). Il est particulièrement élevé chez
les hommes ayant des ascendants africains subsahariens (quels
que soient les lieux de naissance), et particulièrement faibles
chez les populations asiatiques. Ainsi, aux États-Unis, le taux
d’incidence du cancer de la prostate dans la population
afro-américaine est 1,6 fois plus élevée que dans les autres
populations (respectivement 178,3 et 105,7 pour
100 000 personnes-années dans la population afro-américaine et
caucasienne (Noone et coll.,
2018
). Il est particulièrement élevé chez
les hommes ayant des ascendants africains subsahariens (quels
que soient les lieux de naissance), et particulièrement faibles
chez les populations asiatiques. Ainsi, aux États-Unis, le taux
d’incidence du cancer de la prostate dans la population
afro-américaine est 1,6 fois plus élevée que dans les autres
populations (respectivement 178,3 et 105,7 pour
100 000 personnes-années dans la population afro-américaine et
caucasienne (Noone et coll.,
2018 ). Chez les Caucasiens, le taux d’incidence est intermédiaire
avec néanmoins des variations selon les pays. Ainsi, dans les
pays du Nord de l’Europe, les taux d’incidence sont plus élevés
que dans les pays du Sud de l’Europe. Les populations d’origine
latine du continent américain présentent des taux d’incidence
similaires à ceux observés dans les pays dits latins en Europe.
Si de telles variations peuvent être expliquées en partie par
des différences dans l’accès aux soins, les pratiques médicales
et les politiques publiques en matière de dépistage, il est
maintenant admis que des facteurs génétiques jouent un rôle
déterminant. Ainsi, certains polymorphismes génétiques ont été
associés à un risque individuel accru de cancer de la prostate
et puisque leur fréquence varie selon les origines
ethno-géographiques des populations ils pourraient contribuer à
expliquer les importantes variations d’incidence (Chokkalingam
et coll., 2007
). Chez les Caucasiens, le taux d’incidence est intermédiaire
avec néanmoins des variations selon les pays. Ainsi, dans les
pays du Nord de l’Europe, les taux d’incidence sont plus élevés
que dans les pays du Sud de l’Europe. Les populations d’origine
latine du continent américain présentent des taux d’incidence
similaires à ceux observés dans les pays dits latins en Europe.
Si de telles variations peuvent être expliquées en partie par
des différences dans l’accès aux soins, les pratiques médicales
et les politiques publiques en matière de dépistage, il est
maintenant admis que des facteurs génétiques jouent un rôle
déterminant. Ainsi, certains polymorphismes génétiques ont été
associés à un risque individuel accru de cancer de la prostate
et puisque leur fréquence varie selon les origines
ethno-géographiques des populations ils pourraient contribuer à
expliquer les importantes variations d’incidence (Chokkalingam
et coll., 2007 ; Rebbeck,
2018
; Rebbeck,
2018 ). Certains polymorphismes sont spécifiques des populations
d’ascendance africaine confirmant le rôle de la variation de la
lignée germinale spécifiquement liée à l’ascendance, dans la
contribution aux différences de population dans le risque de
cancer de la prostate (Conti et coll.,
2017
). Certains polymorphismes sont spécifiques des populations
d’ascendance africaine confirmant le rôle de la variation de la
lignée germinale spécifiquement liée à l’ascendance, dans la
contribution aux différences de population dans le risque de
cancer de la prostate (Conti et coll.,
2017 ).
). ; Bonkhoff, 2018
; Bonkhoff, 2018 ).
). ). Le rôle de divers facteurs
nutritionnels, associés négativement (lycopènes, vitamine D,
vitamine E, sélénium) ou positivement (calcium alimentaire) au
risque de survenue de cancer de la prostate est encore très
controversé (Pernar et coll.,
2018
). Le rôle de divers facteurs
nutritionnels, associés négativement (lycopènes, vitamine D,
vitamine E, sélénium) ou positivement (calcium alimentaire) au
risque de survenue de cancer de la prostate est encore très
controversé (Pernar et coll.,
2018 ). L’exposition à des xénobiotiques environnementaux, dont les
pesticides, a été également évoquée. Une attention a été portée
sur les xénobiotiques possédant des propriétés hormonales
(perturbateurs endocriniens) et divers travaux expérimentaux
soutiennent l’hypothèse d’une influence délétère en favorisant
le développement tumoral au sein du tissu prostatique (Prins,
2008
). L’exposition à des xénobiotiques environnementaux, dont les
pesticides, a été également évoquée. Une attention a été portée
sur les xénobiotiques possédant des propriétés hormonales
(perturbateurs endocriniens) et divers travaux expérimentaux
soutiennent l’hypothèse d’une influence délétère en favorisant
le développement tumoral au sein du tissu prostatique (Prins,
2008 ; Diamanti-Kandarakis et coll.,
2009
; Diamanti-Kandarakis et coll.,
2009 ).
).Histoire naturelle, agressivité et hétérogénéité du cancer de la prostate
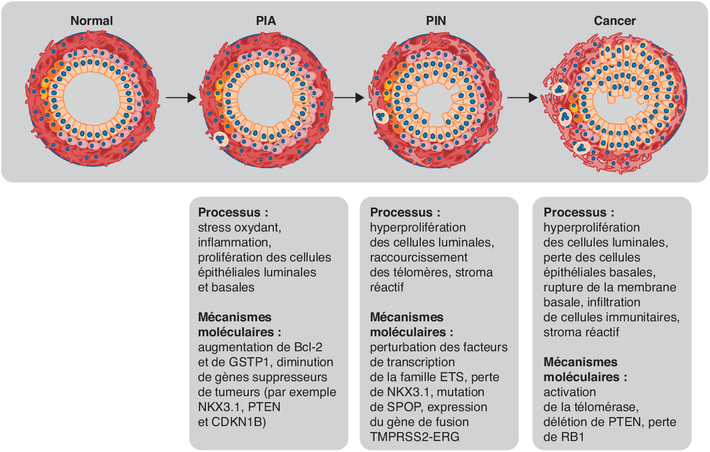
 ) (figure 12.1
) (figure 12.1 ).
). ).
). ).
). ; Figiel et coll.,
2017
; Figiel et coll.,
2017 ). Cela explique l’intérêt croissant qui est porté aux formes
agressives dans les études épidémiologiques visant à identifier
des facteurs de risque, modifiables et non modifiables. Dans le
cadre des études mécanistiques, le rôle particulier du
microenvironnement tumoral (par exemple fibroblastes ou
adipocytes sécrétant à la fois des cytokines pro-inflammatoires,
pro-migratoires ou des exosomes modifiant l’expression génique
des tumeurs) est de plus en plus souvent évoqué (Nawaz et coll.,
2014
). Cela explique l’intérêt croissant qui est porté aux formes
agressives dans les études épidémiologiques visant à identifier
des facteurs de risque, modifiables et non modifiables. Dans le
cadre des études mécanistiques, le rôle particulier du
microenvironnement tumoral (par exemple fibroblastes ou
adipocytes sécrétant à la fois des cytokines pro-inflammatoires,
pro-migratoires ou des exosomes modifiant l’expression génique
des tumeurs) est de plus en plus souvent évoqué (Nawaz et coll.,
2014 ; Shiao et coll., 2016
; Shiao et coll., 2016 ; Nassar et coll.,
2018
; Nassar et coll.,
2018 ).
). ; Marusyk et coll.,
2012
; Marusyk et coll.,
2012 ; Meacham et Morrison, 2013
; Meacham et Morrison, 2013 ). La connaissance de cette
hétérogénéité intra-tumorale et inter-métastases a ouvert la
voie à la médecine personnalisée ou médecine de précision, en
relation avec les thérapeutiques ciblées qui sont développées
depuis une vingtaine d’années. Récemment, cette hétérogénéité
tumorale a été retrouvée sur des biopsies de tumeurs de la
prostate (Boutros et coll.,
2015
). La connaissance de cette
hétérogénéité intra-tumorale et inter-métastases a ouvert la
voie à la médecine personnalisée ou médecine de précision, en
relation avec les thérapeutiques ciblées qui sont développées
depuis une vingtaine d’années. Récemment, cette hétérogénéité
tumorale a été retrouvée sur des biopsies de tumeurs de la
prostate (Boutros et coll.,
2015 ).
). | Figure 12.1 Évolution du tissu prostatique au cours de la
cancérogenèse (d’après Packer et coll.,
2016 ) ) |
Mécanismes biologiques à l’origine du
développement du cancer
de la prostate
 ; Banerjee et coll., 2000
; Banerjee et coll., 2000 ; Taplin et Ho,
2001
; Taplin et Ho,
2001 ). Il a été donc tout à fait légitime d’associer l’activation
du récepteur aux androgènes (AR) à la survenue et à la
progression du cancer de la prostate. Cette activation est
intimement liée à la concentration locale d’androgènes et donc à
leur métabolisme et notamment à leur conversion en œstrogènes
par l’aromatase ou CYP19 (figure 12.2
). Il a été donc tout à fait légitime d’associer l’activation
du récepteur aux androgènes (AR) à la survenue et à la
progression du cancer de la prostate. Cette activation est
intimement liée à la concentration locale d’androgènes et donc à
leur métabolisme et notamment à leur conversion en œstrogènes
par l’aromatase ou CYP19 (figure 12.2 ).
). ; Nelles et coll., 2011
; Nelles et coll., 2011 ). Une étude a aussi montré des
associations entre certains polymorphismes fonctionnels de gènes
codant l’aromatase et le CYP1B1 (enzyme du métabolisme des
xénobiotiques qui catalyse l’hydroxylation de l’œstradiol,
inactivant ce dernier mais produisant un dérivé génotoxique
appelé catéchol) et le risque de survenue de cancer de la
prostate (Cussenot et coll.,
2007
). Une étude a aussi montré des
associations entre certains polymorphismes fonctionnels de gènes
codant l’aromatase et le CYP1B1 (enzyme du métabolisme des
xénobiotiques qui catalyse l’hydroxylation de l’œstradiol,
inactivant ce dernier mais produisant un dérivé génotoxique
appelé catéchol) et le risque de survenue de cancer de la
prostate (Cussenot et coll.,
2007 ).
). ). Ainsi, ceux-ci interfèrent avec la
production d’androgènes i) par la répression de l’axe
hypothalamo-hypophyso-gonadique ; ii) par action directe
sur les testicules. Un rôle indirect est également évoqué pour
les œstrogènes dans la régulation de la prostate via la
voie de la prolactine. Les œstrogènes ont aussi des effets
directs sur la prostate, qui peuvent être provoqués par une
hormone externe ou par l’œstradiol produit par une aromatisation
locale de la testostérone.
). Ainsi, ceux-ci interfèrent avec la
production d’androgènes i) par la répression de l’axe
hypothalamo-hypophyso-gonadique ; ii) par action directe
sur les testicules. Un rôle indirect est également évoqué pour
les œstrogènes dans la régulation de la prostate via la
voie de la prolactine. Les œstrogènes ont aussi des effets
directs sur la prostate, qui peuvent être provoqués par une
hormone externe ou par l’œstradiol produit par une aromatisation
locale de la testostérone. ; Prezioso et coll., 2007
; Prezioso et coll., 2007 ).
). ).
). ). Le rôle du récepteur ERα est démontré chez des souris
knock out4
invalidées pour ce récepteur dans le processus
de cancérogénèse induite par une exposition testostérone +
œstradiol (Ricke et coll., 2008
). Le rôle du récepteur ERα est démontré chez des souris
knock out4
invalidées pour ce récepteur dans le processus
de cancérogénèse induite par une exposition testostérone +
œstradiol (Ricke et coll., 2008 ). En revanche, ERβ, qui fixe
préférentiellement les phyto-œstrogènes, jouerait un rôle de
protection de l’épithélium prostatique dans le processus de
transformation maligne (Bonkhoff et Berges,
2009
). En revanche, ERβ, qui fixe
préférentiellement les phyto-œstrogènes, jouerait un rôle de
protection de l’épithélium prostatique dans le processus de
transformation maligne (Bonkhoff et Berges,
2009 ).
). ).
). ). Une surexpression de c-FLIP est retrouvée par exemple, dans
des tissus tumoraux humains issus de prostatectomie (Gao et
coll., 2005
). Une surexpression de c-FLIP est retrouvée par exemple, dans
des tissus tumoraux humains issus de prostatectomie (Gao et
coll., 2005 ).
). ) suggérant l’implication de cytokines ; ainsi,
l’interleukine 6 (IL-6) favorise à la fois l’activation de STAT3
(Signal transducer and activator of transcription 3),
un facteur de transcription intervenant dans l’inflammation et
bloquant l’apoptose, et l’interaction entre le AR et ses
co-activateurs (SRC-1 et SMRT), et ainsi la transcription de
gènes AR-dépendants (comme celui du PSA), à l’origine de la
division des cellules prostatiques (Wang et coll.,
2016a
) suggérant l’implication de cytokines ; ainsi,
l’interleukine 6 (IL-6) favorise à la fois l’activation de STAT3
(Signal transducer and activator of transcription 3),
un facteur de transcription intervenant dans l’inflammation et
bloquant l’apoptose, et l’interaction entre le AR et ses
co-activateurs (SRC-1 et SMRT), et ainsi la transcription de
gènes AR-dépendants (comme celui du PSA), à l’origine de la
division des cellules prostatiques (Wang et coll.,
2016a ).
). ).
).Modèles d’étude expérimentaux
 ). Ces modèles sont particulièrement
résistants au développement métastatique et la maladie est donc
différente de celle observée chez l’homme. Cependant, les
modèles murins fournissent des informations sur la progression
tumorale lors d’implantation in situ de xénogreffes
humaines (Grabowska et coll.,
2014
). Ces modèles sont particulièrement
résistants au développement métastatique et la maladie est donc
différente de celle observée chez l’homme. Cependant, les
modèles murins fournissent des informations sur la progression
tumorale lors d’implantation in situ de xénogreffes
humaines (Grabowska et coll.,
2014 ). L’alternative à l’utilisation de la souris est représentée
par les lignées cellulaires cancéreuses prostatiques humaines
(par exemple DU-145, PC-3, LNCaP, VCaP). Cependant, ces modèles
cellulaires ne sont pas soumis au contrôle paracrine complexe du
microenvironnement tumoral. Le développement de modèles en
3 dimensions (3D) permet d’obtenir des informations plus proches
de la physiologie tissulaire et les effets des toxiques sont
généralement plus prédictifs en comparaison des cellules
cultivées en 2 dimensions (2D). Le modèle 3D peut aussi faire
intervenir des cellules d’origines différentes, par exemple
cellules tumorales et pré-adipocytes (modèles mixtes 3D). Enfin,
il est possible de produire, pour certains tissus, des
organoïdes à partir de cellules souches cultivées en condition
de différenciation (par exemple pour l’intestin normal et
pathologique) ou bien à partir de cellules tumorales. La
production d’organoïdes construits à partir des lignées LNCaP et
C4-2B a été récemment rapportée (Ma et coll.,
2017
). L’alternative à l’utilisation de la souris est représentée
par les lignées cellulaires cancéreuses prostatiques humaines
(par exemple DU-145, PC-3, LNCaP, VCaP). Cependant, ces modèles
cellulaires ne sont pas soumis au contrôle paracrine complexe du
microenvironnement tumoral. Le développement de modèles en
3 dimensions (3D) permet d’obtenir des informations plus proches
de la physiologie tissulaire et les effets des toxiques sont
généralement plus prédictifs en comparaison des cellules
cultivées en 2 dimensions (2D). Le modèle 3D peut aussi faire
intervenir des cellules d’origines différentes, par exemple
cellules tumorales et pré-adipocytes (modèles mixtes 3D). Enfin,
il est possible de produire, pour certains tissus, des
organoïdes à partir de cellules souches cultivées en condition
de différenciation (par exemple pour l’intestin normal et
pathologique) ou bien à partir de cellules tumorales. La
production d’organoïdes construits à partir des lignées LNCaP et
C4-2B a été récemment rapportée (Ma et coll.,
2017 ) et ils constituent des perspectives d’avenir pour étudier le
dialogue complexe tumeur-microenvironnement.
) et ils constituent des perspectives d’avenir pour étudier le
dialogue complexe tumeur-microenvironnement.Pesticides et cancer de la prostate : données épidémiologiques
Résumé de l’expertise collective Inserm de 2013
Nouvelles données épidémiologiques
Méta-analyses et cohortes en exposition professionnelle agricole aux pesticides
 ). Ces études comprenaient au
total 3 978 cas (incidents ou prévalents) et 7 393 témoins
chez lesquels les expositions ont été estimées de manière
indirecte, principalement par des questionnaires. Cette
méta-analyse ne rassemble pas cependant toutes les études
existant aujourd’hui et les critères de sélection des études
ne sont pas clairement explicités. L’activité
professionnelle en milieu agricole était associée à un
risque augmenté de cancer de la prostate (méta OR = 3,83 ;
IC 95 % [1,96-7,48]) dans les études où les témoins étaient
porteurs d’une hypertrophie bénigne de la prostate. Un excès
de risque a également été retrouvé dans les études où les
témoins ne présentaient aucune pathologie prostatique (méta
OR = 1,38 ; IC 95 % [1,16-1,64]). La différence dans
l’intensité de risque en fonction du choix des témoins
pourrait être due au fait que les sujets témoins avec
hypertrophie bénigne de la prostate ont fait l’objet d’une
attention particulière pour exclure un cancer de la prostate
(par exemple, examen histologique de la pièce de résection).
Une analyse portant sur l’utilisation de pesticides dans le
secteur agricole, incluant 5 des 12 études initiales et
restreinte à 269 cas et 535 témoins, ne précisant ni la
durée d’emploi ni la nature des matières actives, a montré
une association inverse entre l’utilisation de pesticides et
le risque de cancer de la prostate (méta OR = 0,68 ;
IC 95 % [0,49-0,96]). Les auteurs suggèrent que les témoins
inclus dans cette analyse pourraient avoir été également
exposés aux pesticides. Ils s’appuient sur les observations
d’une étude antérieure (Sharpe et coll.,
2001
). Ces études comprenaient au
total 3 978 cas (incidents ou prévalents) et 7 393 témoins
chez lesquels les expositions ont été estimées de manière
indirecte, principalement par des questionnaires. Cette
méta-analyse ne rassemble pas cependant toutes les études
existant aujourd’hui et les critères de sélection des études
ne sont pas clairement explicités. L’activité
professionnelle en milieu agricole était associée à un
risque augmenté de cancer de la prostate (méta OR = 3,83 ;
IC 95 % [1,96-7,48]) dans les études où les témoins étaient
porteurs d’une hypertrophie bénigne de la prostate. Un excès
de risque a également été retrouvé dans les études où les
témoins ne présentaient aucune pathologie prostatique (méta
OR = 1,38 ; IC 95 % [1,16-1,64]). La différence dans
l’intensité de risque en fonction du choix des témoins
pourrait être due au fait que les sujets témoins avec
hypertrophie bénigne de la prostate ont fait l’objet d’une
attention particulière pour exclure un cancer de la prostate
(par exemple, examen histologique de la pièce de résection).
Une analyse portant sur l’utilisation de pesticides dans le
secteur agricole, incluant 5 des 12 études initiales et
restreinte à 269 cas et 535 témoins, ne précisant ni la
durée d’emploi ni la nature des matières actives, a montré
une association inverse entre l’utilisation de pesticides et
le risque de cancer de la prostate (méta OR = 0,68 ;
IC 95 % [0,49-0,96]). Les auteurs suggèrent que les témoins
inclus dans cette analyse pourraient avoir été également
exposés aux pesticides. Ils s’appuient sur les observations
d’une étude antérieure (Sharpe et coll.,
2001 ), où l’usage de pesticides dans
des activités de loisirs (bricolage, jardinage...) a été
associé à un risque augmenté de survenue de cancer de la
prostate.
), où l’usage de pesticides dans
des activités de loisirs (bricolage, jardinage...) a été
associé à un risque augmenté de survenue de cancer de la
prostate. ) a analysé, suite à une
recherche exhaustive de la littérature et une procédure de
sélection bien argumentée, 25 études de type cas-témoins et
4 cohortes publiées entre 1985 et 2014. L’exposition aux
pesticides (en population générale ou professionnelle) a été
retrouvée associée à un excès de risque de cancer de la
prostate (méta OR = 1,33 ; IC 95 % [1,02-1,63]).
) a analysé, suite à une
recherche exhaustive de la littérature et une procédure de
sélection bien argumentée, 25 études de type cas-témoins et
4 cohortes publiées entre 1985 et 2014. L’exposition aux
pesticides (en population générale ou professionnelle) a été
retrouvée associée à un excès de risque de cancer de la
prostate (méta OR = 1,33 ; IC 95 % [1,02-1,63]). ). Ce SIR élevé était présent
chez ceux qui exerçaient une activité professionnelle dans
une exploitation agricole (1,07 ; [1,03-1,12]) et non chez
ceux qui exerçaient une activité professionnelle hors
exploitation agricole (0,97 ; [0,84-1,11]). Parmi les
travailleurs dans les exploitations agricoles, un SIR élevé
a été observé chez les salariés (1,17 ; [1,09-1,26]) et non
chez les exploitants (1,02 ; [0,97-1,08]). Toujours parmi
les travailleurs des exploitations agricoles, un SIR élevé a
été constaté autant chez les utilisateurs (1,09 ;
[1,03-1,15]) que chez les non-utilisateurs de pesticides
(1,27 ; [1,06-1,50]). Parmi les différentes formes
d’utilisation de pesticides, certaines ne présentaient pas
de SIR élevé (0,85 ; [0,71-1,02]), notamment lorsqu’il
s’agissait d’usage d’insecticides dans les élevages ou des
herbicides pour le nettoyage des cours, allées, talus de
l’exploitation.
). Ce SIR élevé était présent
chez ceux qui exerçaient une activité professionnelle dans
une exploitation agricole (1,07 ; [1,03-1,12]) et non chez
ceux qui exerçaient une activité professionnelle hors
exploitation agricole (0,97 ; [0,84-1,11]). Parmi les
travailleurs dans les exploitations agricoles, un SIR élevé
a été observé chez les salariés (1,17 ; [1,09-1,26]) et non
chez les exploitants (1,02 ; [0,97-1,08]). Toujours parmi
les travailleurs des exploitations agricoles, un SIR élevé a
été constaté autant chez les utilisateurs (1,09 ;
[1,03-1,15]) que chez les non-utilisateurs de pesticides
(1,27 ; [1,06-1,50]). Parmi les différentes formes
d’utilisation de pesticides, certaines ne présentaient pas
de SIR élevé (0,85 ; [0,71-1,02]), notamment lorsqu’il
s’agissait d’usage d’insecticides dans les élevages ou des
herbicides pour le nettoyage des cours, allées, talus de
l’exploitation. ). Au total, 1 672 cas incidents
de cancer de la prostate sont survenus jusqu’au
31 décembre 2009. Les risques ont été calculés par des
analyses de survie (modèle de Cox) permettant d’estimer le
rapport des risques instantanés (HR, Hazard Ratio).
L’activité sur une ferme, sans préjuger de l’exposition aux
pesticides (n = 71 388) n’était pas associée de manière
globale à un excès de risque de survenue de cancer de la
prostate par comparaison avec les participants n’ayant pas
travaillé sur une ferme (groupe de référence, n = 10 573)
(HR = 1,05 ; IC 95 % [0,89-1,24]). Ce groupe de comparaison
comportait des personnes affiliées à la Mutualité sociale
agricole pour des activités telles que les métiers du
paysage et des espaces verts, du bois et de la forêt, de la
pêche et de l’ostréiculture, les coopératives agricoles, les
métiers tertiaires agricoles de l’enseignement, de
l’administration ou de la banque...
). Au total, 1 672 cas incidents
de cancer de la prostate sont survenus jusqu’au
31 décembre 2009. Les risques ont été calculés par des
analyses de survie (modèle de Cox) permettant d’estimer le
rapport des risques instantanés (HR, Hazard Ratio).
L’activité sur une ferme, sans préjuger de l’exposition aux
pesticides (n = 71 388) n’était pas associée de manière
globale à un excès de risque de survenue de cancer de la
prostate par comparaison avec les participants n’ayant pas
travaillé sur une ferme (groupe de référence, n = 10 573)
(HR = 1,05 ; IC 95 % [0,89-1,24]). Ce groupe de comparaison
comportait des personnes affiliées à la Mutualité sociale
agricole pour des activités telles que les métiers du
paysage et des espaces verts, du bois et de la forêt, de la
pêche et de l’ostréiculture, les coopératives agricoles, les
métiers tertiaires agricoles de l’enseignement, de
l’administration ou de la banque... ). Cet excès de risque a été
également constaté parmi les exploitants agricoles (1,12 ;
[1,07-1,17]) et à la limite de la significativité
statistique chez les ouvriers agricoles (1,08 ;
[0,99-1,17]). Quant aux secteurs professionnels, les hommes
travaillant dans l’élevage présentaient un excès de risque
(1,26 ; [1,03-1,55]) mais pas ceux travaillant dans les
cultures. Aucune information n’a été apportée concernant
l’emploi de pesticides.
). Cet excès de risque a été
également constaté parmi les exploitants agricoles (1,12 ;
[1,07-1,17]) et à la limite de la significativité
statistique chez les ouvriers agricoles (1,08 ;
[0,99-1,17]). Quant aux secteurs professionnels, les hommes
travaillant dans l’élevage présentaient un excès de risque
(1,26 ; [1,03-1,55]) mais pas ceux travaillant dans les
cultures. Aucune information n’a été apportée concernant
l’emploi de pesticides. ), ont publié une analyse cas
prévalents (n = 114) – témoins (n = 2 824) nichée dans la
cohorte canadienne Saskatchewan Rural Health Study
menée parmi des populations vivant en milieu rural. La
résidence sur une exploitation agricole et l’usage combiné
d’insecticides et de fongicides dans une activité agricole
étaient associés à un excès de risque de cancer de la
prostate (OR = 1,86 ; IC 95 % [1,07-3,25] et 2,06 ;
IC 95 % [1,15-3,69] avec le modèle statistique employé pour
la résidence sur une exploitation agricole, et 2,23 ;
[1,15-4,33] et 2,37 ; [1,19-4,71] avec le modèle statistique
pour l’usage combiné d’insecticides et fongicides). Aucune
information n’était apportée concernant les familles
chimiques ou les matières actives employées.
), ont publié une analyse cas
prévalents (n = 114) – témoins (n = 2 824) nichée dans la
cohorte canadienne Saskatchewan Rural Health Study
menée parmi des populations vivant en milieu rural. La
résidence sur une exploitation agricole et l’usage combiné
d’insecticides et de fongicides dans une activité agricole
étaient associés à un excès de risque de cancer de la
prostate (OR = 1,86 ; IC 95 % [1,07-3,25] et 2,06 ;
IC 95 % [1,15-3,69] avec le modèle statistique employé pour
la résidence sur une exploitation agricole, et 2,23 ;
[1,15-4,33] et 2,37 ; [1,19-4,71] avec le modèle statistique
pour l’usage combiné d’insecticides et fongicides). Aucune
information n’était apportée concernant les familles
chimiques ou les matières actives employées.Études spécifiques de familles de substances ou de substances actives
Organochlorés
 ) a montré que la présence de
DDE (dichlorodiphényldichloroéthylène) dans le sang
(métabolite persistant du DDT –
dichlorodiphényltrichloroéthane) était positivement
associée à un risque accru de survenue du cancer de la
prostate (OR = 1,53 ; IC 95 % [1,02,-2,30] pour le
5e quintile d’exposition comparé au
premier quintile d’exposition avec une relation
dose-effet linéaire significative, p de
tendance = 0,01). Ces résultats ont tenu compte de
l’exposition au chlordécone et aux PCB. En Corée du Sud,
une analyse cas-cohorte au sein de la Korean Cancer
Prevention Study-II conduite en population
générale et sur un suivi compris entre 7,6 et
18,6 années, a comparé 110 cas de cancer de la prostate
identifiés en interrogeant le registre national des
cancers à 256 témoins (Lim et coll.,
2017
) a montré que la présence de
DDE (dichlorodiphényldichloroéthylène) dans le sang
(métabolite persistant du DDT –
dichlorodiphényltrichloroéthane) était positivement
associée à un risque accru de survenue du cancer de la
prostate (OR = 1,53 ; IC 95 % [1,02,-2,30] pour le
5e quintile d’exposition comparé au
premier quintile d’exposition avec une relation
dose-effet linéaire significative, p de
tendance = 0,01). Ces résultats ont tenu compte de
l’exposition au chlordécone et aux PCB. En Corée du Sud,
une analyse cas-cohorte au sein de la Korean Cancer
Prevention Study-II conduite en population
générale et sur un suivi compris entre 7,6 et
18,6 années, a comparé 110 cas de cancer de la prostate
identifiés en interrogeant le registre national des
cancers à 256 témoins (Lim et coll.,
2017 ). Pour tous, un prélèvement
de sang a été obtenu à l’inclusion dans la cohorte
permettant le dosage de 19 pesticides organochlorés,
molécules mères, isomères ou métabolites (oxychlordane,
nonachlore chlordane, heptachlore, heptachlore époxyde,
hexachlorobenzène, hexachlorocyclohexanes, DDT, DDD –
dichlorodiphényldichloroéthane – et DDE). Seul le
trans-nonachlore était positivement associé,
à la limite de la signification statistique, au risque
de survenue de cancer de la prostate (HR = 1,60 ;
[0,99-2,58] ; exposition transformée en logarithme de
base 10). Dans une étude cas incidents (n = 60) –
témoins hospitaliers (n = 60) à Singapour, des
pesticides organochlorés ont été dosés dans le sang
(isomères de l’hexachlorocyclohexane, heptachlor
époxyde, α-endosulfan, DDT, DDD, DDE, hexachlorobenzène,
chlordécone) (Pi et coll.,
2016
). Pour tous, un prélèvement
de sang a été obtenu à l’inclusion dans la cohorte
permettant le dosage de 19 pesticides organochlorés,
molécules mères, isomères ou métabolites (oxychlordane,
nonachlore chlordane, heptachlore, heptachlore époxyde,
hexachlorobenzène, hexachlorocyclohexanes, DDT, DDD –
dichlorodiphényldichloroéthane – et DDE). Seul le
trans-nonachlore était positivement associé,
à la limite de la signification statistique, au risque
de survenue de cancer de la prostate (HR = 1,60 ;
[0,99-2,58] ; exposition transformée en logarithme de
base 10). Dans une étude cas incidents (n = 60) –
témoins hospitaliers (n = 60) à Singapour, des
pesticides organochlorés ont été dosés dans le sang
(isomères de l’hexachlorocyclohexane, heptachlor
époxyde, α-endosulfan, DDT, DDD, DDE, hexachlorobenzène,
chlordécone) (Pi et coll.,
2016 ). Les auteurs rapportent des
associations positives avec le DDT et ses métabolites
pour le 3e tercile d’exposition mais avec
parfois des associations négatives pour d’autres
terciles. Les résultats de cette étude sont
difficilement interprétables compte tenu des faibles
effectifs. Au cours d’une communication dans un congrès
et n’ayant pas encore fait l’objet de publication dans
une revue à comité de lecture (Lemarchand et coll.,
2016b
). Les auteurs rapportent des
associations positives avec le DDT et ses métabolites
pour le 3e tercile d’exposition mais avec
parfois des associations négatives pour d’autres
terciles. Les résultats de cette étude sont
difficilement interprétables compte tenu des faibles
effectifs. Au cours d’une communication dans un congrès
et n’ayant pas encore fait l’objet de publication dans
une revue à comité de lecture (Lemarchand et coll.,
2016b ), une analyse portant sur
1 672 cas de cancer de la prostate de la cohorte
AGRICAN, en utilisant la matrice emploi-exposition
PESTIMAT (Baldi et coll.,
2017
), une analyse portant sur
1 672 cas de cancer de la prostate de la cohorte
AGRICAN, en utilisant la matrice emploi-exposition
PESTIMAT (Baldi et coll.,
2017 ), a rapporté une augmentation
du risque de survenue de cancer de la prostate, à la
limite de la signification statistique, chez les sujets
exposés à la famille des pesticides organochlorés
(HR = 1,15 ; IC 95 % [0,99-1,32]). En individualisant
les matières actives organochlorées (18 au total), des
associations positives ont été observées, y compris avec
leur durée d’utilisation, pour 6 d’entre elles :
aldrine, chlordane, dieldrine, DDD, toxaphène et
hexachlorocyclohexane technique (mélange d’isomères,
principalement α, β et γ). Dans un modèle statistique
prenant en compte simultanément ces 6 matières actives,
les associations se maintenaient pour le DDD et
l’hexachlorocyclohexane.
), a rapporté une augmentation
du risque de survenue de cancer de la prostate, à la
limite de la signification statistique, chez les sujets
exposés à la famille des pesticides organochlorés
(HR = 1,15 ; IC 95 % [0,99-1,32]). En individualisant
les matières actives organochlorées (18 au total), des
associations positives ont été observées, y compris avec
leur durée d’utilisation, pour 6 d’entre elles :
aldrine, chlordane, dieldrine, DDD, toxaphène et
hexachlorocyclohexane technique (mélange d’isomères,
principalement α, β et γ). Dans un modèle statistique
prenant en compte simultanément ces 6 matières actives,
les associations se maintenaient pour le DDD et
l’hexachlorocyclohexane.
 ), rapporte une association
positive chez les agriculteurs qui présentaient une
forme agressive au diagnostic pour l’aldrine,
RR = 1,49 ; IC 95 % [1,03-2,18]) pour le
4e quartile d’exposition comparé au groupe
non exposé de référence, avec une relation dose-effet
croissante, p de tendance = 0,02 (voir discussion sur
les limites de l’étude dans le paragraphe sur les
organophosphorés ci-dessous).
), rapporte une association
positive chez les agriculteurs qui présentaient une
forme agressive au diagnostic pour l’aldrine,
RR = 1,49 ; IC 95 % [1,03-2,18]) pour le
4e quartile d’exposition comparé au groupe
non exposé de référence, avec une relation dose-effet
croissante, p de tendance = 0,02 (voir discussion sur
les limites de l’étude dans le paragraphe sur les
organophosphorés ci-dessous).Organophosphorés
 ). Lors d’un suivi ultérieur
de la cohorte, jusqu’en 2010 ou 2011, selon l’État de
résidence des participants, portant sur 995 cas
incidents, les auteurs n’observent toujours pas
d’association significative (Jones et coll.,
2015
). Lors d’un suivi ultérieur
de la cohorte, jusqu’en 2010 ou 2011, selon l’État de
résidence des participants, portant sur 995 cas
incidents, les auteurs n’observent toujours pas
d’association significative (Jones et coll.,
2015 ). Néanmoins, ils
rapportaient un risque élevé mais non significatif de
survenue de formes agressives de cancer de la prostate
(n = 505, 50,7 % de l’ensemble des cancers de la
prostate) pour le 3e tercile d’exposition
(estimée par un indicateur composite comprenant la durée
et l’intensité d’exposition) comparé au groupe non
exposé (RR = 1,39 ; IC 95 % [0,97-2,01]). L’analyse
portant sur les formes agressives a utilisé comme groupe
de référence les témoins n’ayant pas de cancer
diagnostiqué. Le pourcentage de formes agressives au
diagnostic est très élevé par rapport à l’ensemble des
cas. Les auteurs n’apportent pas d’interprétation à ce
pourcentage élevé si ce n’est la diversité de critères
employés pour définir l’agressivité (explicités par
Koutros et coll., 2013a
). Néanmoins, ils
rapportaient un risque élevé mais non significatif de
survenue de formes agressives de cancer de la prostate
(n = 505, 50,7 % de l’ensemble des cancers de la
prostate) pour le 3e tercile d’exposition
(estimée par un indicateur composite comprenant la durée
et l’intensité d’exposition) comparé au groupe non
exposé (RR = 1,39 ; IC 95 % [0,97-2,01]). L’analyse
portant sur les formes agressives a utilisé comme groupe
de référence les témoins n’ayant pas de cancer
diagnostiqué. Le pourcentage de formes agressives au
diagnostic est très élevé par rapport à l’ensemble des
cas. Les auteurs n’apportent pas d’interprétation à ce
pourcentage élevé si ce n’est la diversité de critères
employés pour définir l’agressivité (explicités par
Koutros et coll., 2013a ).
). ). Lors d’un suivi ultérieur
jusqu’en 2007 portant sur 1 681 cas, cette association
n’a pu être confirmée. Cependant, une association a été
observée chez les sujets porteurs d’une forme agressive
au diagnostic avec comme groupe de référence les sujets
sans cancer de la prostate (n = 787, 47,3 % de
l’ensemble des cancers de la prostate) (RR = 1,29 ;
IC 95 % [1,02-1,64] pour le 4e quartile
d’exposition comparé au groupe non exposé de référence,
avec une relation dose-effet croissante, p = 0,03)
(Koutros et coll.,
2013a
). Lors d’un suivi ultérieur
jusqu’en 2007 portant sur 1 681 cas, cette association
n’a pu être confirmée. Cependant, une association a été
observée chez les sujets porteurs d’une forme agressive
au diagnostic avec comme groupe de référence les sujets
sans cancer de la prostate (n = 787, 47,3 % de
l’ensemble des cancers de la prostate) (RR = 1,29 ;
IC 95 % [1,02-1,64] pour le 4e quartile
d’exposition comparé au groupe non exposé de référence,
avec une relation dose-effet croissante, p = 0,03)
(Koutros et coll.,
2013a ). Mais en absence d’analyses
de l’hétérogénéité, il n’est pas possible d’affirmer que
ces associations sont spécifiques des formes agressives.
Ici encore, l’analyse portant sur les formes agressives
a utilisé comme groupe de référence les témoins sans
cancer. Pour d’autres insecticides organophosphorés
(fonofos et malathion), ces mêmes auteurs ont également
montré, en utilisant comme groupe de comparaison les
sujets sans cancer, une absence d’association avec la
survenue globale du cancer de la prostate mais des
associations positives chez ceux qui présentaient une
forme agressive au diagnostic (pour le fonofos,
RR = 1,63 ; IC 95 % [1,22-2,17] pour le
4e quartile d’exposition comparé au groupe
non exposé de référence, avec une relation dose-effet
croissante, p < 0,001 et pour le malathion,
RR = 1,43 ; IC 95 % [1,08-1,88] pour le
4e quartile d’exposition comparé au groupe
non exposé de référence, avec une relation dose-effet
croissante, p = 0,02). Notons que pour le fonofos, une
étude antérieure au sein de la cohorte avait rapporté
une association positive avec le risque de survenue de
la maladie chez les sujets déclarant un antécédent
familial au 1er degré de cancer de la
prostate (Mahajan et coll.,
2006a
). Mais en absence d’analyses
de l’hétérogénéité, il n’est pas possible d’affirmer que
ces associations sont spécifiques des formes agressives.
Ici encore, l’analyse portant sur les formes agressives
a utilisé comme groupe de référence les témoins sans
cancer. Pour d’autres insecticides organophosphorés
(fonofos et malathion), ces mêmes auteurs ont également
montré, en utilisant comme groupe de comparaison les
sujets sans cancer, une absence d’association avec la
survenue globale du cancer de la prostate mais des
associations positives chez ceux qui présentaient une
forme agressive au diagnostic (pour le fonofos,
RR = 1,63 ; IC 95 % [1,22-2,17] pour le
4e quartile d’exposition comparé au groupe
non exposé de référence, avec une relation dose-effet
croissante, p < 0,001 et pour le malathion,
RR = 1,43 ; IC 95 % [1,08-1,88] pour le
4e quartile d’exposition comparé au groupe
non exposé de référence, avec une relation dose-effet
croissante, p = 0,02). Notons que pour le fonofos, une
étude antérieure au sein de la cohorte avait rapporté
une association positive avec le risque de survenue de
la maladie chez les sujets déclarant un antécédent
familial au 1er degré de cancer de la
prostate (Mahajan et coll.,
2006a ).
).Herbicides
 ). Lors d’un suivi ultérieur
de la cohorte, jusqu’en 2012 ou 2013, selon l’État de
résidence des participants, portant sur 2 844 cas
incidents, aucune association n’a été observée avec le
risque de survenue de la maladie (Andreotti et coll.,
2018
). Lors d’un suivi ultérieur
de la cohorte, jusqu’en 2012 ou 2013, selon l’État de
résidence des participants, portant sur 2 844 cas
incidents, aucune association n’a été observée avec le
risque de survenue de la maladie (Andreotti et coll.,
2018 ). Finalement, au sein de la
cohorte AHS, aucune association avec la survenue du
cancer de la prostate n’a été observée concernant
l’exposition à des herbicides appartenant à la famille
de chloroacétamides tels que l’acétochlore (Lerro et
coll., 2015
). Finalement, au sein de la
cohorte AHS, aucune association avec la survenue du
cancer de la prostate n’a été observée concernant
l’exposition à des herbicides appartenant à la famille
de chloroacétamides tels que l’acétochlore (Lerro et
coll., 2015 ), le métolachlore (Silver et
coll., 2015
), le métolachlore (Silver et
coll., 2015 ) et l’alachlore (Lerro et
coll., 2018
) et l’alachlore (Lerro et
coll., 2018 ). Les auteurs de ces
différents travaux n’ont pas étudié le rôle des
antécédents familiaux de cancer de la prostate ni celui
des caractéristiques d’agressivité de la maladie, sauf
dans le cas de l’alachlore pour lequel aucune
association n’a été retrouvée.
). Les auteurs de ces
différents travaux n’ont pas étudié le rôle des
antécédents familiaux de cancer de la prostate ni celui
des caractéristiques d’agressivité de la maladie, sauf
dans le cas de l’alachlore pour lequel aucune
association n’a été retrouvée.Autres
 ). Une méta-analyse récente
portant sur 8 études n’a pas pu confirmer une telle
association (Kristensen et coll.,
2018
). Une méta-analyse récente
portant sur 8 études n’a pas pu confirmer une telle
association (Kristensen et coll.,
2018 ). Aucune étude
épidémiologique n’a porté sur cette substance dans le
cadre de son usage rodenticide et la survenue du cancer
de la prostate.
). Aucune étude
épidémiologique n’a porté sur cette substance dans le
cadre de son usage rodenticide et la survenue du cancer
de la prostate.Pesticides et cancer de la prostate : données mécanistiques
Insecticides organochlorés
 ) ont ainsi montré que le β-hexachlorocyclohexane (β-HCH, l’un
des isomères du HCH technique) intervient dans l’activation de
STAT3 (relais de la voie de l’interleukine 6, voir plus haut)
sur la lignée humaine cancéreuse prostatique LNCaP (pour rappel,
sensible aux androgènes). Le β-HCH, l’heptachlor époxyde et le
DDT stimulent le récepteur tyrosine kinase membranaire aux
facteurs de croissance EGF (epidermal growth factor),
HER2/Erb-B2 sur les lignées LNCaP et PC3 (pour rappel, pour
cette dernière, résistante aux androgènes) (Tessier et
Matsumara, 2001
) ont ainsi montré que le β-hexachlorocyclohexane (β-HCH, l’un
des isomères du HCH technique) intervient dans l’activation de
STAT3 (relais de la voie de l’interleukine 6, voir plus haut)
sur la lignée humaine cancéreuse prostatique LNCaP (pour rappel,
sensible aux androgènes). Le β-HCH, l’heptachlor époxyde et le
DDT stimulent le récepteur tyrosine kinase membranaire aux
facteurs de croissance EGF (epidermal growth factor),
HER2/Erb-B2 sur les lignées LNCaP et PC3 (pour rappel, pour
cette dernière, résistante aux androgènes) (Tessier et
Matsumara, 2001 ) ; l’activité tyrosine kinase de
HER2/Erb-B2 phosphoryle et active les kinases p42/44 (MAPK)
impliquées dans la prolifération androgéno-indépendante des
cellules tumorales prostatiques. Par ailleurs, le γ-HCH (un
isomère du HCH technique appelé également lindane) est inducteur
de micronoyaux à très faible dose sur les cellules tumorales
prostatiques PC-3 (Kalantzi et coll.,
2004
) ; l’activité tyrosine kinase de
HER2/Erb-B2 phosphoryle et active les kinases p42/44 (MAPK)
impliquées dans la prolifération androgéno-indépendante des
cellules tumorales prostatiques. Par ailleurs, le γ-HCH (un
isomère du HCH technique appelé également lindane) est inducteur
de micronoyaux à très faible dose sur les cellules tumorales
prostatiques PC-3 (Kalantzi et coll.,
2004 ). In vivo, l’hexachlorobenzène interfère aussi avec la
signalisation androgénique chez la souris (Ralph et coll.,
2003
). In vivo, l’hexachlorobenzène interfère aussi avec la
signalisation androgénique chez la souris (Ralph et coll.,
2003 ).
). ). Ces effets sont expliqués par la liaison antagoniste du DDE
sur le AR et donc à sa capacité à inhiber l’expression de gènes
AR-dépendants (Kelce et coll.,
1995
). Ces effets sont expliqués par la liaison antagoniste du DDE
sur le AR et donc à sa capacité à inhiber l’expression de gènes
AR-dépendants (Kelce et coll.,
1995 et 1997
et 1997 ). Certains auteurs relèvent que le
DDT et le DDE inhibent l’expression du PSA sur des lignées
tumorales prostatiques humaines LNCaP et VCaP (Wong et coll.,
2015
). Certains auteurs relèvent que le
DDT et le DDE inhibent l’expression du PSA sur des lignées
tumorales prostatiques humaines LNCaP et VCaP (Wong et coll.,
2015 ). Cette observation est d’importance car une diminution des
concentrations circulantes en PSA pourrait conduire à de faux
négatifs au moment du diagnostic (Wong et coll.,
2015
). Cette observation est d’importance car une diminution des
concentrations circulantes en PSA pourrait conduire à de faux
négatifs au moment du diagnostic (Wong et coll.,
2015 ). Si cela est exact, un tel effet tendrait à favoriser
l’hypothèse nulle des études épidémiologiques conduites sur le
DDT ou le DDE, renforçant ainsi celles qui ont montré une
association positive entre les concentrations circulantes de ces
substances et le risque de survenue de cancer de la prostate
(Koumar et coll., 2010 ; Emeville et coll.,
2015
). Si cela est exact, un tel effet tendrait à favoriser
l’hypothèse nulle des études épidémiologiques conduites sur le
DDT ou le DDE, renforçant ainsi celles qui ont montré une
association positive entre les concentrations circulantes de ces
substances et le risque de survenue de cancer de la prostate
(Koumar et coll., 2010 ; Emeville et coll.,
2015 ). Par ailleurs, il a été suggéré que cette inhibition du PSA
pourrait accélérer la conversion des cellules vers un phénotype
pré-métastatique (Wong et coll.,
2015
). Par ailleurs, il a été suggéré que cette inhibition du PSA
pourrait accélérer la conversion des cellules vers un phénotype
pré-métastatique (Wong et coll.,
2015 ; Di Donato et coll., 2017
; Di Donato et coll., 2017 ).
). ) ont montré que le DDE pouvait activer certains variants
tumoraux du AR (T877A, H874Y, L701H, V715M) et ainsi favoriser
la transcription de certains gènes cibles (dont celui du PSA).
Cet effet n’est pas observé pour des cellules n’exprimant que le
AR « normal », peut-être du fait d’un faible niveau d’expression
du PSA (et l’impossibilité d’observer une action antagoniste
pour le variant normal) (Shah et coll.,
2008
) ont montré que le DDE pouvait activer certains variants
tumoraux du AR (T877A, H874Y, L701H, V715M) et ainsi favoriser
la transcription de certains gènes cibles (dont celui du PSA).
Cet effet n’est pas observé pour des cellules n’exprimant que le
AR « normal », peut-être du fait d’un faible niveau d’expression
du PSA (et l’impossibilité d’observer une action antagoniste
pour le variant normal) (Shah et coll.,
2008 ). On peut donc soulever l’hypothèse d’un rôle distinct du DDT
et du DDE vis-à-vis du AR et de ses variants. Il est donc
tentant de poser la question des interrelations entre les
différents variants du AR et de poser l’hypothèse que le niveau
d’expression de chacun d’entre eux pourrait être
particulièrement important pour considérer l’action de
pesticides comme le DDE. Il est aussi possible d’imaginer qu’il
existerait une compétition au niveau des promoteurs de gènes
cibles du AR en cas d’expression de plusieurs variants. La
question de l’effet des pesticides organochlorés et peut-être
d’autres substances actives sur le cancer de la prostate
pourrait donc être examinée au regard des différences
d’expression des différents variants du AR. Le DDE pourrait
aussi activer certaines voies de signalisation de type MAPK.
Cette diversité des voies activées (MAPK, variants AR) pourrait
favoriser la prolifération des cellules cancéreuses prostatiques
(Shah et coll., 2008
). On peut donc soulever l’hypothèse d’un rôle distinct du DDT
et du DDE vis-à-vis du AR et de ses variants. Il est donc
tentant de poser la question des interrelations entre les
différents variants du AR et de poser l’hypothèse que le niveau
d’expression de chacun d’entre eux pourrait être
particulièrement important pour considérer l’action de
pesticides comme le DDE. Il est aussi possible d’imaginer qu’il
existerait une compétition au niveau des promoteurs de gènes
cibles du AR en cas d’expression de plusieurs variants. La
question de l’effet des pesticides organochlorés et peut-être
d’autres substances actives sur le cancer de la prostate
pourrait donc être examinée au regard des différences
d’expression des différents variants du AR. Le DDE pourrait
aussi activer certaines voies de signalisation de type MAPK.
Cette diversité des voies activées (MAPK, variants AR) pourrait
favoriser la prolifération des cellules cancéreuses prostatiques
(Shah et coll., 2008 ). De plus, comme de nombreux
perturbateurs endocriniens, le DDE est susceptible d’influencer
le mode d’action d’autres récepteurs aux stéroïdes ; en effet,
il présente également des propriétés agonistes vis-à-vis du
récepteur ERα (Li et coll.,
2008
). De plus, comme de nombreux
perturbateurs endocriniens, le DDE est susceptible d’influencer
le mode d’action d’autres récepteurs aux stéroïdes ; en effet,
il présente également des propriétés agonistes vis-à-vis du
récepteur ERα (Li et coll.,
2008 ). Comme indiqué précédemment, ce récepteur est susceptible
d’être impliqué dans les effets néfastes des œstrogènes sur la
prostate, en particulier la prolifération tumorale et
l’inflammation (Ellem et coll.,
2009
). Comme indiqué précédemment, ce récepteur est susceptible
d’être impliqué dans les effets néfastes des œstrogènes sur la
prostate, en particulier la prolifération tumorale et
l’inflammation (Ellem et coll.,
2009 ). Par ailleurs, un troisième effet de perturbation
endocrinienne du DDE (le premier étant sa liaison au AR, le
deuxième son action agoniste sur le ERα) peut être suspecté :
chez des hommes adultes en bonne santé et sans pathologie
tumorale, les concentrations plasmatiques en DDE ont été
retrouvées inversement associées aux concentrations circulantes
en dihydrotestostérone, suggérant ainsi que le DDE pourrait
aussi agir sur la production d’androgènes et donc indirectement
sur leur signalisation (Emeville et coll.,
2013
). Par ailleurs, un troisième effet de perturbation
endocrinienne du DDE (le premier étant sa liaison au AR, le
deuxième son action agoniste sur le ERα) peut être suspecté :
chez des hommes adultes en bonne santé et sans pathologie
tumorale, les concentrations plasmatiques en DDE ont été
retrouvées inversement associées aux concentrations circulantes
en dihydrotestostérone, suggérant ainsi que le DDE pourrait
aussi agir sur la production d’androgènes et donc indirectement
sur leur signalisation (Emeville et coll.,
2013 ).
).Autres pesticides
 ). D’autres, comme par exemple l’herbicide phénoxy 2,4-D et
son métabolite le DCP (2,4-dichlorophénol) n’ont pas d’activité
androgénique sur des lignées tumorales humaines prostatiques
22rV1 et PC3 (exprimant toutes deux le AR) (Kim et coll.,
2005
). D’autres, comme par exemple l’herbicide phénoxy 2,4-D et
son métabolite le DCP (2,4-dichlorophénol) n’ont pas d’activité
androgénique sur des lignées tumorales humaines prostatiques
22rV1 et PC3 (exprimant toutes deux le AR) (Kim et coll.,
2005 ). Cependant le 2,4-D et le DCP en mélange présentent une
activité androgénique lors d’une co-exposition avec la
5α-dihydrotestostérone. Cette action synergique pourrait en
partie reposer sur une augmentation de la translocation
nucléaire du complexe AR.
). Cependant le 2,4-D et le DCP en mélange présentent une
activité androgénique lors d’une co-exposition avec la
5α-dihydrotestostérone. Cette action synergique pourrait en
partie reposer sur une augmentation de la translocation
nucléaire du complexe AR. ). Bien qu’aucun effet de l’atrazine n’ait été observé sur
l’activité ou l’expression du AR, ce pesticide induit la liaison
de SF-1 (steroidogenic factor 1) à la chromatine (Fan et
coll., 2007
). Bien qu’aucun effet de l’atrazine n’ait été observé sur
l’activité ou l’expression du AR, ce pesticide induit la liaison
de SF-1 (steroidogenic factor 1) à la chromatine (Fan et
coll., 2007 ) et possède par ailleurs la propriété
d’activer la signalisation STAT3 (voir plus haut, signalisation
IL-6) au sein de la lignée prostatique murine RM1, stimulant
ainsi la prolifération cellulaire (Hu et coll.,
2016
) et possède par ailleurs la propriété
d’activer la signalisation STAT3 (voir plus haut, signalisation
IL-6) au sein de la lignée prostatique murine RM1, stimulant
ainsi la prolifération cellulaire (Hu et coll.,
2016 ).
). ). Par ailleurs, l’IL-6 favorise l’interaction entre le AR et
ses co-activateurs (SRC-111
et SMRT) et donc l’activité transcriptionnelle
de la voie de signalisation des androgènes. Cette interaction
est aussi bloquée par la cyperméthrine (Wang et coll.,
2016b
). Par ailleurs, l’IL-6 favorise l’interaction entre le AR et
ses co-activateurs (SRC-111
et SMRT) et donc l’activité transcriptionnelle
de la voie de signalisation des androgènes. Cette interaction
est aussi bloquée par la cyperméthrine (Wang et coll.,
2016b ).
). ). Rappelons, comme évoqué plus haut, que la surexpression de
c-FLIP a été fréquemment observée au cours du développement du
cancer de la prostate. De même, le glyphosate et son produit de
dégradation, l’AMPA, sont des analogues de la glycine qui est
synthétisée par la sérine hydroxyméthyltransférase (SHMT). Une
étude, menée sur 8 lignées tumorales et 2 lignées de cellules
normales mais immortalisées, montre que le glyphosate et l’AMPA
favorisent l’apoptose et inhibent la prolifération des cellules
cancéreuses, dont les cellules PC3, et n’ont aucun effet sur les
cellules normales (Li et coll.,
2013
). Rappelons, comme évoqué plus haut, que la surexpression de
c-FLIP a été fréquemment observée au cours du développement du
cancer de la prostate. De même, le glyphosate et son produit de
dégradation, l’AMPA, sont des analogues de la glycine qui est
synthétisée par la sérine hydroxyméthyltransférase (SHMT). Une
étude, menée sur 8 lignées tumorales et 2 lignées de cellules
normales mais immortalisées, montre que le glyphosate et l’AMPA
favorisent l’apoptose et inhibent la prolifération des cellules
cancéreuses, dont les cellules PC3, et n’ont aucun effet sur les
cellules normales (Li et coll.,
2013 ). Dans ces études, les doses de substances actives employées
sont toutefois élevées, de l’ordre du mM.
). Dans ces études, les doses de substances actives employées
sont toutefois élevées, de l’ordre du mM. ). Le mécanisme décrit est une
inhibition de l’époxyde réductase VKOR (Vitamin K epoxide
reductase), une enzyme clé du cycle de la vitamine K.
Cette inhibition est responsable du blocage de la voie de
signalisation PPARγ qui régule positivement l’activité
transcriptionnelle du AR ; ceci a été démontré à la fois par
l’utilisation i) in vitro, de lignées tumorales de
la prostate humaines (LNCaP, BPH-1) pour lesquelles VKOR est
inhibé par des ARN interférents (siRNA) ; ii) in
vivo, de tissu prostatique provenant de souris Nude
traitées à la warfarine. On peut donc poser l’hypothèse d’un
ciblage favorisé de la voie PPARγ et indirectement de la voie AR
(Tew et coll., 2017
). Le mécanisme décrit est une
inhibition de l’époxyde réductase VKOR (Vitamin K epoxide
reductase), une enzyme clé du cycle de la vitamine K.
Cette inhibition est responsable du blocage de la voie de
signalisation PPARγ qui régule positivement l’activité
transcriptionnelle du AR ; ceci a été démontré à la fois par
l’utilisation i) in vitro, de lignées tumorales de
la prostate humaines (LNCaP, BPH-1) pour lesquelles VKOR est
inhibé par des ARN interférents (siRNA) ; ii) in
vivo, de tissu prostatique provenant de souris Nude
traitées à la warfarine. On peut donc poser l’hypothèse d’un
ciblage favorisé de la voie PPARγ et indirectement de la voie AR
(Tew et coll., 2017 ).
).Interactions gènes – environnement et cancer de la prostate
Gènes de réparation
 ). Ces deux gènes sont connus pour
intervenir dans la réparation de l’ADN par excision de
nucléotides (NER) et on peut donc supposer que ces variants
soient associés à une plus faible activité de réparation.
Des interactions similaires ont été identifiées chez les
porteurs des génotypes CT/TT du variant rs1983132 du gène
NEIL3 (nei endonuclease VIII-like3)
impliqué dans la réparation par excision de bases de l’ADN
(BER) et exposés au fonofos (Barry et coll.,
2012
). Ces deux gènes sont connus pour
intervenir dans la réparation de l’ADN par excision de
nucléotides (NER) et on peut donc supposer que ces variants
soient associés à une plus faible activité de réparation.
Des interactions similaires ont été identifiées chez les
porteurs des génotypes CT/TT du variant rs1983132 du gène
NEIL3 (nei endonuclease VIII-like3)
impliqué dans la réparation par excision de bases de l’ADN
(BER) et exposés au fonofos (Barry et coll.,
2012 ).
).Loci associés au risque de survenue du cancer de la prostate dans des études d’association pangénomique (GWAS)
 ) ont étudié les interactions
potentielles entre des SNP situés sur la région 8q24 (région
contenant de nombreux loci à risque pour le cancer de la
prostate et l’exposition à des pesticides). Des
interactions, se traduisant par une augmentation du risque
de survenue de cancer de la prostate, ont été observées
entre certains variants (rs4242382, rs7837328) et
l’exposition au fonofos, terbufos, coumaphos et perméthrine.
Cependant, on ignore si ces loci et variants dans la région
8q24 peuvent influencer le métabolisme de ces pesticides.
S’agissant de variants situés sur des loci présents dans
d’autres régions chromosomiques, parmi les porteurs du
génotype TT du rs2710647 du EHBP1 (EH domain
binding protein 1) le risque de survenue du cancer
de la prostate est augmenté chez les plus exposés au
malathion (Koutros et coll.,
2013b
) ont étudié les interactions
potentielles entre des SNP situés sur la région 8q24 (région
contenant de nombreux loci à risque pour le cancer de la
prostate et l’exposition à des pesticides). Des
interactions, se traduisant par une augmentation du risque
de survenue de cancer de la prostate, ont été observées
entre certains variants (rs4242382, rs7837328) et
l’exposition au fonofos, terbufos, coumaphos et perméthrine.
Cependant, on ignore si ces loci et variants dans la région
8q24 peuvent influencer le métabolisme de ces pesticides.
S’agissant de variants situés sur des loci présents dans
d’autres régions chromosomiques, parmi les porteurs du
génotype TT du rs2710647 du EHBP1 (EH domain
binding protein 1) le risque de survenue du cancer
de la prostate est augmenté chez les plus exposés au
malathion (Koutros et coll.,
2013b ). EHBP1 est connu pour
intervenir dans la régulation du trafic cellulaire,
notamment l’endocytose clathrine-dépendante. Par ailleurs,
les hommes présentant le génotype AA du rs7679673 du TET2
(Ten-eleven-translocation 2) et exposés à l’aldrine,
présentent un risque augmenté de survenue de cancer de la
prostate (Koutros et coll.,
2013b
). EHBP1 est connu pour
intervenir dans la régulation du trafic cellulaire,
notamment l’endocytose clathrine-dépendante. Par ailleurs,
les hommes présentant le génotype AA du rs7679673 du TET2
(Ten-eleven-translocation 2) et exposés à l’aldrine,
présentent un risque augmenté de survenue de cancer de la
prostate (Koutros et coll.,
2013b ). Le gène TET2 code pour
une méthylcytosine dioxygénase qui forme, à partir de la
méthylcytosine, le métabolite 5-hydroxyméthylcytosine dans
l’ADN. Ces modifications participent à l’inhibition de la
transcription lorsqu’elles se retrouvent au niveau des
promoteurs (un des trois processus de régulation
épigénétique). Les modifications observées au niveau
chromatinien ont notamment été associées à une répression de
l’interleukine 6, et donc à une action anti-inflammatoire.
Il serait donc intéressant d’analyser si les variants de
TET2 identifiés sont moins actifs, favorisant
ainsi, avec l’action conjointe de l’aldrine, un phénotype
inflammatoire pro-cancérigène.
). Le gène TET2 code pour
une méthylcytosine dioxygénase qui forme, à partir de la
méthylcytosine, le métabolite 5-hydroxyméthylcytosine dans
l’ADN. Ces modifications participent à l’inhibition de la
transcription lorsqu’elles se retrouvent au niveau des
promoteurs (un des trois processus de régulation
épigénétique). Les modifications observées au niveau
chromatinien ont notamment été associées à une répression de
l’interleukine 6, et donc à une action anti-inflammatoire.
Il serait donc intéressant d’analyser si les variants de
TET2 identifiés sont moins actifs, favorisant
ainsi, avec l’action conjointe de l’aldrine, un phénotype
inflammatoire pro-cancérigène.Gènes associés au métabolisme des lipides
 ). ALOXE3 code une
lipo-oxygénase dont l’activité est impliquée, entre autres,
dans le métabolisme des acides gras polyinsaturés. Ce
résultat associant un risque élevé de cancer de la prostate
au métabolisme des lipides est intéressant dans la mesure où
le tissu adipeux péri-prostatique et sa composition en
acides gras ont été démontrés comme étant impliqués dans la
survenue et l’agressivité du cancer de la prostate (Finley
et coll., 2009
). ALOXE3 code une
lipo-oxygénase dont l’activité est impliquée, entre autres,
dans le métabolisme des acides gras polyinsaturés. Ce
résultat associant un risque élevé de cancer de la prostate
au métabolisme des lipides est intéressant dans la mesure où
le tissu adipeux péri-prostatique et sa composition en
acides gras ont été démontrés comme étant impliqués dans la
survenue et l’agressivité du cancer de la prostate (Finley
et coll., 2009 ; Laurent et coll.,
2016
; Laurent et coll.,
2016 ; Figiel et coll.,
2018
; Figiel et coll.,
2018 ).
).Gènes associés aux fonctions biologiques de la vitamine D
 ; Adorini et coll.,
2007
; Adorini et coll.,
2007 ). Les hommes porteurs des
génotypes GG/GC du rs1547387 du gène RXRB
(retinoid-x-receptor β) ou du génotype CC des
rs7041 et rs222040 du gène GC (Group-specific
component vitamin D binding protein) et exposés à
l’insecticide organophosphoré parathion ont un risque élevé
de survenue du cancer de la prostate (Karami et coll.,
2013
). Les hommes porteurs des
génotypes GG/GC du rs1547387 du gène RXRB
(retinoid-x-receptor β) ou du génotype CC des
rs7041 et rs222040 du gène GC (Group-specific
component vitamin D binding protein) et exposés à
l’insecticide organophosphoré parathion ont un risque élevé
de survenue du cancer de la prostate (Karami et coll.,
2013 ). Un risque élevé de survenue de
la maladie est également observé chez les hommes présentant
le génotype TT du rs12512631 du GC ou les génotypes
GT/TT du rs4328262 du gène VDR (Vitamin D
receptor) et exposés au terbufos (Karami et coll.,
2013
). Un risque élevé de survenue de
la maladie est également observé chez les hommes présentant
le génotype TT du rs12512631 du GC ou les génotypes
GT/TT du rs4328262 du gène VDR (Vitamin D
receptor) et exposés au terbufos (Karami et coll.,
2013 ).
).Autres mécanismes mis en jeu
 ). Un raccourcissement de la longueur des télomères des
cellules du stroma de la prostate humaine a été associé à un
risque augmenté de survenue du cancer de la prostate (Heaphy et
coll., 2015
). Un raccourcissement de la longueur des télomères des
cellules du stroma de la prostate humaine a été associé à un
risque augmenté de survenue du cancer de la prostate (Heaphy et
coll., 2015 ). Une étude réalisée parmi
1 372 hommes caucasiens sans cancer et participant à la cohorte
AHS a montré que les sujets exposés à certains pesticides
(alachlore, 2,4-D, métolachlore, trifluraline, perméthrine,
toxaphène, DDT) présentaient à partir de cellules buccales des
longueurs de télomères réduites comparés aux hommes non exposés
(Hou et coll., 2013
). Une étude réalisée parmi
1 372 hommes caucasiens sans cancer et participant à la cohorte
AHS a montré que les sujets exposés à certains pesticides
(alachlore, 2,4-D, métolachlore, trifluraline, perméthrine,
toxaphène, DDT) présentaient à partir de cellules buccales des
longueurs de télomères réduites comparés aux hommes non exposés
(Hou et coll., 2013 ). Au sein de cette même cohorte et
parmi 568 hommes sans cancer, la longueur des télomères a été
estimée dans des leucocytes (Andreotti et coll.,
2015
). Au sein de cette même cohorte et
parmi 568 hommes sans cancer, la longueur des télomères a été
estimée dans des leucocytes (Andreotti et coll.,
2015 ). L’exposition à certains pesticides (2,4-D, butilate,
diazinon, malathion) a été associée à des longueurs de télomères
plus courtes. En revanche, l’exposition à l’alachlore a été
associée à des télomères plus longs. Cette observation, en
contradiction avec l’étude de Hou (Hou et coll.,
2013
). L’exposition à certains pesticides (2,4-D, butilate,
diazinon, malathion) a été associée à des longueurs de télomères
plus courtes. En revanche, l’exposition à l’alachlore a été
associée à des télomères plus longs. Cette observation, en
contradiction avec l’étude de Hou (Hou et coll.,
2013 ), pourrait selon les auteurs être expliquée par la différence
de cellules employées (cellules buccales versus
leucocytes) ou par la durée d’exposition des sujets à cette
substance active. Une étude réalisée parmi des sujets sains en
Corée a montré des corrélations positives entre les
concentrations plasmatiques d’insecticides (DDT, DDE,
oxychlordane, trans-nonachlore, heptachlore époxyde,
β-HCH, HCB et mirex) et un allongement des télomères (Shin et
coll., 2010
), pourrait selon les auteurs être expliquée par la différence
de cellules employées (cellules buccales versus
leucocytes) ou par la durée d’exposition des sujets à cette
substance active. Une étude réalisée parmi des sujets sains en
Corée a montré des corrélations positives entre les
concentrations plasmatiques d’insecticides (DDT, DDE,
oxychlordane, trans-nonachlore, heptachlore époxyde,
β-HCH, HCB et mirex) et un allongement des télomères (Shin et
coll., 2010 ). Aucun lien causal n’a été établi
jusqu’à présent par le biais d’études mécanistiques.
L’interprétation de ces résultats, raccourcissement ou
allongement des télomères, doit donc être considérée avec
précaution dans la mesure où ces processus pourraient avoir des
rôles fonctionnellement opposés selon qu’il s’agisse de la
sénescence des cellules, de l’initiation ou de la progression
tumorale (où la télomérase est activée, contribuant au maintien
de la longueur des télomères).
). Aucun lien causal n’a été établi
jusqu’à présent par le biais d’études mécanistiques.
L’interprétation de ces résultats, raccourcissement ou
allongement des télomères, doit donc être considérée avec
précaution dans la mesure où ces processus pourraient avoir des
rôles fonctionnellement opposés selon qu’il s’agisse de la
sénescence des cellules, de l’initiation ou de la progression
tumorale (où la télomérase est activée, contribuant au maintien
de la longueur des télomères). ). Les hommes ayant été fortement
exposés à des pesticides présentaient un taux plus élevé de
méthylations du promoteur (région CpG7) du gène codant la GSTp1
(Glutathion-S-transferase p1) et dans certains
sous-groupes (en fonction de leurs concentrations plasmatiques
en folates) des taux réduits de méthylation sur le promoteur
(régions CpG2 et CpG3) du gène MGMT
(O-6-Methylguanine-DNA Methyltransferase) ainsi que
sur l’un des promoteurs contenus dans l’élément transposable
LINE-1 (Long Interspersed Element-1). La méthylation des
promoteurs de gènes est classiquement associée à une répression
de l’expression du gène correspondant. Dans le cas de la
prostate, la diminution de l’expression de la GSTp1 a été
associée à une augmentation de la survie des cellules tumorales
(Mian et coll., 2016
). Les hommes ayant été fortement
exposés à des pesticides présentaient un taux plus élevé de
méthylations du promoteur (région CpG7) du gène codant la GSTp1
(Glutathion-S-transferase p1) et dans certains
sous-groupes (en fonction de leurs concentrations plasmatiques
en folates) des taux réduits de méthylation sur le promoteur
(régions CpG2 et CpG3) du gène MGMT
(O-6-Methylguanine-DNA Methyltransferase) ainsi que
sur l’un des promoteurs contenus dans l’élément transposable
LINE-1 (Long Interspersed Element-1). La méthylation des
promoteurs de gènes est classiquement associée à une répression
de l’expression du gène correspondant. Dans le cas de la
prostate, la diminution de l’expression de la GSTp1 a été
associée à une augmentation de la survie des cellules tumorales
(Mian et coll., 2016 ). La GSTp1 en tant qu’enzyme du
métabolisme des xénobiotiques de phase II, contribue à conjuguer
des métabolites activés par les enzymes de phase I et
potentiellement toxiques. Un équilibre entre ces deux activités
semble essentiel pour limiter le risque de cancer (Morel et
Barouki, 1999
). La GSTp1 en tant qu’enzyme du
métabolisme des xénobiotiques de phase II, contribue à conjuguer
des métabolites activés par les enzymes de phase I et
potentiellement toxiques. Un équilibre entre ces deux activités
semble essentiel pour limiter le risque de cancer (Morel et
Barouki, 1999 ).
).Chlordécone et cancer de la prostate
Caractéristiques du cancer de la prostate aux Antilles
Incidence des cancers aux Antilles
 ; Joachim-Contaret et coll.,
2019
; Joachim-Contaret et coll.,
2019 ). Ces taux d’incidence plus
faibles sont observés pour la plupart des localisations, en
particulier le poumon, le côlon-rectum et le sein. À
l’inverse, certaines localisations de cancers ont un taux
d’incidence plus élevé qu’en France métropolitaine comme le
cancer du col de l’utérus, de l’estomac, les myélomes
multiples ou le cancer de la prostate.
). Ces taux d’incidence plus
faibles sont observés pour la plupart des localisations, en
particulier le poumon, le côlon-rectum et le sein. À
l’inverse, certaines localisations de cancers ont un taux
d’incidence plus élevé qu’en France métropolitaine comme le
cancer du col de l’utérus, de l’estomac, les myélomes
multiples ou le cancer de la prostate. ). Parmi les explications
possibles figurent l’accroissement et le vieillissement de
la population, l’amélioration des procédures de diagnostic,
l’occidentalisation des modes de vie et d’alimentation et
l’augmentation de la prévalence du tabagisme. Cependant, les
tendances évolutives sont hétérogènes selon les
localisations de cancer, avec une augmentation notable de
l’incidence du cancer de la prostate, du sein et du
colon-rectum, alors qu’une tendance à la baisse est observée
pour les cancers de l’estomac et du col de l’utérus.
). Parmi les explications
possibles figurent l’accroissement et le vieillissement de
la population, l’amélioration des procédures de diagnostic,
l’occidentalisation des modes de vie et d’alimentation et
l’augmentation de la prévalence du tabagisme. Cependant, les
tendances évolutives sont hétérogènes selon les
localisations de cancer, avec une augmentation notable de
l’incidence du cancer de la prostate, du sein et du
colon-rectum, alors qu’une tendance à la baisse est observée
pour les cancers de l’estomac et du col de l’utérus. ; Joachim-Contaret et coll.,
2019
; Joachim-Contaret et coll.,
2019 ).
).Le cancer de la prostate aux Antilles
Incidence et mortalité
 ; Joachim-Contaret et coll.,
2019
; Joachim-Contaret et coll.,
2019 ). Ce taux d’incidence aux
Antilles est près de deux fois supérieur au taux
d’incidence estimé en France métropolitaine sur la même
période (88,8 pour 100 000 personnes-années). Le rapport
d’incidence standardisé (SIR) est de 1,91 [1,85-1,97] en
Guadeloupe et de 1,79 [1,73-1,84] en Martinique. Cette
sur-incidence n’est pas surprenante car il est connu que
les populations dont les origines remontent à l’Afrique
subsaharienne présentent, plus que tout autre groupe
ethno-géographique, un risque élevé de développer la
maladie. De fait, l’incidence du cancer de la prostate
aux Antilles est du même ordre que celle observée chez
les populations afro-américaines aux États-Unis et
afro-caribéennes et africaines résidant au Royaume-Uni
(Ben-Shlomo et coll.,
2008
). Ce taux d’incidence aux
Antilles est près de deux fois supérieur au taux
d’incidence estimé en France métropolitaine sur la même
période (88,8 pour 100 000 personnes-années). Le rapport
d’incidence standardisé (SIR) est de 1,91 [1,85-1,97] en
Guadeloupe et de 1,79 [1,73-1,84] en Martinique. Cette
sur-incidence n’est pas surprenante car il est connu que
les populations dont les origines remontent à l’Afrique
subsaharienne présentent, plus que tout autre groupe
ethno-géographique, un risque élevé de développer la
maladie. De fait, l’incidence du cancer de la prostate
aux Antilles est du même ordre que celle observée chez
les populations afro-américaines aux États-Unis et
afro-caribéennes et africaines résidant au Royaume-Uni
(Ben-Shlomo et coll.,
2008 ; Forman et coll.,
2013
; Forman et coll.,
2013 ).
). ).
). ; Joachim-Contaret et coll.,
2019
; Joachim-Contaret et coll.,
2019 ).
). ). En Martinique, entre 1981
et 2005, l’incidence a augmenté de manière assez
régulière et en moyenne de 5 % par an. En Guadeloupe, la
création récente du registre des cancers ne permet pas
de disposer d’un recul suffisant. Néanmoins, une étude
basée sur un recueil exhaustif de données, provenant de
l’ensemble des laboratoires d’anatomopathologie de la
Guadeloupe, a permis d’estimer l’incidence et son
évolution entre 1995 et 2003 (Mallick et coll.,
2005
). En Martinique, entre 1981
et 2005, l’incidence a augmenté de manière assez
régulière et en moyenne de 5 % par an. En Guadeloupe, la
création récente du registre des cancers ne permet pas
de disposer d’un recul suffisant. Néanmoins, une étude
basée sur un recueil exhaustif de données, provenant de
l’ensemble des laboratoires d’anatomopathologie de la
Guadeloupe, a permis d’estimer l’incidence et son
évolution entre 1995 et 2003 (Mallick et coll.,
2005 ). De 1995 à 2001, le taux
d’incidence, standardisé sur la population mondiale, se
situait en moyenne aux alentours de 93 pour
100 000 personnes-années (ce qui correspond en moyenne à
235 nouveaux cas annuels). Puis, de 2001 à 2003, le taux
d’incidence a brusquement augmenté pour atteindre 168,7
pour 100 000 personnes-années en 2013 (correspondant à
427 nouveaux cas), puis se stabiliser aux valeurs
actuelles. Cette évolution sur une période de 3 ans,
coïncide avec la création en Guadeloupe d’un poste
hospitalo-universitaire en urologie. La promotion du
dépistage précoce individuel et l’amélioration de la
prise en charge du cancer de la prostate dans ce
territoire sont susceptibles d’expliquer en grande
partie cette progression soudaine (Mallick et coll.,
2005
). De 1995 à 2001, le taux
d’incidence, standardisé sur la population mondiale, se
situait en moyenne aux alentours de 93 pour
100 000 personnes-années (ce qui correspond en moyenne à
235 nouveaux cas annuels). Puis, de 2001 à 2003, le taux
d’incidence a brusquement augmenté pour atteindre 168,7
pour 100 000 personnes-années en 2013 (correspondant à
427 nouveaux cas), puis se stabiliser aux valeurs
actuelles. Cette évolution sur une période de 3 ans,
coïncide avec la création en Guadeloupe d’un poste
hospitalo-universitaire en urologie. La promotion du
dépistage précoce individuel et l’amélioration de la
prise en charge du cancer de la prostate dans ce
territoire sont susceptibles d’expliquer en grande
partie cette progression soudaine (Mallick et coll.,
2005 ).
).Caractéristiques clinico-pathologiques
 ; Brureau et coll.,
2018
; Brureau et coll.,
2018 ). Une étude récente montre
que les tumeurs prostatiques, à un stade localisé de la
maladie, mais considérées comme localement
agressives13
, se caractérisent par une délétion plus
fréquente dans la région 1q41-43 englobant le gène de
réparation de l’ADN PARP1 (poly(ADP-ribose)
polymérase 1), ainsi qu’une proportion plus élevée de
réarrangements intrachromosomiques, y compris des
duplications associées aux mutations de troncature des
CDK12 (cyclin-dependant kinase 12) dans des
populations antillaises (et résidentes aux Antilles)
comparées à celles provenant de patients d’origine
caucasienne (résidents en France métropolitaine) (Tonon
et coll., 2019
). Une étude récente montre
que les tumeurs prostatiques, à un stade localisé de la
maladie, mais considérées comme localement
agressives13
, se caractérisent par une délétion plus
fréquente dans la région 1q41-43 englobant le gène de
réparation de l’ADN PARP1 (poly(ADP-ribose)
polymérase 1), ainsi qu’une proportion plus élevée de
réarrangements intrachromosomiques, y compris des
duplications associées aux mutations de troncature des
CDK12 (cyclin-dependant kinase 12) dans des
populations antillaises (et résidentes aux Antilles)
comparées à celles provenant de patients d’origine
caucasienne (résidents en France métropolitaine) (Tonon
et coll., 2019 ).
).Données épidémiologiques
 ; Faroon et coll., 1995
; Faroon et coll., 1995 ; EPA,
2009
; EPA,
2009 ). De par ses propriétés hormonales œstrogéniques bien
établies, il est également considéré comme un perturbateur
endocrinien. Des études épidémiologiques ont été entreprises ces
dernières années aux Antilles pour identifier les risques
sanitaires que cette pollution pourrait entraîner.
). De par ses propriétés hormonales œstrogéniques bien
établies, il est également considéré comme un perturbateur
endocrinien. Des études épidémiologiques ont été entreprises ces
dernières années aux Antilles pour identifier les risques
sanitaires que cette pollution pourrait entraîner. ). Tenant compte de l’âge médian
avancé de survenue du cancer de la prostate et de la période de
latence prévisible entre le début de l’exposition et
l’apparition de la maladie, ce type d’étude a été retenu pour
apporter des éléments de réponse dans un délai raisonnable,
contrairement à une étude de cohorte prospective qui aurait
nécessité un suivi sur de très nombreuses années avant de
pouvoir aboutir à des résultats. L’autre étude était une étude
de cohorte avec un suivi prospectif longitudinal et avait comme
objectif spécifique d’étudier l’hypothèse d’une association
entre l’exposition au chlordécone et le risque de récidive
biologique de cancer de la prostate chez des patients ayant eu
comme traitement initial curatif une prostatectomie radicale
(Brureau et coll., 2019).
). Tenant compte de l’âge médian
avancé de survenue du cancer de la prostate et de la période de
latence prévisible entre le début de l’exposition et
l’apparition de la maladie, ce type d’étude a été retenu pour
apporter des éléments de réponse dans un délai raisonnable,
contrairement à une étude de cohorte prospective qui aurait
nécessité un suivi sur de très nombreuses années avant de
pouvoir aboutir à des résultats. L’autre étude était une étude
de cohorte avec un suivi prospectif longitudinal et avait comme
objectif spécifique d’étudier l’hypothèse d’une association
entre l’exposition au chlordécone et le risque de récidive
biologique de cancer de la prostate chez des patients ayant eu
comme traitement initial curatif une prostatectomie radicale
(Brureau et coll., 2019).Étude cas-témoins Karuprostate
Méthodes
 ), et ayant au moins un
parent (père ou mère) né aux Antilles françaises ou dans
une île de la Caraïbe – dont les populations sont
majoritairement d’ascendance africaine (notamment Haïti
et Dominique) – ont été retenus dans l’analyse des
données.
), et ayant au moins un
parent (père ou mère) né aux Antilles françaises ou dans
une île de la Caraïbe – dont les populations sont
majoritairement d’ascendance africaine (notamment Haïti
et Dominique) – ont été retenus dans l’analyse des
données. ), enzyme hépatique
intervenant dans la réduction de la fonction cétone et
de ce fait dans l’élimination du chlordécone après
glucuro-conjugaison, ont été typés. Tenant compte de la
faible fréquence des allèles variants dans la population
d’étude (< 4 %), le risque a été calculé pour les
sujets présentant des concentrations en chlordécone
au-dessus de la LD, en comparant aux sujets présentant
des concentrations en chlordécone en dessous de la LD.
La mesure de l’association entre l’exposition au
chlordécone et la probabilité de survenue de la maladie
a été réalisée par le calcul de l’odds ratio (OR)
et de son intervalle de confiance à 95 % (IC 95 %) à
l’aide d’une régression logistique. Cette procédure a
permis la prise en compte de facteurs potentiels de
confusion ou d’interaction, notamment : âge, lieu de
naissance, lieux de naissance des parents, lieux de
résidence, caractéristiques anthropométriques dont
l’indice de masse corporelle et le rapport tour de
taille sur tour de hanche, niveau de scolarité, métiers
exercés, usage professionnel ou non professionnel de
pesticides, antécédents familiaux de cancer de la
prostate, antécédents médicaux (notamment diabète,
infections virales et infections uro-génitales), taux de
lipides plasmatiques, consommation de tabac et
d’alcool.
), enzyme hépatique
intervenant dans la réduction de la fonction cétone et
de ce fait dans l’élimination du chlordécone après
glucuro-conjugaison, ont été typés. Tenant compte de la
faible fréquence des allèles variants dans la population
d’étude (< 4 %), le risque a été calculé pour les
sujets présentant des concentrations en chlordécone
au-dessus de la LD, en comparant aux sujets présentant
des concentrations en chlordécone en dessous de la LD.
La mesure de l’association entre l’exposition au
chlordécone et la probabilité de survenue de la maladie
a été réalisée par le calcul de l’odds ratio (OR)
et de son intervalle de confiance à 95 % (IC 95 %) à
l’aide d’une régression logistique. Cette procédure a
permis la prise en compte de facteurs potentiels de
confusion ou d’interaction, notamment : âge, lieu de
naissance, lieux de naissance des parents, lieux de
résidence, caractéristiques anthropométriques dont
l’indice de masse corporelle et le rapport tour de
taille sur tour de hanche, niveau de scolarité, métiers
exercés, usage professionnel ou non professionnel de
pesticides, antécédents familiaux de cancer de la
prostate, antécédents médicaux (notamment diabète,
infections virales et infections uro-génitales), taux de
lipides plasmatiques, consommation de tabac et
d’alcool.Principaux résultats
 ). En utilisant les valeurs du chlordécone comme
variable continue (valeurs en dessous de la LD
remplacées par la LD/2), une relation dose-effet
positive a été retrouvée (p de tendance
linéaire < 0,002). En employant l’indicateur cumulé
d’exposition, un risque augmenté de survenue de la
maladie a été observé pour les sujets situés dans le
quatrième quartile de l’indicateur (le plus élevé) par
rapport au premier quartile (OR = 1,73,
IC 95 % [1,04-2,88]). En utilisant les valeurs du
chlordécone comme variable continue et restreintes aux
sujets présentant une concentration plasmatique en
chlordécone au-dessus de la LD, une relation dose-effet
positive a été trouvée entre cet indicateur cumulé et le
risque de survenue d’un cancer de la prostate (p de
tendance linéaire < 0,004).
). En utilisant les valeurs du chlordécone comme
variable continue (valeurs en dessous de la LD
remplacées par la LD/2), une relation dose-effet
positive a été retrouvée (p de tendance
linéaire < 0,002). En employant l’indicateur cumulé
d’exposition, un risque augmenté de survenue de la
maladie a été observé pour les sujets situés dans le
quatrième quartile de l’indicateur (le plus élevé) par
rapport au premier quartile (OR = 1,73,
IC 95 % [1,04-2,88]). En utilisant les valeurs du
chlordécone comme variable continue et restreintes aux
sujets présentant une concentration plasmatique en
chlordécone au-dessus de la LD, une relation dose-effet
positive a été trouvée entre cet indicateur cumulé et le
risque de survenue d’un cancer de la prostate (p de
tendance linéaire < 0,004). et III
et III ). Par ailleurs, en
dichotomisant l’exposition (< LD comme groupe de
référence versus > LD), le risque de survenue du
cancer de la prostate, bien que non statistiquement
significatif, était augmenté chez les sujets porteurs
d’allèles variants G des polymorphismes fonctionnels de
la chlordécone réductase (OR = 5,2 ;
IC 95 % [0,8-33,3]), le risque chez les porteurs des
variants sauvages C étant de 1,30
(IC 95 % [0,91-1,85]).
). Par ailleurs, en
dichotomisant l’exposition (< LD comme groupe de
référence versus > LD), le risque de survenue du
cancer de la prostate, bien que non statistiquement
significatif, était augmenté chez les sujets porteurs
d’allèles variants G des polymorphismes fonctionnels de
la chlordécone réductase (OR = 5,2 ;
IC 95 % [0,8-33,3]), le risque chez les porteurs des
variants sauvages C étant de 1,30
(IC 95 % [0,91-1,85]). ) et un modèle de régression
polytomique à plusieurs modalités (témoins comme groupe
de référence, cas peu agressifs, cas agressifs), le
risque de survenue a été retrouvé augmenté de manière
significative chez les cas présentant une forme
agressive de la maladie (OR = 2,16 ; IC 95 % [1,33-3,51]
pour le 3e tercile des valeurs supérieures à
la LD comparé au groupe de référence en dessous de la
LD) avec une relation dose-effet en utilisant
l’exposition comme variable continue (p de tendance
linéaire = 0,004). Pour les formes moins agressives, le
risque associé au 3e tercile était augmenté,
mais à la limite de la signification statistique
(OR = 1,45 ; IC 95 % [0,96-2,19]) et en utilisant
l’exposition comme continue le p de tendance linéaire
était de 0,04.
) et un modèle de régression
polytomique à plusieurs modalités (témoins comme groupe
de référence, cas peu agressifs, cas agressifs), le
risque de survenue a été retrouvé augmenté de manière
significative chez les cas présentant une forme
agressive de la maladie (OR = 2,16 ; IC 95 % [1,33-3,51]
pour le 3e tercile des valeurs supérieures à
la LD comparé au groupe de référence en dessous de la
LD) avec une relation dose-effet en utilisant
l’exposition comme variable continue (p de tendance
linéaire = 0,004). Pour les formes moins agressives, le
risque associé au 3e tercile était augmenté,
mais à la limite de la signification statistique
(OR = 1,45 ; IC 95 % [0,96-2,19]) et en utilisant
l’exposition comme continue le p de tendance linéaire
était de 0,04. ) et en considérant les
données toxicologiques et mécanistiques disponibles à ce
moment-là, l’expertise collective de l’Inserm en 2013
avait conclu à une présomption forte d’un lien entre
l’exposition au chlordécone et la survenue du cancer de
la prostate.
) et en considérant les
données toxicologiques et mécanistiques disponibles à ce
moment-là, l’expertise collective de l’Inserm en 2013
avait conclu à une présomption forte d’un lien entre
l’exposition au chlordécone et la survenue du cancer de
la prostate. )
(tableau 12.IV
)
(tableau 12.IV ) où : i) la LD du
chlordécone a été améliorée, après validation des cartes
de contrôles, à 0,06 µg/l ; ii) l’amélioration de
la LD a permis le classement des expositions en
quintiles en fonction de la répartition du chlordécone
plasmatique chez les témoins ; iii) 31 autres
polluants organochlorés persistants, notamment des PCB
et le DDE, ont été dosés et pris en compte dans les
modèles d’ajustement ; iv) les covariables
manquantes ont été remplacées par des procédures
d’imputation multiples ; v) les valeurs des
divers polluants en dessous de la LD ont été estimées
par imputation simple. Dans le modèle ajusté, un risque
augmenté de survenue de la maladie était observé lorsque
les concentrations en chlordécone dépassaient ~1 µg/l
(5e quintile) comparé au groupe de
référence (1er quintile) (OR = 1,65 ;
IC 95 % [1,09-2,48], p de tendance = 0,01 ; ajusté sur
DDE, OR = 1,64 ; IC 95 % [1,09-2,47], p de
tendance = 0,01 ; ajusté sur PCB-153, OR = 1,70 ;
IC 95 % [1,12-2,56], p de tendance = 0,008). Une
relation dose-effet positive a été trouvée entre
l’exposition au chlordécone (continue) et le risque de
survenue d’un cancer de la prostate (p = 0,01 ; ajusté
sur DDE, p = 0,01 ; ajusté sur PCB-153, p = 0,008).
) où : i) la LD du
chlordécone a été améliorée, après validation des cartes
de contrôles, à 0,06 µg/l ; ii) l’amélioration de
la LD a permis le classement des expositions en
quintiles en fonction de la répartition du chlordécone
plasmatique chez les témoins ; iii) 31 autres
polluants organochlorés persistants, notamment des PCB
et le DDE, ont été dosés et pris en compte dans les
modèles d’ajustement ; iv) les covariables
manquantes ont été remplacées par des procédures
d’imputation multiples ; v) les valeurs des
divers polluants en dessous de la LD ont été estimées
par imputation simple. Dans le modèle ajusté, un risque
augmenté de survenue de la maladie était observé lorsque
les concentrations en chlordécone dépassaient ~1 µg/l
(5e quintile) comparé au groupe de
référence (1er quintile) (OR = 1,65 ;
IC 95 % [1,09-2,48], p de tendance = 0,01 ; ajusté sur
DDE, OR = 1,64 ; IC 95 % [1,09-2,47], p de
tendance = 0,01 ; ajusté sur PCB-153, OR = 1,70 ;
IC 95 % [1,12-2,56], p de tendance = 0,008). Une
relation dose-effet positive a été trouvée entre
l’exposition au chlordécone (continue) et le risque de
survenue d’un cancer de la prostate (p = 0,01 ; ajusté
sur DDE, p = 0,01 ; ajusté sur PCB-153, p = 0,008).
Tableau 12.I Exposition au chlordécone et risque de
cancer de la prostate (d’après Multigner et coll.,
2010 )
)
|
Concentration plasmatique
(µg/l)
|
Cas/Témoins (n)
|
ORajusté
*
[IC 95 %] |
Indicateur cumulé d’exposition
(quartiles)
|
Cas/Témoins (n)
|
ORajusté
*
[IC 95 %] |
|---|---|---|---|---|---|
|
< 0,25
|
195/223
|
1,00
|
1er
|
88/112
|
1,00
|
|
> 0,25-0,47
|
128/150
|
1,11 [0,75-1,65]
|
2e
|
101/112
|
1,06 [0,62-1,82]
|
|
> 0,47-0,96
|
139/149
|
1,22 [0,82-1,83]
|
3e
|
101/112
|
1,23 [0,72-2,11]
|
|
> 0,96
|
161/149
|
1,77 [1,21-2,58]
|
4e
|
134/112
|
1,73 [1,04-2,88]
|
|
pde
tendance = 0,002
|
pde
tendance = 0,004
|
* Ajusté à l’âge, rapport tour de taille/tour de hanche, antécédents de diagnostic individuel et précoce de cancer de la prostate, concentration plasmatique en lipides
Tableau 12.II Exposition au chlordécone, risque de
cancer de la prostate et interactions avec les
antécédents familiaux de cancer de la prostate
(d’après Multigner et coll.,
2010 )
)
|
Concentration plasmatique
(µg/l)
|
Sans antécédents familiaux de cancer de
la prostate
|
Avec antécédents familiaux de cancer de
la prostate
|
|||
|---|---|---|---|---|---|
|
Cas/Témoins (n)
|
ORajusté *
[IC 95 %]
|
Cas/ Témoins (n)
|
ORajusté *
[IC 95 %]
|
Pteraction
|
|
|
< 0,25
|
116/161
|
1,00
|
45/26
|
1,00
| |
|
> 0,25-0,47
|
78/111
|
1,35 [0,80-2,26]
|
26/19
|
0,97 [0,33-2,83]
| |
|
> 0,47-0,96
|
81/115
|
1,13 [0,66-1,95]
|
34/8
|
3,22 [1,03-10,1]
| |
|
> 0,96
|
68/123
|
1,27 [0,76-2,13]
|
45/14
|
3,00 [1,12-8,07]
|
< 0,01
|
|
pde
tendance > 0,05
|
pde
tendance = 0,03
| ||||
* Ajusté à l’âge, rapport tour de taille/tour de hanche, antécédents de diagnostic individuel et précoce de cancer de la prostate, concentration plasmatique en lipides
Tableau 12.III Exposition au chlordécone, risque de
cancer de la prostate et interactions avec un séjour
dans un pays occidental (d’après Multigner et coll.,
2010 )
)
|
Concentration plasmatique
(µg/l)
|
Sans séjour antérieur dans un pays
occidental
|
Avec séjour antérieur dans un pays
occidental
|
|||
|---|---|---|---|---|---|
|
Cas/Témoins (n)
|
ORajusté *
[IC 95 %]
|
Cas/Témoins (n)
|
ORajusté *
[IC 95 %]
|
Pteraction
|
|
|
< 0,25
|
137/165
|
1,00
|
58/56
|
1,00
| |
|
> 0,25-0,47
|
87/116
|
1,09 [0,68-1,74]
|
41/34
|
1,15 [0,53-2,48]
| |
|
> 0,47-0,96
|
103/110
|
1,12 [0,69-1,82]
|
36/39
|
1,33 [0,62-2,86]
| |
|
> 0,96
|
110/118
|
1,53 [0,98-2,39]
|
51/31
|
2,71 [1,26-5,83]
|
< 0,01
|
|
pde
tendance > 0,05
|
pde
tendance < 0,01
| ||||
* Ajusté à l’âge, rapport tour de taille/tour de hanche, antécédents de diagnostic individuel et précoce de cancer de la prostate, concentration plasmatique en lipides
Tableau 12.IV Exposition au chlordécone et risque de
cancer de la prostate (d’après Emeville et coll.,
2015 )
)
|
Concentration plasmatique
(µg/l)
|
Cas/Témoins (n)
|
ORajusté *
[IC 95 %]
|
ORajusté * + DDE
[IC 95 %]
|
ORajusté * +
PCB153
|
|---|---|---|---|---|
|
< 0,13
|
132/113
|
1,00
|
1,00
|
1,00
|
|
> 0,13-0,30
|
128/85
|
1,00 [0,65-1,54]
|
1,01 [0,66-1,56]
|
0,98 [0,64-1,52]
|
|
> 0,30-0,51
|
131/127
|
1,47 [0,98-2,21]
|
1,48 [0,99-2,22]
|
1,51 [1,01-2,27]
|
|
> 0,51-1,02
|
134/121
|
1,41 [0,93-2,13]
|
1,41 [0,93-2,12]
|
1,45 [0,96-2,27]
|
|
> 1,02
|
130/130
|
1,65 [1,09-2,48]
|
1,64 [1,09-2,47]
|
1,67 [1,12-2,56]
|
|
pde
tendance = 0,01
|
pde tendance =
0,01
|
pde
tendance < 0,01
|
* Ajusté à l’âge, rapport tour de taille/tour de hanche, antécédents de diagnostic individuel et précoce de cancer de la prostate, concentration plasmatique en lipides. Remplacement des données manquantes par imputation multiple (équations chaînées, MICE)
Limites
 ). Mais cette mesure
reflète-t-elle correctement l’exposition passée ? Le
chlordécone est un polluant persistant dans l’organisme
avec des durées de demi-vie variables en fonction de
l’organe ou tissu considéré. Dans le sang, cette
demi-vie a été estimée à environ 6 mois lorsque
l’exposition externe cesse totalement. La mise en
évidence, dès 1975, de sols contaminés destinés à des
cultures alimentaires susceptibles d’accumuler la
molécule (Snegaroff,
1977
). Mais cette mesure
reflète-t-elle correctement l’exposition passée ? Le
chlordécone est un polluant persistant dans l’organisme
avec des durées de demi-vie variables en fonction de
l’organe ou tissu considéré. Dans le sang, cette
demi-vie a été estimée à environ 6 mois lorsque
l’exposition externe cesse totalement. La mise en
évidence, dès 1975, de sols contaminés destinés à des
cultures alimentaires susceptibles d’accumuler la
molécule (Snegaroff,
1977 ), suggère que la population
générale a pu être contaminée depuis cette période.
L’utilisation légale du chlordécone a été interrompue
définitivement en 1993, mais la pollution de sols – site
primaire de stockage de la molécule à l’origine de la
contamination de la chaîne trophique – s’est maintenue
jusqu’à nos jours. Les premières mesures visant à
réduire l’exposition de la population ont été prises en
2000 et ne concernaient que l’installation de filtres à
charbon pour les eaux de consommation au robinet. Ces
mesures, bien qu’indispensables, sont de portée limitée
dans la mesure où les niveaux de contamination des eaux
de consommation par le chlordécone sont bien plus
faibles que ceux présents dans les denrées alimentaires,
et contribuent donc faiblement à la charge corporelle.
Les arrêtés préfectoraux, mis en place en 2003 mais
appliqués efficacement qu’au cours des années suivantes
(Beaugendre, 2005
), suggère que la population
générale a pu être contaminée depuis cette période.
L’utilisation légale du chlordécone a été interrompue
définitivement en 1993, mais la pollution de sols – site
primaire de stockage de la molécule à l’origine de la
contamination de la chaîne trophique – s’est maintenue
jusqu’à nos jours. Les premières mesures visant à
réduire l’exposition de la population ont été prises en
2000 et ne concernaient que l’installation de filtres à
charbon pour les eaux de consommation au robinet. Ces
mesures, bien qu’indispensables, sont de portée limitée
dans la mesure où les niveaux de contamination des eaux
de consommation par le chlordécone sont bien plus
faibles que ceux présents dans les denrées alimentaires,
et contribuent donc faiblement à la charge corporelle.
Les arrêtés préfectoraux, mis en place en 2003 mais
appliqués efficacement qu’au cours des années suivantes
(Beaugendre, 2005 ), visant à limiter la
production de certaines denrées alimentaires (légumes
racines) cultivées sur des sols pollués, ont sûrement eu
des effets plus conséquents. Mais compte tenu de la
période d’inclusion des participants à l’étude
(2004-2007), les effets de ces mesures n’ont pu être que
relativement modestes. Il est donc vraisemblable, sous
l’hypothèse d’un apport constant de denrées alimentaires
locales au cours des dernières décennies, que les
concentrations plasmatiques en chlordécone mesurées chez
les participants reflètent, en moyenne, leur exposition
au cours des années précédentes quelles que soient la
voie ou les circonstances d’exposition.
), visant à limiter la
production de certaines denrées alimentaires (légumes
racines) cultivées sur des sols pollués, ont sûrement eu
des effets plus conséquents. Mais compte tenu de la
période d’inclusion des participants à l’étude
(2004-2007), les effets de ces mesures n’ont pu être que
relativement modestes. Il est donc vraisemblable, sous
l’hypothèse d’un apport constant de denrées alimentaires
locales au cours des dernières décennies, que les
concentrations plasmatiques en chlordécone mesurées chez
les participants reflètent, en moyenne, leur exposition
au cours des années précédentes quelles que soient la
voie ou les circonstances d’exposition. ). L’ensemble de ces
caractéristiques réduisent les biais de classement de
l’exposition estimée par la mesure de sa concentration
dans le sang.
). L’ensemble de ces
caractéristiques réduisent les biais de classement de
l’exposition estimée par la mesure de sa concentration
dans le sang. ; Weiss,
2003a
; Weiss,
2003a et
b
et
b ; Adolfsson,
2007
; Adolfsson,
2007 ). Les études réalisées sur des
autopsies ont confirmé l’existence de lésions tumorales
prostatiques croissantes avec l’âge, affectant 5 % des
hommes avant 30 ans et augmentant avec l’âge pour
atteindre 60 % à partir de 80 ans (Rich,
1935
). Les études réalisées sur des
autopsies ont confirmé l’existence de lésions tumorales
prostatiques croissantes avec l’âge, affectant 5 % des
hommes avant 30 ans et augmentant avec l’âge pour
atteindre 60 % à partir de 80 ans (Rich,
1935 ; Zlotta et coll.,
2013
; Zlotta et coll.,
2013 ; Bell et coll.,
2015
; Bell et coll.,
2015 ). Ces lésions, dont les
pourcentages dépassent largement le risque cumulé de
cancer de la prostate (IARC, 2014), sont considérées
dans leur grande majorité comme indolentes et propres à
l’histoire naturelle de la prostate. C’est ainsi que les
hommes qui se font pratiquer régulièrement un dosage de
PSA sont plus à même d’avoir un diagnostic
d’adénocarcinome sur de telles lésions et qui peuvent ne
pas toujours être liées à l’exposition d’intérêt. Un
autre aspect important pris en considération est celui
de l’obésité. L’obésité estimée par l’indice de masse
corporelle n’était pas associée ni avec l’exposition au
chlordécone ni au risque de survenue de la maladie. En
revanche, l’obésité dite centrale ou abdominale, estimée
par le rapport tour de taille/tour de hanche, était
inversement associée aux concentrations plasmatiques en
chlordécone et positivement associée au risque de
survenue de la maladie, et de ce fait prise en compte
dans les ajustements.
). Ces lésions, dont les
pourcentages dépassent largement le risque cumulé de
cancer de la prostate (IARC, 2014), sont considérées
dans leur grande majorité comme indolentes et propres à
l’histoire naturelle de la prostate. C’est ainsi que les
hommes qui se font pratiquer régulièrement un dosage de
PSA sont plus à même d’avoir un diagnostic
d’adénocarcinome sur de telles lésions et qui peuvent ne
pas toujours être liées à l’exposition d’intérêt. Un
autre aspect important pris en considération est celui
de l’obésité. L’obésité estimée par l’indice de masse
corporelle n’était pas associée ni avec l’exposition au
chlordécone ni au risque de survenue de la maladie. En
revanche, l’obésité dite centrale ou abdominale, estimée
par le rapport tour de taille/tour de hanche, était
inversement associée aux concentrations plasmatiques en
chlordécone et positivement associée au risque de
survenue de la maladie, et de ce fait prise en compte
dans les ajustements. ; Mahajan et coll.,
2006b
; Mahajan et coll.,
2006b ; Lynch et coll.,
2009
; Lynch et coll.,
2009 ; Christensen et coll.,
2010
; Christensen et coll.,
2010 ).
). ). Si l’amélioration de
l’accès aux soins et aux procédures de diagnostic peut
expliquer de telles variations, l’influence de facteurs
environnementaux liés aux modes de vie des pays
occidentaux a été également avancée. À partir des années
1960, une forte immigration d’Antillais vers la
métropole s’est produite, et certains d’entre eux sont
retournés aux Antilles des années plus tard. Dans la
population d’étude, près de 27 % des participants
(23,9 % chez les témoins et 29,9 % chez les cas) ont
déclaré avoir séjourné temporairement en métropole
pendant une période supérieure à un an (en moyenne
14 années). Si l’on tient compte de l’âge médian des
participants au départ (20 ans) et au retour (34 ans),
la majorité des individus est retournée aux Antilles
avant la fin des années 1970. Autrement dit, la période
de résidence dans un pays occidental de la population
d’étude a précédé, pour la grande majorité d’entre eux,
le début de l’exposition au chlordécone (à partir de
1973). Dans l’étude cas-témoins Karuprostate, le fait
d’avoir résidé temporairement dans un pays occidental a
été retrouvé associé à un risque augmenté de survenue du
cancer de la prostate en Guadeloupe (OR = 1,4 ;
IC 95 % [1,2-2,0] ; modèle ajusté sur l’âge, le niveau
d’éducation, le lieu de naissance du sujet et des
parents et le nombre de dosage de PSA antérieurs)
(Multigner et coll.,
2009
). Si l’amélioration de
l’accès aux soins et aux procédures de diagnostic peut
expliquer de telles variations, l’influence de facteurs
environnementaux liés aux modes de vie des pays
occidentaux a été également avancée. À partir des années
1960, une forte immigration d’Antillais vers la
métropole s’est produite, et certains d’entre eux sont
retournés aux Antilles des années plus tard. Dans la
population d’étude, près de 27 % des participants
(23,9 % chez les témoins et 29,9 % chez les cas) ont
déclaré avoir séjourné temporairement en métropole
pendant une période supérieure à un an (en moyenne
14 années). Si l’on tient compte de l’âge médian des
participants au départ (20 ans) et au retour (34 ans),
la majorité des individus est retournée aux Antilles
avant la fin des années 1970. Autrement dit, la période
de résidence dans un pays occidental de la population
d’étude a précédé, pour la grande majorité d’entre eux,
le début de l’exposition au chlordécone (à partir de
1973). Dans l’étude cas-témoins Karuprostate, le fait
d’avoir résidé temporairement dans un pays occidental a
été retrouvé associé à un risque augmenté de survenue du
cancer de la prostate en Guadeloupe (OR = 1,4 ;
IC 95 % [1,2-2,0] ; modèle ajusté sur l’âge, le niveau
d’éducation, le lieu de naissance du sujet et des
parents et le nombre de dosage de PSA antérieurs)
(Multigner et coll.,
2009 ). L’interprétation d’un
risque accru chez ceux qui ont résidé dans un pays
occidental et ont été exposés au chlordécone est
délicate et on ne peut à ce stade que soulever des
hypothèses. Parmi ces dernières, on peut évoquer
l’influence d’expositions environnementales acquises
lors de la période de migration, telles que la
co-exposition à d’autres polluants chimiques
susceptibles de favoriser la survenue de la maladie et
qui agiraient en synergie avec le chlordécone. Cela ne
semble pas être le cas pour de nombreuses molécules
organochlorées telles que le DDE et les PCB (Emeville et
coll., 2015
). L’interprétation d’un
risque accru chez ceux qui ont résidé dans un pays
occidental et ont été exposés au chlordécone est
délicate et on ne peut à ce stade que soulever des
hypothèses. Parmi ces dernières, on peut évoquer
l’influence d’expositions environnementales acquises
lors de la période de migration, telles que la
co-exposition à d’autres polluants chimiques
susceptibles de favoriser la survenue de la maladie et
qui agiraient en synergie avec le chlordécone. Cela ne
semble pas être le cas pour de nombreuses molécules
organochlorées telles que le DDE et les PCB (Emeville et
coll., 2015 ). Une autre hypothèse
concernerait les modifications des comportements
alimentaires des populations antillaises à l’occasion de
leur séjour dans un pays à mode de vie occidental. D’une
alimentation traditionnelle antillaise, riche en
poissons, fruits et légumes racines à faible index
glycémique, les populations migrantes se sont vues
confrontées à une alimentation dite occidentalisée
(Western diet). Certains aspects de cette
alimentation, à forte teneur en graisses animales et en
laitages, ont été associés à un risque accru de survenue
de cancer de la prostate (Chan et coll.,
2005
). Une autre hypothèse
concernerait les modifications des comportements
alimentaires des populations antillaises à l’occasion de
leur séjour dans un pays à mode de vie occidental. D’une
alimentation traditionnelle antillaise, riche en
poissons, fruits et légumes racines à faible index
glycémique, les populations migrantes se sont vues
confrontées à une alimentation dite occidentalisée
(Western diet). Certains aspects de cette
alimentation, à forte teneur en graisses animales et en
laitages, ont été associés à un risque accru de survenue
de cancer de la prostate (Chan et coll.,
2005 ). L’adoption d’un tel régime
à risque, au cours d’une période de migration moyenne de
14 ans, peut avoir perduré au retour aux Antilles et
ainsi contribuer à un risque supplémentaire.
). L’adoption d’un tel régime
à risque, au cours d’une période de migration moyenne de
14 ans, peut avoir perduré au retour aux Antilles et
ainsi contribuer à un risque supplémentaire. et
b
et
b ; Kume et coll.,
1999
; Kume et coll.,
1999 ). Il est également
intéressant de souligner que la fonction physiologique
de la chlordécone réductase est celle de catalyser la
transformation de la dihydrotestostérone (la forme
biologiquement active de la testostérone) en un
androgène bien plus actif, le 5α-androstane-3α-17β diol
(Khanna et coll., 1995
). Il est également
intéressant de souligner que la fonction physiologique
de la chlordécone réductase est celle de catalyser la
transformation de la dihydrotestostérone (la forme
biologiquement active de la testostérone) en un
androgène bien plus actif, le 5α-androstane-3α-17β diol
(Khanna et coll., 1995 ; Penning et coll.,
2000
; Penning et coll.,
2000 ). De ce fait, la présence de
variants exprimant une enzyme de plus faible activité
catalytique pourrait également jouer un rôle dans le
métabolisme des androgènes, et de ce fait dans le cancer
de la prostate.
). De ce fait, la présence de
variants exprimant une enzyme de plus faible activité
catalytique pourrait également jouer un rôle dans le
métabolisme des androgènes, et de ce fait dans le cancer
de la prostate.Étude de cohorte Karuprostate
Méthodes
Principaux résultats
 ). En utilisant les valeurs du chlordécone comme
variable continue (avec les valeurs en dessous de la LD
estimées par imputation simple), une relation dose-effet
positive a été retrouvée (p de tendance
linéaire = 0,002). Des résultats similaires ont été
obtenus après ajustement supplémentaire à deux autres
polluants persistants (DDE et PCB153) : HR = 2,32 ;
IC 95 % [1,40-4,90] pour le 4e quartile
d’exposition au chlordécone comparé au
1er quartile (p de tendance linéaire = 0,002)
(tableau 12.V
). En utilisant les valeurs du chlordécone comme
variable continue (avec les valeurs en dessous de la LD
estimées par imputation simple), une relation dose-effet
positive a été retrouvée (p de tendance
linéaire = 0,002). Des résultats similaires ont été
obtenus après ajustement supplémentaire à deux autres
polluants persistants (DDE et PCB153) : HR = 2,32 ;
IC 95 % [1,40-4,90] pour le 4e quartile
d’exposition au chlordécone comparé au
1er quartile (p de tendance linéaire = 0,002)
(tableau 12.V ). À noter que le DDE tout comme le PCB153 n’ont pas
été retrouvés associés, ajustés ou pas aux autres
polluants persistants, à une modification de risque de
survenue de récidive biologique de la maladie. Des
résultats similaires ont été observés suite à une
analyse de sensibilité excluant les patients présentant
un stade clinico-pathologique avancé ou un score de
Gleason ISUP de grade 3 ou supérieur ou des marges
chirurgicales positives : HR = 2,98 ;
IC 95 % [1,06-8,38] pour le 4e quartile
d’exposition au chlordécone comparé au
1er quartile dans un modèle ajusté et
comprenant le DDE et le PCB153 (p de tendance
linéaire = 0,003) (tableau 12.VI
). À noter que le DDE tout comme le PCB153 n’ont pas
été retrouvés associés, ajustés ou pas aux autres
polluants persistants, à une modification de risque de
survenue de récidive biologique de la maladie. Des
résultats similaires ont été observés suite à une
analyse de sensibilité excluant les patients présentant
un stade clinico-pathologique avancé ou un score de
Gleason ISUP de grade 3 ou supérieur ou des marges
chirurgicales positives : HR = 2,98 ;
IC 95 % [1,06-8,38] pour le 4e quartile
d’exposition au chlordécone comparé au
1er quartile dans un modèle ajusté et
comprenant le DDE et le PCB153 (p de tendance
linéaire = 0,003) (tableau 12.VI ).
).Tableau 12.V Exposition au chlordécone et risque de récidive biologique de cancer de la prostate (d’après Brureau et coll., 2019)
|
Concentration plasmatique
(µg/l)
|
Sans/Avec récidive biologique
(n)
|
ORajusté *
[IC 95 %]
|
ORajusté **
[IC 95 %]
|
|---|---|---|---|
|
< 0,16
|
62/18
|
1,00
|
1,00
|
|
0,16-0,37
|
57/27
|
1,63 [0,89-2,98]
|
1,55 [0,81-2,93]
|
|
0,38-0,68
|
64/18
|
1,03 [0,53-2,00]
|
0,94 [0,46-1,90]
|
|
≥ 0,69
|
50/30
|
2,51 [1,39-4,56]
|
2,62 [1,40-4,90]
|
|
pde
tendance =0,002
|
pde
tendance =0,002
|
* Ajusté au stade pathologique, au
score de Gleason sur pièce opératoire, aux marges
chirurgicales, à l’indice de masse corporelle et aux
antécédents familiaux de cancer de la
prostate
** Ajusté au stade pathologique, au
score de Gleason sur pièce opératoire, aux marges
chirurgicales, à l’indice de masse corporelle et aux
antécédents familiaux de cancer de la prostate, au
DDE et au PCB153
Tableau 12.VI Exposition au chlordécone et risque de récidive biologique de cancer de la prostate. Analyse de sensibilité parmi les patients ayant des marges chirurgicales négatives, un stade clinico-pathologique localisé et un score de Gleason de grade 2 ISUP ou inférieur (d’après Brureau et coll., 2019)
|
Concentration plasmatique
(µg/l)
|
Sans/Avec récidive biologique
(n)
|
ORajusté *
[IC 95 %]
|
|---|---|---|
|
< 0,16
|
35/6
|
1,00
|
|
0,16-0,37
|
43/6
|
0,61 [0,18-2,09]
|
|
0,38-0,68
|
42/3
|
0,42 [0,10-1,79]
|
|
≥ 0,69
|
34/15
|
2,98 [1,06-8,38]
|
|
pde
tendance =0,003
|
* Ajusté à l’indice de masse corporelle, aux antécédents familiaux de cancer de la prostate, au DDE et au PCB153
Limites
Données toxicologiques et mécanistiques
Études de cancérogenèse chez l’animal
 ; Larson et coll.,
1979
; Larson et coll.,
1979 ). Il a été ainsi rapporté que
l’exposition chronique (de 1 à 2 ans) au chlordécone par
voie orale (de 0 à 80 ppm dans l’alimentation) chez des rats
albinos (40 mâles et 40 femelles) induisait des lésions
hépatiques de type carcinome hépatocellulaire, autant chez
les mâles (seuls les animaux exposés à la dose de 25 ppm ont
été examinés) que chez les femelles (seuls les animaux
exposés aux doses de 10 et 25 ppm ont été examinés), alors
qu’aucun des animaux témoins ne présentait de lésions
tumorales hépatiques, les différences étant statistiquement
significatives. Les animaux exposés présentaient d’autres
localisations tumorales, mais leur faible nombre ne
permettait pas d’établir une différence statistiquement
significative par rapport aux animaux témoins. Tenant compte
du taux de mortalité élevé parmi les animaux exposés, nombre
d’entre eux n’ont pu être correctement examinés. Dans un
deuxième essai où les rats ont été exposés par voie orale à
la dose unique de 1 ppm, 2 des 10 mâles et 2 des 13 femelles
exposés ont développé des lésions tumorales hépatiques
(carcinomes) alors qu’aucun des témoins (14 mâles et
17 femelles) ne développa de quelconque lésion tumorale ;
cependant le seuil de signification statistique (α < 5 %)
n’était pas atteint.
). Il a été ainsi rapporté que
l’exposition chronique (de 1 à 2 ans) au chlordécone par
voie orale (de 0 à 80 ppm dans l’alimentation) chez des rats
albinos (40 mâles et 40 femelles) induisait des lésions
hépatiques de type carcinome hépatocellulaire, autant chez
les mâles (seuls les animaux exposés à la dose de 25 ppm ont
été examinés) que chez les femelles (seuls les animaux
exposés aux doses de 10 et 25 ppm ont été examinés), alors
qu’aucun des animaux témoins ne présentait de lésions
tumorales hépatiques, les différences étant statistiquement
significatives. Les animaux exposés présentaient d’autres
localisations tumorales, mais leur faible nombre ne
permettait pas d’établir une différence statistiquement
significative par rapport aux animaux témoins. Tenant compte
du taux de mortalité élevé parmi les animaux exposés, nombre
d’entre eux n’ont pu être correctement examinés. Dans un
deuxième essai où les rats ont été exposés par voie orale à
la dose unique de 1 ppm, 2 des 10 mâles et 2 des 13 femelles
exposés ont développé des lésions tumorales hépatiques
(carcinomes) alors qu’aucun des témoins (14 mâles et
17 femelles) ne développa de quelconque lésion tumorale ;
cependant le seuil de signification statistique (α < 5 %)
n’était pas atteint. ) entreprit par la suite une
étude détaillée de cancérogenèse chez le rat Osborn-Mendel
(50 mâles et 50 femelles) et la souris B6C3F1 (50 mâles et
50 femelles), menée sur une période de 80 semaines, à deux
doses dans l’alimentation (à 8 et 24 ppm pour les rats
mâles, 18 et 26 ppm pour les rats femelles, 20 et 23 ppm
pour les souris mâles et 20 et 40 ppm pour les souris
femelles) (NTP, 1976
) entreprit par la suite une
étude détaillée de cancérogenèse chez le rat Osborn-Mendel
(50 mâles et 50 femelles) et la souris B6C3F1 (50 mâles et
50 femelles), menée sur une période de 80 semaines, à deux
doses dans l’alimentation (à 8 et 24 ppm pour les rats
mâles, 18 et 26 ppm pour les rats femelles, 20 et 23 ppm
pour les souris mâles et 20 et 40 ppm pour les souris
femelles) (NTP, 1976 ; Reuber,
1978
; Reuber,
1978 et
1979
et
1979 ). La survenue de carcinomes
hépatocellulaires a été retrouvée plus élevée, de manière
statistiquement significative, chez les rats aux doses les
plus élevées et chez les souris à l’ensemble des doses et
quel que soit le sexe de l’animal. Cependant, la fréquence
d’hépatocarcinomes a été retrouvée plus élevée chez les rats
femelles que les mâles et l’inverse chez la souris. D’autres
tumeurs ont été signalées chez les animaux traités, mais
leur faible nombre n’a pas permis d’établir une différence
significative avec les animaux témoins, lesquels par
ailleurs n’ont développé aucune tumeur.
). La survenue de carcinomes
hépatocellulaires a été retrouvée plus élevée, de manière
statistiquement significative, chez les rats aux doses les
plus élevées et chez les souris à l’ensemble des doses et
quel que soit le sexe de l’animal. Cependant, la fréquence
d’hépatocarcinomes a été retrouvée plus élevée chez les rats
femelles que les mâles et l’inverse chez la souris. D’autres
tumeurs ont été signalées chez les animaux traités, mais
leur faible nombre n’a pas permis d’établir une différence
significative avec les animaux témoins, lesquels par
ailleurs n’ont développé aucune tumeur.Génotoxicité et mutagenèse
 ; Probst et coll.,
1981
; Probst et coll.,
1981 ; Mortelmans et coll.,
1986
; Mortelmans et coll.,
1986 ) se sont avérés négatifs. Le
chlordécone alcool, principal métabolite du chlordécone chez
certaines espèces dont l’être humain, n’est pas mutagène
chez S. typhimurium (Mortelmans et coll.,
1986
) se sont avérés négatifs. Le
chlordécone alcool, principal métabolite du chlordécone chez
certaines espèces dont l’être humain, n’est pas mutagène
chez S. typhimurium (Mortelmans et coll.,
1986 ). Le chlordécone a également
donné des résultats négatifs lorsqu’il a été testé sur la
synthèse d’ADN non programmée dans des cultures primaires
d’hépatocytes de rats adultes (Williams,
1980
). Le chlordécone a également
donné des résultats négatifs lorsqu’il a été testé sur la
synthèse d’ADN non programmée dans des cultures primaires
d’hépatocytes de rats adultes (Williams,
1980 ; Probst et coll.,
1981
; Probst et coll.,
1981 ). L’activité clastogène
(aberration de la structure chromosomique) du chlordécone a
été étudiée sur des cellules d’ovaire de hamster chinois
aboutissant à des observations contradictoires. Bale
(1983
). L’activité clastogène
(aberration de la structure chromosomique) du chlordécone a
été étudiée sur des cellules d’ovaire de hamster chinois
aboutissant à des observations contradictoires. Bale
(1983 ) a signalé que le traitement à
des doses de 2, 4 ou 6 µg/ml produisait des ruptures de
chromosomes, des ruptures de chromatides, des chromosomes
dicentriques et des échanges chromosomiques. À l’inverse,
Galloway et coll. (1987
) a signalé que le traitement à
des doses de 2, 4 ou 6 µg/ml produisait des ruptures de
chromosomes, des ruptures de chromatides, des chromosomes
dicentriques et des échanges chromosomiques. À l’inverse,
Galloway et coll. (1987 ), en utilisant des doses plus
élevées (10 à 20 µg/l sans activation métabolique ; 5 à
15 µg/l après activation métabolique [fraction S9 provenant
de foie de rat induit par l’Arochlor 1254]) n’ont observé
aucune augmentation de morphologie chromosomique anormale.
L’effet clastogène potentiel du chlordécone n’a pas été
retrouvé sur les cellules germinales mâles de rat dans un
essai létal dominant à des doses de 3,6 ou 11,4 mg/kg pc/j
par voie orale pendant 5 jours consécutifs (Simon et coll.,
1986
), en utilisant des doses plus
élevées (10 à 20 µg/l sans activation métabolique ; 5 à
15 µg/l après activation métabolique [fraction S9 provenant
de foie de rat induit par l’Arochlor 1254]) n’ont observé
aucune augmentation de morphologie chromosomique anormale.
L’effet clastogène potentiel du chlordécone n’a pas été
retrouvé sur les cellules germinales mâles de rat dans un
essai létal dominant à des doses de 3,6 ou 11,4 mg/kg pc/j
par voie orale pendant 5 jours consécutifs (Simon et coll.,
1986 et
1978
et
1978 ). Le National Toxicology
Program (NTP, 1976
). Le National Toxicology
Program (NTP, 1976 ) mentionne cependant que des
tests cytogénétiques basés sur des échanges entre
chromatides sœurs et de mutation génique in vitro sur
cellules de lymphomes de souris se sont avérés positifs. En
conclusion, malgré des résultats contradictoires, un effet
clastogène est suggéré.
) mentionne cependant que des
tests cytogénétiques basés sur des échanges entre
chromatides sœurs et de mutation génique in vitro sur
cellules de lymphomes de souris se sont avérés positifs. En
conclusion, malgré des résultats contradictoires, un effet
clastogène est suggéré.Mécanismes de cancérogenèse
 ) ont suggéré que le potentiel
tumoral des pesticides organochlorés, en absence de
génotoxicité, reflète un mécanisme épigénétique, impliquant
probablement un effet promotionnel résultant d’une
perturbation des communications intercellulaires. Des études
in vivo ont montré que le chlordécone agit
principalement comme promoteur tumoral plutôt que comme
initiateur (Sirica et coll.,
1989
) ont suggéré que le potentiel
tumoral des pesticides organochlorés, en absence de
génotoxicité, reflète un mécanisme épigénétique, impliquant
probablement un effet promotionnel résultant d’une
perturbation des communications intercellulaires. Des études
in vivo ont montré que le chlordécone agit
principalement comme promoteur tumoral plutôt que comme
initiateur (Sirica et coll.,
1989 ). De la diéthylnitrosamine a été
administrée par voie orale à des rats Sprague-Dawley
partiellement hépatectomisés, suivie de deux doses
sous-cutanées de 0,86 ou 2,6 mg/kg pc/j de chlordécone
pendant 27 semaines. La dose plus élevée a entraîné des
nodules hépatiques hyperplasiques chez sept des huit mâles
initiés et des carcinomes hépatocellulaires chez cinq des
six femelles initiées. Aucune activité d’initiation tumorale
n’a été observée avec une dose orale unique de 30 mg/kg pc
de chlordécone après hépatectomie et suivie d’une promotion
par du phénobarbital, qui est un promoteur de cancérogenèse
bien connu. Cette capacité du chlordécone à agir comme
promoteur tumoral, tout comme à favoriser la progression et
l’invasion tumorale est confortée par un ensemble d’autres
observations décrites ci-après.
). De la diéthylnitrosamine a été
administrée par voie orale à des rats Sprague-Dawley
partiellement hépatectomisés, suivie de deux doses
sous-cutanées de 0,86 ou 2,6 mg/kg pc/j de chlordécone
pendant 27 semaines. La dose plus élevée a entraîné des
nodules hépatiques hyperplasiques chez sept des huit mâles
initiés et des carcinomes hépatocellulaires chez cinq des
six femelles initiées. Aucune activité d’initiation tumorale
n’a été observée avec une dose orale unique de 30 mg/kg pc
de chlordécone après hépatectomie et suivie d’une promotion
par du phénobarbital, qui est un promoteur de cancérogenèse
bien connu. Cette capacité du chlordécone à agir comme
promoteur tumoral, tout comme à favoriser la progression et
l’invasion tumorale est confortée par un ensemble d’autres
observations décrites ci-après.Inhibition des communications intercellulaires
 ) mais aussi des cellules
mésenchymateuses palatines embryonnaires (Caldwell et
Loch-Caruso, 1992
) mais aussi des cellules
mésenchymateuses palatines embryonnaires (Caldwell et
Loch-Caruso, 1992 ). La perte de leur fonction
est fréquemment induite par des promoteurs tumoraux.
). La perte de leur fonction
est fréquemment induite par des promoteurs tumoraux.Inhibition des jonctions adhérentes
 ), un phénomène observé dans
différents types de cancer, notamment les formes
agressives (et précisément pour la prostate) (De Marzo
et coll., 1999
), un phénomène observé dans
différents types de cancer, notamment les formes
agressives (et précisément pour la prostate) (De Marzo
et coll., 1999 ).
).Induction enzymatique de cytochromes
 , Kocarek et coll.,
1991
, Kocarek et coll.,
1991 et
1994
et
1994 ), tout en transactivant le
récepteur nucléaire PXR (Lemaire et coll.,
2004
), tout en transactivant le
récepteur nucléaire PXR (Lemaire et coll.,
2004 ; Lee et coll.,
2008
; Lee et coll.,
2008 ). L’induction des CYP2B et
CYP3A est une propriété du phénobarbital. Les effets du
phénobarbital sont pléiotropiques et les mécanismes de
promotion sont complexes, mais conduisent à la
prolifération du réticulum endoplasmique aboutissant à
une hyperplasie et une hépatomégalie comme cela est le
cas également du chlordécone suggérant que ces deux
composés partagent des modes d’action communs.
). L’induction des CYP2B et
CYP3A est une propriété du phénobarbital. Les effets du
phénobarbital sont pléiotropiques et les mécanismes de
promotion sont complexes, mais conduisent à la
prolifération du réticulum endoplasmique aboutissant à
une hyperplasie et une hépatomégalie comme cela est le
cas également du chlordécone suggérant que ces deux
composés partagent des modes d’action communs.Augmentation de l’activité de l’ornithine décarboxylase (ODC)
 ). L’ODC catalyse la
conversion d’ornithine en putrescine, première étape
limitante dans la synthèse des polyamines (spermine et
spermidine). Les polyamines sont requises pour la
croissance et la multiplication des cellules. Elles
interviennent dans le contrôle et la fidélité de
l’expression génétique (car chargées positivement et
interagissant avec l’ADN) et jouent donc un rôle clé
pendant la cancérogenèse prostatique (Shukla-Dave et
coll., 2016
). L’ODC catalyse la
conversion d’ornithine en putrescine, première étape
limitante dans la synthèse des polyamines (spermine et
spermidine). Les polyamines sont requises pour la
croissance et la multiplication des cellules. Elles
interviennent dans le contrôle et la fidélité de
l’expression génétique (car chargées positivement et
interagissant avec l’ADN) et jouent donc un rôle clé
pendant la cancérogenèse prostatique (Shukla-Dave et
coll., 2016 ). L’augmentation de sa
production ou de son activité est donc parfaitement
cohérente avec la promotion tumorale, d’autant que le
génome des tumeurs est fréquemment instable.
). L’augmentation de sa
production ou de son activité est donc parfaitement
cohérente avec la promotion tumorale, d’autant que le
génome des tumeurs est fréquemment instable.Inhibition de plusieurs activités ATPases
 ; Folmar,
1978
; Folmar,
1978 ; Desaiah,
1980
; Desaiah,
1980 ; Desaiah et coll.,
1980
; Desaiah et coll.,
1980 ; Curtis et Mehendale,
1981
; Curtis et Mehendale,
1981 ; Curtis,
1988
; Curtis,
1988 ; Jinna et coll.,
1989
; Jinna et coll.,
1989 ). L’inhibition des ATPases
mitochondriales par le chlordécone serait susceptible de
promouvoir la glycolyse anaérobique et la production
d’espèces réactives de l’oxygène (ERO), ce qui
favoriserait à son tour la prolifération et la survie
cellulaire (Sanchez-Arago et coll.,
2013
). L’inhibition des ATPases
mitochondriales par le chlordécone serait susceptible de
promouvoir la glycolyse anaérobique et la production
d’espèces réactives de l’oxygène (ERO), ce qui
favoriserait à son tour la prolifération et la survie
cellulaire (Sanchez-Arago et coll.,
2013 ).
).Perturbation de la distribution de Ca2+ intracellulaire
 ; Komulainen et Bondy,
1987
; Komulainen et Bondy,
1987 ; Inoue et coll.,
1990
; Inoue et coll.,
1990 ). Les auteurs mentionnent
que les niveaux de calcium peuvent augmenter dans
certains organites comme la mitochondrie ou le noyau,
tout en diminuant dans le cytoplasme. Ils relèvent
également des modifications de la distribution entre
compartiments intra- et extracellulaires. Par extension,
il est donc possible que la distribution de
Ca2+ dans d’autres tissus soit aussi
perturbée par le chlordécone, favorisant certaines voies
de signalisation impliquées dans la prolifération
cellulaire comme celles des protéines kinases C
(PKC).
). Les auteurs mentionnent
que les niveaux de calcium peuvent augmenter dans
certains organites comme la mitochondrie ou le noyau,
tout en diminuant dans le cytoplasme. Ils relèvent
également des modifications de la distribution entre
compartiments intra- et extracellulaires. Par extension,
il est donc possible que la distribution de
Ca2+ dans d’autres tissus soit aussi
perturbée par le chlordécone, favorisant certaines voies
de signalisation impliquées dans la prolifération
cellulaire comme celles des protéines kinases C
(PKC).Perturbation du métabolisme mitochondrial
 ). Le transport du calcium
dans des mitochondries isolées de cerveau de rat est
inhibé, in vivo et in vitro, par le
chlordécone (End et coll.,
1979
). Le transport du calcium
dans des mitochondries isolées de cerveau de rat est
inhibé, in vivo et in vitro, par le
chlordécone (End et coll.,
1979 ). Le métabolisme
mitochondrial est primordial pour les cellules
tumorales. Cependant, les différentes altérations
énergétiques, glycolytiques ou oxydatives, dépendront en
partie du stade de développement des cellules subissant
une transformation tumorale (Wallace,
2012
). Le métabolisme
mitochondrial est primordial pour les cellules
tumorales. Cependant, les différentes altérations
énergétiques, glycolytiques ou oxydatives, dépendront en
partie du stade de développement des cellules subissant
une transformation tumorale (Wallace,
2012 ).
).Stimulation de l’activité des protéines kinases C (PKC)
 ; Shiota et coll.,
2017
; Shiota et coll.,
2017 ).
).Propriétés hormonales
 ; Hammond et coll.,
1979
; Hammond et coll.,
1979 ; Kocarek et coll.,
1994
; Kocarek et coll.,
1994 ; Lemaire et coll.,
2006b
; Lemaire et coll.,
2006b ). L’ERα est connu pour être
impliqué dans les effets indésirables des œstrogènes,
tels que la prolifération cellulaire et l’inflammation,
tandis que l’ERβ exerce des actions opposées et
bénéfiques telles que des effets antiprolifératifs,
pro-apoptotiques, anti-inflammatoires et donc
potentiellement anticancérigènes (Ellem et Risdbridger,
2009
). L’ERα est connu pour être
impliqué dans les effets indésirables des œstrogènes,
tels que la prolifération cellulaire et l’inflammation,
tandis que l’ERβ exerce des actions opposées et
bénéfiques telles que des effets antiprolifératifs,
pro-apoptotiques, anti-inflammatoires et donc
potentiellement anticancérigènes (Ellem et Risdbridger,
2009 ). La prostate humaine exprime
ces deux récepteurs, l’ERα s’exprimant
préférentiellement dans les cellules du stroma et l’ERβ,
dans les cellules épithéliales (Schulze et Claus,
1990
). La prostate humaine exprime
ces deux récepteurs, l’ERα s’exprimant
préférentiellement dans les cellules du stroma et l’ERβ,
dans les cellules épithéliales (Schulze et Claus,
1990 ; Enmark et coll.,
1997
; Enmark et coll.,
1997 ). L’action combinée des
effets agonistes du chlordécone sur les ERα et des
effets antagonistes sur les ERβ pourrait entraîner un
déséquilibre, favorisant la prolifération cellulaire
(Bonkhoff et Berges,
2009
). L’action combinée des
effets agonistes du chlordécone sur les ERα et des
effets antagonistes sur les ERβ pourrait entraîner un
déséquilibre, favorisant la prolifération cellulaire
(Bonkhoff et Berges,
2009 ; Bonkhoff,
2018
; Bonkhoff,
2018 ). Une étude réalisée chez un
poisson cyprinidé de Chine (Gobiocypris rarus)
indique une induction par le chlordécone de l’ARNm de
ERα mais aucune action sur ERβ et sur le récepteur aux
androgènes (AR) pour les gonades mâles (Yang et coll.,
2016
). Une étude réalisée chez un
poisson cyprinidé de Chine (Gobiocypris rarus)
indique une induction par le chlordécone de l’ARNm de
ERα mais aucune action sur ERβ et sur le récepteur aux
androgènes (AR) pour les gonades mâles (Yang et coll.,
2016 ). L’augmentation du ratio
E2/T est observée avec toutes les conséquences
potentielles évoquées plus haut (cancérogenèse,
agressivité des cellules tumorales...) et pourrait être
reliée à l’activité agoniste du chlordécone sur le
CYP19A (aromatase, une enzyme qui convertit les
androgènes en œstrogènes), une interaction retrouvée en
analyse de « docking » ligand-récepteur.
). L’augmentation du ratio
E2/T est observée avec toutes les conséquences
potentielles évoquées plus haut (cancérogenèse,
agressivité des cellules tumorales...) et pourrait être
reliée à l’activité agoniste du chlordécone sur le
CYP19A (aromatase, une enzyme qui convertit les
androgènes en œstrogènes), une interaction retrouvée en
analyse de « docking » ligand-récepteur. ). Cette induction facilite
la liaison de Bip à l’ERα, permettant de contrôler
l’expression de gènes ERα-dépendants. Cela suggère que
des protéines comme Bip pourraient agir comme
amplificateurs des propriétés œstrogéniques de molécules
ayant une faible affinité pour ER. Le chlordécone active
également l’expression du gène œstrogéno-sensible de la
lactoferrine chez une souris pour laquelle ERα a été
inactivé (Das et coll.,
1997
). Cette induction facilite
la liaison de Bip à l’ERα, permettant de contrôler
l’expression de gènes ERα-dépendants. Cela suggère que
des protéines comme Bip pourraient agir comme
amplificateurs des propriétés œstrogéniques de molécules
ayant une faible affinité pour ER. Le chlordécone active
également l’expression du gène œstrogéno-sensible de la
lactoferrine chez une souris pour laquelle ERα a été
inactivé (Das et coll.,
1997 et
1998
et
1998 ), un effet qui n’est pas
inhibé par les antagonistes habituels de ERα. Il se lie
et active également le récepteur membranaire aux
œstrogènes GPR-30 (Thomas et Dong,
2006
), un effet qui n’est pas
inhibé par les antagonistes habituels de ERα. Il se lie
et active également le récepteur membranaire aux
œstrogènes GPR-30 (Thomas et Dong,
2006 ). Une étude in vitro
a par ailleurs montré que le chlordécone inhibe
l’activité de l’aromatase de cellules embryonnaires en
culture et de fractions microsomiales d’extraits
placentaires ou de l’enzyme purifiée (Benachour et
coll., 2007
). Une étude in vitro
a par ailleurs montré que le chlordécone inhibe
l’activité de l’aromatase de cellules embryonnaires en
culture et de fractions microsomiales d’extraits
placentaires ou de l’enzyme purifiée (Benachour et
coll., 2007 ).
). ). Sur des extraits
cytosoliques de prostate ventrale de rat, le chlordécone
présente également une très faible capacité à déplacer
la liaison de l’androgène synthétique IR1881 au
récepteur aux androgènes (Kelce et coll.,
1995
). Sur des extraits
cytosoliques de prostate ventrale de rat, le chlordécone
présente également une très faible capacité à déplacer
la liaison de l’androgène synthétique IR1881 au
récepteur aux androgènes (Kelce et coll.,
1995 ). Le chlordécone présente
une activité androgénique sur des cellules PC-3
transfectées exprimant le récepteur humain aux
androgènes ; le chlordécone seul n’a aucun effet, mais
il inhibe partiellement l’activation générée par la
liaison de la dihydrotestostérone (Schrader et Cooke,
2000
). Le chlordécone présente
une activité androgénique sur des cellules PC-3
transfectées exprimant le récepteur humain aux
androgènes ; le chlordécone seul n’a aucun effet, mais
il inhibe partiellement l’activation générée par la
liaison de la dihydrotestostérone (Schrader et Cooke,
2000 ). Le chlordécone présente
également des propriétés de type progestagène (Das et
coll., 1998
). Le chlordécone présente
également des propriétés de type progestagène (Das et
coll., 1998 et
1999
et
1999 ) en interagissant avec le
récepteur à la progestérone (récepteur humain
recombinant) (Scippo et coll., 2009) et en inhibant la
liaison de la progestine R5020 (agoniste du récepteur A
de la progestérone) (Vonier et coll.,
1996
) en interagissant avec le
récepteur à la progestérone (récepteur humain
recombinant) (Scippo et coll., 2009) et en inhibant la
liaison de la progestine R5020 (agoniste du récepteur A
de la progestérone) (Vonier et coll.,
1996 ). Finalement, comme
mentionné précédemment, le chlordécone active également
le « Pregnane X Receptor » (PXR) (Lee et coll.,
2008
). Finalement, comme
mentionné précédemment, le chlordécone active également
le « Pregnane X Receptor » (PXR) (Lee et coll.,
2008 ) ce qui pourrait avoir des
conséquences indirectes sur les concentrations
circulantes de certaines hormones métabolisées par les
cibles géniques de ce récepteur (CYP2 et 3).
) ce qui pourrait avoir des
conséquences indirectes sur les concentrations
circulantes de certaines hormones métabolisées par les
cibles géniques de ce récepteur (CYP2 et 3).Propriétés pro-angiogéniques
 ). Cet effet est aboli en
éteignant l’expression de ERα et implique la voie
ERα/Nox2/O2 mitochondriale. Récemment, Alabed Alibrahim
et coll. (2019
). Cet effet est aboli en
éteignant l’expression de ERα et implique la voie
ERα/Nox2/O2 mitochondriale. Récemment, Alabed Alibrahim
et coll. (2019 ) ont montré que l’exposition
au chlordécone par voie orale (1,7 µg/kg pc/j pendant
8 semaines) chez des souris nude xénogreffées avec des
cellules tumorales humaines de la prostate (PC3), induit
une augmentation de la taille des tumeurs prostatiques.
L’immunomarquage à l’aide du marqueur endothélial CD31 a
révélé une augmentation de la néovascularisation
tumorale. Il est à noter que la concentration
plasmatique après 8 semaines d’exposition était en
moyenne de 26,3 µg/l et que l’effet pro-angiogénique
était fortement diminué en cas d’exposition à des
dérivés déchlorés du chlordécone.
) ont montré que l’exposition
au chlordécone par voie orale (1,7 µg/kg pc/j pendant
8 semaines) chez des souris nude xénogreffées avec des
cellules tumorales humaines de la prostate (PC3), induit
une augmentation de la taille des tumeurs prostatiques.
L’immunomarquage à l’aide du marqueur endothélial CD31 a
révélé une augmentation de la néovascularisation
tumorale. Il est à noter que la concentration
plasmatique après 8 semaines d’exposition était en
moyenne de 26,3 µg/l et que l’effet pro-angiogénique
était fortement diminué en cas d’exposition à des
dérivés déchlorés du chlordécone.Augmentation de l’expression du
récepteur CXCR4 et de la protéine d’adhésion VCAM-1 (Wang et
coll., 2007 )
)
 ; Schlesinger et Bendas,
2015
; Schlesinger et Bendas,
2015 ) y compris des tumeurs
prostatiques (Taichman et coll.,
2002
) y compris des tumeurs
prostatiques (Taichman et coll.,
2002 ; Tai et coll.,
2014
; Tai et coll.,
2014 ).
).Effets épigénétiques transgénérationnels
 ). Des souris gestantes ont
été exposées par voie orale au chlordécone à une dose de
100 µg/kg pc/j, presque trois fois en dessous de la
LOAEL dans cette espèce. Les auteurs ont observé une
augmentation du nombre d’animaux porteurs de néoplasies
intraépithéliales prostatiques chez les générations F1
et F3. Chez l’homme, ces lésions lorsqu’elles sont de
haut grade, sont fortement suspectées de constituer des
précurseurs du cancer de la prostate. Une analyse
transcriptomique a montré une expression différentielle
de 970 gènes chez la génération F1 et de 218 gènes chez
génération F3, comprenant des gènes du développement
(Hoxa7, Hoxa9, Hoxb13...) et des gènes
impliqués dans la voie de synthèse des androgènes
(Cyp17a1, Cyp19a1, Srd5a1...). Une analyse
épigénomique réalisée sur des prostates et le sperme des
générations F1 et F3 a identifié des changements
d’intensité de certaines marques (H3K4me3, H3K27me3) à
proximité de gènes intervenant dans la différenciation
des cellules souches et du développement de la
prostate.
). Des souris gestantes ont
été exposées par voie orale au chlordécone à une dose de
100 µg/kg pc/j, presque trois fois en dessous de la
LOAEL dans cette espèce. Les auteurs ont observé une
augmentation du nombre d’animaux porteurs de néoplasies
intraépithéliales prostatiques chez les générations F1
et F3. Chez l’homme, ces lésions lorsqu’elles sont de
haut grade, sont fortement suspectées de constituer des
précurseurs du cancer de la prostate. Une analyse
transcriptomique a montré une expression différentielle
de 970 gènes chez la génération F1 et de 218 gènes chez
génération F3, comprenant des gènes du développement
(Hoxa7, Hoxa9, Hoxb13...) et des gènes
impliqués dans la voie de synthèse des androgènes
(Cyp17a1, Cyp19a1, Srd5a1...). Une analyse
épigénomique réalisée sur des prostates et le sperme des
générations F1 et F3 a identifié des changements
d’intensité de certaines marques (H3K4me3, H3K27me3) à
proximité de gènes intervenant dans la différenciation
des cellules souches et du développement de la
prostate.Classements du chlordécone dans les substances cancérogènes
 ). Son classement dans la
catégorie 2B (peut-être cancérogène pour l’humain) est
intervenu en 198717
sur des critères qui ne correspondent plus
à ceux actuellement en vigueur. Depuis, aucune actualisation
n’a été faite par le Circ.
). Son classement dans la
catégorie 2B (peut-être cancérogène pour l’humain) est
intervenu en 198717
sur des critères qui ne correspondent plus
à ceux actuellement en vigueur. Depuis, aucune actualisation
n’a été faite par le Circ.Discussion
 ). Dans ces conditions, il est difficile d’attribuer une ou
plusieurs causes à un cancer dans une relation univoque, le
terme de causalité étant par ailleurs soumis à de multiples
interprétations, y compris philosophiques et sociologiques.
S’agissant des approches épidémiologiques, notamment dans le
domaine du cancer, on parle de manière plus pragmatique de
facteurs de risque. La validité interne et la validité externe
des études leur confèrent du sens. La plausibilité biologique
des facteurs de risque identifiés par les études
épidémiologiques permet, lorsqu’elle est bien documentée,
d’apporter des arguments en faveur d’une interprétation causale
des associations.
). Dans ces conditions, il est difficile d’attribuer une ou
plusieurs causes à un cancer dans une relation univoque, le
terme de causalité étant par ailleurs soumis à de multiples
interprétations, y compris philosophiques et sociologiques.
S’agissant des approches épidémiologiques, notamment dans le
domaine du cancer, on parle de manière plus pragmatique de
facteurs de risque. La validité interne et la validité externe
des études leur confèrent du sens. La plausibilité biologique
des facteurs de risque identifiés par les études
épidémiologiques permet, lorsqu’elle est bien documentée,
d’apporter des arguments en faveur d’une interprétation causale
des associations. ; voir également l’expertise collective Inserm, « Approche
méthodologique du lien avec l’environnement », 2005
; voir également l’expertise collective Inserm, « Approche
méthodologique du lien avec l’environnement », 2005 ).
).Conclusion
Pesticides et cancer de la prostate
Chlordécone et cancer de la prostate
Addenda : Le chlordécone
Caractéristiques physico-chimiques
 ; Faroon et coll., 1995
; Faroon et coll., 1995 ; EPA,
2009
; EPA,
2009 ). Il possède une structure chimique en cage avec dix atomes
de carbone, dix de chlore et une fonction cétone. Cette
structure et l’arrangement spatial de ses atomes lui confèrent
des propriétés qui détermineront en grande partie son devenir
environnemental. Les principales propriétés physico-chimiques du
chlordécone sont : i) un coefficient de partage avec le
carbone organique élevé (Log Koc ~ 3,4) expliquant sa grande
capacité de rétention par les sols organiques ; ii) un
coefficient de partage octanol – eau élevé (log Kow de 5,41) se
traduisant par une forte affinité pour les composés
hydrophobes ; iii) une faible pression de vapeur
(2,25x10-7 mmHg à 25 °C) résultant en une faible
volatilité ; iv) une faible solubilité dans l’eau
(inférieure à 3 mg/l) ; v) une résistance exceptionnelle
à la dégradation biotique et abiotique.
). Il possède une structure chimique en cage avec dix atomes
de carbone, dix de chlore et une fonction cétone. Cette
structure et l’arrangement spatial de ses atomes lui confèrent
des propriétés qui détermineront en grande partie son devenir
environnemental. Les principales propriétés physico-chimiques du
chlordécone sont : i) un coefficient de partage avec le
carbone organique élevé (Log Koc ~ 3,4) expliquant sa grande
capacité de rétention par les sols organiques ; ii) un
coefficient de partage octanol – eau élevé (log Kow de 5,41) se
traduisant par une forte affinité pour les composés
hydrophobes ; iii) une faible pression de vapeur
(2,25x10-7 mmHg à 25 °C) résultant en une faible
volatilité ; iv) une faible solubilité dans l’eau
(inférieure à 3 mg/l) ; v) une résistance exceptionnelle
à la dégradation biotique et abiotique.Production et usages
 ; Le Déaut et Procaccia,
2009
; Le Déaut et Procaccia,
2009 ), toujours pour lutter contre le charançon du bananier, son
utilisation s’est poursuivie jusqu’en 1993. On estime à près de
6 000 tonnes de formulation commerciale (à 300 tonnes de
substance active) la quantité employée et épandue aux Antilles
(Beaugendre et coll., 2005
), toujours pour lutter contre le charançon du bananier, son
utilisation s’est poursuivie jusqu’en 1993. On estime à près de
6 000 tonnes de formulation commerciale (à 300 tonnes de
substance active) la quantité employée et épandue aux Antilles
(Beaugendre et coll., 2005 ).
).Toxicité non cancérigène
 ). Dans des circonstances déplorables
d’hygiène industrielle, une trentaine d’employés du secteur de
la production ont été exposés à la molécule par voie orale et
respiratoire (ingestion et aspiration de poussières de
chlordécone) mais aussi par contact cutané. Majoritairement de
sexe masculin, les employés ont montré des signes de toxicité
prolongée impliquant le système nerveux (principalement :
tremblements intentionnels appendiculaires, ataxie,
dysfonctionnements oculomoteurs, troubles de l’élocution,
irritabilité, troubles de l’humeur et perte de la mémoire
récente), une hépatomégalie et des atteintes testiculaires
(faible nombre de spermatozoïdes et pourcentage réduit de
spermatozoïdes mobiles (Cannon et coll.,
1978
). Dans des circonstances déplorables
d’hygiène industrielle, une trentaine d’employés du secteur de
la production ont été exposés à la molécule par voie orale et
respiratoire (ingestion et aspiration de poussières de
chlordécone) mais aussi par contact cutané. Majoritairement de
sexe masculin, les employés ont montré des signes de toxicité
prolongée impliquant le système nerveux (principalement :
tremblements intentionnels appendiculaires, ataxie,
dysfonctionnements oculomoteurs, troubles de l’élocution,
irritabilité, troubles de l’humeur et perte de la mémoire
récente), une hépatomégalie et des atteintes testiculaires
(faible nombre de spermatozoïdes et pourcentage réduit de
spermatozoïdes mobiles (Cannon et coll.,
1978 ; Cohn et coll., 1978
; Cohn et coll., 1978 ; Taylor et coll.,
1978
; Taylor et coll.,
1978 ; Guzelian et coll., 1980
; Guzelian et coll., 1980 ; Taylor,
1982
; Taylor,
1982 ; Taylor, 1985
; Taylor, 1985 ). Ces symptômes et signes cliniques
ont été regroupés sous le terme de syndrome du Kepone
Shake. Ces troubles ont été observés chez les sujets
présentant des concentrations de chlordécone dans le sang
supérieures ou égales à 1 mg/ml, l’intensité des troubles étant
proportionnel à leur degré de contamination. Après arrêt de
l’exposition, la plupart des symptômes et signes cliniques ont
régressé au fil des années et de manière parallèle avec la
diminution des concentrations de la molécule dans le sang. Ces
personnes ont fait l’objet d’un suivi sur une dizaine d’années
et aucune pathologie tumorale n’a été observée (Cohn et coll.,
1978
). Ces symptômes et signes cliniques
ont été regroupés sous le terme de syndrome du Kepone
Shake. Ces troubles ont été observés chez les sujets
présentant des concentrations de chlordécone dans le sang
supérieures ou égales à 1 mg/ml, l’intensité des troubles étant
proportionnel à leur degré de contamination. Après arrêt de
l’exposition, la plupart des symptômes et signes cliniques ont
régressé au fil des années et de manière parallèle avec la
diminution des concentrations de la molécule dans le sang. Ces
personnes ont fait l’objet d’un suivi sur une dizaine d’années
et aucune pathologie tumorale n’a été observée (Cohn et coll.,
1978 ; Taylor, 1982
; Taylor, 1982 ; Guzelian et coll.,
1992
; Guzelian et coll.,
1992 ).
). ; Faroon et coll., 1995
; Faroon et coll., 1995 ), dans un cadre syndromique similaire
à celui observé chez l’être humain (Guzelian,
1982
), dans un cadre syndromique similaire
à celui observé chez l’être humain (Guzelian,
1982 ). L’exposition gestationnelle et post-natale précoce au
chlordécone chez des rongeurs porte atteinte au bon
développement embryonnaire ainsi qu’au développement
neurologique, comportemental et moteur, après la naissance
(Mactutus et coll., 1982
). L’exposition gestationnelle et post-natale précoce au
chlordécone chez des rongeurs porte atteinte au bon
développement embryonnaire ainsi qu’au développement
neurologique, comportemental et moteur, après la naissance
(Mactutus et coll., 1982 et
1984
et
1984 ; Mactutus et Tilson, 1984
; Mactutus et Tilson, 1984 et
1985
et
1985 ).
).Toxicocinétique et métabolisme
 ; Cohn et coll., 1978
; Cohn et coll., 1978 ). La demi-vie dans le tissu adipeux a
été estimée en moyenne à 120 jours (Cohn et coll.,
1978
). La demi-vie dans le tissu adipeux a
été estimée en moyenne à 120 jours (Cohn et coll.,
1978 ). L’analyse détaillée des tissus et fluides biologiques
humains a montré que la plus forte concentration de chlordécone
se situait dans le foie. Les ratios des concentrations en
chlordécone de divers tissus par rapport au sang étaient pour le
foie, les graisses, les muscles et la bile respectivement de 15,
6,7, 2,9 et 2,5 (Cohn et coll.,
1978
). L’analyse détaillée des tissus et fluides biologiques
humains a montré que la plus forte concentration de chlordécone
se situait dans le foie. Les ratios des concentrations en
chlordécone de divers tissus par rapport au sang étaient pour le
foie, les graisses, les muscles et la bile respectivement de 15,
6,7, 2,9 et 2,5 (Cohn et coll.,
1978 ). Ces coefficients de partage, en particulier celui
concernant les graisses, sont très inférieurs à ceux attendus
pour une substance apparemment très lipophile, compte tenu de
son Kow élevé. Cela s’explique par le fait que le chlordécone se
lie spécifiquement à certaines protéines hépatiques, mais aussi
au fait que son transport plasmatique est assuré
préférentiellement par l’albumine et par les lipoprotéines de
haute densité (HDL), contrairement aux autres organochlorés qui
se lient préférentiellement aux lipoprotéines VLDL et LDL
(Skalsky et coll., 1979
). Ces coefficients de partage, en particulier celui
concernant les graisses, sont très inférieurs à ceux attendus
pour une substance apparemment très lipophile, compte tenu de
son Kow élevé. Cela s’explique par le fait que le chlordécone se
lie spécifiquement à certaines protéines hépatiques, mais aussi
au fait que son transport plasmatique est assuré
préférentiellement par l’albumine et par les lipoprotéines de
haute densité (HDL), contrairement aux autres organochlorés qui
se lient préférentiellement aux lipoprotéines VLDL et LDL
(Skalsky et coll., 1979 ; Soine et coll.,
1982
; Soine et coll.,
1982 et 1984
et 1984 ). Le chlordécone est excrété dans la
bile sous la forme d’un métabolite (chlordécone alcool) et
conjugué à un glucuronide (Cohn et coll.,
1978
). Le chlordécone est excrété dans la
bile sous la forme d’un métabolite (chlordécone alcool) et
conjugué à un glucuronide (Cohn et coll.,
1978 ). La réduction (transformation de la fonction cétone en
alcool) est catalysée par une enzyme hépatique cytosolique de
type aldo-keto réductase et dénommée chlordécone réductase
(Molowa et coll., 1986a
). La réduction (transformation de la fonction cétone en
alcool) est catalysée par une enzyme hépatique cytosolique de
type aldo-keto réductase et dénommée chlordécone réductase
(Molowa et coll., 1986a et
b
et
b )22
. Néanmoins, à peine 5 % du chlordécone présent
dans la bile se retrouve dans les selles, la molécule subissant
à nouveau un cycle entéro-hépatique après oxydation et
dé-glucuroconjugaison dans la lumière intestinale (Blanke et
coll., 1978
)22
. Néanmoins, à peine 5 % du chlordécone présent
dans la bile se retrouve dans les selles, la molécule subissant
à nouveau un cycle entéro-hépatique après oxydation et
dé-glucuroconjugaison dans la lumière intestinale (Blanke et
coll., 1978 ; Fariss et coll.,
1980
; Fariss et coll.,
1980 ).
). ; Houston et coll., 1981
; Houston et coll., 1981 ; Soine et coll.,
1983
; Soine et coll.,
1983 ). La chlordécone réductase a été mise en évidence chez le
cochon, la gerbille et le lapin (Soine et coll.,
1983
). La chlordécone réductase a été mise en évidence chez le
cochon, la gerbille et le lapin (Soine et coll.,
1983 ; Molowa et coll., 1986b
; Molowa et coll., 1986b ), mais pas chez le rat, la souris,
le cochon d’inde ou le hamster. Chez la gerbille, l’exposition
au chlordécone induit l’expression et la synthèse de la
chlordécone réductase. Le foie est dans tous les cas l’organe où
s’accumule préférentiellement le chlordécone. Chez ces espèces,
le chlordécone traverse également la barrière placentaire et est
présent dans le lait (Kavlock et coll.,
1980
), mais pas chez le rat, la souris,
le cochon d’inde ou le hamster. Chez la gerbille, l’exposition
au chlordécone induit l’expression et la synthèse de la
chlordécone réductase. Le foie est dans tous les cas l’organe où
s’accumule préférentiellement le chlordécone. Chez ces espèces,
le chlordécone traverse également la barrière placentaire et est
présent dans le lait (Kavlock et coll.,
1980 ).
).Mécanismes de toxicité générale
 ; Faroon et coll., 1995
; Faroon et coll., 1995 ). De même, ses propriétés hormonales
de type œstrogénique et progestagénique, clairement établies dès
la fin des années 1970 in vivo et in vitro
(Palmiter et coll., 1978
). De même, ses propriétés hormonales
de type œstrogénique et progestagénique, clairement établies dès
la fin des années 1970 in vivo et in vitro
(Palmiter et coll., 1978 ; Bulger et coll.,
1979
; Bulger et coll.,
1979 ; Hammond et coll., 1979
; Hammond et coll., 1979 ; Eroschenko et coll.,
1981
; Eroschenko et coll.,
1981 ; Huang et coll., 1986
; Huang et coll., 1986 ; Williams et coll.,
1989
; Williams et coll.,
1989 ; Brown et coll., 1991
; Brown et coll., 1991 ; Vonier et coll.,
1996
; Vonier et coll.,
1996 ; Bolger et coll., 1998
; Bolger et coll., 1998 ; Kuiper et coll.,
1998
; Kuiper et coll.,
1998 ; Das et coll., 1997
; Das et coll., 1997 ,
1998
,
1998 et 1999
et 1999 ; Gellert, 2004 ; Lemaire et coll.,
2006a
; Gellert, 2004 ; Lemaire et coll.,
2006a et b
et b ; Ray et coll., 2007
; Ray et coll., 2007 ), pourraient être impliquées dans la
survenue d’atteintes de la reproduction et du développement. De
ce fait, depuis la diffusion de l’expression « perturbateur
endocrinien », le chlordécone a été logiquement inclus dans
cette catégorie de substances.
), pourraient être impliquées dans la
survenue d’atteintes de la reproduction et du développement. De
ce fait, depuis la diffusion de l’expression « perturbateur
endocrinien », le chlordécone a été logiquement inclus dans
cette catégorie de substances.Devenir environnemental
 ). Sa présence a été constatée deux ans après son application
sur des soles bananières reconverties à d’autres activités
agricoles (aubergine), ainsi que dans les eaux de rivières à des
concentrations pouvant dépasser 200 µg/l. D’autres travaux de
l’Inra dresseront rapidement un tableau détaillé de la
contamination de la faune sauvage au cours de la période
1979-1980 (Cavelier, 1980
). Sa présence a été constatée deux ans après son application
sur des soles bananières reconverties à d’autres activités
agricoles (aubergine), ainsi que dans les eaux de rivières à des
concentrations pouvant dépasser 200 µg/l. D’autres travaux de
l’Inra dresseront rapidement un tableau détaillé de la
contamination de la faune sauvage au cours de la période
1979-1980 (Cavelier, 1980 ). Des mammifères, oiseaux, poissons,
crustacés et mollusques (praires, huîtres de mangrove) furent
prélevés à différents points de la Guadeloupe. Les résultats ont
montré, pour toutes les espèces animales étudiées, une
contamination particulièrement élevée en chlordécone (atteignant
jusqu’à plusieurs dizaines de mg par kg de poids corporel).
Cependant, il faudra attendre la fin des années 1990 pour que la
pollution des milieux naturels antillais (Guadeloupe et
Martinique) soit publiquement communiquée, suite à la mise en
évidence du chlordécone dans les eaux de consommation en 1999,
puis successivement dans les sols, les eaux de surface et
profondes, le littoral marin et dans de nombreuses denrées
alimentaires, végétales et animales, terrestres et aquatiques
(d’eau douce ou de mer) (Bonan et Prime,
2001
). Des mammifères, oiseaux, poissons,
crustacés et mollusques (praires, huîtres de mangrove) furent
prélevés à différents points de la Guadeloupe. Les résultats ont
montré, pour toutes les espèces animales étudiées, une
contamination particulièrement élevée en chlordécone (atteignant
jusqu’à plusieurs dizaines de mg par kg de poids corporel).
Cependant, il faudra attendre la fin des années 1990 pour que la
pollution des milieux naturels antillais (Guadeloupe et
Martinique) soit publiquement communiquée, suite à la mise en
évidence du chlordécone dans les eaux de consommation en 1999,
puis successivement dans les sols, les eaux de surface et
profondes, le littoral marin et dans de nombreuses denrées
alimentaires, végétales et animales, terrestres et aquatiques
(d’eau douce ou de mer) (Bonan et Prime,
2001 ). On estime qu’au moins un tiers des surfaces agricoles
(20 000 hectares) et près de la moitié des ressources en eau
douce et du littoral marin sont pollués par le chlordécone. Les
surfaces agricoles polluées correspondent pour l’essentiel à des
soles bananières existantes sur la période 1973-1993. Récemment
des sols où aucune culture bananière n’a été enregistrée dans le
passé ont été retrouvés contaminés, suite à des usages détournés
sur cultures maraîchères et d’agrumes pour lutter contre les
charançons qui les affectent23
.
). On estime qu’au moins un tiers des surfaces agricoles
(20 000 hectares) et près de la moitié des ressources en eau
douce et du littoral marin sont pollués par le chlordécone. Les
surfaces agricoles polluées correspondent pour l’essentiel à des
soles bananières existantes sur la période 1973-1993. Récemment
des sols où aucune culture bananière n’a été enregistrée dans le
passé ont été retrouvés contaminés, suite à des usages détournés
sur cultures maraîchères et d’agrumes pour lutter contre les
charançons qui les affectent23
.Exposition des populations
 ; Multigner et Kadhel, 2008
; Multigner et Kadhel, 2008 ; Guldner et coll.,
2010
; Guldner et coll.,
2010 ; Multigner et coll., 2010
; Multigner et coll., 2010 ; Guldner et coll.,
2011
; Guldner et coll.,
2011 ; Dallaire et coll., 2012
; Dallaire et coll., 2012 ; Boucher et coll.,
2013
; Boucher et coll.,
2013 ; Kadhel et coll., 2014
; Kadhel et coll., 2014 ; Hervé et coll.,
2016
; Hervé et coll.,
2016 ; Dereumeaux et Saoudi, 2018
; Dereumeaux et Saoudi, 2018 ). L’exposition a été principalement
reliée à la consommation d’aliments d’origine locale eux-mêmes
contaminés (principalement légumes racines, viandes, poissons)
(Multigner et Kadhel, 2008
). L’exposition a été principalement
reliée à la consommation d’aliments d’origine locale eux-mêmes
contaminés (principalement légumes racines, viandes, poissons)
(Multigner et Kadhel, 2008 ; Guldner et coll.,
2010
; Guldner et coll.,
2010 ; Dereumeaux et Saoudi, 2018
; Dereumeaux et Saoudi, 2018 ).
). ). Cependant, on ne dispose d’aucune information directe
permettant d’estimer l’intensité d’exposition de ces
travailleurs à cette époque. À ce jour, la présence du syndrome
du Kepone (Kepone Shake) aux Antilles n’a jamais été
observée ou rapportée. Sans exclure totalement la possibilité de
sa présence aux Antilles, cela suggère que le seuil à partir
duquel les symptômes et signes de ce syndrome se manifestent
(1 mg de chlordécone/l de sang) n’a peut-être que rarement ou
jamais été atteint. Une étude sur la période 1999 à 2001,
réalisée chez des travailleurs de même âge et résidant dans les
mêmes communes de Basse-Terre (principal secteur géographique
bananier en Guadeloupe), a montré que les concentrations
plasmatiques en chlordécone étaient plus élevées chez les
salariés du secteur agricole bananier (médiane : 6,5 µg/l,
percentile 75 : 17,1 µg/l, maximum : 100 µg/l) comparé à des
salariés du secteur non-agricole (médiane : 5,5 µg/l,
percentile 75 : 9,0 µg/l, maximum : 24,3 µg/l) (Multigner et
coll., 2006
). Cependant, on ne dispose d’aucune information directe
permettant d’estimer l’intensité d’exposition de ces
travailleurs à cette époque. À ce jour, la présence du syndrome
du Kepone (Kepone Shake) aux Antilles n’a jamais été
observée ou rapportée. Sans exclure totalement la possibilité de
sa présence aux Antilles, cela suggère que le seuil à partir
duquel les symptômes et signes de ce syndrome se manifestent
(1 mg de chlordécone/l de sang) n’a peut-être que rarement ou
jamais été atteint. Une étude sur la période 1999 à 2001,
réalisée chez des travailleurs de même âge et résidant dans les
mêmes communes de Basse-Terre (principal secteur géographique
bananier en Guadeloupe), a montré que les concentrations
plasmatiques en chlordécone étaient plus élevées chez les
salariés du secteur agricole bananier (médiane : 6,5 µg/l,
percentile 75 : 17,1 µg/l, maximum : 100 µg/l) comparé à des
salariés du secteur non-agricole (médiane : 5,5 µg/l,
percentile 75 : 9,0 µg/l, maximum : 24,3 µg/l) (Multigner et
coll., 2006 et
2008
et
2008 ). Parmi les travailleurs du secteur bananier, les hommes qui
avaient exercé leur métier pendant plus de 14 années (médiane de
la durée d’emploi) présentaient également les concentrations les
plus élevées (médiane : 6,5 µg/l, percentile 75 : 22,8 µg/l,
maximum : 104 µg/l) par rapport à ceux ayant exercé pendant
moins de 14 années (médiane : 5,9 µg/l, percentile 75 :
12,3 µg/l, maximum : 104 µg/l) (Multigner et Kadhel,
2008
). Parmi les travailleurs du secteur bananier, les hommes qui
avaient exercé leur métier pendant plus de 14 années (médiane de
la durée d’emploi) présentaient également les concentrations les
plus élevées (médiane : 6,5 µg/l, percentile 75 : 22,8 µg/l,
maximum : 104 µg/l) par rapport à ceux ayant exercé pendant
moins de 14 années (médiane : 5,9 µg/l, percentile 75 :
12,3 µg/l, maximum : 104 µg/l) (Multigner et Kadhel,
2008 ). Une étude, réalisée sur la période 2004 à 2007 en
population générale, sur des hommes âgés entre 45 et 80 ans, a
montré que les hommes exerçant ou ayant exercé une activité
professionnelle dans le secteur bananier présentaient des
concentrations plus élevées (médiane : 1,0 µg/l, percentile 75 :
2,3 µg/l, maximum : 49 µg/l) en comparaison des hommes ne
travaillant pas et n’ayant jamais travaillé dans ce secteur
(médiane : 0,5 µg/l, percentile 75 : 1,3 µg/l, maximum :
44 µg/l) (Multigner et coll.,
2010
). Une étude, réalisée sur la période 2004 à 2007 en
population générale, sur des hommes âgés entre 45 et 80 ans, a
montré que les hommes exerçant ou ayant exercé une activité
professionnelle dans le secteur bananier présentaient des
concentrations plus élevées (médiane : 1,0 µg/l, percentile 75 :
2,3 µg/l, maximum : 49 µg/l) en comparaison des hommes ne
travaillant pas et n’ayant jamais travaillé dans ce secteur
(médiane : 0,5 µg/l, percentile 75 : 1,3 µg/l, maximum :
44 µg/l) (Multigner et coll.,
2010 ). Bien que les travailleurs du secteur bananier sur les deux
périodes citées aient présenté des niveaux d’exposition interne
plus élevés que ceux n’ayant pas travaillé dans ce secteur, la
différence reste modeste. Il faut bien garder à l’esprit que,
tenant compte de la demi-vie plasmatique du chlordécone (moyenne
de 165 jours), il n’est pas impossible que la fraction
d’exposition interne liée à une exposition professionnelle ait
diminué depuis 1993 et que les niveaux d’exposition rejoignent
progressivement ceux du reste de la population, qui a été
continuellement exposée via l’alimentation depuis le
milieu des années 1970. On ne peut exclure, vu l’utilisation
détournée du chlordécone vers d’autres cultures, que d’autres
populations que celles du secteur bananier puissent avoir
également été exposées professionnellement.
). Bien que les travailleurs du secteur bananier sur les deux
périodes citées aient présenté des niveaux d’exposition interne
plus élevés que ceux n’ayant pas travaillé dans ce secteur, la
différence reste modeste. Il faut bien garder à l’esprit que,
tenant compte de la demi-vie plasmatique du chlordécone (moyenne
de 165 jours), il n’est pas impossible que la fraction
d’exposition interne liée à une exposition professionnelle ait
diminué depuis 1993 et que les niveaux d’exposition rejoignent
progressivement ceux du reste de la population, qui a été
continuellement exposée via l’alimentation depuis le
milieu des années 1970. On ne peut exclure, vu l’utilisation
détournée du chlordécone vers d’autres cultures, que d’autres
populations que celles du secteur bananier puissent avoir
également été exposées professionnellement.Risques sanitaires
Références

































































































































































































 •
•







































































→ Aller vers SYNTHESE