 |
| |||
Med Sci (Paris). 34: 35–38. doi: 10.1051/medsci/201834s210.15es JSFM : Prix Master 2017* Effet de l’interféron-gamma sur la biologie des cellules musculaires squelettiques 1ED402, Paris Est-Créteil University, Créteil, France 2Inserm U955 Team 10, Paris Est-Créteil University, Créteil, France Corresponding author. | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Le muscle squelettique possède de grandes capacités d’adaptation lui permettant de détecter et de s’accommoder aux changements d’activité contractile. Cette plasticité du tissu musculaire répond de manière spécifique à différents changements ou conditions tels que l’exercice physique, les facteurs de croissance, les apports nutritionnels, le stress et certaines pathologies. Cette plasticité est possible par la complémentarité de deux phénomènes : la myogenèse et l’angiogenèse, toutes deux essentielles pour le maintien de l’homéostasie du muscle squelettique [1]. Ce tissu contient en effet une population de progéniteurs musculaires, également nommés cellules satellites, présents dans un microenvironnement particulier, la niche satellitaire [2]. Les cellules satellites sont localisées entre la lame basale et le sarcolemme et sont majoritairement à l’état quiescent dans un muscle sain. A la suite d’une lésion musculaire, les cellules satellites s’activent, prolifèrent puis se différencient et fusionnent pour former de nouvelles fibres musculaires (Figure 1A, 1B). Une partie des cellules satellites activées (i.e. myoblastes) ne se différencient pas mais retournent en position satellite, permettant ainsi de reconstituer le pool de cellules souches [2]. La cellule musculaire et son microenvironnement sont perturbés en cas de pathologies neuromusculaires, qu’elles soient acquises (inflammatoires/dysimmunitaires ou toxiques) ou non-acquises (génétiques). Les myopathies inflammatoires et dysimmunitaires (DIMs) idiopathiques résultant d’un dysfonctionnement du système immunitaire sont classées en quatre groupes selon des critères histopathologiques : (1) polymyosites (PM) / myosites à inclusion (inclusion body myositis, IBM), (2) dermatomyosites (DM), (3) myopathies nécrosantes auto-immunes (immune-mediated necrotizing myopathies, IMNM) et (4) myosites de chevauchement comprenant le syndrome anti-synthétase (antisynthetase myopathy, ASM) (Tableau I) [3].
Les signatures interférons dans le sang et dans le muscle permettent de mieux analyser les mécanismes physiopathologiques à l’origine des lésions musculaires au cours des DIMs. Ainsi, la DM se distingue des autres DIMs par une signature interféron (IFN) de type 1 (IFNα et β) corrélée à la sévérité de la maladie [4]. À l’inverse, le syndrome anti-synthétase (ASM) et les myosites à inclusions (IBM) se caractérisent par une signature IFN de type 2 (IFNγ) [5]. Dans le cas des PM/IBM, les complexes majeurs d’histocompatibilité de types 1 et 2 (CMH1 ; CMH2) sont surexprimés dans les fibres musculaires tandis que les fibres musculaires de sujets sains n’expriment pas le CMH [6]. L’IFNγ est un puissant inducteur du CMH2 par l’intermédiaire du transactivateur CIITA via la phosphorylation de STAT1 [7]. Les effets de l’IFNγ sur les cellules musculaires squelettiques sont mal connus, les effets réels sur la régénération musculaire restant encore controversés. Après une lésion musculaire, l’inflammation induite est associée à une production d’IFNγ. L’IFNγ est essentielle pour obtenir une réparation efficace du muscle squelettique grâce à son implication dans la régulation du système immunitaire telle que l’activation des macrophages [8]. In vitro, l’IFNγ stimule la prolifération des cellules myogéniques murines [9] et inhibe leur différenciation [7,9]. Dans les ASM et les IBM, le niveau d’expression d’IFNγ pourrait avoir un effet direct sur les cellules myogéniques, et/ou indirect par l’activation des cellules inflammatoires résidentes, et ainsi contribuer à la physiopathologie de ces maladies. | |||||||||||||||||||||||||||||
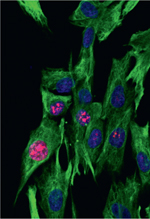
Mon travail de thèse a pour objectif d’étudier le rôle de l’IFNγ sur la biologie des cellules musculaires à l’état normal et dans les myopathies inflammatoires. La première partie du travail est l’analyse in vitro des effets de l’IFNγ sur la prolifération et la différentiation des myoblastes (Figure 1A, 1B) (cultures primaires humaines et murines). Des cultures primaires de cellules myogéniques humaines ont été obtenues à partie de biopsies musculaires de patients avec un muscle histologiquement normal ou présentant une DIMs. Après dissociation mécanique, digestion enzymatique et tri sur billes magnétiques, la myogénicité de la population cellulaire isolée a été déterminée par l’expression de desmine (Figure 1C). Les myoblastes isolés ont été exposés à l’IFNγ humain (exposition unique ou répétée) en condition de prolifération ou de différenciation. Nos résultats préliminaires montrent que le traitement par IFNγ active fortement la voie de signalisation de l’IFNγ (Figure 1D). L’exposition à une dose unique d’IFNγ (≥1ng/ml) induit également une réponse cellulaire dès 24 h avec une induction génique encore présente 72 h après traitement pour une dose supérieure à 5ng/mL. Ces protocoles nous permettent de caractériser l’effet sur la prolifération et la différenciation des cellules myogéniques. La seconde partie de mon travail portera sur l’étude in vivo de différents modèles murins de pathologie musculaire en analysant notamment l’effet de l’IFNγ endogène. En particulier, je réaliserai l’étude qualitative et quantitative des effets de l’IFNγ sur le développement musculaire en analysant notamment les facteurs de régulation myogénique : Pax7 pour les cellules satellites, MyoD pour les myoblastes et myogénine (MyoG) pour les myocytes, puis les deux chaînes lourdes de myosine pour les myotubes (Figure 1A, 1B). Cette approche vise à caractériser les effets de l’IFNγ sur les myoblastes et les fibres musculaires, en conditions normale et pathologique. Ceci est d’autant plus important que pour certaines myopathies il n’existe pas de thérapie efficace sur le long terme. De plus, le rôle des interférons est de plus en plus étudié dans la physiopathologie des maladies auto-immunes [10] incluant des approches spécifiques basées sur leur neutralisation in vivo.
| |||||||||||||||||||||||||||||
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. | |||||||||||||||||||||||||||||
1.
Kostallari E,
Baba-Amer Y,
Alonso-Martin S.
et al. Pericytes in the myovascular niche promote post-natal myofiber growth and satellite cell quiescence . Development. 2015; ; 142 : :1242.–1253. 2.
Relaix F,
Zammit PS.
Satellite cells are essential for skeletal muscle regeneration: the cell on the edge returns centre stage . Development. 2012; ; 139 : :2845.–2856. 3.
De Bleecker JL,
Lundberg IE,
de Visser M.
193rd ENMC international workshop pathology diagnosis of idiopathic inflammatory myopathies 30 November-2 December 2012, Naarden . The Netherlands. Neuromuscul Disord. 2013; ; 23 : :945.–951. 4.
Gitiaux C,
Latroche C,
Weiss-Gayet M.
et al. Myogenic progenitor cells exhibit type I interferon-driven proangiogenic properties and molecular signature during juvenile dermatomyositis . Arthritis Rheumatol Hoboken NJ. 2018; ; 70 : :134.–145. 5.
Rigolet M, Hou C, Baba Amer Y, et al. Distinct interferon signatures stratify inflammatory and dysimmune myopathies . 2018 (soumis pour publication).. 6.
Aouizerate J,
De Antonio M,
Bassez G.
et al. Myofiber HLA-DR expression is a distinctive biomarker for antisynthetase-associated myopathy . Acta Neuropathol Commun. 2014; ; 2 : :154.. 7.
Londhe P,
Davie JK.
Gamma interferon modulates myogenesis through the major histocompatibility complex class II transactivator . CIITA. Mol Cell Biol. 2011; ; 31 : :2854.–2866. 8.
Cheng M,
Nguyen MH,
Fantuzzi G.
et al. Endogenous interferon is required for efficient skeletal muscle regeneration . AJP Cell Physiol. 2008; ; 294 : :C1183.–C1191. | |||||||||||||||||||||||||||||