L’enjeu est de maintenir l’exhaustivité du dépistage, dans un contexte oú les nouveau-nés restent moins longtemps en maternité et que les naissances se font aussi en maison de naissance ou à domicile. Il s’agit également d’adapter les algorithmes de dépistage actuels. Ainsi de la mesure de la PAP pour le dépistage de la mucoviscidose ou des discussions sur les seuils de 17-OHP pour le dépistage de l’hyperplasie congénitale des surrénales. Les seuils de TSH pourraient également être revus prochainement. De nouvelles questions émergent sur le devenir des nouveau-nés dépistés à l’âge adulte : les mères avec phénylcétonurie ou avec hypothyroïdie ont besoin d’un encadrement médical lors de leur grossesse. Actuellement, nous sommes en mesure, dans certaines maladies de dépister des hétérozygotes, ce qui posent de nouvelles questions de prise en charge. Enfin, l’un des enjeux forts est l’introduction de nouveaux dépistages, comme le déficit en acyl-CoA déshydrogénase des acides gras à chaîne moyenne (MCAD), recommandé par la HAS, ou d’autres maladies métaboliques. Une expérimentation actuelle porte, par exemple, sur le dépistage des déficits immunitaires combinés sévères.
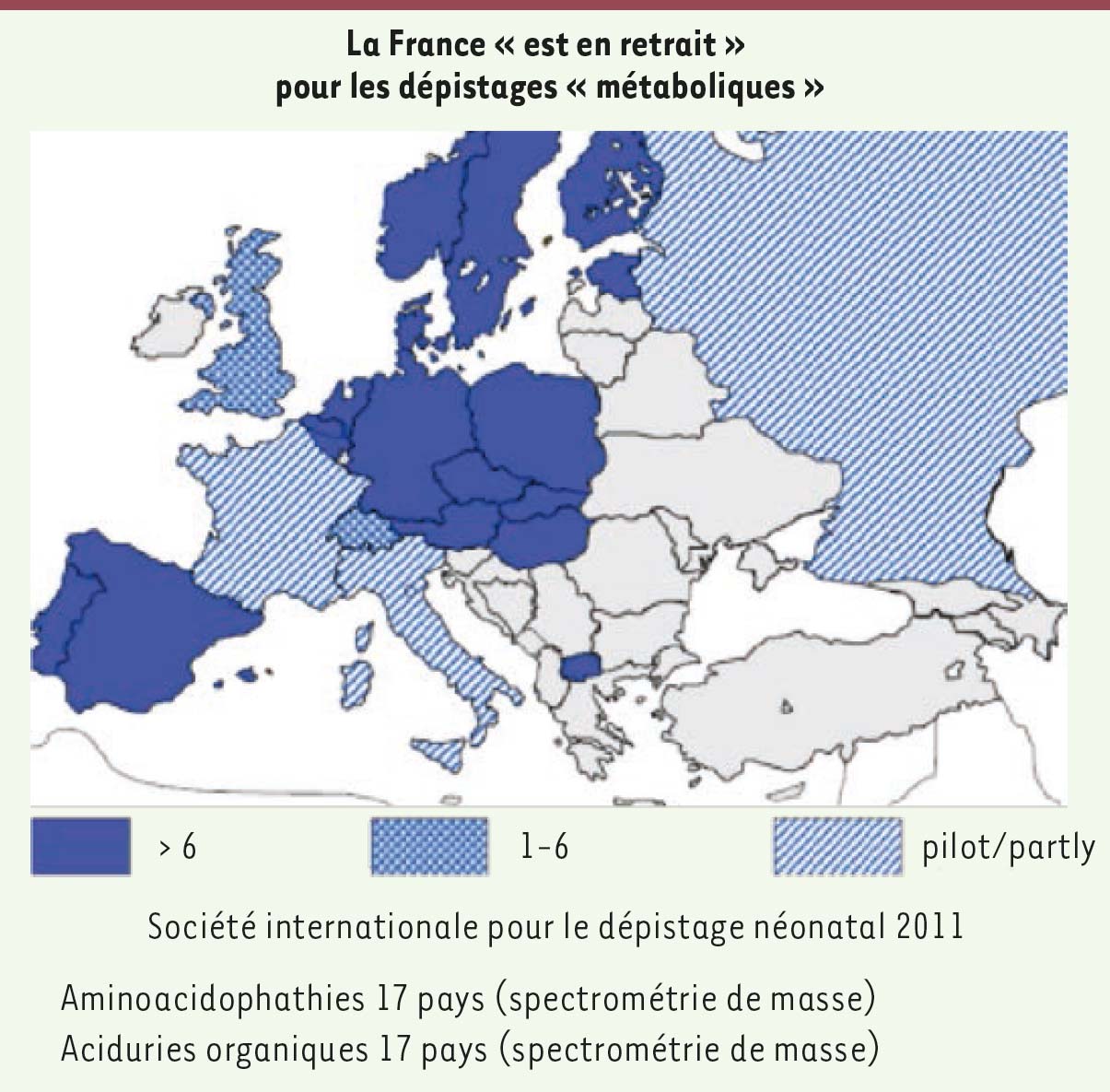
La France a été extrêmement active très tôt depuis les premières découvertes, mais elle a pris du retard (Figure 1). Des pays comme l’Allemagne et l’Autriche dépistent plus de vingt maladies métaboliques grâce à la spectrométrie de masse, alors que la seule maladie métabolique dépistée en France est la phénylcétonurie.
 | Figure 1 Les dépistages métaboliques en France. |
Un grand nombre d’enfants ne seraient pas décédés ou lourdement handicapés si le dépistage avait évolué en France de la même façon que dans d’autres pays.
L’extension du dépistage doit prendre en compte l’intérêt de ce dépistage pour les enfants dépistés, mais également l’absence d’effet délétère pour les enfants non malades. En effet, l’élargissement du dépistage entraîne un risque important de faux-positifs, c’est-à-dire de convoquer des parents dont les enfants ne sont pas malades ou dont l’atteinte n’est pas suffisamment grave pour justifier le dépistage néonatal. Le dépistage de la mucoviscidose en est un exemple. Ce dépistage se fait en deux étapes, d’abord biochimique puis génomique. L’évolution des concepts par rapport à ce dépistage a conduit à retirer certaines mutations du kit, car elles n’étaient pas prédictives d’une maladie suffisamment sévère pour être annoncée en période néo-natale. Chaque dépistage doit être étudié au cas par cas. Les conditions éthiques pour l’implémentation d’un nouveau-dépistage doivent bien súr être discutées.
La HAS travaille actuellement sur l’évaluation des maladies métaboliques à ajouter au panel des maladies à dépister en période néonatale. Il est fondamental que ce travail se fasse, mais il faut aussi mettre en place rapidement les mesures qui sont prévues pour faire évoluer le système français. Les laboratoires de dépistage néonatal doivent être équipés de spectromètres de masse en tandem, de techniciens de laboratoire, de biologistes pour valider les résultats et de ressources pour communiquer les résultats aux centres de référence et de compétences, pour que les patients puissent être dépistés et pris en charge dans les meilleurs conditions.
Pour ce qui est des maladies que l’on pourrait dépister, tout ou presque est techniquement possible aujourd’hui d’un point de vue biochimique, enzymologique et génétique. Les techniques de séquençage à haut débit sont aujourd’hui proposées pour le dépistage néonatal systématique. La question majeure, en réalité, est de déterminer pourquoi l’on veut dépister. Appeler une famille pour un dépistage néonatal positif, peu après la naissance, est un événement extrêmement traumatisant. Selon les critères actuels en vigueur, qui sont ceux retenus par l’OMS, il faut pouvoir offrir à cette famille une prise en charge du nouveau-né dépisté. L’évolution du dépistage en France devrait avoir pour objectif, non pas de dépister le plus possibles de maladies, mais de dépister tous les enfants qui pourraient, voire devraient, être traités avant d’être malades et qui ne le sont toujours pas.