| |
| Med Sci (Paris). 34(12): 1042–1045. doi: 10.1051/medsci/2018287.Échec de maturation ovocytaire Un rôle essentiel pour la protéine PATL2 dans l’ovogenèse Marie Christou-Kent,1 Pierre F. Ray,1,2 and Christophe Arnoult1* 1Génétique, épigénétique et thérapies de l’Infertilité, Institut pour l’avancée des biosciences, Inserm U1209, CNRS UMR 5309, université Grenoble Alpes, 38000Grenoble, France 2Unité de génétique de l’infertilité et diagnostic pré-implantatoire, CHU de Grenoble, 38000Grenoble, France MeSH keywords: Animaux, Femelle, Humains, Infertilité féminine, Souris, Protéines nucléaires, Ovocytes, Ovogenèse, Maladies ovariennes, Protéines de liaison à l'ARN, génétique, physiologie |
L’infertilité qui représente un enjeu majeur de santé, touche un couple sur sept et un facteur féminin est retrouvé dans plus de 70 % des infertilités de couple. Parmi les différentes causes connues d’infertilité féminine, les anomalies génétiques jouent un rôle prépondérant et sont impliquées dans les infertilités les plus sévères, comme l’insuffisance ovarienne [1] (→). (→) Voir la Nouvelle de S. Caburet et E. Vilain, m/s, n° 2, février 2015, page 129 Il est donc important d’identifier ces causes génétiques afin de proposer un meilleur diagnostic et d’envisager, par la compréhension moléculaire des physiopathologies de l’ovogenèse, des alternatives thérapeutiques. |
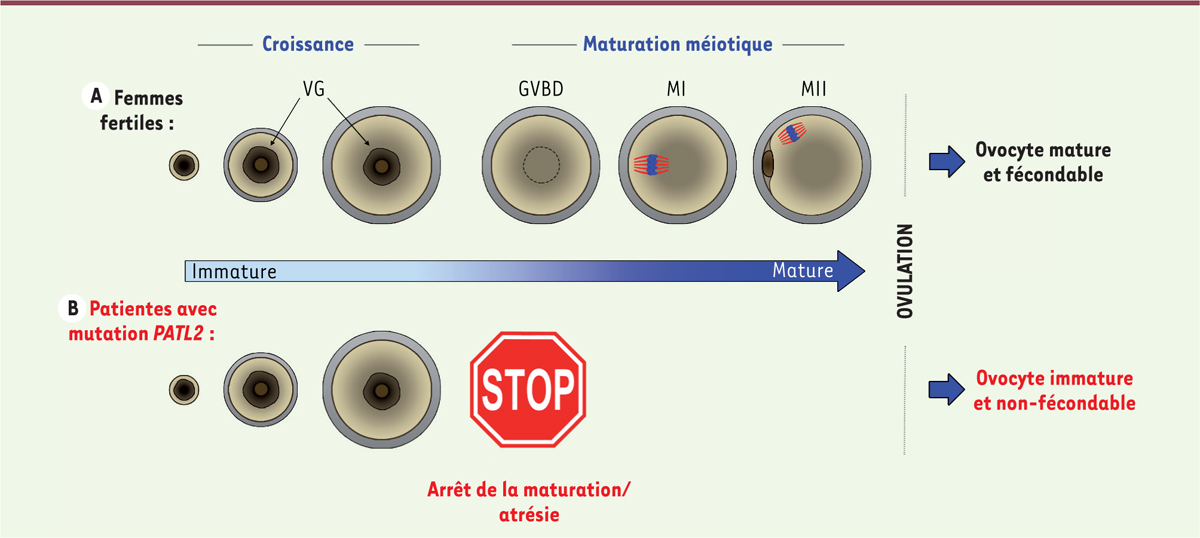
L’ovogenèse et la déficience méiotique ovocytaire (DMO) Chez la femme, la production d’ovocytes matures est un processus long et complexe qui débute lors du développement embryonnaire et s’arrête pendant une douzaine d’années pour reprendre à la puberté. Les ovocytes quiescents sont bloqués en prophase de méiose I. Ils sont entourés de quelques cellules folliculaires, l’ensemble formant les follicules primordiaux. Des follicules primordiaux sont recrutés de manière périodique. Ils commencent une croissance au cours de laquelle la taille des ovocytes va être multipliée par 10 et le nombre de cellules folliculaires par plus de 1 000, via une stimulation croisée entre cellules folliculaires et ovocyte. Le follicule mature, ou follicule antral, contient un ovocyte qui est au stade de vésicule germinale ou germinative (VG), encore bloqué au stade de prophase I. Le terme VG se réfère au noyau de l’ovocyte qui présente alors une membrane nucléaire qui peut être observée à l’aide d’une loupe binoculaire. Dans l’espèce humaine, ce processus se réalise en 290 jours [2, 3]. À ce stade, l’ovocyte est en attente d’une stimulation hormonale qui provoquera la reprise de la méiose, la rupture de la vésicule germinale (GVBD : germinal vesicle breakdown) et l’extrusion du premier globule polaire. Les ovocytes arrêtent de nouveau leur maturation au stade métaphase de méiose II (MII). Ils attendent un signal provenant du spermatozoïde pour poursuivre la méiose. Un type d’infertilité féminine, que nous avons appelé « déficience méiotique ovocytaire (DMO) », se caractérise par un échec de maturation de l’ovocyte [4, 5]. Les femmes atteintes de ce syndrome, produisent, malgré un cycle menstruel d’apparence normal, des ovocytes immatures qui ne sont pas aptes à la fécondation. Dans le cas d’une procréation médicalement assistée, ces ovocytes, récoltés après stimulations ovariennes, ne pourront donner des embryons. Le couple est alors stérile. Jusqu’à récemment, seul le gène TUBB8 (tubulin beta 8 class VIII), codant une isoforme de la tubuline, avait été identifié comme étant impliqué dans ce contexte d’infertilité [6]. |
Séquençage exomique d’une cohorte de patientes atteintes de la DMO Afin d’identifier des variants génétiques pouvant expliquer la déficience méiotique ovocytaire (DMO), nous avons analysé, par séquençage total de l’exome (ADN codant), une cohorte de 23 patientes atteintes de ce syndrome, présentant des blocages de maturation à divers stades (stade VG, stade M1) ou des ovocytes atrétiques1. L’analyse génétique a permis d’identifier une mutation délétère dans le gène PATL2 (protein-associated with topoisomerase II homolog 2) dans 26 % des ADN de patientes analysés ; ces patientes présentant un phénotype en commun : un blocage des ovocytes au stade immature VG (Figure 1).  | Figure 1. Le phénotype de « déficience méiotique ovocytaire (DMO) » chez des patientes avec un variant homozygote pathogène de PATL2. A. L’ovogenèse à partir d’ovocytes quiescents de follicules primordiaux et jusqu’à l’ovulation chez les femmes fertiles. VG : Vésicule germinale, GVBD : rupture de la vésicule germinale (Germinal vesicle breakdown), MI : métaphase I, MII : métaphase II. B. Le phénotype de blocage de maturation ovocytaire chez les patientes atteintes d’une mutation de PATL2. |
|
Transcription et contrôle des ARN messagers au cours d’ovogenèse - La protéine PATL2 Lors de la reprise de la méiose, la transcription est arrêtée jusqu’à l’activation du génome embryonnaire (EGA). C’est pourquoi, au cours de la croissance de l’ovocyte, on assiste à une synthèse massive d’ARN messagers (ARNm) nécessaires à la synthèse des protéines de l’ovocyte, mais également de protéines qui seront utilisées dans l’embryon avant l’EGA. Chez l’homme, l’EGA est assez tardif et est observé au stade 4-8 cellules. La gestion des ARNm au cours de l’ovogenèse est très spécifique et les voies de dégradation des transcrits sont en grande partie réprimées jusqu’à la fécondation [7]. Pour cela, des protéines régulatrices associées dans des complexes macromoléculaires avec les ARNm sont indispensables pour le développement ovocytaire. Parmi les différents acteurs, PATL2 pourrait jouer un rôle spécifique : son orthologue, chez le batracien Xenopus laevis (x-pat1a), est en effet essentiel dans la régulation des ARNm maternels et son expression est spécifique de l’ovocyte [8, 9]. Afin de mieux explorer la fonction de la protéine humaine PATL2, nous avons généré une lignée de souris déficiente pour le gène PATL2. |
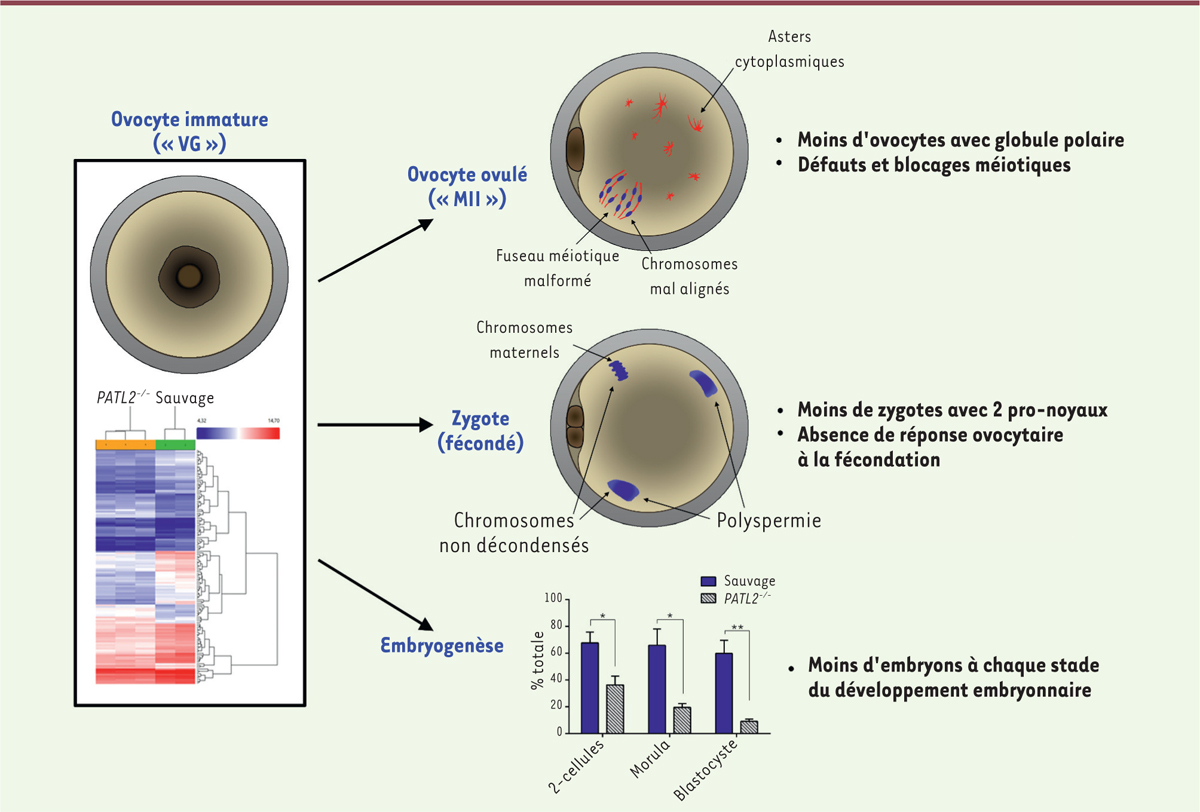
Phénotype des souris déficientes en PATL2Nous avons dans un premier temps étudié le phénotype reproductif des souris déficientes en PATL2 (PATL2-/-). Pour évaluer leur fertilité, les femelles PATL2-/- ont été mises en accouplement avec des mâles sauvages pendant une période de 6 mois. La taille moyenne des portées obtenues était plus de trois fois inférieure à la taille moyenne de celles des femelles contrôles pour la même période, et leur fréquence deux fois plus faible. Dans les expériences de fécondation in vitro (FIV), le taux de développement des embryons au stade « 2 cellules » des femelles PATL2-/- était diminué de moitié en comparaison des taux des embryons sauvages et le taux de développement jusqu’au stade blastocyste était plus de 6 fois inférieur à celui des contrôles (Figure 2).
 | Figure 2.La dérégulation du transcriptome des ovocytes VG de souris PATL2-/- et ses conséquences morphologiques et développementales. Comparaison des ovocytes de souris PATL2-/- et sauvages : (1) diminution de l’abondance des ARN messagers (ARNm) mesurée par analyse transcriptomique (micropuce), (2) différence de morphologie analysée par immunofluorescence (marquage de la β-tubuline et de l’ADN, en rouge et bleu respectivement) et (3) détermination des taux de développement obtenus par fécondation in vitro. (VG : vésicule germinale, MII : métaphase II). Ovocyte : en beige ; zone pellucide : en gris ; vésicule germinale/globules polaires : en marron ; fuseau méiotique/microtubules : en rouge ; et chromosomes : en bleu (figure adaptée de [ 10]). |
L’observation par immunofluorescence des ovocytes ovulés des femelles PATL2
-/- révèle : (1) un plus grand pourcentage d’ovocytes ovulés sans globule polaire (signe d’immaturité méiotique et absence du stade attendu MII), et (2) parmi les ovocytes avec globule polaire, un pourcentage élevé d’ovocytes qui présentent les signes de défauts méiotiques : fuseau malformé ou mal positionné, chromosomes mal alignés et augmentation du nombre d’« asters » (étoiles de tubuline) dans le cytoplasme (Figure 2). En analysant les zygotes de femelles PATL2-/- après fécondation, nous avons observé une réduction du pourcentage de zygotes au stade attendu de 2 pro-noyaux (14,4 % versus 53,4 %) et un nombre élevé de zygotes atypiques. Parmi ces zygotes anormaux, nous avons identifié soit un nombre atypique de pro-noyaux, soit une non-décondensation des chromosomes paternels et maternels souvent accompagnée d’une polyspermie2, indication d’une absence de réponse de l’ovocyte à la fécondation. Ce travail sur les souris déficiente PATL2-/- a donc permis de confirmer que la déficience de PATL2 entraînait un phénotype de DMO. Cependant, de manière surprenante, chez la souris, l’absence de PATL2 entraîne un phénotype moins sévère que chez l’homme. |
Analyse du transcriptome des ovocytes VG de souris PATL2-/- Étant donné le rôle de PATL2 chez les amphibiens, nous avons voulu explorer les conséquences de l’absence du gène au niveau des transcrits. Les ovocytes de femelles PATL2-/- isolés en stade VG sont légèrement plus petits que ceux des femelles sauvages au même stade, mais ils ne présentent pas d’autres défauts visuels. Les coupes d’ovaires des femelles PATL2-/-, à 12 jours et à 26 jours, ne montrent pas non plus d’anomalies morphologiques du développement des follicules. Pourtant, l’analyse transcriptomique met en évidence le fait que les ovocytes VG PATL2-/- issus de follicules antraux présentent une dérégulation, d’un facteur supérieur à 2, de l’expression de 134 gènes dont 95 sont sous-exprimés et 39 sur-exprimés. Ce nombre limité de gènes indique que PATL2 intervient de manière spécifique et ciblée dans la régulation des ARNm. Parmi les gènes dont l’expression est modulée, on retrouve des gènes codant des protéines ayant différentes fonctions : des facteurs de croissance et de différenciation de l’ovocyte, de l’assemblage et de la stabilité du fuseau méiotique, du contrôle de la méiose II et de la gestion du stress oxydatif, ainsi que des facteurs secrétés qui participent à l’interaction avec le cumulus (les cellules folliculaires). Étonnamment, une partie de ces transcrits correspondent à des protéines nécessaires à l’implantation de l’embryon. Ces dérégulations expliquent les défauts ovocytaires et embryonnaires observés, ainsi que les taux de développement diminués en l’absence de PATL2. Elles correspondent également au rôle de PATL2 comme régulateur de l’expression des ARNm. Restait donc à caractériser le rôle précis de PATL2 dans la gestion de ces ARNm. |
Une nouvelle fonction de PATL2 chez les mammifères ? Chez Xenopus laevis, la protéine codée par l’orthologue de PATL2, x-Pat1a, est associée, au sein d’un complexe macromoléculaire, à plusieurs autres protéines, comme Cpeb1 (cytoplasmic polyadenymation element-binding protein 1) et Frgy2 (frog Y-box protein 2), et est impliquée dans la régulation spécifique de certains ARNm. Nous n’avons pas trouvé que ces ARNm soient dérégulés dans le transcriptome des ovocytes VG des souris PATL2
-/-. Dans la lignée de souris « PATL2-étiquettée » (chez lesquelles une étiquette HA [human influenza hemagglutinin] est insérée à l’extrémité C-terminale de la protéine par la technique fondée sur CRISPR/Cas9), la réalisation d’un co-marquage sur des coupes d’ovaires n’a pas mis en évidence une co-localisation de PATL2 avec Cpeb1 et Ybx2 (Y box protein 2, alias Msy 2), la protéine murine équivalente à Frgy2. Chez la souris, le profil d’expression de la protéine codée par PATL2 semble différent de ceux de ces deux protéines. Une autre différence entre x-Pat1a (chez le xénope) et PATL2 (chez la souris) apparaît : chez le xénope, x-Pat1a est en effet fortement dégradée après la rupture de la vésicule germinale (GVBD, germinal vesicle breakdown) alors que PATL2 reste présente jusqu’au stade zygote chez la souris. Il est donc possible que la fonction de PATL2 ait évoluée entre ces deux vertébrés. Il serait donc très intéressant d’identifier les protéines partenaires et les ARNm cibles de PATL2 chez les mammifères afin de mieux comprendre son rôle dans l’ovogenèse. |
La mutation du gène PATL2 est donc une cause importante de la déficience méiotique ovocytaire chez la femme. Ces résultats devraient permettre aux patientes de bénéficier d’un meilleur diagnostic et d’une meilleure compréhension de leur pathologie. À plus long terme, des stratégies thérapeutiques pourront ainsi être envisagées. Nous avons également révélé le rôle important que PATL2 joue dans la régulation des ARNm maternels chez la souris. Ces découvertes améliorent notre compréhension des mécanismes de stockage et de contrôle des ARNm dans l’ovocyte de mammifères pendant sa maturation. Nos résultats pourraient être très pertinents dans le domaine novateur de la maturation in vitro des ovocytes. Cette technique a des applications potentielles multiples, comme le traitement de patientes atteintes d’insuffisance ovarienne précoce, mais également la préservation de la fertilité en vue d’une future reproduction pour les personnes atteintes de cancer et traitées par chimiothérapie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Caburet S, Vilain E. Mutation de STAG3 Une nouvelle cause d’insuffisance ovarienne prématurée . Med Sci (Paris). 2015; ; 31 : :129.–131. 2.
Li R, Albertini DF. The road to maturation: somatic cell interaction and self-organization of the mammalian oocyte . Nat Rev Mol Cell Biol. 2013; ; 14 : :141.–152. 3.
Williams CJ, Erickson GF. Morphology and physiology of the ovary . In: De Groot LJ, et al. eds. South Dartmouth (MA): : MDText.com, Inc; ; 2012. 4.
Beall S, Brenner C, Segars J. Oocyte maturation failure: a syndrome of bad eggs . Fertil Steril. 2010; ; 94 : :2507.–2513. 5.
Levran D, Farhi J, Nahum H, et al. Maturation arrest of human oocytes as a cause of infertility: case report . Hum Reprod. 2002; ; 17 : :1604.–1609. 6.
Feng R, Sang Q, Kuang Y, et al. Mutations in TUBB8 and human oocyte meiotic arrest . N Engl J Med. 2016; ; 374 : :223.–232. 7.
Svoboda P, Franke V, Schultz RM. Sculpting the transcriptome during the oocyte-to embryo transition in mouse. , 1st ed. New York: : Elsevier Inc.; , 2015 : :306. p. 8.
Nakamura Y, Tanaka KJ, Miyauchi M, et al. Translational repression by the oocyte-specific protein P100 in Xenopus . Dev Biol. 2010; ; 344 : :272.–283. 9.
Marnef A, Maldonado M, Bugaut A, et al. Distinct functions of maternal and somatic Pat1 protein paralogs . RNA. 2010; ; 16 : :2094.–2107. 10.
Christou-Kent M, Kherraf Z-E, Amiri-Yekta A, et al. PATL2 is a key actor of oocyte maturation whose invalidation causes infertility in women and mice . EMBO Mol Med. 2018; ; 10 : :e8515.. |