Le virus de la grippe A, ou virus influenza de type A (VIA), qui appartient à la famille des Orthomyxoviridae, cause des épidémies annuelles et des pandémies sporadiques qui en font un problème majeur de santé publique [1]. La grippe entraîne des symptômes locaux et systémiques de sévérité variable et peut être mortelle. Bien que la réponse immunitaire innée de l’hôte permette un contrôle précoce de la réplication virale, la sévérité des symptômes est liée à sa suractivation à l’origine notamment d’une hypercytokinémie1, [1]. Comprendre les mécanismes d’induction et de régulation de la réponse immunitaire innée au cours de l’infection est donc essentiel pour lutter efficacement contre la grippe.
Le VIA est un virus enveloppé, dont le génome est segmenté en 8 ARN simple brin à polarité négative codant chacun une ou plusieurs protéines [1]. La réplication des ARN viraux s’effectue dans le noyau de la cellule infectée. Le VIA est détecté par les cellules de l’hôte par les récepteurs de reconnaissance de motifs moléculaires associés aux pathogènes. Dans les cellules infectées, le principal et le plus ubiquitaire de ces récepteurs permettant la détection de la présence du virus, RIG-I (retinoic acid-inducible gene I), s’active en présence d’ARN 5’-triphosphate, un motif moléculaire associé à certains virus, dont le VIA [1]. L’activation de RIG-I permet, par l’intermédiaire de la protéine adaptatrice mitochondriale MAVS (mitochondrial antiviral-signaling protein), d’activer les facteurs de transcription NF-κB (nuclear factor-kappa B) et IRF-3/IRF-7 (interferon regulatory factor 3/7) qui, à leur tour, induisent l’expression de cytokines inflammatoires telles que les interférons (IFN) de type I, cytokines clés de la réponse immunitaire antivirale innée [1]. Face à cette réponse, le VIA est capable de limiter l’activation de RIG-I dans les cellules qu’il infecte, principalement via l’action de sa protéine non structurale 1 (NS1) [1, 2].
L’infection par le VIA perturbe les voies métaboliques de la cellule hôte et notamment la macroautophagie (par la suite désignée « autophagie ») (→).
(→) Voir le numéro thématique Autophagie, m/s n° 3, mars 2017
L’autophagie est une voie du catabolisme cellulaire qui dégrade les éléments cytoplasmiques tels que les organites endommagés et les agrégats protéiques après leur isolement au sein de vésicules à double membrane. Ces vésicules, appelées autophagosomes, fusionnent après leur formation avec les lysosomes selon un processus de maturation qui conduit à la dégradation enzymatique de leur contenu [3]. En réponse à un stress cellulaire (par exemple le manque en nutriments), l’autophagie agit comme un mécanisme de survie cellulaire en permettant notamment la production de nouveaux nutriments à partir du contenu vésiculaire. De nombreux virus distants du point de vue de leur évolution perturbent l’activité autophagique des cellules qu’ils infectent [3]. En particulier, le VIA stimule l’autophagie. Cependant, sa protéine de matrice 2 (M2) interfère avec l’étape de maturation des autophagosomes [4]. Si, pour de nombreux virus, il a été montré que l’autophagie impacte la réplication virale et/ou la réponse cellulaire à l’infection [5], le rôle de l’autophagie et sa perturbation par le VIA sont encore peu compris.
Les méthodes communément utilisées en laboratoire pour étudier l’autophagie sont peu spécifiques. Elles perturbent en effet d’autres processus métaboliques et/ou les réponses inflammatoires cellulaires, ce qui rend particulièrement difficile l’interprétation des résultats. Ainsi, les inhibiteurs de mTOR (mammalian target of rapamycin), utilisés pour induire l’autophagie, perturbent également la transcription et la traduction cellulaires ainsi que le métabolisme mitochondrial [6]. L’utilisation de la transfection de petits ARN interférents (pARNi) pour limiter l’expression de gènes codant des protéines impliquées dans l’autophagie montre également des limites puisque la transfection entraîne, en elle-même, un stress cellulaire. Les pARNi peuvent aussi activer les voies de signalisation de l’immunité innée de manière variable, selon leur structure/séquence nucléotidique, ce qui peut conduire à des phénotypes artéfactuels [7]. L’utilisation d’invalidation génique (knock-out en anglais) dans des lignées cellulaires afin de les rendre incapables d’autophagie montre également des limites : la perte d’un processus clé du métabolisme cellulaire, au cours de plusieurs passages (ou cultures en série) rend risquée la comparaison de telles lignées avec des lignées parentales sans délétion de gène. La dérive génétique entre lignées cellulaires peut en effet être rapide et générer des différences de phénotype qui ne sont pas liées à la perte de l’autophagie induite par la délétion initiale. Pour toutes ces raisons, et pour étudier les interactions entre des phénomènes biologiques complexes (l’autophagie, le stress cellulaire, la réplication virale et les voies de l’immunité innée), nous avons développé des modèles cellulaires dans lesquelles la capacité d’autophagie peut être modulée de manière spécifique et rapide au sein d’une même lignée cellulaire.
Nous avons utilisé des lignées de fibroblastes embryonnaires murins (FEM) déficients pour Atg (autophagy-related)5 ou Atg7 (Atg5 –/– ou Atg7 –/–), des gènes nécessaires à l’autophagie [8] (→).
(→) Voir la Synthèse de I. Vergne et al., m/s n° 3, mars 2017, page 312
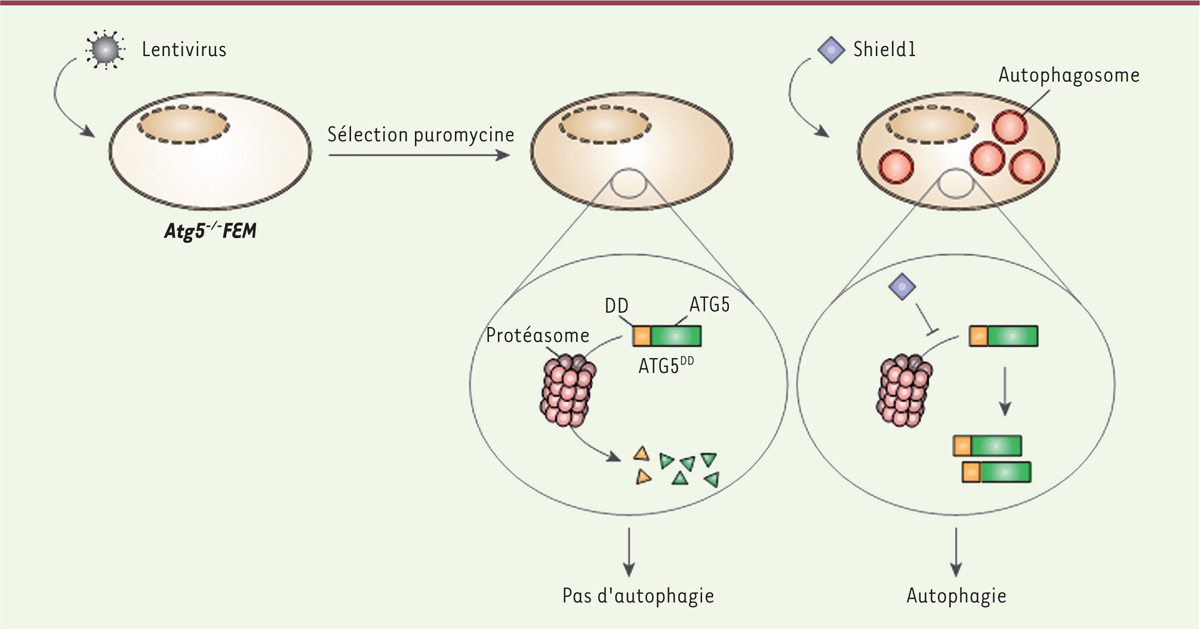
Nous avons ensuite modifié génétiquement ces lignées pour qu’elles expriment une version des protéines ATG5 ou ATG7, désignées ATG5DD ou ATG7DD, fusionnées à leur extrémité N-terminale avec un domaine de déstabilisation (DD) [9]. La fusion de ce DD à une protéine entraîne sa dégradation par le protéasome. Cette dégradation peut être empêchée par une petite molécule chimique, appelée Shield1, à laquelle la membrane plasmique est perméable2,. Shield1 n’induit pas de changement transcriptomique par elle-même [9]. Nous avons montré que l’ajout de Shield1 dans le milieu de culture des FEM Atg5 –/– et exprimant ATG5DD, et dans les FEM Atg7 –/– exprimant ATG7DD, induisait effectivement la stabilisation des protéines fusionnées au motif DD et permettait aux cellules de retrouver leur capacité autophagique (Figure 1) [10]. Ce modèle nous a permis de montrer que l’autophagie n’impacte pas la propension des cellules à s’infecter, ni leur capacité à produire de nouvelles particules virales [10].
| Figure 1. Stratégie de génération des modèles cellulaires à capacité autophagique modulable. L’exemple des fibroblastes embryonnaires murins (FEM) Atg5–/– (autophagy-related 5) exprimant de façon stable ATG5DD. L’infection lentivirale des FEM Atg5–/– suivie d’une sélection par la puromycine a permis l’expression stable d’ATG5DD (ATG5 fusionnée au motif de déstabilisation DD) dans ces cellules. Cette protéine de fusion est rapidement dégradée par le protéasome : ces cellules sont donc incompétentes pour l’autophagie. Après ajout de la petite molécule chimique Shield1, qui lie le motif DD, la dégradation de la protéine de fusion est empêchée et la capacité cellulaire d’autophagie est restaurée. |
Pour étudier l’impact de l’autophagie sur la réaction cellulaire à l’infection, nous avons utilisé une méthode permettant la quantification des molécules d’ARN messagers sans étape de transcription inverse ou d’amplification enzymatique. Nous avons ainsi pu estimer l’expression de 561 gènes impliqués dans l’immunité, le stress et la mort cellulaires. Les cellules incapables d’autophagie présentaient une signature inflammatoire liée à la voie des IFN de type I plus importante que les cellules à capacité d’autophagie intacte [10]. L’expression du gène Ifnb1, codant l’IFN-β, le seul IFN de type I exprimé par ces cellules, était supprimée par autophagie dans les cellules dès une heure et demi après l’infection, entraînant une induction réduite des gènes stimulés par ces IFN [9]. Parmi ces gènes, on trouve les gènes codant CD274 (aussi connue sous le nom PD-L1 [programmed death-ligand 1]), un régulateur négatif majeur de la réponse immunitaire adaptative impliquant les lymphocytes T, le complexe majeur d’histocompatibilité de type I (CMH I), participant à l’élimination des cellules infectées, et CXCL10 (chemokine [C-X-C motif] ligand 10), une chimiokine permettant notamment l’attraction des lymphocytes cytotoxiques spécifiques des cellules infectées.
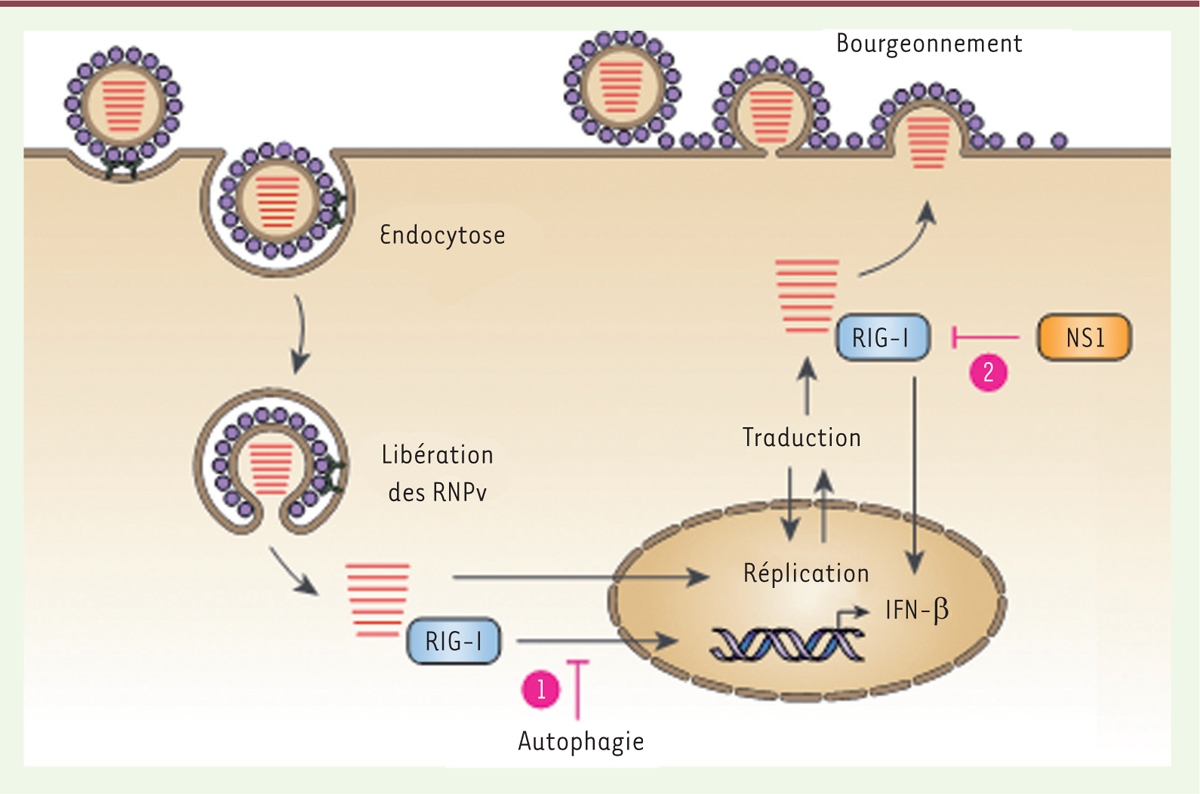
Puisque NS1 (non-structural protein 1) est l’inhibiteur viral majeur de la voie des IFN de type I en cas d’infection par le VIA, nous avons cherché à savoir si l’impact négatif de l’autophagie sur l’induction d’IFN-β dépendait de cette protéine virale. L’utilisation d’une souche de VIA incapable de synthétiser NS1 a révélé que cette protéine virale n’était pas nécessaire à la fonction anti-inflammatoire de l’autophagie [10]. Notons ici que NS1 ne semble pas être présente en quantité suffisante dans les virions [11] et nécessite donc une traduction de novo dans la cellule infectée pour exercer cette fonction. Nous avons donc décrit un autre mécanisme anti-inflammatoire, plus précoce, et indépendant de NS1, impliquant l’autophagie (Figure 2).
| Figure 2. Modèle des mécanismes précoce et tardif de limitation de la détection des virus influenza A (VIA) par RIG-I dans la cellule infectée durant le cycle viral. Après l’endocytose du VIA, les ribonucléoprotéines virales (RNPv), qui sont libérées dans le cytosol, sont détectées par RIG-I (retinoic acid-inducible gene I). Ceci conduit à la transcription de Ifnb1 (interféron β-1) qui est réprimée par l’autophagie (1) et induite par le virus. Les RNPv sont ensuite importées dans le noyau où les ARN viraux sont produits, et deviennent invisibles à RIG-I qui est une protéine cytosolique. La traduction de la protéine non structurale 1 (NS1) a alors lieu. NS1 permet l’inhibition de l’activation de RIG-I quand les RNPv sortent du noyau et transitent vers la membrane plasmique pour permettre la génération et le bourgeonnement des nouveaux virions (2) ; ceci constitue une inhibition tardive de l’induction d’IFN-β par la cellule infectée. |
Nos modèles cellulaires ont révélé que l’autophagie, de manière précoce et intrinsèque aux cellules infectées, limite leur propension à sécréter l’IFN-β, ce qui diminue l’expression des gènes stimulés par cette cytokine, notamment celle d’acteurs clés de la réponse immunitaire adaptative (CD274, CMH I et CXCL10). Il serait désormais intéressant d’étudier dans des cellules épithéliales pulmonaires (cibles du virus) et dans des modèles murins d’infection, l’impact de l’autophagie sur la réplication virale, la réponse inflammatoire et la réponse immunitaire adaptative, ainsi que sur la sévérité des symptômes induits par l’infection.
L’autophagie est donc induite de manière précoce par le VIA. La protéine de matrice 2 du virus interfère ultérieurement avec l’étape de maturation des autophagosomes.
Une meilleure compréhension des dynamiques de perturbation de l’autophagie par le VIA et du rôle des différentes protéines impactant l’activité autophagique pourrait permettre le développement de nouvelles molécules antivirales ou immunomodulatrices pour limiter la pathologie associée à ce virus, mais également la génération de virus atténués induisant une réponse immunitaire plus forte dans le cadre de développement de vaccins.