La caractéristique majeure des lymphocytes T CD8 est leur capacité à distinguer les cellules normales des cellules anormales (qu’elles soient infectées ou tumorales) grâce à leur récepteur membranaire, le TcR (T cell receptor). Le mécanisme d’action de ces cellules repose sur la reconnaissance d’antigènes tumoraux ou viraux présentés par le complexe majeur d’histocompatibilité de classe I (CMH-I) à la surface des cellules infectées ou tumorales, par leur TcR, conduisant à l’expression et à la production de protéines pro-apoptotiques (comme Fas-ligand, les granzymes ou la perforine) qui induisent la mort des cellules reconnues.
Les premières descriptions de l’activité anti-tumorale des lymphocytes T CD8 ont été relatées à la fin du xx e siècle, avec l’observation que les lymphocytes T CD8 présents dans les tumeurs de patients perdaient leur fonction cytolytique et devenaient incapables de tuer les cellules cancéreuses. Cette inefficacité des lymphocytes T CD8 à tuer les cellules cancéreuses repose sur l’expression à leur membrane de molécules capables d’inhiber leur réponse, comme PD-1 (programmed cell death-1). Le développement récent d’immunothérapies qui visent spécifiquement ces molécules inhibitrices (comme le nivolumab ou le pembrolizumab) a révolutionné le traitement de certains cancers [1, 2] (→).
(→) Voir le Dossier technique de T. Idziorek et al., m/s n° 5, mai 2018, page 439
Néanmoins, certains patients ne répondent pas à ces thérapies. Une meilleure compréhension de la fonctionnalité des lymphocytes T CD8 présents dans les tumeurs pourrait donc permettre d’améliorer les thérapies contre le cancer.
Notre équipe s’est intéressée à l’identification des antigènes tumoraux reconnus par les lymphocytes T CD8. Actuellement, la plupart des recherches porte sur les néoantigènes, des peptides résultant de la traduction de gènes affectés par des mutations non-synonymes dans le génome des cellules tumorales. Ces mutations sont à l’origine de la production de peptides « nouveaux » qui ne sont pas issus du soi (ou néoantigènes). Ils sont spécifiques de chaque patient (en fonction des mutations et selon l’haplotype du CMH-I que leurs cellules expriment). Les cibler nécessite donc une thérapeutique personnalisée [3].
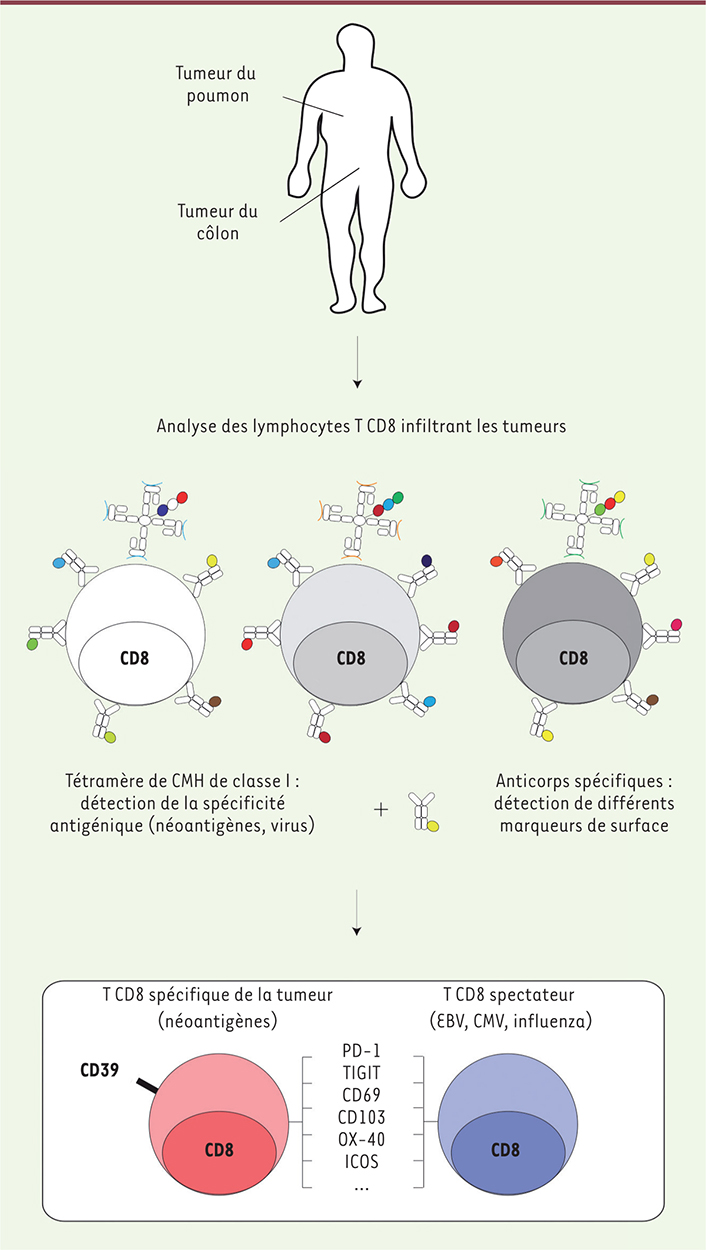
Le large spectre de néoantigènes possiblement exprimés par les cellules tumorales a rendu difficile les études expérimentales visant à caractériser la spécificité des lymphocytes T CD8 infiltrant les tumeurs qui leur sont spécifiques et seuls quelques épitopes ont été identifiés, chez la souris et chez l’homme. Chez l’homme, les peptides identifiés comme néoantigènes ont été caractérisés après expansion ex-vivo des lymphocytes T CD8. La fréquence de leur expression ou le phénotype observable in vivo était donc difficile à déterminer et aucune étude n’avait analysé simultanément les différentes classes d’antigènes tumoraux. De nouveaux outils, comme le tétramère de CMH-I, une molécule artificielle permettant la présentation in vitro de peptides déterminés, rendent désormais possible la détection de lymphocytes T CD8 qui leurs sont spécifiques.
La méthode de « marquage combinatoire des tétramères » a été développée dans notre laboratoire, permettant d’identifier un grand nombre de lymphocytes T CD8 spécifiques de différents peptides en une seule expérience [4]. En combinant cette approche avec la cytométrie de masse [5] (→) nous avons pu identifier plusieurs centaines de peptides, présentés par les tétramères capables d’interagir avec les TcR des lymphocytes.
(→) Voir l’Éditorial de S. Champiat et J.C. Soria, m/s n° 6-7, juin-juillet 2017, page 563
En collaboration avec les équipes hospitalières du National cancer center de Singapour, nous avons examiné 144 échantillons issus de patients atteints de cancer du côlon ou du poumon et déterminé la présence de lymphocytes T CD8 [6]. Seuls 0,18 % des néoantigenes prédits in silico ont été détectés dans cette étude et confirmés expérimentalement : les algorithmes proposant les néoantigènes candidats restent donc largement à parfaire. Cette étude illustre ainsi la difficulté d’identifier les lymphocytes T CD8 spécifiques de néoantigènes.
Au cours de cette étude, nous avons observé, au sein même du microenvironnement tumoral, des lymphocytes T CD8 spécifiques pour des antigènes viraux inattendus, comme le virus de la grippe ou le cytomégalovirus. L’analyse de l’expression de marqueurs associés aux lymphocytes T résidents-mémoire (CD69 et CD103) a cependant permis d’exclure une possible contamination sanguine. Des lymphocytes, qui ne sont pas spécifiques d’antigènes tumoraux, peuvent donc infiltrer les tumeurs chez l’homme. Nous avons nommé ces cellules « bystander » (ou spectatrices) [6].
En comparant le phénotype de lymphocytes T CD8 spécifiques d’antigènes tumoraux à celui des cellules spectatrices, nous avons révélé que PD-1, proposé comme un marqueur de lymphocytes T spécifiques des tumeurs, était également exprimé par des lymphocytes T CD8 spectateurs. Nous avons également observé que le marqueur de surface CD39 était, lui, spécifiquement exprimé par les lymphocytes T CD8 ciblant les tumeurs, et absent des lymphocytes spectateurs (Figure 1). Nous avons alors proposé que l’expression de CD39 pouvait être une conséquence de la stimulation chronique du TcR des lymphocytes T au sein du microenvironnement tumoral, en réponse à la présence d’un néoantigène à la surface des cellules tumorales. En étudiant le transcriptome de lymphocytes T CD8 (CD39+ ou CD39-) issus de tumeurs du côlon et du poumon, nous avons montré que les cellules T CD8 CD39+ présentaient une signature transcriptomique d’activation et d’épuisement (exhaustion) compatible avec l’hypothèse d’une stimulation antigénique chronique [6].
| Figure 1. Analyse des populations de lymphocytes T CD8 intra-tumoraux. Des tumeurs du poumon et du côlon ont été analysées par cytométrie de masse, par un marquage combinatorial des tétramères CMH-I (complexe majeur d’histocompatibilité de classe I) permettant d’étudier la spécificité du TCR (T cell receptor), et par des marquages de molécules membranaires. Des lymphocytes T CD8 spécifiques de néoantigènes et de virus ont été détectés. CD39 est exprimé par les lymphocytes T spécifiques de néoantigènes et absent sur ceux spécifiques de virus. EBV : Epstein Barr virus ; CMV : cytomégalovirus ; PD1 : programmed cell death 1 ; TIGIT : T cell immunoreceptor with Ig and ITIM domains ; OX-40 : tumor necrosis factor receptor superfamily, member 4 ; ICOS : inducible T-cell COStimulator. |
Dans le sang d’un patient traité par un anticorps anti-PD-1, après réponse au traitement, l’expression de CD39 est associée à celle du marqueur de prolifération Ki67. Cette population de cellules qui expriment CD39 et Ki67 pourrait donc représenter un marqueur précoce de la réponse du patient au traitement. À noter que, parmi les patients atteints de cancers du poumon, ceux présentant des tumeurs avec des mutations du gène codant l’EGFR (epidermal growth factor receptor), qui sont associées à une plus faible réponse aux traitements par les anticorps anti-PD-1 [7], présentent des tumeurs moins infiltrées par les lymphocytes T CD8 CD39+ [6]. Une évaluation de l’expression d’un marqueur de surface, comme CD39, pourrait donc permettre de différencier localement les lymphocytes T CD8 spécifiques de l’antigène tumoral des cellules spectatrices. Ceci pourrait permettre de faciliter grandement l’étude des lymphocytes T CD8 spécifiques, en permettant leur enrichissement par cytométrie en flux. Les thérapies cellulaires, fondées sur l’utilisation de lymphocytes T autologues cultivés ex-vivo, pourraient aussi permettre d’enrichir la population de lymphocytes T CD8 spécifiques des tumeurs en culture. Dans d’autres situations de stimulation antigénique, par exemple au cours de maladies autoimmunes ou d’infections chroniques, il apparaît possible que CD39 puisse permettre l’identification de lymphocytes T spécifiques d’un antigène lié à la pathologie.
Dans les cohortes de patients que nous avons analysées, nous avons observé une grande hétérogénéité de fréquence de cellules CD39+ parmi les lymphocytes T CD8 infiltrant les tumeurs. Chez certains patients, une grande proportion de lymphocytes infiltrant ne serait pas spécifique d’antigènes tumoraux. Des études sur des cohortes plus importantes devraient permettre d’évaluer si la quantification des cellules CD39+ peut aider à affiner les prédictions cliniques associées aux marqueurs immunitaires, comme la présence de lymphocytes T CD8 effecteurs mémoire, qui est corrélée à un bon pronostic [8].
La spécificité des lymphocytes T CD4+ pour des antigènes tumoraux est difficile à étudier car la prédiction algorithmique de l’affinité de peptides pour le CMH-II est complexe. Si les résultats de l’étude que nous relatons ici s’avèrent être applicables à ces lymphocytes, ils permettraient d’ouvrir un nouvel axe pour l’analyse de leur spécificité vis-à-vis des antigènes. Cependant, les lymphocytes T CD4 régulateurs exprimant CD39 au sein du microenvironnement tumoral, il sera nécessaire de les examiner indépendamment.
Notre travail a donc permis de révéler l’existence d’une proportion importante de lymphocytes T CD8 infiltrant les tumeurs qui ne sont pas spécifiques d’antigènes tumoraux. Ces lymphocytes, qui ne peuvent donc induire l’apoptose des cellules tumorales, peuvent être distingués par leur absence d’expression du marqueur de surface CD39, ce qui pourrait permettre d’améliorer les thérapies et les marqueurs pronostiques existant.