| |
| Med Sci (Paris). 34(12): 1025–1028. doi: 10.1051/medsci/2018283.Transition des cellules de mélanome vers un phénotype invasif et pharmacorésistant Un rôle pour NAMPT et le NAD Corine Bertolotto,1,2* Mickaël Ohanna,1,2 and Robert Ballotti1,2 1Université Nice Côte d’Azur, Inserm, C3M, 151, route Saint Antoine de Ginestière, 06204Nice, France 2Inserm, U1065, Biology and pathologies of melanocytes. Équipe labellisée ARC 2015, Nice, France MeSH keywords: Animaux, Protocoles de polychimiothérapie antinéoplasique, Cytokines, Résistance aux médicaments antinéoplasiques, Antienzymes, Humains, Mélanome, Thérapie moléculaire ciblée, NAD, Invasion tumorale, Nicotinamide phosphoribosyltransferase, Phénotype, Tumeurs cutanées, usage thérapeutique, antagonistes et inhibiteurs, physiologie, génétique, traitement médicamenteux, métabolisme, anatomopathologie |
Le mélanome cutané dérive des mélanocytes, des cellules de la peau dont la fonction physiologique est la production de pigments mélaniques responsables de notre couleur de peau en lien avec la protection solaire. Son incidence a augmenté ces trois dernières décennies et c’est environ 15 000 nouveaux cas qui sont diagnostiqués chaque année en France. Dépisté de manière précoce, le mélanome se guérit, avec 85 % de survie sans récidive à 5 ans. En revanche, s’il devient métastatique, le taux de survie à 5 ans chute dramatiquement à 10-15 %. Des avancées spectaculaires ont été réalisées récemment dans le traitement du mélanome cutané métastatique grâce aux thérapies ciblées et aux immunothérapies qui, pour la première fois, ont permis d’augmenter la survie globale des patients. Cependant, il reste un besoin thérapeutique important pour cette maladie, car les réponses cliniques restent transitoires ou limitées à des sous-groupes restreints de patients en raison de résistances intrinsèques ou acquises. Ces résistances peuvent avoir pour origine des altérations génétiques, mais la plasticité phénotypique due aux remodelages génique et métabolique de la tumeur est maintenant acceptée comme la principale source de résistance [1]. Les mélanomes sont constitués de deux sous-populations cellulaires principales : les cellules prolifératives et invasives, qui, sous l’effet de stress (l’hypoxie, la carence en nutriments, le traitement lui-même, etc.) peuvent transiter entre ces deux phénotypes et s’adapter aux conditions environnementales, créant ainsi une hétérogénéité intra-tumorale qui aura un impact sur la réponse aux traitements. Notre équipe a montré le rôle clé de la protéine MITF (microphthalmia-associated transcription factor), un facteur essentiel à l’homéostasie mélanocytaire [2-4] (→) dans la plasticité des cellules de mélanome [5-7]. (→) Voir la nouvelle de C. Bertolotto et al., m/s n° 3, mars 2012, page 258 Comprendre les mécanismes moléculaires impliqués dans la plasticité cellulaire afin de lutter contre la transition phénotypique et l’hétérogénéité intratumorale responsables des résistances et des récidives reste un objectif essentiel. La transformation maligne des cellules, telles que celle des mélanocytes à l’origine du mélanome, est associée à une augmentation de l’activité métabolique et au développement d’un métabolisme glycolytique, contrairement aux cellules normales qui utilisent la phosphorylation oxydative. Cette propriété des cellules malignes est exploitée dans la tomographie par émission de positrons (TEP) : elle mesure l’absorption de 18F-désoxyglucose (un dérivé de glucose radiomarqué) afin de visualiser les tumeurs et évaluer les effets thérapeutiques. Un lien entre l’expression de l’oncogène BRAFV600E 1, principale altération génique observée dans le mélanome cutané, et l’activation des voies métaboliques a par ailleurs été rapporté [8]. Le PLX4032 (ou vemurafenib), l’inhibiteur de la protéine BRAF mutée qui est utilisé en clinique, inhibe la glycolyse et la prolifération. Cependant, les cellules de mélanome traitées par le PLX4032 sont capables de rétablir un métabolisme oxydatif pour survivre, via, d’une part, la réduction des transporteurs du glucose, GLUT1 et GLUT3, et de l’enzyme glycolytique héxokinase 2, et, d’autre part, l’augmentation de l’expression de PGC1A (proliferator-activated receptor γ coactivator 1α), un effecteur important de la biogenèse mitochondriale et de la phosphorylation oxydative. De plus, les cellules résistantes aux inhibiteurs de BRAF utilisent, comme source de carbone, la glutamine, au détriment du glucose. Il a été démontré que le métabolisme cellulaire interfère globalement avec le phénotype des cellules de mélanome [9]. Ainsi, les cellules de mélanome, grâce à leur plasticité, ont la capacité de s’adapter aux conditions environnementales et à la disponibilité fluctuante des ressources énergétiques [8]. Ces voies métaboliques alternatives pourraient contribuer à l’acquisition de la résistance au PLX4032 et à l’échec du traitement chez les patients atteints de mélanome. La question du métabolisme mis en jeu par les cellules en réponse aux inhibiteurs de BRAF se posait donc afin d’identifier les mécanismes compensatoires pouvant contribuer à la résistance des cellules au traitement et dont l’inhibition pourrait permettre d’améliorer l’efficacité des thérapies et de prévenir les récidives. Notre équipe a étudié l’ensemble des modifications métaboliques précoces induites lors d’un traitement par le PLX4032. Les résultats obtenus ont révélé une dérégulation du métabolisme du NAD (nicotinamide adénine dinucléotide). Cette observation est intéressante puisque le NAD joue un rôle essentiel dans de nombreuses fonctions cellulaires, comme la production énergétique (la glycolyse, la phosphorylation oxydative et la β-oxydation), les mécanismes de réparation de l’ADN et le remodelage de la chromatine. |
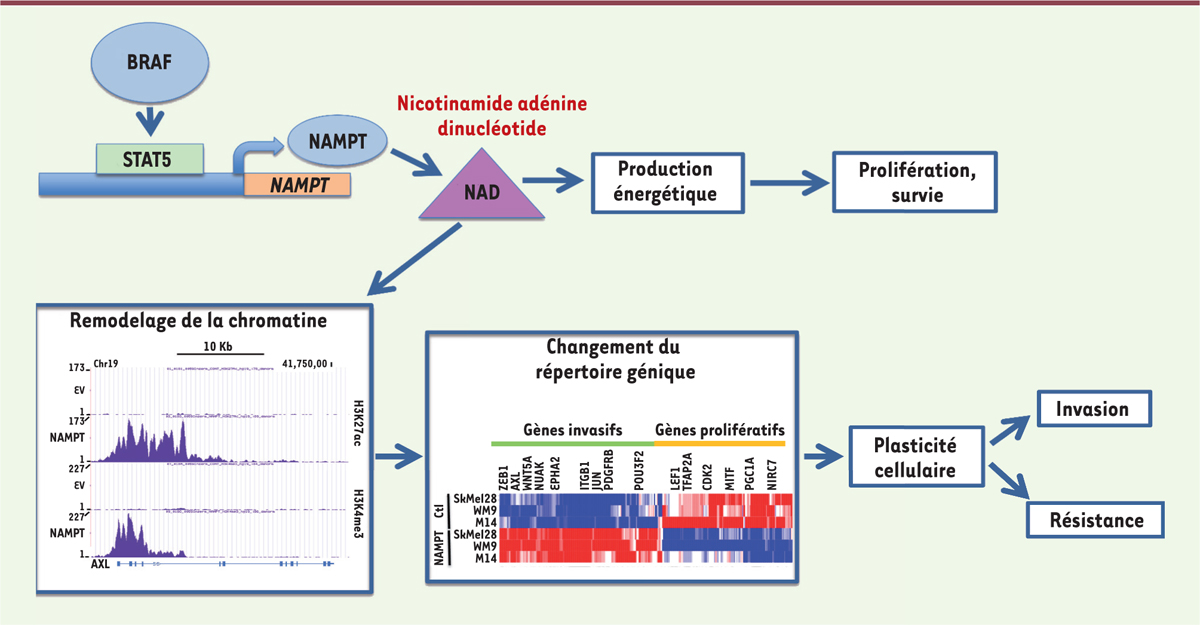
NAMPT est régulé par la voie BRAF/STAT5 et favorise la résistance aux thérapies ciblées Plusieurs précurseurs et enzymes sont impliqués dans les voies de biosynthèse du NAD. Chez les mammifères, il est principalement synthétisé via la voie du recyclage à laquelle participe la nicotinamide phosphoribosyltransférase (NAMPT) [10]. Dans les cellules de mélanome, un inhibiteur de NAMPT induit une inhibition drastique du niveau de NAD, démontrant que cette enzyme est essentielle au maintien du niveau intracellulaire de NAD dans ces cellules. La voie de signalisation BRAF/ERK (extracellular signal-regulated kinase) régule la transcription et l’expression de NAMPT et le niveau cellulaire de NAD, via l’activation de STAT5 (signal transducer and activator of transcription-5) (Figure 1). Or, il a été montré que, dans les cellules de mélanome résistantes aux inhibiteurs de BRAF, l’expression de NAMPT est régulée au niveau transcriptionnel par STAT3, un autre membre de la famille STAT, et par les facteurs HIF1α (hypoxia-inducible factor-1α) et NFB (nuclear factor-kappa B) [11]. NAMPT joue un rôle déterminant dans la réponse aux thérapies ciblées. Une augmentation de son expression, qui se traduit par une amplification du taux de NAD, inhibe les effets cytotoxiques des inhibiteurs de BRAF in vitro, comme l’ajout de NAD exogène [11, 12].
 | Figure 1.
Régulation et implication de la voie de la nicotinamide dans les cellules de mélanome. La nicotinamide phosphoribosyltransférase (NAMPT), qui régule la synthèse du NAD (nicotinamide adénine dinucléotide), est contrôlée par la voie de signalisation BRAF/ERK/STAT5. Le NAD exerce des fonctions cellulaires importantes. Il régule la production énergétique (la β-oxydation, la glycolyse et la phosphorylation oxydative) et agit comme substrat de plusieurs enzymes impliquées dans le remodelage de la chromatine (comme l’histone déacétylase sirtuine 1) et la réparation de l’ADN (la poly[ADP-ribose] polymérase). Dans les cellules de mélanome, l’augmentation de NAMPT modifie le paysage épigénétique comme le montre l’analyse des modifications des histones (acétylation de l’histone H3 sur la lysine 27 [H3K27Ac] et triméthylation de la lysine 4 [H3K4Me3]) sur le chromosome 19 au niveau du gène AXL (du grec anexelekto, récepteur tyrosine kinase à activité transformante). Le surcroît de NAMPT modifie également le répertoire génique et favorise la reprogrammation des cellules de mélanome vers un phénotype plus invasif et pharmaco-résistant. SkMel28, WM9 et M14 sont trois lignées cellulaires de mélanome. BRAF: v-raf murine sarcoma viral oncogene homolog B1 ; ERK : extracellular signal-regulated kinase ; STAT5 : signal transducer and activator of transcription-5 ; Ctl : contrôle ; EV : vecteur vide. |
|
NAMPT favorise la transition vers un phénotype invasif et pharmaco-résistant Nous avons réalisé une étude transcriptomique pour déterminer comment NAMPT pouvait favoriser la résistance des cellules aux inhibiteurs de BRAF. Cette analyse a montré que l’expression de NAMPT était associée à une augmentation de l’expression de gènes caractéristiques du phénotype « invasif » (comme AXL
2 [du grec anexelekto], PDGFR [platelet-derived growth factor receptor], ou ZEB1 [zinc finger E-box binding homeobox 1]) et à une diminution de ceux du phénotype « prolifératif » (comme MITF, CDK2 [cyclin-dependent kinase 2], etc.) (Figure 1). La signature transcriptomique des cellules suggère de plus que NAMPT peut également moduler le paysage épigénétique des cellules de mélanome. En effet, l’étude de la distribution des principales marques épigénétiques sur l’ensemble du génome en réponse à l’expression de NAMPT montre un changement des modifications des histones H3 impliquées dans l’activation (H3K4me33, H3K27Ac) ou la répression (H3K27me3) de la transcription (Figure 1). Notamment, une augmentation des marques actives au locus AXL et une inhibition de ces marques au locus MITF induiraient un changement d’expression de ces gènes et la reprogrammation des cellules de mélanome vers un phénotype « invasif ». Des études supplémentaires sont cependant nécessaires pour déterminer comment NAMPT modifie ces marques épigénétiques. Le NAD est nécessaire à l’activité de l’histone déacétylase sirtuine 1 (SIRT1) et de la poly(ADP-ribose) polymérase PARP, deux enzymes impliquées dans la régulation de la chromatine et l’expression génique. L’ensemble de ces résultats montre donc comment NAMPT, via une reprogrammation génique, favorise la transition vers un phénotype « invasif » qui résiste aux thérapies ciblées. |
L’inhibition de NAMPT : une option thérapeutique prometteuse Les résultats prometteurs que nous avons obtenus ouvrent la voie au développement de nouvelles stratégies thérapeutiques du mélanome. L’inhibition de NAMPT induit des effets cytotoxiques in vitro dans des cultures cellulaires et in vivo sur des xénogreffes de mélanome chez la souris, qui sont comparables à ceux observés par un traitement au PLX4032. Il serait intéressant de valider ces effets dans des modèles de souris immunocompétentes et génétiquement modifiées développant spontanément des mélanomes. Audrito et al. ont montré que les cellules de mélanome résistantes aux inhibiteurs de BRAF présentaient une expression de NAMPT et un niveau intracellulaire de NAD supérieurs à ceux des cellules qui y sont sensibles ; une observation confirmée sur des échantillons de mélanomes humains [11]. Cependant, selon l’analyse de données publiques TCGA (the cancer genome atlas), il semblerait que cette relation entre résistance aux inhibiteurs de BRAF et niveaux de NAMPT et NAD ne concerne que 10 à 20 % des cellules de mélanome résistantes. Une augmentation des taux plasmatiques de la forme sécrétée de NAMPT est par ailleurs observée chez des patients porteurs d’un mélanome muté BRAFV600E métastatique, par comparaison à ceux ayant un mélanome localisé ou durant l’acquisition de la résistance. Le taux plasmatique de NAMPT pourrait donc être également un marqueur prédictif de l’évolution maligne et de la réponse aux traitements [13]. Il est intéressant de noter que les cellules de mélanome résistantes au PLX4032 restent sensibles à l’inhibition de NAMPT [11, 12]. Chez la souris, PLX4032 et l’inhibiteur de NAMPT, en combinaison, ont une action inhibitrice synergique, et la survie des souris traitées est statistiquement significativement prolongée. Ces résultats démontrent l’intérêt du ciblage des voies NAMPT et NAD en clinique. Cette capacité des inhibiteurs de NAMPT à exercer des effets cytotoxiques dans les cellules de mélanome résistantes aux inhibiteurs de BRAF est en effet particulièrement intéressante, en raison de l’absence de traitements efficaces pour ces patients. Il sera évidemment important d’évaluer si les inhibiteurs de NAMPT, en combinaison, peuvent également représenter une option thérapeutique valide, dans les cas de résistances aux immunothérapies. |
Les cellules de mélanome sont plastiques et reprogramment leur répertoire de gènes et leur métabolisme pour s’adapter aux conditions environnementales et faire face à la disponibilité des ressources. Nos résultats apportent un nouvel éclairage sur ce mécanisme en révélant comment la voie BRAF/ERK, via l’activation de STAT5 et la régulation de l’expression de NAMPT, favorise la plasticité des cellules de mélanome et leur transition vers un phénotype « invasif » et pharmaco-résistant. Prise dans son ensemble, cette étude montre que l’inhibition de NAMPT est une stratégie très prometteuse dans le traitement de mélanomes résistants (primaires ou acquis) aux inhibiteurs de BRAF. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Les auteurs remercient l’ARC et la Ville de Nice pour avoir financé ce travail.
|
Footnotes |
1.
Hugo W, Shi H, Sun L, et al. Non-genomic and immune evolution of melanoma acquiring MAPKi resistance . Cell. 2015; ; 162 : :1271.–1285. 2.
Bertolotto C, Lesueur F, Giuliano S, et al. A SUMOylation-defective MITF germline mutation predisposes to melanoma and renal carcinoma . Nature. 2011; ; 480 : :94.–98. 3.
Bonet C, Luciani F, Ottavi JF, et al. Deciphering the role of oncogenic MITFE318K in senescence delay and melanoma progression . J Natl Cancer Inst. 2017;; 109 ((8)). 4.
Bertolotto C, Lesueur F, Bressac de Paillerets B. MIFT, une clé génétique du mélanome et du carcinome rénal . Med Sci Paris. 2012;; 28 : :258.–61. 5.
Cheli Y, Giuliano S, Botton T, et al. Mitf is the key molecular switch between mouse or human melanoma initiating cells and their differentiated progeny . Oncogene. 2011; ; 30 : :2307.–2318. 6.
Cheli Y, Giuliano S, Fenouille N, et al. Hypoxia and MITF control metastatic behaviour in mouse and human melanoma cells . Oncogene. 2012; ; 31 : :2461.–2470. 7.
Ohanna M, Giuliano S, Bonet C, et al. Senescent cells develop a PARP-1 and nuclear factor-{kappa}B-associated secretome (PNAS) . Genes Dev. 2011; ; 25 : :1245.–1261. 8.
Ratnikov BI, Scott DA, Osterman AL, et al. Metabolic rewiring in melanoma . Oncogene. 2017; ; 36 : :147.–157. 9.
Falletta P, Sanchez-Del-Campo L, Chauhan J, et al. Translation reprogramming is an evolutionarily conserved driver of phenotypic plasticity and therapeutic resistance in melanoma . Genes Dev. 2017; ; 31 : :18.–33. 10.
Canto C, Menzies KJ, Auwerx J. NAD (+) metabolism and the control of energy homeostasis: A balancing act between mitochondria and the nucleus . Cell metabolism. 2015; ; 22 : :31.–53. 11.
Audrito V, Manago A, La Vecchia S, et al. Nicotinamide phosphoribosyltransferase (NAMPT) as a therapeutic target in BRAF-mutated metastatic melanoma . J Natl Cancer Inst. 2018; ; 110 : 12.
Ohanna M, Cerezo M, Nottet N, et al. Pivotal role of NAMPT in the switch of melanoma cells toward an invasive and drug-resistant phenotype . Genes Dev. 2018; ; 32 : :448.–461. 13.
Audrito V, Manago A, Zamporlini F, et al. Extracellular nicotinamide phosphoribosyltransferase (eNAMPT) is a novel marker for patients with BRAF-mutated metastatic melanoma . Oncotarget. 2018; ; 9 : :18997.–19005. |