| |
| Med Sci (Paris). 34(10): 795–797. doi: 10.1051/medsci/2018196.ESX-4, un système de sécrétion mycobactérien ancestral, essentiel pour la croissance de Mycobacterium abscessus dans les phagocytes environnementaux et humains Fabienne Girard-Misguich,1* Laura Laencina,1 Violaine Dubois,1 Vincent Le Moigne,1 Laurent Kremer,2,3 Laleh Maljessi,4 Roland Brosch,4 and Jean-Louis Herrmann1,5 1Université de Versailles Saint Quentin en Yvelines, Inserm UMR1173, 78000Versailles, France 2Institut de recherche en infectiologie de Montpellier, Université de Montpellier, CNRS UMR 9004, 34293Montpellier, France 3Inserm, institut de recherche en infectiologie de Montpellier, 34293Montpellier, France 4Unité de pathogénomique mycobactérienne, institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France 5Hôpitaux universitaires Île de France Ouest, Ambroise Paré, Boulogne et Raymond Poincaré, 92380Garches, France MeSH keywords: Animaux, Protéines bactériennes, Mucoviscidose, Microbiologie de l'environnement, Humains, Infections à mycobactéries non tuberculeuses, Mycobacterium abscessus, Phagocytes, Systèmes de sécrétion de type VII, physiologie, microbiologie, mortalité, anatomopathologie, génétique, croissance et développement, pathogénicité |
Mycobacterium abscessus, un pathogène majeur chez les patients atteints de la mucoviscidose Mycobacterium abscessus est une mycobactérie pathogène opportuniste, à croissance rapide (RGM), responsable d’infections cutanéomuqueuses et pulmonaires. Ces dernières sont particulièrement sévères chez les patients atteints de mucoviscidose [1]. Les études épidémiologiques ont révélé la persistance de M. abscessus chez l’hôte infecté, parfois pendant plusieurs années [2]. Plus que d’autres infections par des bactéries pathogènes retrouvées chez les personnes atteintes de mucoviscidose, les infections pulmonaires à M. abscessus altèrent la fonction ventilatoire, entraînant une augmentation de la morbidité et de la mortalité chez ces patients. L’origine de l’infection par M. abscessus reste à déterminer. Une étude britannique récente, fondée sur la recherche de mutations spécifiques dans les souches de M. abscessus circulant en Grande-Bretagne, suggère soit une contamination entre patients, soit une contamination par l’environnement proche du patient [3]. Le réservoir environnemental de M. abscessus reste encore mal défini [4]. Les études génomiques, par séquençage du génome total, montrent la présence de gènes non-mycobactériens acquis par transfert horizontal au sein du génome de M. abscessus, ainsi que la présence de gènes de résistance pour la survie intracellulaire de la bactérie. D’autres études suggèrent que ces échanges génétiques horizontaux se réaliseraient dans un écosystème commun, notamment à l’interface sol/eau où les amibes environnementales sont présentes. Ces amibes représentent un hôte eucaryote unicellulaire naturel et un réservoir pour de nombreuses bactéries pathogènes, telles que Legionella, Chlamydia et Pseudomonas, et probablement aussi pour certaines espèces mycobactériennes, comme M. abscessus, qui peuvent ainsi survivre dans l’environnement. Des résultats publiés par notre équipe montrent que M. abscessus est capable de se multiplier au sein d’amibes. Une co-culture d’amibes et de M. abscessus avant infection chez l’animal, augmente la virulence de la mycobactérie [5], comme cela avait déjà été démontré pour une autre mycobactérie, Mycobacterium avium [6]. Au cours du processus infectieux, les amibes peuvent ainsi contribuer à forger la virulence des mycobactéries pour s’adapter face à la réponse immunitaire. Chez l’homme, une différence clé entre les mycobactéries non pathogènes et pathogènes, comme le bacille de la tuberculose Mycobacterium tuberculosis, est la capacité des mycobactéries pathogènes à survivre et à se répliquer dans les macrophages et les cellules dendritiques en bloquant la maturation des phagosomes [7]. Nous avons démontré récemment que M. abscessus possède également ces propriétés de survie intracellulaire [8] (→). La coexistence de M. abscessus avec les amibes semble ainsi avoir contribué à façonner la virulence des mycobactéries non tuberculeuses chez l’homme. L’un des acteurs de cette survie intracellulaire est représenté par le système de sécrétion de protéines, dit de type VII (SST7). (→) Voir la Nouvelle de A. Bernut et al. m/s n° 5, mai 2014, page 499 |
Le système de sécrétion de type VII (ESX-4) impliqué dans la virulence de M. abscessusCinq locus SST7 sont retrouvés chez les mycobactéries pathogènes, désignés esx-1 à 5 [9]. L’ancêtre commun est esx-4, à partir duquel dériverait esx-1, dont les gènes codent les éléments de l’appareil de sécrétion ESX-1, indispensable à la virulence et la survie intracellulaire de M. tuberculosis. M. abscessus ne possède que 2 locus esx : esx-3 et esx-4. Aucun rôle n’était à ce jour connu pour un éventuel système de sécrétion ESX-4. Nous avons démontré qu’il jouait un rôle similaire à ESX-1, dans la survie intracellulaire et la virulence de M. abscessus [10]. Partant de l’hypothèse que M. abscessus possédait l’arsenal génétique nécessaire pour survivre au sein d’amibes, nous avons criblé 6 000 mutants obtenus par transposition, en utilisant un test de survie intracellulaire chez l’amibe environnementale axénisée1 Acanthamoeba castellanii (Figure 1A). Quarante-sept mutants de M. abscessus, présentant un taux de survie inférieur à 50 % par rapport à la souche parentale à l’intérieur d’amibes ou de macrophages, ont été retenus. Le séquençage du site d’insertion du transposon pour chaque mutant a permis d’identifier plusieurs mutants possédant une insertion au sein de cinq gènes (eccC4 [esx-conserved component C4], eccD4, mycP4 [mycosin-1 protease], eccB4, et eccE4) appartenant au locus esx-4. Pour confirmer les résultats du crible et comprendre la contribution d’ESX-4 à la croissance et à la survie intracellulaire de M. abscessus chez les amibes et dans les macrophages, nous avons construit un mutant de délétion d’eccB4, qui code un élément structural de base du système ESX-4. La croissance intracellulaire de ce mutant s’est avérée atténuée chez les amibes et dans les macrophages (Figure 1B). La diminution de la survie intracellulaire du mutant est liée à son incapacité à bloquer l’acidification du phagosome, mais surtout à la diminution du contact entre le phagosome et le cytosol, tel qu’il est observé pour la souche parentale. Ces caractéristiques montrent donc la capacité unique de M. abscessus, en tant que mycobactérie pathogène opportuniste, à se répliquer à l’intérieur des phagocytes professionnels, contournant ainsi certaines réponses antibactériennes de l’hôte.
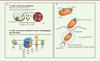 | Figure 1. Le système de sécrétion de type VII (ESX-4) impliqué dans la virulence de Mycobacterium abscessus. A. Crible de survie intracellulaire chez l’amibe de 6 000 mutants de la banque de M. abscessus lors d’une co-culture en présence de l’amibe Acanthamoeba castellanii. La survie intracellulaire des mutants est évaluée par comptage des CFU (colony -forming unit) ; 136 mutants défectueux pour leur croissance intracellulaire (soit 2,3 % de la banque) ont été identifiés. Un second crible de survie intracellulaire, chez l’amibe et en présence de macrophages, a ensuite permis de confirmer l’atténuation de 47 mutants dont 12 portant des mutations localisées (y compris des doublons) dans le locus esx-4 du système de sécrétion de type VII (SST7). Parmi ces 12 mutants, 9 présentent une insertion dans les gènes eccC4 (esx-conserved component : 2 mutants-souches 37F10 et 24H3), eccD4 (2 mutants-5A1 ; 7A1), MycP4 (mycosin-1 protease : 18D4), eccB4 (5 mutants-32C9 ; 14B9 ; 19D4 ; 32C7 ; 25E4), eccE4 (2 mutants 14E9 ; 15G8) et du locus esx-4. Trois mutants supplémentaires présentent des mutations localisées dans le gène espI (esx-1 secretion-associated protein : 43A3 ; 13F7 ; 2D10) impliqués dans la régulation d’ESX-1 chez M. tuberculosis, et 1 mutant supplémentaire dans le gène sigM (sigma factor gene : 13C3). B. L’analyse du génome de M. abscessus indique la présence de 2 systèmes de sécrétion, ESX-3 et ESX-4. Un mutant obtenu par double recombinaison homologue du gène eccB4 a permis de confirmer, par des expériences de co-cultures entre ce mutant (Mabs-ΔEccB) et des macrophages humains, que ce gène, et par conséquent le système de sécrétion ESX-4, sont impliqués dans la survie intracellulaire, le blocage de l’acidification phagosomale, et favorisent les contacts entre la bactérie et le cytosol. Le sécrétome de ce mutant versus celui de la souche parentale est actuellement en cours d’étude afin d’identifier les substrats de cette machinerie de sécrétion. |
Le locus esx-4 de M. abscessus comprend un gène supplémentaire, eccE4, qui est absent de tous les autres locus esx-4 retrouvés chez les mycobactéries pathogènes. Sa présence pourrait expliquer la fonctionnalité du système ESX-4 chez M. abscessus, à l’instar du système ESX-1 chez M. tuberculosis. Au cours de la dernière décennie, les SST7 sont apparus comme essentiels pour la virulence des mycobactéries et, parmi eux, notamment le système ESX-1 absent chez M. abscessus. Nous montrons par cette étude le rôle biologique inattendu et authentique du système ESX-4 dans la virulence de M. abscessus. Nos observations montrent donc que M. abscessus est bien équipé d’un arsenal génétique acquis au cours de l’évolution pour survivre dans les amibes de l’environnement. Ce même arsenal génétique aiderait M. abscessus à provoquer une infection chez l’homme. Les substrats sécrétés par ESX-1 de M. tuberculosis comprennent ESAT-6 (6-kDa early secreted antigenic target) et CFP-10 (10-kDa culture filtrate protein) et plusieurs autres protéines. Ces dernières sont des acteurs clés dans l’interaction de la mycobactérie avec les cellules immunitaires de l’hôte. Les substrats d’ESX-4 présents chez M. abscessus sont donc à identifier dans le futur. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Qvist T, Taylor-Robinson D, Waldmann E, et al. Comparing the harmful effects of nontuberculous mycobacteria and Gram negative bacteria on lung function in patients with cystic fibrosis . J Cyst Fibros. 2016; ; 15 : :380.–385. 2. Cullen AR, Cannon CL, Mark EJ, et al. Mycobacterium abscessus infection in cystic fibrosis. Colonization or infection? . Am J Respir Crit Care Med. 2000; ; 161 : :641.–645. 3. Bryant JM, Grogono DM, Greaves D, et al. Whole-genome sequencing to identify transmission of Mycobacterium abscessus between patients with cystic fibrosis: a retrospective cohort study . Lancet. 2013; ; 381 : :1551.–1560. 4. Ripoll F, Pasek S, Schenowitz C, et al. Non mycobacterial virulence genes in the genome of the emerging pathogen Mycobacterium abscessus . PLoS One. 2009; ; 4 : :e5660.. 5. Bakala N’Goma JC, Le Moigne V, Soismier N, et al. Mycobacterium abscessus phospholipase C expression is induced during coculture within amoebae and enhances M. abscessus virulence in mice . Infect Immun. 2015; ; 83 : :780.–791. 6. Cirillo JD, Falkow S, Tompkins LS, et al. Interaction of Mycobacterium avium with environmental amoebae enhances virulence . Infect Immun. 1997; ; 65 : :3759.–3767. 7. Bernut A, Herrmann JL, Lutfalla G, et al. Les cordes mycobactériennes : un nouveau moyen d’échappement au système immunitaire ? . Med Sci (Paris). 2014; ; 30 : :499.–522. 8. Roux A-L, Viljoen A, Bah A, et al. The distinct fate of smooth and rough Mycobacterium abscessus variants inside macrophages . Open Biol. 2016; ; 6 : :160185.. 9. Groschel MI, Sayes F, Simeone R, et al. ESX secretion systems: mycobacterial evolution to counter host immunity . Nat Rev Microbiol. 2016; ; 14 : :677.–691. 10. Laencina L, Dubois V, , Le Moigne V, et al. Identification of genes required for Mycobacterium abscessus growth in vivo with a prominent role of the ESX-4 locus . Proc Natl Acad Sci USA. 2018; ; 115 : :E1002.–E1011. |