La résistance aux antibiotiques est un problème de santé globale important qui requiert de nouvelles classes de molécules antibactériennes [1] (→).
(→) Voir la Synthèse de F. Trémolières, m/s n° 11, novembre 2010, page 925
Les bactéries multirésistantes du groupe ESKAPE, qui comprend Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa et Enterobacter, sont parmi les plus problématiques [2] (→).
(→) Voir la Synthése de F. Barbier et M. Wolff, m/s n° 11, novembre 2010, page 960
Les infections associées requièrent de nouvelles classes de molécules aux mécanismes différents des antibiotiques courants [3]. Un nouvel antibiotique devrait idéalement être bactéricide contre les pathogènes Gram-positifs et Gram-négatifs, être efficace in vitro et in vivo et provoquer l’élimination des bactéries tout en possédant une toxicité minimale.
Dans un article publié dans la revue Nature Communications, Chin et al. décrivent une nouvelle classe de macromolécules qui répond à ce cahier des charges et offre une perspective prometteuse dans la lutte contre les bactéries multirésistantes [4].
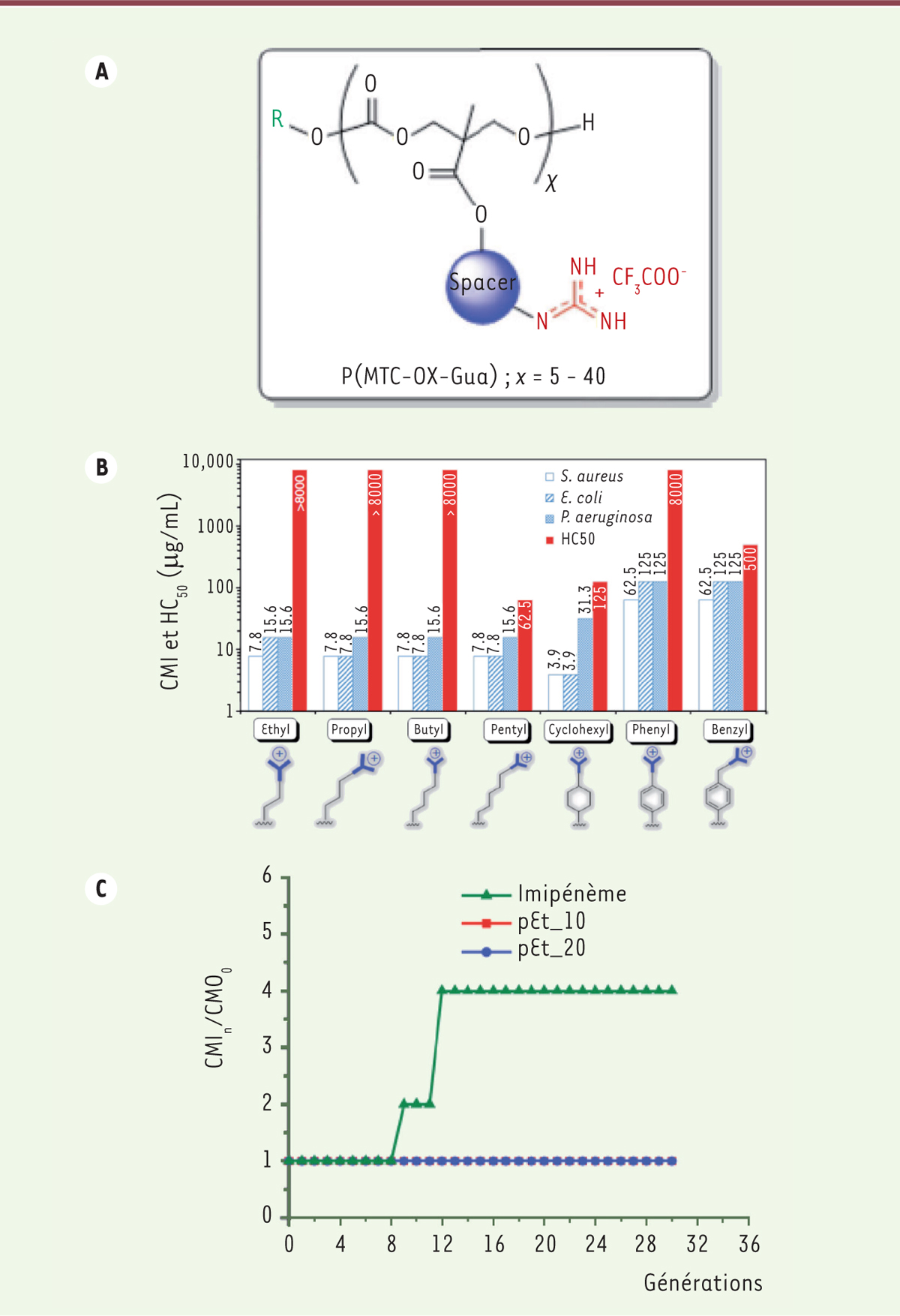
Ces molécules, de la classe des polymères polycationiques, possèdent un squelette polycarbonate assemblé à partir de monomères composés (Figure 1A) de (1) une fonction carbonate pour la polymérisation ; (2) un segment modulable (ou espaceur) pour optimiser les propriétés et comprendre la relation structure-activité ; et (3) une fonction guanidinium retrouvée dans certains peptides antimicrobiens et des peptides perméants [5].
| Figure 1. Les polymères pEt. A. Structure générique des polymères décrits dans l’article de Chin et al. [4]. Les polycarbonates fonctionnalisés avec une guanidine comportent entre 5 et 40 motifs espaceurs (spacer) X. Ils sont notés MTC-OX-GUA. B. Activités antimicrobienne (CMI : concentration minimale inhibitrice) et hémolytique (HC50 : concentration induisant l’hémolyse de 50 % des globules rouges de rat) des polymères en fonction de la taille de l’espaceur. C. Développement de résistance à A. baumannii après exposition aux composés pEt_10, pEt_20 et à l’imipénème, pendant 30 passages (figure reproduite avec la permission de l’éditeur Springer Nature selon les termes de la licence Creative Commons CC BY). |
Dans un premier temps, Chin et al. ont synthétisé 9 monomères possédant des espaceurs alkyle, cycloalkyle ou aryle. L’ouverture des cycles en absence de métaux a permis leur polymérisation. Les polymères ainsi synthétisés ont été purifiés par chromatographie liquide sur gel et leurs chaînes cationiques ont ensuite été déprotégées. Ces polymères possèdent une polydispersité1 étroite (1,1 – 1,2) qui devrait favoriser la reproductibilité de la synthèse ainsi que l’analyse de la relation structure-activité (RSA).
Les auteurs ont évalué l’influence de la masse moléculaire sur l’activité antimicrobienne et l’hémolyse, avec des polymères de 5 à 40 unités (Figure 1B). Parmi les molécules testées, pEt_20 (comprenant un espaceur éthyle et 20 monomères) a présenté la meilleure activité antimicrobienne. Les concentrations minimales inhibitrices, c’est-à-dire les plus basses concentrations capables d’inhiber la croissance bactérienne (ou CMI), sont de 7,8 mg/mL et 15,6 mg/mL pour, respectivement, S. aureus et E. coli, avec les moyennes géométriques (Gm) de CMI les plus faibles. Ces valeurs sont très inférieures à celles relatées pour les polycarbonates antimicrobiens portant des groupements ammonium quaternaires [6]. Le composé pEt_20 possède également une faible toxicité puisque sa concentration induisant l’hémolyse de 50 % des globules rouges de rat (HC50) est supérieure à 8 000 mg/mL. Cette sélectivité (HC50/CMI) estimée à plus de 500 est très supérieure à celle de nombreux peptides antimicrobiens de l’hôte et est également confirmée par la faible cytotoxicité de pEt_20 vis-à-vis des cellules rénales d’embryon humain HEK293T. En effet, la concentration inhibant de 50 % la viabilité cellulaire (IC50) est supérieure à 500 mg/mL, une valeur supérieure à celle reportée pour la polymyxine B (165 mg/mL), la classe d’antibiotiques de dernier recours contre les infections multirésistantes. Le composé pEt_10 (polymère comportant 10 unités avec un espaceur éthyle) possède également une excellente sélectivité. Les auteurs ont par ailleurs observé que l’augmentation de l’hydrophobicité des polymères accroit l’hémolyse tout en conservant l’effet antibiotique. Ceci peut théoriquement s’expliquer par une interaction accrue avec les membranes cellulaires et leur perturbation, la membrane étant de fait un environnement hydrophobe.
Les spectres d’activité de pEt_20 et pET_10 ont été évalués contre 4 pathogènes du groupe ESKAPE : la bactérie Gram-positif S. aureus résistant à la méthycilline (SARM) et les bactéries Gram-négatif A. baumannii, K. pneumoniae et E. coli. Les deux polymères possèdent une activité antimicrobienne contre l’ensemble des bactéries testées à des concentrations qui varient entre 8 et 64 mg/mL. Les sélectivités rapportées (supérieures à 125 voire à 1 000) contre des isolats multirésistants sont prometteuses et contrastent avec l’efficacité restreinte des polymères peptidiques polycationiques et des oligoarginines comme (Arg)10 et (Arg)20 pour lesquels des CMI supérieures à 512 mg/mL ont été rapportées [7].
Afin de comprendre leur mécanisme d’action, le coefficient de partition entre l’octanol et l’eau a été déterminé à l’aide d’un analogue fluorescent de pEt_20 et comparé à un polycarbonate portant des groupements ammonium quaternaires. Compte tenu de leur charge, les deux polymères se répartissent partiellement dans la phase aqueuse. L’ajout de laurate de sodium (qui mime un acide gras lié à la membrane) à la phase octanol augmente la partition de pEt_20 dans la phase organique, et le polymère portant des ammoniums quaternaires reste quant à lui dans la phase aqueuse. Ces expériences suggèrent que pEt_20 pourrait traverser la membrane cellulaire. L’incubation de pEt_20 en présence de A. baumannii pendant 2 h à la concentration bactéricide minimale (c’est-à-dire la concentration la plus faible donnant 99,9 % de mort bactérienne [CBM]) ne provoque aucune fuite du contenu cytoplasmique. Ceci suggère que pEt_20 traverse la membrane bactérienne sans modifier son intégrité, contrairement à la polymyxine B qui relâche le contenu cellulaire même à une concentration bactéricide inférieure (0,5 CBM). L’analyse en microscopie électronique à balayage (MEB) ou à transmission (MET) indique que ni pEt_20 ni pEt_10 ne provoquent de changement morphologique notable de la membrane, après 2 h de traitement à des concentrations élevées (4 fois ou 16 fois la CMI). Les analyses en MET révèlent une précipitation du contenu cytoplasmique des bactéries, qui résulte probablement d’une interaction entre le polymère et des composantes intracellulaires suite au passage membranaire [8]. Le mécanisme d’action est à décrypter, mais sa particularité confère à cette classe de molécules une puissance et une sélectivité supérieures aux analogues portant des groupements ammonium quaternaires. L’absence de fuite du contenu cytoplasmique bactérien dans le milieu devrait réduire les risques de septicémie résultant du relargage d’endotoxines.
Pour tester le développement possible de résistance, des bactéries A. baumannii 10073 ont été traitées par pEt_10 ou pEt_20 pendant 30 passages consécutifs à des concentrations sub-CMI (Figure 1C). La CMI reste stable tout au long des passages, suggérant une absence de développement de résistance dans ces conditions, contrairement à l’imipénème dont l’efficacité diminue à partir du 8e passage. L’analyse transcriptomique a confirmé que le nombre de gènes altérés en réponse à pEt_20 est bien inférieur à celui reporté en réponse à l’imipénème ; ces gènes ne correspondent pas de surcroît à ceux qui varient lors du développement de résistance.
Pour promouvoir l’application in vivo de pEt_10 et pEt_20 contre des infections résistantes, les LD50 et LD5 (doses uniques menant respectivement à 50 % ou 5 % de mortalité chez la souris) ont été déterminées, révélant des valeurs identiques pour les deux composés et une LD5 de l’ordre de 42 mg/kg. Le traitement de cellules mononucléées de sang périphérique de souris avec pEt_10 ou pEt_20 a révélé en outre une réponse immunitaire négligeable, estimée par la sécrétion de cytokines.
La biodistribution d’un analogue fluorescent de pEt_20 chez la souris, administré par voie intrapéritonéale (i.p.) ou intraveineuse (i.v.), a révélé une distribution dans le foie, la rate, les poumons et les reins, confirmant sa pénétration tissulaire. Sa demi-vie d’élimination plasmatique de 17 minutes, légèrement supérieure à celles du méropénème, de l’imipénème et du doripénème, combinée à une action bactéricide rapide, permet de proposer le pET_20 pour des traitements in vivo.
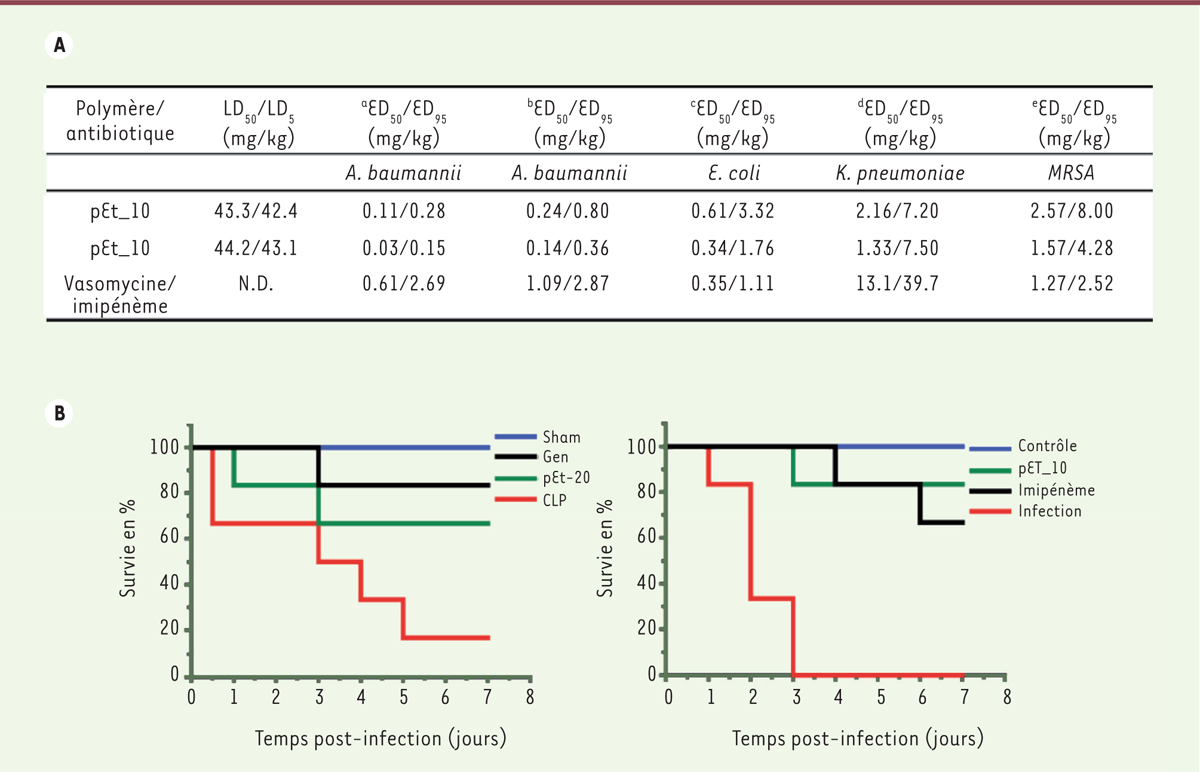
L’activité antibiotique in vivo a été déterminée dans des modèles de péritonite induite par l’injection par voie intrapéritonéale des isolats multirésistants d’A. baumannii, E. coli, K. pneumoniae ou SARM à leur dose létale sur 48 h (Figure 2A). L’injection par voie intrapéritonéale de pEt_10 et pEt_20 à différents temps post-infection (1 h et 6 h ou 3 h et 8 h) a démontré une efficacité élevée dans tous les modèles, avec des ED50 et ED95 (doses efficaces donnant respectivement 50 % et 95 % de survie chez les souris infectées) bien en-deçà de leurs valeurs de LD5, particulièrement pour A. baumannii. Ceci confirme une fenêtre thérapeutique élevée, avec un ratio ED50/LD50 supérieur à 1 400. Un délai de 2 h dans le traitement augmente peu les valeurs d’ED50 et ED95. Dans les infections par E. coli sensibles à l’imipénème, ou les infections par SARM sensibles à la vancomycine, les polymères possèdent des valeurs d’ED50 et ED95 similaires à celles des antibiotiques de référence. Cependant, dans des infections par les bactéries A. baumannii ou K. pneumoniae résistantes à l’imipénème, les polymères sont plus efficaces. En outre, dans les modèles de péritonite induite par A. baumannii ou E. coli, les polymères induisent une disparition complète des bactéries dans le sang, le liquide péritonéal et les organes, avec des taux d’efficacité supérieurs à 99 % à leur concentration ED95. Ceci est important afin de réduire les risques de septicémie bactérienne.
| Figure 2. Efficacité in vivo des polymères pEt_10 et pEt_20. A..les LD50 et LD5 (dose unique menant respectivement à 50 % ou 5 % de mortalité), et les ED50 et ED95 (doses efficaces donnant respectivement 50 et 95 % de survie) chez les souris infectées puis traitées par pEt_10 et pEt_20 en comparaison avec les traitements par la vancomycine et l’imipénème pour les modèles d’infections suivants : a. modèle murin de péritonite causée par A. baumannii 10073 multirésistante, injection par voie intra-péritonéale à 1 h et 6 h post-infection ; b. modèle murin de péritonite causée par A. baumannii 10073 multirésistante, injection par voie intra-péritonéale à 3 h et 8 h post-infection; c. modèle murin de péritonite causée par E. coli 56809 multirésistante, injection par voie intra-péritonéale à 1 h et 6 h post-infection; d. modèle murin de péritonite causée par K. pneumoniae 8637 multirésistante, injection par voie intra-péritonéale à 1 h et 6 h post-infection; e. modèle murin de péritonite causée par S. aureus 25312 multirésistante, injection par voie intra-péritonéale. à 1 h et 6 h post-infection; B. Panneau de gauche : Survie dans un modèle murin de ligature et ponction cæcale (noté CLP, caecal ligation and puncture) ; panneau de droite : survie dans un modèle murin d’infection pulmonaire à P. aeruginosa PA14. Sham : souris contrôles opérées en absence de CLP ; Gen : souris CLP traitées par la gentamicine ; Imipénème : souris infectées (infection) traitées par l’imipénème (figure reproduite avec la permission de l’éditeur Springer Nature selon les termes de la licence Creative Commons CC BY). |
L’efficacité des deux polymères a été confirmée in fine dans un modèle de perforation de l’intestin, consistant en la ligature puis la perforation du cæcum (Figure 2B) [9]. Ce modèle murin reproduit les causes et signes cliniques d’une septicémie par perforation de l’intestin chez l’homme, et implique à la fois des bactéries Gram-positives et Gram-négatives. Le composé pEt_20 présente une efficacité comparable à celle de la gentamicine, estimée par la survie des souris et l’élimination des bactéries. Dans un modèle murin d’infection pulmonaire par P. aeruginosa avec l’isolat clinique PA14, trois injections par voie intraveineuse de pET_20 à 1 h, 6 h et 25 h post-infection ont sauvé 5 souris infectées sur 6. Par comparaison, seulement 4 souris traitées par l’imipénème ont survécu (Figure 2B). De plus, pEt_20 élimine plus efficacement les bactéries. Par ailleurs, le traitement des souris par pEt_20 à la dose de 8 mg/kg, 2 fois par jour pendant 3 jours (soit 48 mg/kg total) n’a causé ni néphro- ni hépatotoxicité, ni de perturbation du potassium sanguin, suggérant peu d’hémolyse. Une dégradation complète du polymère et une toxicité négligeable de ses produits de dégradation peuvent expliquer ce profil de toxicité avantageux.
En conclusion, les nouveaux polymères pEt_10 et pET_20 sont des candidats très prometteurs comme nouveaux antibiotiques à large spectre pour le traitement des infections intestinales aux bactéries multirésistantes comme A. baumannii, K. pneumoniae, E. coli, SARM, P. aeruginosa, ainsi que vis-à-vis des infections pulmonaires à P. aeruginosa. Leur mécanisme d’action nouveau, l’absence de résistance, leur efficacité in vivo et leur excellente fenêtre thérapeutique en font des candidats robustes dans la prévention et le traitement des infections systémiques par les bactéries multirésistantes [10] (→).
(→) Voir la Brève de A. Carcone et al., m/s n° 10, octobre 2017, page 869