| |
| Med Sci (Paris). 34(10): 781–784. doi: 10.1051/medsci/2018194.La proximité de lésions dans l’ADN favorise la mutagenèse Luisa Laureti1 and Vincent Pagès1* 1CRCM, Centre de recherche en cancérologie de Marseille, CNRS, Inserm, Université Aix Marseille, Institut Paoli-Calmettes, 27, boulevard Lei Roure, 13009Marseille, France MeSH keywords: Séquence nucléotidique, ADN, Altération de l'ADN, Escherichia coli, Génome bactérien, Mutagenèse, Tests de mutagénicité, physiologie, génétique |
L’ADN est le support de l’information génétique de tous les êtres vivants. Afin de transmettre cette information génétique aux cellules filles issues de la division cellulaire, les cellules doivent répliquer leur ADN de manière fidèle. Il arrive fréquemment que des dommages ou lésions au niveau de l’ADN viennent perturber ce processus de réplication. Ces lésions ont diverses origines exogènes, comme par exemple les rayons ultra-violets (UV) dus à l’exposition au soleil, ou des cancérogènes chimiques, tels que le benzopyrène issu de la fumée de cigarette, mais également des origines endogènes, telles que les dommages oxydatifs générés par les produits réactifs de l’oxygène issus de la respiration cellulaire. Afin de faire face à ces lésions, les cellules possèdent des mécanismes de réparation qui permettent de « nettoyer » l’ADN avant qu’il ne soit répliqué. Cependant, ces mécanismes de réparation peuvent être défectueux, ou certaines lésions peuvent leur échapper. Ces lésions alors présentes dans l’ADN pendant le processus de réplication vont bloquer la progression de l’ADN polymérase réplicative. Nous avons montré par le passé que dans une telle situation il se produit un découplage de la synthèse des deux brins d’ADN [1], ce qui permet au brin endommagé de poursuivre la réplication sur une certaine distance. Il a été montré depuis qu’un mécanisme de ré-initiation de la réplication en aval de la lésion [2] permet à la fourche de réplication de poursuivre sa progression, laissant une brèche d’ADN simple-brin. Tous les organismes vivants (des bactéries aux humains) possèdent plusieurs stratégies pour combler cette brèche et tolérer une lésion non réparée : (1) la synthèse translésionnelle (ou TLS pour trans-lesion synthesis), un mécanisme par lequel une ADN polymérase spécialisée (dite translésionnelle) remplace transitoirement l’ADN polymérase réplicative et insère un nucléotide directement en face de la lésion. Ces ADN polymérases translésionnelles étant très peu fidèles, la TLS est donc souvent à l’origine de mutations [3] ; (2) le mécanisme de contournement des dommages (ou DA pour damage avoidance), un mécanisme fondé sur la recombinaison homologue. La région d’ADN simple-brin générée en aval de la lésion envahit la région homologue (double-brin) de la chromatide sœur ce qui permet à la cellule de récupérer l’information génétique altérée par la lésion. Ce mécanisme contrairement à la TLS est fidèle. L’équilibre entre ces deux voies de tolérance des dommages est très important puisqu’il définit le niveau de mutagenèse de la cellule. Par conséquent, décrypter la réplication d’un ADN endommagé, en particulier l’équilibre entre synthèse translésionnelle et mécanismes de contournement des dommages, est fondamental pour comprendre comment les mutations apparaissent et comment elles sont évitées. Si d’un côté cette mutagenèse est essentielle au processus d’évolution et d’adaptation au stress de l’environnement, en particulier chez les microorganismes, elle est également responsable de graves dérèglements cellulaires qui peuvent notamment conduire à la cancérisation des cellules humaines. À l’heure actuelle, on ne sait pas comment une cellule dont l’ADN est lésé va choisir une voie de réparation plutôt que l’autre. |
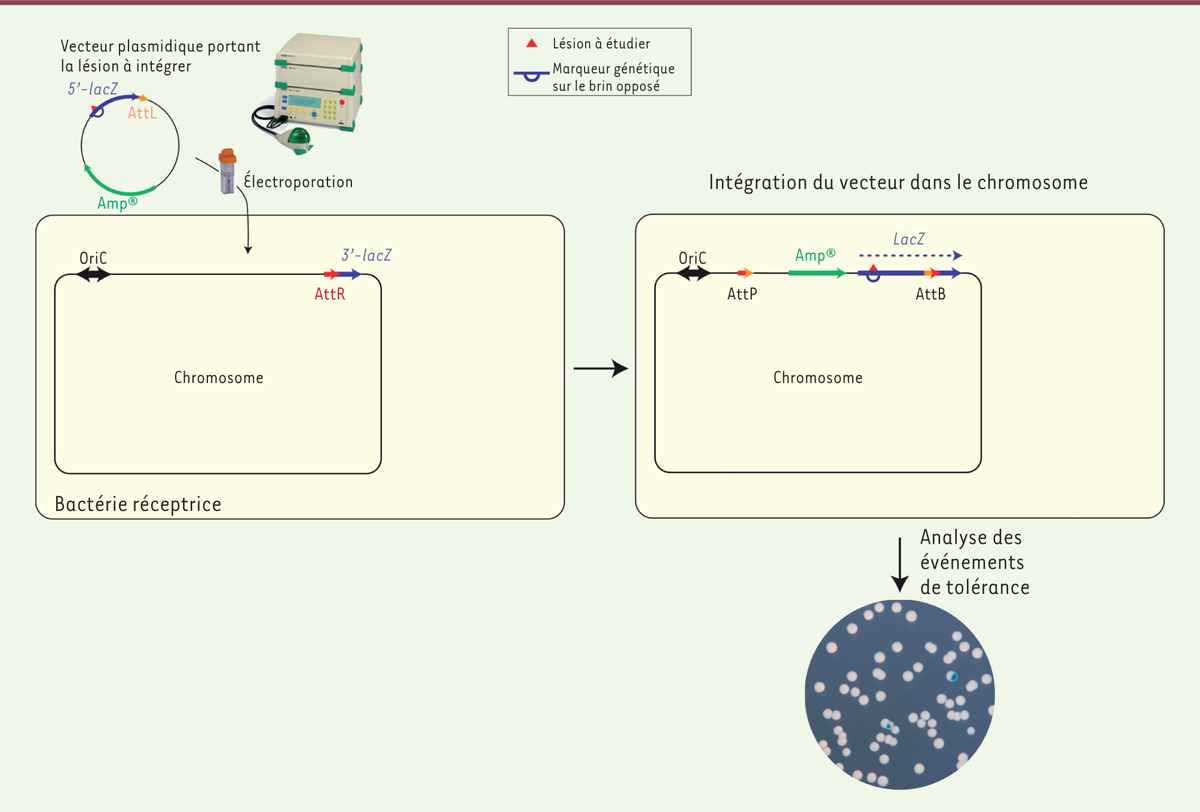
Étudier les voies de tolérance en introduisant une lésion dans le génome bactérien Afin d’étudier comment est régulé l’équilibre entre voie mutagène (TLS) et voie fidèle (DA), notre équipe utilise la bactérie Escherichia coli comme organisme modèle. Nous avons mis au point une technique qui permet d’insérer une lésion unique à un site bien défini du chromosome bactérien [4, 5]. Grâce à un système colorimétrique fondé sur le gène rapporteur lacZ (qui code la β-galactosidase et donne, sur un milieu indicateur, un phénotype bleu à la bactérie qui l’exprime), nous pouvons observer directement quelle voie de tolérance a été utilisée durant la réplication de l’ADN endommagé. Ainsi, si la cellule utilise la TLS, elle donnera naissance à une colonie bleue, et si elle utilise le DA, la colonie sera blanche (Figure 1). En utilisant cet outil, nous avons pu réaliser une étude génétique des voies de tolérance des lésions. Nous avons montré que pour des lésions très bloquantes1, telles que celles induites par l’acétylaminofluorène (AAF : une amine aromatique), ou les lésions générées par les radiations UV, le contournement des dommages (DA) était la voie majoritaire dans les conditions physiologiques [4]. Nous avons également montré que, bien que minoritaire, la TLS intervenait avant les mécanismes de DA. Cette priorité de la voie mutagène sur la voie fidèle permet aux cellules de générer de la diversité afin de répondre au stress environnemental, avant d’assurer la survie par des mécanismes non-mutagènes [6]. Nous avons également mis en évidence une nouvelle voie de tolérance des dommages à l’ADN par laquelle la cellule abandonne la chromatide endommagée et ne survit donc qu’avec l’information génétique portée par le brin non endommagé [7].
 | Figure 1. Insertion d’une lésion dans le génome bactérien. Un vecteur plasmidique contenant une lésion unique dans le gène rapporteur lacZ codant la β-galactosidase est introduit par électroporation dans une souche E. coli réceptrice. Cette souche exprime l’intégrase du phage lambda qui permet l’intégration du vecteur à un site spécifique. Lorsque la bactérie réplique son chromosome, l’utilisation de la synthèse translésionnelle (TLS, trans lesion synthesis) se traduit par l’apparition d’un secteur bleu, tandis que l’utilisation du mécanisme de contournement des dommages (ou DA pour damage avoidance) apparaît comme une colonie blanche sur milieu indicateur X-gal (ou 5-bromo-4-chloro-3-indolyl-bêta-D-galactopyranoside). Les séquences Att sont des séquences d’attachement, B pour la bactérie, P pour le phage et R et L pour le prophage. Amp : gène codant la résistance à l’ampicilline ; LacZ : gène codant la β-galactosidase ; OriC : origine de réplication chez E. coli. |
|
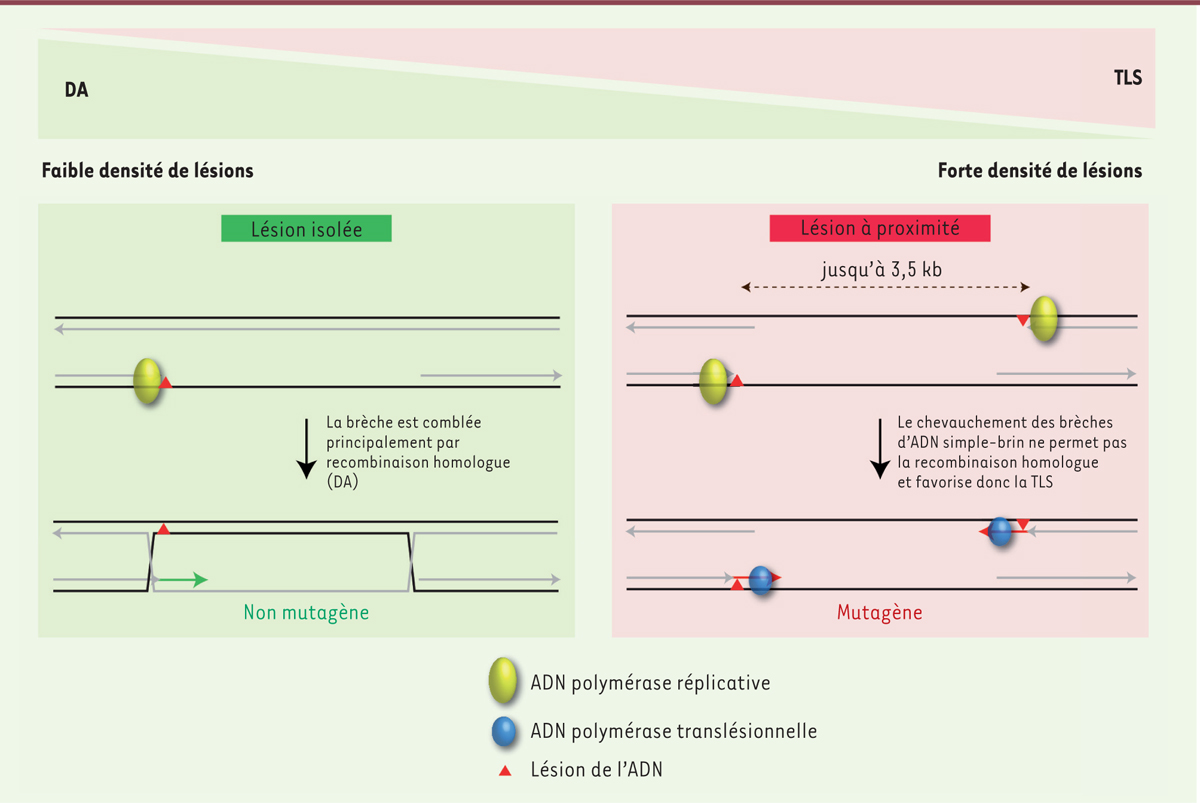
Régulation du niveau de mutagenèse Lorsque les cellules bactériennes subissent un stress génotoxique2,, les lésions sur l’ADN bloquent la réplication, ce qui conduit à l’apparition de régions d’ADN simple-brin en aval de la fourche de réplication. L’accumulation de cet ADN simple-brin est le signal qui déclenche chez les bactéries la réponse appelée SOS3. Cette réponse SOS qui a été décrite pour la première fois il y a plus de 40 ans [8], permet d’augmenter l’expression de certains gènes, notamment ceux qui codent les ADN polymérases translésionnelles. Ainsi, l’induction du système SOS conduit à une augmentation de la mutagenèse par TLS qui permet aux bactéries de s’adapter à différentes pressions environnementales et qui est, entre autres, responsable de l’acquisition des résistances aux antibiotiques comme cela a été montré par de nombreux travaux [9] (→). (→) Voir la Synthèse de S. Da Re et M.C. Ploy, m/s n° 2, février 2012, page 179 Nous avons récemment mis en évidence un autre mécanisme qui permet de favoriser la mutagenèse en réponse à un stress génotoxique. Afin de mimer l’effet local de ce type de stress, nous avons modifié le système précédemment décrit afin d’intégrer deux lésions localisées sur les brins opposés à des distances variables. Nous avons pu observer qu’à une distance comprise entre 1 800 et 3 500 nucléotides, la proximité des lésions conduisait à une augmentation de la TLS d’un facteur 3 [10]. Cette augmentation de l’utilisation de la TLS est due à une forte diminution de la voie du DA. En effet, des lésions situées à proximité sur les brins opposés génèrent des brèches d’ADN simple-brin chevauchantes (Figure 2). Or, la recombinaison homologue (impliquée dans le DA) nécessite une région d’ADN double-brin pour combler la brèche générée en aval de la lésion. Cette inhibition de la voie du DA conduit à une augmentation de l’utilisation de la TLS et donc du taux de mutagenèse. De manière intéressante, cet effet « proximité des lésions » est additif avec celui de l’induction du système SOS. Ainsi en combinant l’induction du système SOS avec la proximité des lésions, la TLS augmente de plus de 10 fois et devient alors le principal mécanisme de tolérance (présent dans plus de 90 % des cellules qui survivent aux deux lésions).
 | Figure 2. La proximité des lésions empêche la recombinaison homologue et favorise la mutagenèse. À faible densité de lésions, la brèche d’ADN simple brin générée en aval des lésions peut être réparée par recombinaison homologue (DA) en utilisant l’ADN double-brin présent au niveau de la chromatide sœur. Lors d’un stress génotoxique important, la proximité des lésions génère des régions d’ADN simple-brin chevauchantes qui empêchent la recombinaison homologue, ce qui favorise l’utilisation de la synthèse translésionnelle (TLS) potentiellement mutagène. |
Ce phénomène, observé aujourd’hui chez la bactérie E. coli, permet à cet organisme de répondre à un stress génotoxique. À faible densité de lésions, la voie non mutagène est préférée, ce qui permet à la cellule de préserver son patrimoine génétique. Avec l’augmentation du nombre des lésions (et donc de leur densité), la voie mutagène est favorisée. En augmentant la mutagenèse, la bactérie peut répondre au nouvel environnement et s’y adapter. Il s’agit en quelque sorte d’un mécanisme d’évolution accélérée. Nous montrons que la proximité des lésions à elle seule favorise la voie mutagène, indépendamment de tout facteur génétique. De plus, la recombinaison homologue étant conservée à travers les espèces, son inhibition par la proximité des lésions et l’augmentation de TLS qui en résulte pourrait a priori exister chez tous les organismes vivants. Un tel mécanisme, s’il est confirmé dans les cellules humaines, pourrait favoriser l’apparition de cancers chez l’homme. Par ailleurs, les traitements de chimiothérapie consistent en de forts stress génotoxiques induisant de ce fait une forte densité de lésions : l’augmentation de la mutagenèse résultant de la proximité des lésions pourrait donc participer à la résistance aux traitements de chimiothérapie, et également à l’apparition de cancers secondaires. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données pubiées dans cet article. |
Footnotes |
1. Pagès V, Fuchs RP. Uncoupling of leading- and lagging-strand DNA replication during lesion bypass in vivo . Science. 2003; ; 300 : :1300.–3. 2. Heller RC, Marians KJ. Replication fork reactivation downstream of a blocked nascent leading strand . Nature. 2006; ; 439 : :557.–62. 3. Pagès V, Fuchs RPP. How DNA lesions are turned into mutations within cells? Oncogene. 2002; ; 21 : :8957.–66. 4. Pagès V, Mazon G, Naiman K, et al. Monitoring bypass of single replication-blocking lesions by damage avoidance in the Escherichia coli chromosome . Nucleic Acids Res. 2012; ; 40 : :9036.–43. 5. Pagès V, Fuchs RP. Inserting site-specific DNA lesions into whole genomes . Methods Mol Biol. 2018; ; 1672 : :107.–18. 6. Naiman K, Philippin G, Fuchs RP, Pagès V. Chronology in lesion tolerance gives priority to genetic variability . Proc Natl Acad Sci USA. 2014; ; 111 : :5526.–31. 7. Laureti L, Demol J, Fuchs RP, Pagès V. Bacterial proliferation: keep dividing and don’t mind the gap . PLoS Genet. 2015; ; 11 : :e1005757.. 8. Radman M. SOS repair hypothesis: phenomenology of an inducible DNA repair which is accompanied by mutagenesis . Basic Life Sci. 1975; ; 5A : :355.–67. 9. Da Re S, Ploy MC. Antibiotiques et reponse SOS bacterienne : une voie efficace d’acquisition des resistances aux antibiotiques . Med Sci (Paris). 2012; ; 28 : :179.–84. 10. Chrabaszcz E, Laureti L, Pagès V. DNA lesions proximity modulates damage tolerance pathways in Escherichia coli . Nucleic Acids Res. 2018; ; 46 : :4004.–12. |