| |
| Med Sci (Paris). 34(10): 765–768. doi: 10.1051/medsci/2018201.Expression ectopique du récepteur membranaire de l’interleukine 6 dans l’hypertension artérielle pulmonaire Ly Tu,1,2 Carole Phan,1,2 Marc Humbert,1,2,3 and Christophe Guignabert1,2* 1Inserm UMR_S 999, hôpital Marie Lannelongue, 133, avenue de la Résistance, 92350Le Plessis-Robinson, France 2Faculté de médecine, université Paris-Sud et université Paris-Saclay, Le Kremlin-Bicêtre, France 3AP-HP, service de pneumologie, centre de référence de l’hypertension pulmonaire sévère, DHU thorax innovation, Hôpital de Bicêtre, Le Kremlin-Bicêtre, France MeSH keywords: Animaux, Humains, Hypertension pulmonaire, Interleukine-6, Souris, Thérapie moléculaire ciblée, Myocytes du muscle lisse, Récepteurs à l'interleukine-6, Transduction du signal, traitement médicamenteux, étiologie, usage thérapeutique, méthodes, tendances, effets des médicaments et substances chimiques, physiologie |
L’hypertension artérielle pulmonaire Le terme « hypertension artérielle pulmonaire » (HTAP) regroupe un ensemble de maladies cardio-pulmonaires qui sont caractérisées par une augmentation de la pression artérielle pulmonaire moyenne et des résistances vasculaires pulmonaires, conduisant in fine à une insuffisance cardiaque droite et au décès. En France, la prévalence moyenne de l’HTAP est de 15 cas par million d’habitants avec une prédominance féminine. Bien que la prise en charge ait considérablement évolué ces dernières années, il n’existe malheureusement pas de traitement curatif de l’HTAP. Les thérapies actuelles restent essentiellement palliatives et ne ciblent pas directement les mécanismes physiopathologiques clés impliqués dans le remodelage du lit vasculaire pulmonaire, qui vont être responsables du déclin fonctionnel progressif des patients. La survie à 5 ans est inférieure à 60 %. La transplantation cardio-pulmonaire ou bi-pulmonaire est la seule solution chez les patients réfractaires au traitement médical avec un taux de survie de 52 à 75 % à 5 ans. Les progrès récents réalisés dans le déchiffrage de la physiopathologie de l’HTAP soulignent clairement que les processus de développement et d’entretien du remodelage de la circulation pulmonaire sont complexes et multifactoriels [1]. Parmi ces acteurs, les perturbations des fonctions de l’endothélium pulmonaire, l’accumulation excessive de cellules de la paroi vasculaire, tout comme l’infiltration périvasculaire de cellules inflammatoires jouent des rôles critiques [1]. Cependant, les mécanismes exacts sous-jacents sont encore largement méconnus. Au cours des deux dernières décennies, l’accumulation des connaissances autour du rôle de l’inflammation associée à l’HTAP s’est cependant accélérée [2] (→). (→) Voir la Synthèse de F. Perros et al., m/s n° 6-7, juin-juillet 2013, page 607 Une forte augmentation de facteurs de l’inflammation, au niveau circulant et au niveau pulmonaire, est observée chez les patients HTAP, caractérisée notamment par des niveaux anormalement élevés de plusieurs cytokines et chimiokines pro-inflammatoires et la présence plus ou moins importante d’infiltrats inflammatoires transmuraux et périvasculaires. Quelques-uns de ces facteurs pro-inflammatoires peuvent être reliés à la sévérité de certaines formes d’HTAP [3, 4], notamment l’interleukine (IL)-6. |
Sur-activation des voies de l’IL-6 dans l’HTAP humaine et expérimentale L’IL-6 est une cytokine essentielle au système immunitaire qui possède de nombreuses fonctions allant de la régulation du cycle cellulaire à la modulation de l’état de différenciation des cellules inflammatoires. Or, l’IL-6 et sa voie de signalisation sont maintenant décrites comme étant parmi les acteurs de premier plan dans la pathogenèse de l’HTAP, en raison de leurs rôles critiques dans l’augmentation de la susceptibilité et de la progression du remodelage vasculaire pulmonaire. En effet, notre laboratoire a joué un rôle déterminant dans l’obtention d’éléments clés supportant un rôle de la voie de signalisation de l’IL-6/gp1301 dans les changements structurels et fonctionnels du lit vasculaire pulmonaire associé à l’HTAP [5-8]. L’administration chronique d’IL-6 recombinante chez les rongeurs est en effet suffisante pour induire un remodelage vasculaire pulmonaire et augmenter la susceptibilité de ces animaux au développement de la maladie dans les modèles expérimentaux d’étude de l’HTAP [9]. La surexpression d’IL-6 est également suffisante pour induire un remodelage vasculaire pulmonaire et une hypertension pulmonaire spontanée chez la souris, tandis que la déficience en IL-6 a un effet protecteur contre le développement d’hypertension pulmonaire induite par l’hypoxie chronique [7, 10]. Nous avons récemment pu mettre en évidence que la production excessive d’IL-6 par l’endothélium pulmonaire dysfonctionnel contribuait à une couverture péricytaire excessive des artères pulmonaires remodelées dans l’HTAP expérimentale et humaine, facilitant leur muscularisation [6, 11]. Bien que ces différents éléments soulignent un lien entre la signalisation cellulaire induite par l’IL-6 et la progression de l’HTAP, les mécanismes sous-jacents unissant ces observations restaient jusqu’à présent méconnus. Deux voies de signalisation différentes ont été décrites pour l’IL-6 : la voie cis (également dite voie classique) et la voie trans (Figure 1). Dans la voie classique, l’IL-6 se lie à la surface membranaire par l’intermédiaire de son récepteur, l’IL-6R, et conduit à sa dimérisation avec la protéine gp130 qui va initier la transduction du signal intracellulaire aboutissant à l’activation de la voie de signalisation transduite par JAK/STAT (janus kinase/signal transducers and activators of transcription). En situation physiologique, cette voie classique est limitée aux hépatocytes, aux cellules épithéliales et intestinales, aux mégacaryocytes, aux polynucléaires neutrophiles, aux monocytes/macrophages et aux lymphocytes CD4+ ainsi qu’aux plasmocytes puisque l’expression membranaire de l’IL-6R est restreinte à ces différents types cellulaires. Les cellules qui n’expriment pas l’IL-6R membranaire peuvent néanmoins répondre à l’IL-6 au travers de la voie de trans-signalisation. Dans cette voie, l’IL-6 se lie à la forme soluble de l’IL-6R (ou sIL-6R), ce complexe IL-6/sIL-6R peut ensuite se lier à la glycoprotéine gp130 membranaire qui est présente de manière ubiquitaire sur toutes les cellules. La voie de trans-signalisation permet donc d’élargir le spectre d’action de l’IL-6, puisque les cellules n’exprimant pas l’IL-6R à leur surface vont pouvoir être stimulées par le complexe IL-6/sIL6R. Il est maintenant reconnu que certains aspects des désordres inflammatoires et néoplasiques sont transduits par cette voie de trans-signalisation de l’IL-6.
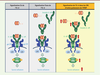 | Figure 1. Dérégulation des voies de l’IL-6 chez les patients avec hypertension artérielle pulmonaire. Les deux voies de signalisation de l’interleukine-6 (IL-6) : voie cis (panneau de gauche) et voie trans (au centre). Représentation schématique de la signalisation dérégulée des voies de l’IL-6 dans les cellules musculaires lisses d’artère pulmonaire (CML-AP) de patients avec hypertension artérielle pulmonaire (HTAP, panneau de droite). IL-6R : récepteur de l’IL-6, gp130 : glycoprotéine membranaire ; JAK : janus kinase ; STAT : signal transducers and activators of transcription. |
C’est en suivant l’expression des différentes protéines constitutives des voies cis et trans que nous avons pu montrer que ces deux voies étaient également impliquées dans l’HTAP humaine et expérimentale [8]. En plus de la surabondance d’IL-6 et de sIL-6R dans le sérum des patients, nous avons noté une surexpression de la gp130 et une expression ectopique de l’IL-6R à la surface des cellules musculaires lisses d’artère pulmonaire (CML-AP) de patients avec HTAP idiopathique (HTAPi). Des analyses fonctionnelles réalisées in vitro, menées avec des CML-AP de patients HTAPi ou de sujets contrôles, ont permis de démontrer que l’activation de l’IL-6R dans les CML-AP HTAPi induit l’expression de facteurs anti-apoptotiques, comme MCL-1 (myeloid cell leukemia-1) et Bcl-2 (B-cell lymphoma-2), facilitant ainsi la survie de ces cellules dans la paroi des artères pulmonaires remodelées. La mise en place de cette signalisation pathologique de l’IL-6R dans les CML-AP a pu être validée dans deux modèles précliniques d’étude de l’HTAP : le modèle monocrotaline2, (MCT) et le modèle d’administration de SU5416 combiné à l’hypoxie chronique (SuHx)3,. En cohérence avec ces données, l’invalidation spécifique du gène codant l’IL-6R dans le muscle lisse chez la souris (souris Sm22-Cre/Il6rflox/flox) confère une moindre susceptibilité au développement d’hypertension pulmonaire induite par l’exposition chronique à l’hypoxie [8]. Nous avons également pu mettre en évidence des effets bénéfiques d’un traitement chronique par un antagoniste spécifique de l’IL-6R (le 20S, 21-epoxy-resibufogenin-3-formate ou ERBF) sur le remodelage des artères pulmonaires et l’infiltration pulmonaire de cellules inflammatoires dans les deux modèles précliniques MCT2 et SuHx3. Ces effets étaient associés à la réduction de l’activation des kinases JAK/STAT [8]. Ainsi, cette découverte jette les bases de thérapies ciblant la signalisation de l’IL-6R pour les patients atteints d’HTAP. |
Conclusions et perspectives thérapeutiques En conclusion, de nombreuses données indiquent que l’inflammation est une des voies physiopathologiques du développement de l’HTAP et que l’expression ectopique de l’IL-6R à la surface des CML-AP pourrait représenter une cible pertinente pour lutter contre sa progression. Il existe déjà plusieurs stratégies d’inhibition des voies de l’IL-6 qui ciblent : (1) soit directement l’IL-6 ; (2) soit son récepteur (IL-6R) affectant les voies cis et trans ; (3) soit le complexe IL-6/sIL-6R par l’utilisation de protéines de fusion gp130 inhibant sélectivement la signalisation trans ; (4) soit, enfin, la transduction intracellulaire du signal en faisant appel à des inhibiteurs ciblant notamment la phosphorylation de JAK ou de STAT. Les travaux menés par Hashimoto-Kataoka et ses collaborateurs ont également montré que le blocage de l’IL-21, qui peut être induite par l’IL-6, peut également permettre de limiter certaines actions des voies de l’IL-6 et notamment celles liées à l’activation macrophagique dans l’HTAP expérimentale [12]. L’efficacité de traitements chroniques avec des protéines de fusion gp130 a aussi été démontrée dans les modèles expérimentaux d’hypertension pulmonaire [13]. Cependant cette dernière stratégie ainsi que celle utilisant des inhibiteurs de JAK ou STAT ne sont pas spécifiques des voies de l’IL-6. La gp130 est en effet un corécepteur impliqué dans les voies de signalisation induites par l’IL-11, l’IL-27, du leukemia inhibitory factor (LIF) et celles de l’oncostatine M (OSM). Ces stratégies peuvent donc potentiellement impacter d’autres mécanismes de l’inflammation et de l’immunité. Bien que les capacités de pléïotropisme, de redondance d’actions et d’interconnections des systèmes d’activation ainsi que les potentiels effets indésirables soient de clairs obstacles à franchir, le développement de stratégies anti-inflammatoires dans l’HTAP reste très prometteur. Récemment, une étude ouverte de phase 2 pour évaluer la tolérance et l’efficacité du tocilizumab chez les patients atteints d’HTAP a été initiée (ClinicalTrials, gov NCT02676947). Le tocilizumab est un anticorps monoclonal humanisé qui reconnaît l’IL-6R et bloque à la fois les signalisations cis et trans de l’IL-6. Il est actuellement approuvé pour le traitement de la polyarthrite rhumatoïde. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Ce travail a notamment reçu le support de l’ANR (ANR-16-CE17-0014 - TAMIRAH), du département hospitalo-universitaire (DHU) thorax innovation (TORINO) et de la chancellerie des universités de Paris. Carole Phan a reçu une allocation doctorale du fonds de recherche en santé respiratoire/fondation du souffle (FRSR/FdS).
|
Footnotes |
1. Guignabert C, Tu L, Girerd B, et al. New molecular targets of pulmonary vascular remodeling in pulmonary arterial hypertension: importance of endothelial communication . Chest. 2015; ; 147 : :529.–537. 2. Perros F, Humbert M, Cohen-Kaminski S,
Hypertension pulmonaire artérielle : un parfum d’auto-immunité . Med Sci (Paris). 2013; ; 29 : :607.–616. 3. Cracowski JL, Chabot F, Labarere J, et al. Proinflammatory cytokine levels are linked to death in pulmonary arterial hypertension . Eur Respir J. 2014; ; 43 : :915.–917. 4. Soon E, Holmes AM, Treacy CM, et al. Elevated levels of inflammatory cytokines predict survival in idiopathic and familial pulmonary arterial hypertension . Circulation. 2010; ; 122 : :920.–927. 5. Humbert M, Monti G, Brenot F, et al. Increased interleukin-1 and interleukin-6 serum concentrations in severe primary pulmonary hypertension . Am J Respir Crit Care Med. 1995; ; 151 : :1628.–1631. 6. Ricard N, Tu L, , Le Hiress M, et al. Increased pericyte coverage mediated by endothelial-derived fibroblast growth factor-2 and interleukin-6 is a source of smooth muscle-like cells in pulmonary hypertension . Circulation. 2014; ; 129 : :1586.–1597. 7. Savale L, Tu L, Rideau D, et al. Impact of interleukin-6 on hypoxia-induced pulmonary hypertension and lung inflammation in mice . Respir Res. 2009; ; 10 : :6.. 8. Tamura Y, Phan C, Tu L, et al. Ectopic upregulation of membrane-bound IL6R drives vascular remodeling in pulmonary arterial hypertension . J Clin Invest. 2018; ; 128 : :1956.–1970. 9. Golembeski SM, West J, Tada Y, Fagan KA. Interleukin-6 causes mild pulmonary hypertension and augments hypoxia-induced pulmonary hypertension in mice . Chest. 2005; ; 128 : :S572.–S573. 10. Steiner MK, Syrkina OL, Kolliputi N, et al. Interleukin-6 overexpression induces pulmonary hypertension . Circ Res. 2009;; 104 : :236.–44, 28p following 44.. 11. Le Hiress M, Tu L, Ricard N, et al. Proinflammatory signature of the dysfunctional endothelium in pulmonary hypertension. Role of the macrophage migration inhibitory factor/CD74 complex . Am J Respir Crit Care Med. 2015; ; 192 : :983.–997. 12. Hashimoto-Kataoka T, Hosen N, Sonobe T, et al. Interleukin-6/interleukin-21 signaling axis is critical in the pathogenesis of pulmonary arterial hypertension . Proc Natl Acad Sci USA. 2015; ; 112 : :E2677.–E2686. 13. Jasiewicz M, Knapp M, Waszkiewicz E, et al. Enhanced IL-6 trans-signaling in pulmonary arterial hypertension and its potential role in disease-related systemic damage . Cytokine. 2015; ; 76 : :187.–192. |