| |
| Med Sci (Paris). 34(8-9): 654–656. doi: 10.1051/medsci/20183408008.Effet majeur sur le microbiote intestinal des médicaments non antibiotiques Quentin Le Bastard,1 François Javaudin,1 and Emmanuel Montassier1* 1Université de Nantes, Microbiotas hosts antibiotics and bacterial resistances (MiHAR), 1, place A. Ricordeau, 44093Nantes, France MeSH keywords: Antibactériens, Bactéries, Résistance bactérienne aux médicaments, Microbiome gastro-intestinal, Humains, pharmacologie, effets des médicaments et substances chimiques |
Le microbiote intestinal est l’ensemble des micro-organismes, majoritairement des bactéries, qui colonise le tube digestif et dont la composition évolue de façon dynamique sous l’influence de nombreux facteurs. On peut citer l’alimentation, les pathologies chroniques comme le diabète ou encore les antibiotiques [1]. Récemment, des travaux réalisés chez l’homme ont révélé des associations entre une prescription de certaines molécules non antibiotiques comme les inhibiteurs de la pompe à proton (IPP), la metformine, les anti-inflammatoires non stéroïdiens ou les antipsychotiques, et des altérations spécifiques de la flore digestive [2–6]. Afin de déterminer si ces modifications sont liées à une action directe sur les populations bactériennes composant le microbiote intestinal, Maier et ses collègues ont évalué individuellement l’action de plus d’un millier de molécules sur une quarantaine de souches bactériennes représentatives de ce microbiote [7]. |
Les molécules non antibiotiques ont une action directe sur les bactéries composant le microbiote intestinal Maier et ses collègues ont analysé la croissance de 40 souches bactériennes considérées comme représentatives du microbiote intestinal humain en présence de 1 197 molécules référencées dans la bibliothèque prestwick chemical library1. Ces molécules représentent les principales classes thérapeutiques utilisées en médecine humaine, les trois quarts ayant pour cible des cellules humaines et un quart une cible microbiologique (bactérienne, parasitaire, virale ou fongique). Les souches bactériennes testées représentaient 78 % des genres bactériens du microbiote intestinal humain en termes d’abondance relative. Chaque souche était mise en culture en présence de chacune des molécules testées et sa croissance estimée par spectrophotométrie. Une molécule était retenue comme ayant une action sur la flore digestive si elle inhibait la croissance d’au moins une espèce bactérienne. In fine, 78 % des molécules à action antibactérienne étaient actives sur au moins une espèce bactérienne. Parmi les molécules non antibiotiques, 27 % étaient actives sur au moins une espèce bactérienne, la moitié étant des molécules anti-infectieuses, notamment anti-virales ou anti-fongiques. De façon plus surprenante, 24 % des molécules ciblant des cellules humaines ont montré une activité sur une espèce bactérienne. Bien que majoritairement actives sur uniquement quelques souches bactériennes, 40 d’entre elles se sont révélées actives sur 10 souches ou plus. Parmi ces molécules ayant une activité anti-commensale, les antipsychotiques étaient surreprésentés. Certaines espèces reconnues comme « bénéfiques » se sont, de plus, révélées être les plus sensibles aux molécules testées, telles les bactéries productrices de butyrate comme Roseburia intestinalis, Eubacterium rectale ou celles productrices de propionate comme Bacteroides vulgatus, Prevotella copri ou Blautia obeum [8,9]. |
L’effet des molécules non antibiotiques sur le microbiote intestinal est probablement sous-évalué Maier et ses collègues ont ensuite évalué la pertinence des concentrations des molécules sélectionnées par rapport aux concentrations intestinales attendues en médecine humaine. Pour cela, ils ont estimé les concentrations coliques attendues à partir des profils d’excrétion et des concentrations entériques rapportées dans la littérature. Il en résulte que les concentrations utilisées dans leur travail étaient inférieures aux concentrations intestinales attendues. La metformine n’avait, par exemple, pas d’activité anti-commensale dans une première expérience en raison de concentrations testées inférieures aux concentrations atteintes dans l’intestin chez des patients diabétiques traités par celle-ci. La même expérience réitérée à des doses plus élevées révélait ainsi une inhibition de la croissance bactérienne. Les auteurs ont également déterminé pour 25 molécules les concentrations inhibant 25 % de la croissance bactériennes (IC25) de 27 souches. Ces expérimentations ont montré que l’IC25 était bien souvent inférieure aux concentrations attendues dans le tractus digestif et dans le plasma, et qu’un plus grand nombre d’espèces bactériennes étaient inhibées à des concentrations plus élevées. |
Ces données expérimentales sont pertinentes avec les constatations in vivo réalisées chez l’humain Maier et ses collègues ont évalué la pertinence de leurs résultats précédents avec les données issues de cohortes de patients. Les études caractérisant les modifications du microbiote intestinal chez les patients traités par inhibiteurs de la pompe à proton (IPP) suggéraient un spectre d’activité comparable à celui observé in vitro. Les espèces dont l’abondance relative était ainsi diminuée chez les patients sous IPP présentaient une croissance inhibée, alors que les espèces dont l’abondance relative était augmentée in vivo n’avait que très rarement une croissance inhibée. Ces observations suggèrent qu’au-delà d’une action directe sur le pH gastrique, et donc des espèces bactériennes pouvant atteindre l’intestin, les IPP semblent influencer directement la composition du microbiote intestinal. Les mêmes résultats ont été observés pour d’autres classes thérapeutiques dont les anti-psychotiques. |
L’activité anti-commensale d’une molécule dépend de ses caractéristiques chimiques Parmi les différentes classes thérapeutiques testées, trois émergent principalement de ce travail : les anti-métabolites, les anti-psychotiques et les inhibiteurs de canaux calciques. Les anti-métabolites, prescrits comme chimiothérapie anticancéreuse ou comme agent immunosuppresseur, ont une action cytotoxique vis-à-vis des cellules humaines. Leurs cibles moléculaires sont également présentes chez les bactéries, expliquant ainsi leur action anti-commensale. L’effet des anti-psychotiques apparaît plus surprenant, puisque ceux-ci ciblent des récepteurs intracérébraux à dopamine et sérotonine, absents des membranes bactériennes. Tous les anti-psychotiques testés ont présenté une empreinte anti-commensale similaire. En analysant les mécanismes en jeu, les auteurs ont mis en évidence que les molécules à structures complexes et de masse moléculaire élevée ciblaient préférentiellement les bactéries Gram-positif, alors que les bactéries Gram-négatif semblaient protégées par leur membrane externe. |
Les molécules non antibiotiques pourraient promouvoir l’émergence de résistance aux antibiotiques La susceptibilité aux antibiotiques et celle aux molécules ciblant des cellules humaines sont corrélées parmi les espèces bactériennes, suggérant des mécanismes communs de résistance. Pour explorer ce phénomène, les auteurs ont sélectionné une souche d’E. coli déficiente pour le gène tolC (responsable d’une résistance à de nombreux antibiotiques par un mécanisme d’efflux) ainsi qu’une souche sauvage et les ont exposées à l’ensemble des molécules testées. La souche déficiente en tolC s’est avérée plus sensible aux antibiotiques et aux molécules non antibiotiques que la souche sauvage. Les auteurs ont observé cette même corrélation chez d’autres souches présentant une importante résistance aux antibiotiques et de façon concomitante aux molécules non antibiotiques. Ces résultats sont toutefois à nuancer, puisqu’ils n’étaient pas reproductibles sur des souches de C. difficile ou P. distansonis, qui présentaient une antibiorésistance importante contrastant avec une faible résistance aux molécules non antibiotiques. Il existe donc probablement deux mécanismes distincts, une résistance spécifique aux antibiotiques et des mécanismes plus généraux conférant une résistance aux deux classes de molécules. Afin d’analyser ces mécanismes, une seconde expérience a consisté à identifier l’ensemble des gènes surexprimés par E. coli (souche sauvage versus souche déficiente pour le gène tolC) en présence de sept molécules non antibiotiques à forte activité anti-commensale. Une surexpression du gène tolC chez les souches sauvages était associée à une résistance accrue, observée également avec de nombreux transporteurs transmembranaires, des facteurs de transcription et de maturation ribosomale ou des mécanismes de détoxification. Ces résultats suggèrent une intrication des mécanismes d’acquisition de résistance aux antibiotiques et aux molécules non antibiotiques. L’ensemble de ces résultats fournit de nouvelles preuves de l’action des différentes classes de médicaments sur le microbiote intestinal (Figure 1). Ces expériences soulignent le pouvoir de modulation du microbiote intestinal par des molécules non antibiotiques, d’usage usuel en médecine humaine et mettent en évidence leur rôle potentiel dans l’acquisition d’antibiorésistance. Ces constatations sont d’autant plus significatives qu’elles concordent avec les observations rapportées dans des cohortes cliniques. L’effet direct des molécules sur les bactéries composant le microbiote intestinal est de plus probablement sous-estimé dans cette étude compte tenu des concentrations utilisées. Enfin, ce travail ouvre également de nouvelles perspectives quant à la conception de nouveaux antibiotiques ou d’outils de modulations du microbiote intestinal à partir des molécules non antibiotiques [10] (→). (→) Voir la Synthèse de H.M. Blottière et J. Doré, m/s n° 11, novembre 2016, page 944
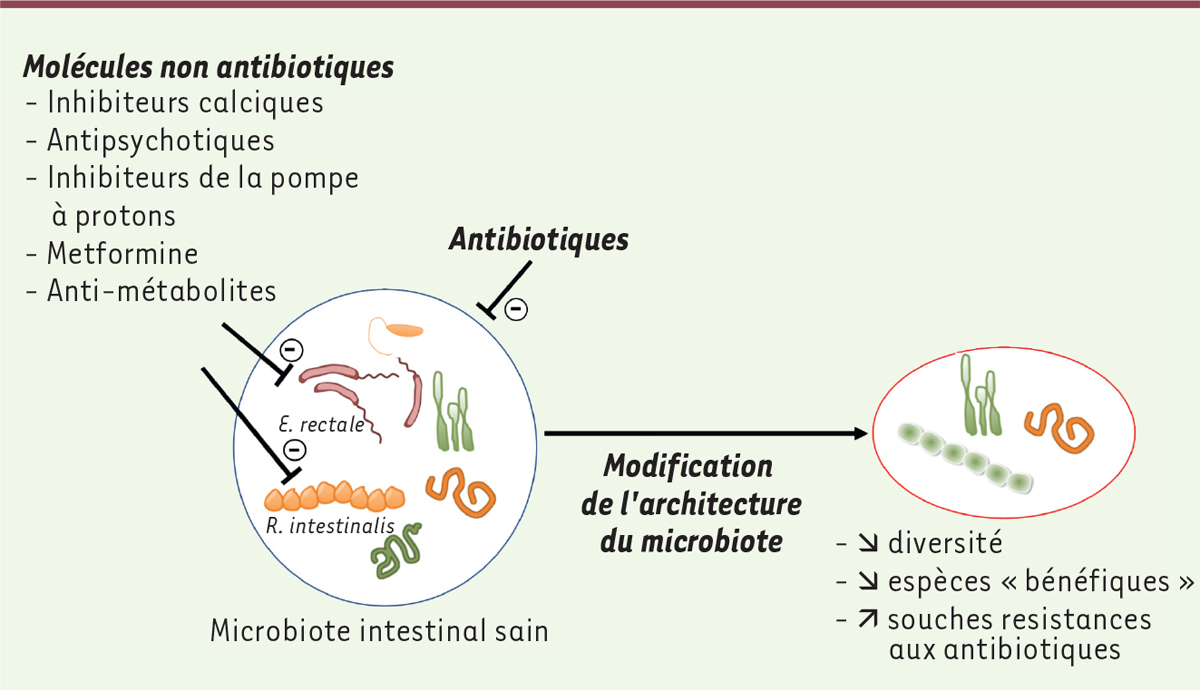
 | Figure 1.
Schématisation de l’effet des molécules sur le microbiote. Un grand nombre des molécules prescrites en médecine humaine ont une action inhibitrice directe sur la croissance d’une sélection de souches bactériennes représentatives du microbiote intestinal. Les espèces associées à un « microbiote sain », comme celles productrices de butyrate ou de propionate, semblent être les plus sensibles. Les inhibiteurs calciques, les antipsychotiques atypiques, ainsi que les antimétabolites se révèlent être les classes ayant une activité anticommensale la plus significative. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Falony G Joossens M Vieira-Silva S et al. Population-level analysis of gut microbiome variation . Science. 2016; ; 352 : :560.–564. 2.
Forslund K Hildebrand F Nielsen T et al. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota . Nature. 2015; ; 528 : :262.–266. 3.
Imhann F Bonder MJ Vich Vila A et al. Proton pump inhibitors affect the gut microbiome . Gut. 2016; ; 65 : :740.–748. 4.
Jackson MA Goodrich JK Maxan ME et al. Proton pump inhibitors alter the composition of the gut microbiota . Gut. 2016; ; 65 : :749.–756. 5.
Rogers MM, Aronoff DM. The influence of non-steroidal anti-inflammatory drugs on the gut microbiome . Clin Microbiol Infect. 2016;; 22 : :178.e1.–178.e9. 6.
Le Bastard Q Al-Ghalith GA Grégoire M et al. Systematic review: human gut dysbiosis induced by non-antibiotic prescription medications . Aliment Pharmacol Ther. 2018; ; 47 : :332.–345. 7.
Maier L Pruteanu M Kuhn M et al. Extensive impact of non-antibiotic drugs on human gut bacteria . Nature. 2018; ; 555 : :623.–628. 8.
Arumugam M Raes J Pelletier E et al. Enterotypes of the human gut microbiome . Nature. 2011; ; 473 : :174.–180. 9.
Donaldson GP Lee SM Mazmanian SK Gut biogeography of the bacterial microbiota . Nat Rev Microbiol. 2016; ; 14 : :20.–32. 10.
Blottières HM Doré J Impact des nouveaux outils de métagénomique sur notre connaissance du microbiote intestinal et de son rôle en santé humaine : enjeux diagnostiques et thérapeutiques . Med Sci (Paris). 2016; ; 32 : :944.–951. |