| |
| Med Sci (Paris). 34(5): 383–386. doi: 10.1051/medsci/20183405004.Traitement des dystrophies rétiniennes affectant l’épithélium pigmentaire par ingénierie tissulaire fondée sur les cellules souches embryonnaires humaines Karim Ben M’Barek,1,2,3 Walter Habeler,1,2,3 Olivier Goureau,4b* and Christelle Monville1,2a* 1Inserm U861, I-Stem, AFM, Institute for stem cell therapy and exploration of monogenic diseases, 28, rue Henri Desbruères, 91100Corbeil-Essonnes, France 2UEVE Inserm U861, I-Stem, AFM, Institute for stem cell therapy and exploration of monogenic diseases, 28, rue Henri Desbruères, 91100Corbeil-Essonnes, France 3CECS, I-Stem, AFM, Institute for stem cell therapy and exploration of monogenic diseases, 28, rue Henri Desbruères, 91100Corbeil-Essonnes, France 4Institut de la vision, Sorbonne Université, Inserm, CNRS, 75012Paris, France MeSH keywords: Animaux, Différenciation cellulaire, Cellules souches embryonnaires humaines, Humains, Souris, Dystrophies rétiniennes, Épithélium pigmentaire de la rétine, Ingénierie tissulaire, physiologie, thérapie, transplantation, méthodes |
La conversion du signal lumineux en influx électrique par la rétine puis sa transmission au cerveau sont le fondement des mécanismes permettant la vision. Les cellules rétiniennes sensibles à la lumière, ou photorécepteurs, sont l’objet de subtiles régulations garantissant leur homéostasie et leur survie, notamment grâce à la présence d’un feuillet cellulaire adjacent : l’épithélium pigmentaire rétinien (EPR). Cet épithélium permet le fonctionnement adéquat des photorécepteurs en sécrétant des protéines ayant une activité trophique, en éliminant les débris provenant des photorécepteurs (par un mécanisme de phagocytose), en favorisant le transport d’ions, de la vitamine A et du glucose, en absorbant le surplus de rayons lumineux ou en participant au recyclage de certaines protéines impliquées dans la détection de la lumière [1]. Cet EPR est altéré dans de nombreuses dystrophies rétiniennes. Dans le cadre de la dégénérescence maculaire liée à l’âge (DMLA), celui-ci peut être atrophié avec la mort des cellules qui le constituent. Certaines rétinites pigmentaires, pathologies formant un groupe de maladies génétiques rares, ont pour origine une mutation des gènes spécifiques des cellules de l’EPR. Il en résulte un défaut de fonctionnement de celui-ci, entraînant la mort des photorécepteurs et la cécité. Pour toutes ces maladies, il n’existe pas de traitement curatif. La thérapie cellulaire, qui repose sur la génération, en laboratoire, de cellules de l’EPR dans le but de remplacer celles qui sont mortes ou non fonctionnelles chez certains patients est une piste prometteuse [2] (→). (→) Voir la Nouvelle de S. Reichman et al., m/s n° 10, octobre 2014, page 845 Des essais cliniques ont d’ores et déjà débuté avec de premiers résultats encourageants en termes de sécurité pour des patients atteints de DMLA [3]. Cependant le domaine est encore balbutiant et ces technologies doivent être optimisées. L’une des voies d’amélioration majeure envisagée de la thérapie cellulaire dans ce domaine est la formulation du produit qui est administré au patient. Pour les premiers essais chez l’homme, les cellules de l’EPR ont été injectées sous la forme d’une suspension liquide. Cette stratégie à l’avantage d’être simple : la fabrication et la préparation avant greffe sont rapides et la chirurgie requise pour implanter ces cellules existe déjà. Cependant la survie des cellules greffées est limitée et leur intégration dans la rétine n’est pas optimale. Pour être pleinement fonctionnelles, les cellules doivent, en effet, s’organiser en feuillet épithélial. La recherche s’oriente ainsi actuellement vers la fabrication préalable d’un tissu épithélial déjà organisé qui sera ensuite greffé [4, 5]. |
Reconstitution in vitro par ingénierie tissulaire de l’EPR Dans le cadre d’une collaboration entre l’institut de la vision, l’I-Stem (AFM-Téléthon, Inserm, université d’Évry) et l’hôpital Saint Louis, nous avons reconstitué, en laboratoire, un feuillet épithélial d’EPR par ingénierie tissulaire [6]. Comme source de cellules, nous avons utilisé des cellules souches embryonnaires humaines. Ces cellules ont la propriété de proliférer indéfiniment tout en maintenant leur capacité à se différencier en tous types de cellules [7]. Nous avons ensuite développé un protocole afin d’orienter spécifiquement la différenciation de ces cellules souches en cellules d’EPR. Ce procédé de production robuste permet la conversion de toutes les cellules souches embryonnaires humaines en cellules d’EPR (avec moins de 0,05 % de cellules souches résiduelles). Les cellules d’EPR obtenues ont un niveau de pureté élevé (entre 96,5 et 99,3 %, selon les marqueurs utilisés). De larges banques de cellules EPR ont ainsi pu être produites. Elles ont été finement caractérisées selon différents critères : leur identité, leur pureté, leur fonctionnalité, leur degré de sécurité et leur stabilité. Le tissu épithélial a été obtenu en cultivant les cellules d’EPR issues des cellules souches sur des fragments de membrane amniotique humaine (qui peuvent être conservés congelés après leur obtention lors de césariennes). La membrane amniotique présente une membrane basale similaire à celle sur laquelle les cellules d’EPR reposent pour former l’épithélium en contact avec les photorécepteurs. Les cellules d’EPR générées en laboratoire sont capables de s’attacher à cette membrane amniotique. Elles s’organisent en un tissu épithélial complet après quatre semaines de culture minimum (Figure 1). Au cours de cette période, elles vont, entre autres, commencer à se pigmenter, à former des jonctions serrées entre elles et des microvilli à leur surface apicale. Le feuillet reconstitué est fonctionnel in vitro : il est en effet capable d’éliminer des débris de photorécepteurs et de sécréter des protéines à activité trophique.
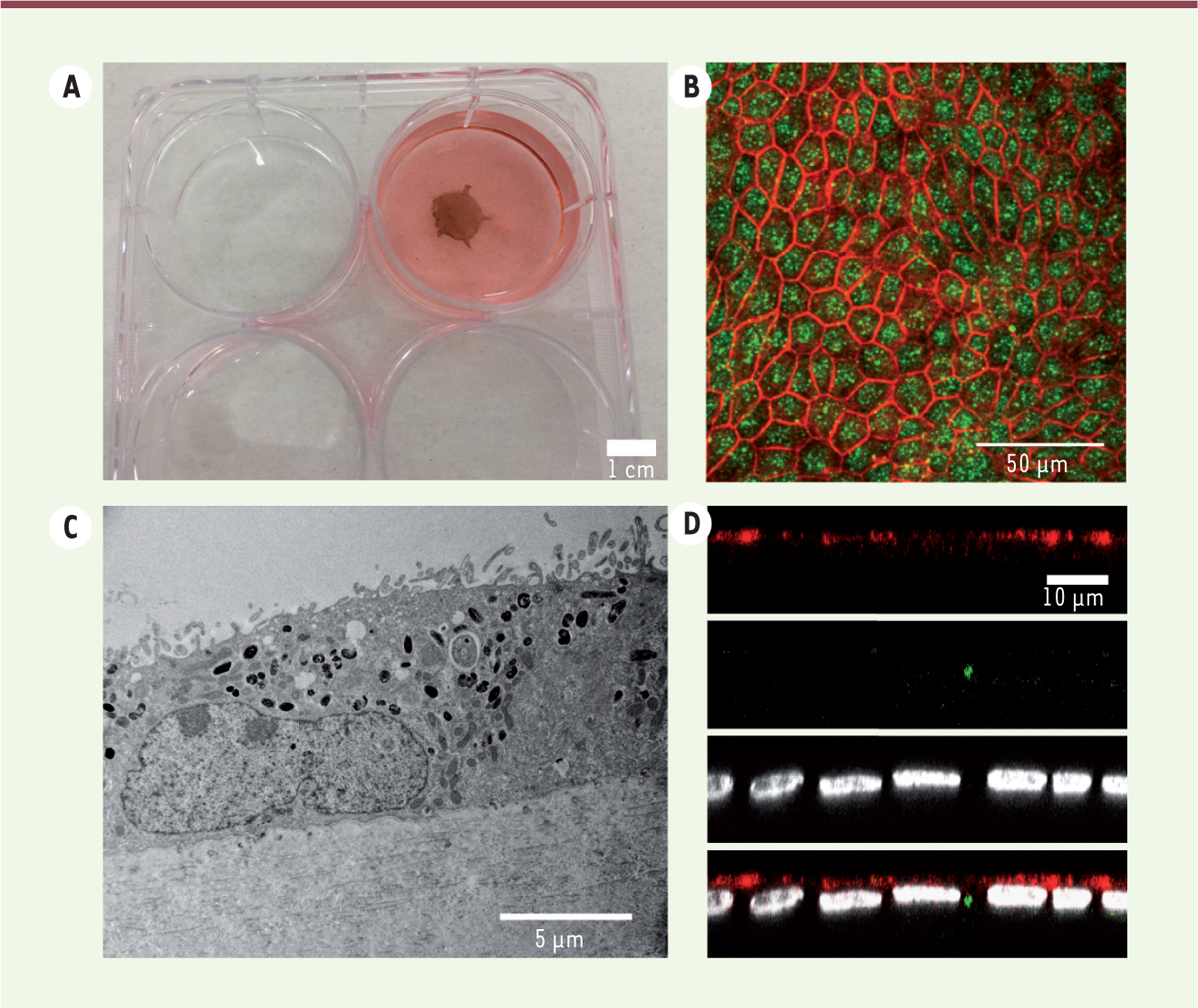
 | Figure 1.
Production d’un épithélium de cellules de l’EPR en laboratoire à partir de cellules souches embryonnaires humaines. A. Photo d’un tissu reconstitué de l’épithélium pigmentaire rétinien (EPR) sur une membrane amniotique dans une boîte de culture. B. Les cellules de l’EPR obtenues après différenciation expriment des marqueurs caractéristiques : PAX-6 (le facteur de transcription paired box protein, en vert) et Ezrine (une protéine liant le cytosquelette à la membrane plasmique, en rouge). C. Photo en microscopie électronique montrant la structure des cellules de l’EPR sur membrane. D. Le tissu reconstitué exprime MERTK (myeloid-epithelial-reproductive tyrosine kinase, récepteur apical, en rouge) et est fonctionnel via sa capacité à capter et éliminer les débris de photorécepteurs (en vert). Les noyaux contre-colorés par du DAPI apparaissent en blanc. |
Le feuillet épithélial reconstitué n’étant pas rigide et se froissant très facilement, le développement d’une stratégie de transplantation dans l’œil a donc été nécessaire. Le feuillet a été enrobé de deux fines couches de gélatine (sous forme solide à 4 °C) puis placé dans une canule transparente très fine dans laquelle il se replie sur lui-même (la zone cellulaire étant à l’intérieur). À la sortie de la canule, le feuillet se déplie, grâce à l’élasticité de la gélatine, pour se placer directement au contact des photorécepteurs de la rétine. À la température corporelle, la gélatine se liquéfie très rapidement et est éliminée. Les cellules d’EPR ainsi implantées peuvent alors interagir avec les photorécepteurs. Nous avons démontré que le tissu reconstitué de cellules EPR n’était pas altéré par cette méthode et que son positionnement sous la rétine était adéquat après cette chirurgie. |
Le tissu reconstitué de l’EPR est plus efficace que la formulation en suspension cellulaire Pour démontrer l’activité thérapeutique d’une telle formulation, nous avons utilisé un modèle murin de rétinite pigmentaire : le rat RCS (royal college of surgeons) qui présente une mutation d’un gène responsable d’une des fonctions des cellules de l’EPR. Elle est à l’origine d’une perte rapide des photorécepteurs et, par conséquent, de la vision [8]. L’opération de ces animaux, avant la perte définitive des photorécepteurs, a révélé que la greffe d’un tissu composé de cellules EPR permet une préservation plus importante et prolongée des fonctions visuelles, et de la structure de la rétine, que la méthode de la suspension cellulaire (sur une période de suivi de 3 mois), telle qu’évaluée par l’activité électrique résultant de la perception des signaux lumineux par les photorécepteurs. L’analyse de la structure de la rétine, par tomographie par cohérence optique, indique également une préservation accrue du nombre de photorécepteurs dans la zone de greffe. Enfin, des études comportementales ont permis de confirmer une amélioration de l’acuité visuelle : les rats greffés étant capables de détecter des objets en mouvement. Notre étude démontre que la formulation des produits de thérapie cellulaire pour le traitement des dystrophies rétiniennes est cruciale pour obtenir un bénéfice thérapeutique maximal chez le patient (Figure 2). Nous avons réalisé ce tissu thérapeutique avec un support biologique, la membrane amniotique. D’autres équipes de recherche travaillent actuellement sur des supports synthétiques, à base de polymères stables (comme le polyester ou le pyralène), ou biodégradables (comme le copolymère PLGA, poly-[acide lactide-co-glycolide]) [4, 9]. Une équipe japonaise réalise des essais cliniques sans aucun support [10]. La diversité des approches testées contribuera à développer la meilleure stratégie possible au bénéfice des patients. Nous évaluons désormais la sécurité du geste chirurgical, chez le primate, dont l’œil a une taille et une forme comparables à celles de l’œil humain. Nous espérons pouvoir traiter les premiers patients atteints de rétinite pigmentaire ayant pour origine un défaut de fonction de l’EPR, dans le cadre d’un essai clinique de phase I/II au cours de l’année 2019.
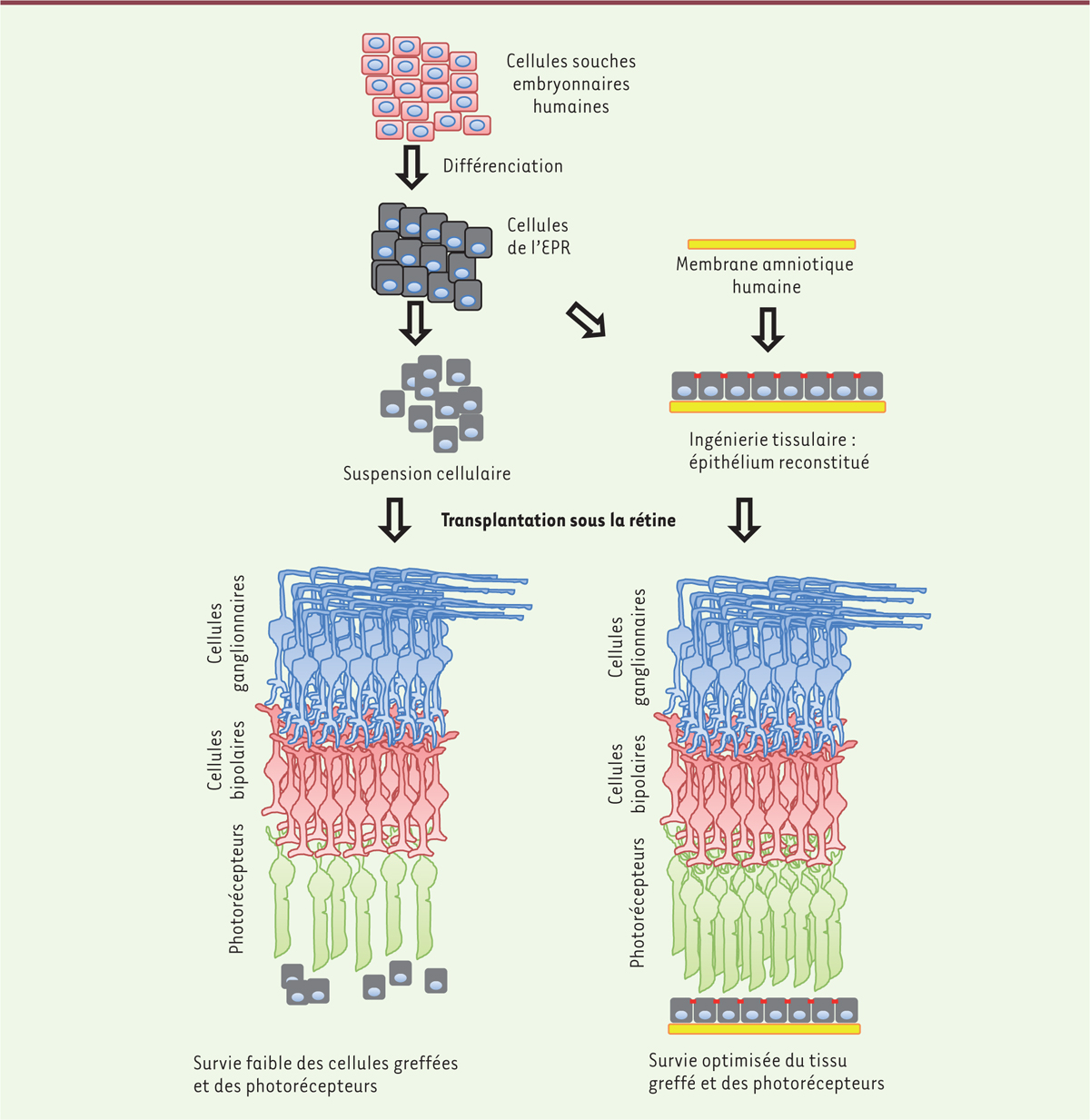
 | Figure 2.
Schéma décrivant les deux méthodes de formulation du produit de thérapie cellulaire et les effets sur la rétine.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Strauss O. The retinal pigment epithelium in visual function . Physiol Rev. 2005; ; 85 : :845.–881. 2.
Reichman S, Sahel JA, Goureau O. Production de rétines in vitro à partir de cellules pluripotentes humaines . Un nouvel outil thérapeutique. Med Sci (Paris). 2014; ; 30 : :845.–848. 3.
Schwartz SD, Regillo CD, Lam BL, et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt’s macular dystrophy: follow-up of two open-label phase 1/2 studies . Lancet. 2015; ; 385 : :509.–516. 4.
Nazari H, Zhang L, Zhu D, et al. Stem cell based therapies for age-related macular degeneration: The promises and the challenges . Prog Retin Eye Res. 2015; ; 48 : :1.–39. 5.
Carr AJ, Smart MJ, Ramsden CM, et al. Development of human embryonic stem cell therapies for age-related macular degeneration . Trends Neurosci. 2013; ; 36 : :385.–395. 6.
Ben M’Barek K, Habeler W, Plancheron A, et al. Human ESC-derived retinal epithelial cell sheets potentiate rescue of photoreceptor cell loss in rats with retinal degeneration . Sci Transl Med. 2017;; 9 ((421)). 7.
Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Embryonic stem cell lines derived from human blastocysts . Science. 1998; ; 282 : :1145.–1147. 8.
D’Cruz PM, Yasumura D, Weir J, et al. Mutation of the receptor tyrosine kinase gene Mertk in the retinal dystrophic RCS rat . Hum Mol Gen. 2000; ; 9 : :645.–651. 9.
Bharti K, Rao M, Hull SC, et al. Developing cellular therapies for retinal degenerative diseases . Invest Ophthalmol Vis Sci. 2014; ; 55 : :1191.–1202. 10.
Mandai M, Watanabe A, Kurimoto Y, et al. Autologous induced stem-cell-derived retinal cells for macular degeneration . N Engl J Med. 2017; ; 376 : :1038.–1046. |