| |
| Med Sci (Paris). 34(4): 345–353. doi: 10.1051/medsci/20183404016.Le modèle poisson zèbre dans la lutte contre le cancer Pamela Völkel,1 Babara Dupret,2 Xuefen Le Bourhis,2 and Pierre-Olivier Angrand2* 1CNRS Lille, Inserm U908, Université de Lille, Bâtiment SN3, Cité Scientifique, 59655Villeneuve d’Ascq, France 2Inserm U908, Université de Lille, Bâtiment SN3, Cité Scientifique, 59655Villeneuve d’Ascq, France |

Vignette (Photo © Inserm/Leclerc, Philippe). Dès le 9 avril 1910, William H. Taft, le vingt-septième président des États-Unis d’Amérique, demandait 50 000 dollars au Congrès pour la création d’un laboratoire fédéral de recherche focalisé sur l’étude du cancer chez les poissons. Dans son mémorandum, il déclarait : « We have every reason to believe that a close investigation into the subject of cancer in fishes, which are frequently swept away by an epidemic of it, may give us light upon this dreadful human scourge » [
1]. Cette proposition était accompagnée d’un rapport du Docteur Harvey R. Gaylord, directeur du New York State Cancer Laboratory, qui avait montré que les cancers de la thyroïde chez la truite possédaient de grandes similarités avec les cancers humains. Au cours des ans, de nombreuses autres espèces de poissons telles que le xipho (Xiphophorus hellerii), le platy (Xiphophorus maculatus), le guppy (Poecilia reticulata), le medaka (Oryzias latipes), le cyprinodon (Cyprinodon variegatus), la gambusie (Gambusia affinis) ou l’anguille du Japon (Aguilla japonica), ont fait l’objet d’études de carcinogenèse. Ces études ont montré que, sur le plan histologique, les néoplasmes des poissons étaient identiques aux cancers humains [
2]. Mais parmi tous les poissons utilisés en cancérologie, le modèle poisson zèbre (Danio rerio) a pris ces dernières années une importance particulière dans la recherche contre les cancers. Le poisson zèbre est un petit téléostéen1 de 3 à 4 cm de la famille des Cyprinidés, originaire de l’Inde et de la péninsule Malaise. Son élevage est extrêmement facile, peu coûteux et chaque femelle peut pondre de 100 à 200 œufs par semaine. La fécondation et le développement des embryons s’effectuent ex utero, et rapidement, puisque la plupart des organes sont mis en place au cours des 24 premières heures du développement. La relative transparence des embryons permet de suivre l’organogenèse avec une résolution cellulaire. Mais, la véritable force du modèle poisson zèbre a été démontrée par l’utilisation de cribles génétiques directs à grande échelle qui ont permis d’identifier des mutants dans lesquels le développement de pratiquement tous les organes et types cellulaires était affecté [
3,
4]. Les méthodes puissantes de génétique inverse comme la transgenèse [
5], ou les techniques d’édition du génome par les TALEN (transcription activator-like effector nucleases) et le système CRISPR/Cas9 sont applicables au poisson zèbre [
52,
53] ➔.
➔
Voir la Synthèse de B. Dupret et P.O. Angrand, m/s n° 2, février 2014, page 186, et la Nouvelle de H. Gilgenkrantz, m/s n° 12, décembre 2014, page 1066
L’ensemble de ces caractéristiques et le fait que 70 % des gènes humains aient au moins un orthologue chez le poisson zèbre [
6], en font un modèle de choix pour l’étude du développement [
54,
55] ➔ mais également pour la recherche translationnelle [
56] ➔.
➔
Voir la Synthèse de M. Ekker et M.A. Akimenko, m/s n° 6, juin 1991, page 553 et la Nouvelle de K. Kissa et al., m/s n° 8-9, août-septembre 2007, page 698
➔
Voir la Synthèse de L. Ryckebüsch, m/s n° 10, octobre 2015, page 912
Le poisson zèbre a été la première espèce de poisson utilisée dans des tests de carcinogenèse. Dans les années 1960, Mearle Stanton avait en effet montré que son exposition à la N-nitrosodiéthylamine (DEN) provoquait l’apparition de tumeurs hépatiques [
7], alors que le taux d’incidence de cancers chez ce poisson est, normalement, relativement faible [
8]. L’exposition à différents carcinogènes, comme la N-nitroso-N-éthylurée (ENU), le 7,12-diméthylbenzanthracène (DMBA) ou la N-méthyl-N’-nitro-N-nitrosoguanidine (MNNG), est aussi à l’origine de l’apparition chez le poisson, de plusieurs types de néoplasies telles que des papillomes de la peau, des rhabdomyosarcomes2,, des séminomes3, des tumeurs du côlon, du rein, des ovaires, du pancréas ou des vaisseaux sanguins [9-11]. En plus d’être proches des cancers humains sur le plan histologique, ces cancers présentent des similitudes d’altérations moléculaires avec celles observées dans les tumeurs humaines [
12,
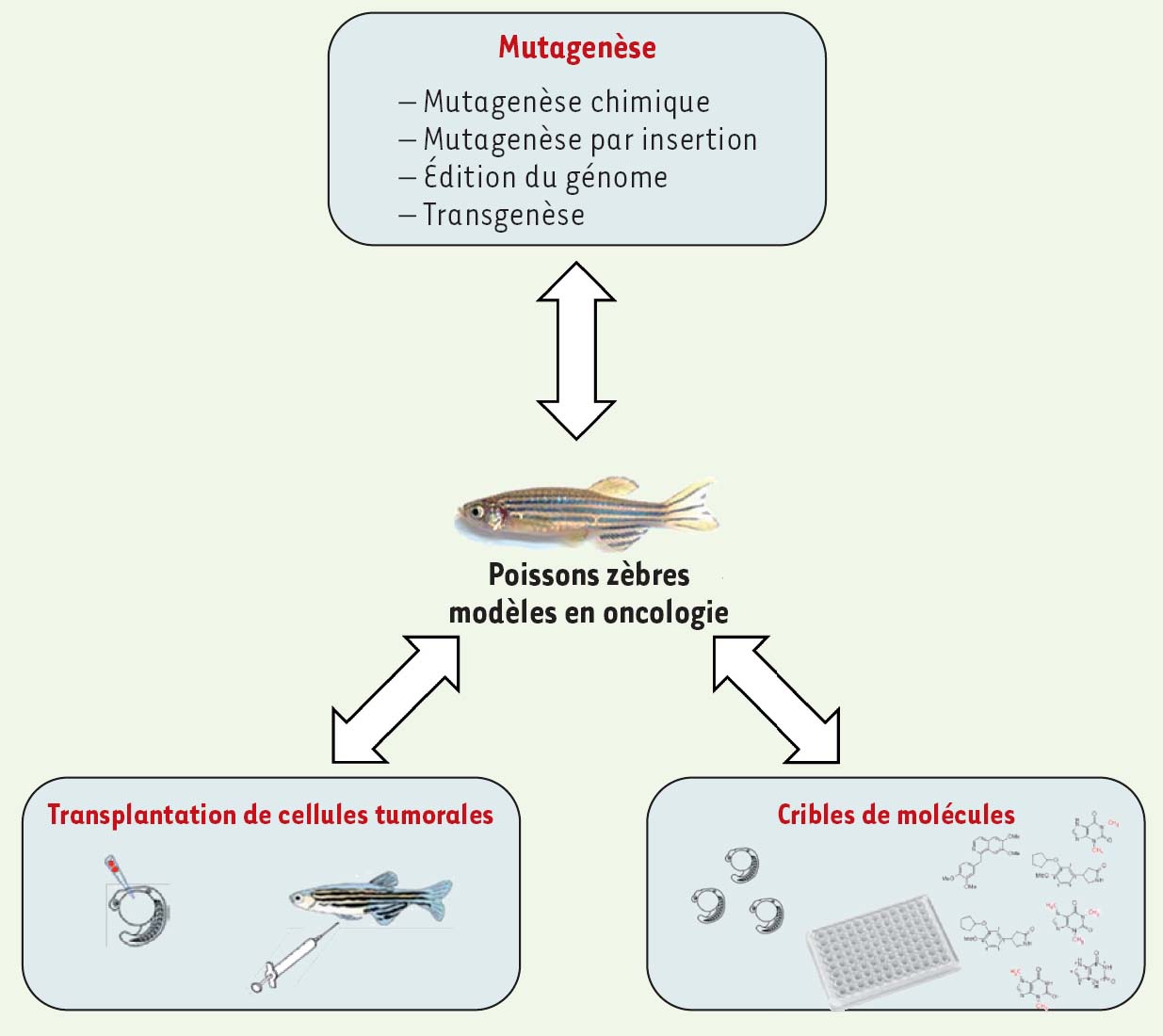
13]. Ces études de carcinogenèse, conjuguées aux attributs qui ont fait le succès du poisson zèbre dans la recherche en biologie du développement, font ainsi de ce poisson, un modèle exceptionnel pour la recherche en oncologie (Figure 1).  | Figure 1.
Utilisation du modèle poisson zèbre en oncologie.
Différentes approches expérimentales sont utilisées chez le poisson zèbre pour la recherche en cancérologie. La mutagenèse chimique, la transgenèse et les techniques d’édition du génome permettent de générer des poissons zèbres modèles. La xénogreffe de cellules tumorales humaines chez le poisson zèbre permet de suivre le comportement des cellules cancéreuses in vivo. Le poisson zèbre peut être utilisé dans des cribles de molécules afin d’identifier des composants anticancéreux. |
|
Mutagenèse pour un modèle de cancérogenèse La découverte, au cours des années 1990, que la N-nitroso-N-éthylurée (ENU) pouvait induire des mutations ponctuelles dans le génome du poisson zèbre [
14] a ouvert la voie à la recherche de mutants, à grande échelle. Ces cribles génétiques ont permis d’identifier de nombreux mutants touchant le développement [3, 4], mais également des mutants susceptibles de développer des tumeurs. C’est notamment le cas de mutations dans les gènes suppresseurs de tumeurs ptena, ptenb [
15], apc [
16], mlh1, msh2, msh6 [
17], brca2 [
18] ou tp53 [
19] (Tableau I et voir Glossaire). En particulier, Berghmans et al. [19] ont analysé les allèles du gène tp53 chez le poisson soumis à une mutagenèse à l’ENU. Parmi les mutations identifiées, certaines sont retrouvées à des positions qui s’avèrent orthologues à celles que l’on observe dans des tumeurs chez l’homme. C’est le cas des mutations tp53N168K
et tp53M214K
qui affectent le domaine de liaison à l’ADN de Tp53 et dont des mutations en positions identiques sont rencontrées dans plus d’une centaine de tumeurs humaines. Ces altérations n’affectent pas le développement du poisson zèbre, mais le prédisposent à la tumorigenèse. En effet, 28 % des poissons porteurs de mutations dans ce gène présentent des tumeurs malignes des nerfs périphériques à l’âge de huit mois et demi. Ces tumeurs sont souvent aneuploïdes et présentent des altérations génétiques similaires à celles des cancers humains [13]. La prédisposition des poissons mutants tp53-/-
à développer des tumeurs reflète ainsi l’aspect séquentiel du développement tumoral. Et le fait que TP53 soit non fonctionnel ou muté dans un grand nombre de cancers humains fait de ces poissons un excellent modèle génétique pour analyser l’action coopérative potentielle d’oncogènes. L’expression dans les mélanocytes des oncogènes BRAFV600E ou NRASQ61K est ainsi responsable de l’apparition d’une pigmentation anormale et de nævus4 chez les poissons zèbres sauvages. En revanche, elles conduiront à la formation de mélanomes dans un fond génétique dépourvu d’expression de tp53 (tp53-/-) [
20,
21]. Tableau I.
|
Méthodes
|
Gènes
|
Cancers
|
Références
|
| Mutagenèse par N-nitroso-N-éthylurée (ENU) |
tp53
|
tp53M214K : tumeurs malignes des gaines des nerfs périphériques (incidence : 28 % à 16 mois) |
[19] |
| Mutagenèse par ENU |
ptenb ptena+/-ptenb-/- et ptena-/- ptenb+/-
|
Tumeurs oculaires (incidence : 33 % à 7-18 mois). Sarcomes des tissus mous (incidence : 10 % à partir de 3 mois)
|
[15] |
| Mutagenèse par ENU |
apc
|
Foie, intestin (incidence : 29 % à 15 mois) |
[16] |
| Mutagenèse par ENU |
mlh1, msh2, msh6
|
Neurofibromes, sarcomes des tissus mous (incidence : 33 % à 17 mois) |
[17] |
| Mutagenèse par ENU |
dnaaf1 (lrcc50)
|
Séminomes (incidence : 90 % après 24 mois) |
[
25] |
| Mutagenèse par ENU |
brca2
|
Cancer des testicules (incidence : 31 % à 10-16 mois) |
[18] |
| Mutagenèse insertionnelle
|
Gènes codant des protéines ribosomales (S8, S15a, L7, L35, L36, L36a, L13, L23a, S7, S18, S29)
|
Tumeurs malignes des gaines des nerfs périphériques (incidence : 14 à 60 % à 24 mois) |
[
22] |
| Mutagenèse insertionnelle |
nf2a
|
Tumeurs malignes des gaines des nerfs périphériques |
[22] |
| Mutagenèse insertionnelle |
Dérégulation (surexpression) du gène fgf8
|
Neuroblastomes (incidence : 10-20 % à 5 mois) |
[8] |
|
ZFN (zinc-finger nucleases)
|
nf1a, nf1b
|
Gliomes de haut grade et tumeurs malignes des gaines des nerfs périphériques chez les mutants tp53-/-
|
[
23] |
| ZFN |
tet2
|
Syndrome myélodysplasique généralisé à 24 mois |
[
24] |
|
TALEN (transcription activator-like effector nucleases)
|
rb1
|
Tumeurs neuroectodermiques et gliales à 3,5 mois |
[25] |
Poissons zèbres mutants, modèles en oncologie.
|
L’utilisation de vecteurs rétroviraux est une stratégie qui permet de générer des mutants à grande échelle par mutagenèse par insertion aléatoire dans le génome. Cette approche a permis de montrer que la perte de fonction de plusieurs gènes codant des protéines ribosomales pouvait être impliquée dans l’apparition de cancers [22]. Les technologies récentes d’édition de génomes qui ciblent des gènes spécifiques participent à la génération de modèles qui permettent de mimer les altérations génétiques observées dans les cancers humains. Les nucléases à doigts de zinc (ZFN) et les TALEN ont ainsi été utilisés pour l’ingénierie de poissons zèbres porteurs de mutations dans les gènes nf1a et 1b [23], tet2 [24] ou rb1 [25]. Il est très probable que ces technologies soient également employées dans les années à venir afin d’introduire des mutations somatiques mimant les altérations trouvées dans de nombreuses tumeurs humaines. Si la mutagenèse a conduit à la génération de poissons qui modélisent des cancers chez l’homme, elle a aussi permis, inversement, l’identification d’altérations génétiques de tumeurs humaines. Ainsi, il a été observé que les poissons zèbres identifiés dans un crible à l’ENU et porteurs d’une mutation hétérozygote dans le gène qui code la protéine Lrrc50 (leucine-rich repeat containing protein 50 aussi appelée Dnaaf1) développaient des séminomes [
26]. L’implication de ce gène dans la tumorigenèse chez l’homme était jusqu’alors inconnue, mais la recherche de mutations dans l’orthologue humain LRRC50 a montré qu’il était effectivement altéré dans environ 13 % des séminomes chez l’homme [26]. Cette étude représente ainsi un bon exemple qui illustre comment l’analyse des cancers chez le poisson zèbre peut conduire à la découverte de mécanismes moléculaires impliqués dans les pathologies humaines. |
GLOSSAIRE
Akt1 : protéine kinase B alpha
apc :
adenomatous polyposis coli
brca2 : breast cancer antigen 2
cd10 : common acute lymphoblastic leukemia antigen
CDKN2A : cyclin-dependent kinase inhibitor 2A
dnaaf 1: dynein, axonemal, assembly factor 1
fgf8 : fibroblast growth factor 8a
fli1 : friend leukemia virus integration 1
LMO2 : LIM domain only 2
mitfa : microphthalmia-associated transcription factor a
mlh : mutL homolog
mTOR : target of rapamycin
myf5 : myogenic factor 5
myog : myogenin
nf1/2 : neurofibromin 1/2
PI3K : phosphoinositide 3-kinase
ptena/b : phosphatase and tensin homolog A/B
rag2 : recombination activating 2
rb1 : retinoblastoma 1
TAL1/SCL : T-cell acute lymphoblastic leukemia 1/stem cell leukemia
tet : tet methylcytosine dioxygenase 2
tp53 : tumor protein p53
|
|
Transgenèse et poissons zèbres La facilité d’introduction d’un ADN exogène dans le génome du poisson zèbre par transgenèse a ouvert la voie à la génération de nombreux modèles développant des leucémies ou des tumeurs solides. Le premier cancer induit par transgénèse dans ce modèle a été une leucémie lymphoblastique T aiguë [
27]. Dans ce modèle, l’oncogène murin Myc est fusionné au gène codant la GFP (green fluorescent protein), et placé sous le contrôle du promoteur du gène rag2 exprimé dans les lymphocytes. Dans ce système, l’expression de Myc est responsable de l’expansion rapide des cellules leucémiques. Ces cellules, qui expriment la protéine de fusion GFP-Myc, émergent du thymus, colonisent les muscles squelettiques et d’autres organes voisins, et provoquent la mort des poissons transgéniques avant l’âge de 3 mois. Les cellules leucémiques exprimant la GFP (et donc Myc) conservent leur pouvoir tumorigène après transplantation dans des poissons zèbres sauvages. Leur analyse transcriptomique montre qu’elles ont pour origine des précurseurs des lymphocytes T. Elles expriment les orthologues des oncogènes TAL1/SCL et LMO2 et présentent des caractéristiques génétiques que l’on observe dans un sous-groupe de leucémies lymphoblastiques aiguës humaines très répandues et résistantes aux traitements [27]. Les poissons transgéniques qui expriment la protéine de fusion TEL-AML1 développent une leucémie lymphoblastique B aiguë. Elle se caractérise par l’expression des marqueurs ikaros, rag2, scl et cd10, comme cela est le cas chez les patients porteurs d’une leucémie lymphoblastique aiguë pré-B associée à la translocation t(12;21)(p13;q22) [
28]. Ces exemples illustrent ainsi parfaitement la pertinence de la transgénèse en cancérologie, et de nombreux autres poissons zèbres modèles ont été générés depuis. Ainsi, la surexpression de Myc ou KRASG12V conduit à la formation d’hépatomes ou de cancers du pancréas [
29,
30], l’amplification de MYCN promeut la formation de neuroblastomes [
31], et l’activation d’Akt1 augmente la formation de lipomes [
32]. Dans un fond génétique tp53-/-, la surexpression de différents oncogènes est à l’origine de plusieurs types de cancers chez le poisson, tels que des hépatomes (src) [
33], des mélanomes (NRASQ61K ou BRAFV600E) [20, 21], ou des sarcomes d’Ewing (EWS-FLI1) [
34], suggérant que les poissons zèbres transgéniques peuvent contribuer à l’étude de la coopération et des relations entre différentes voies impliquées dans la tumorigenèse. |
Allogreffes et xénogreffes de cellules tumorales La transplantation de cellules tumorales dans un organisme de même espèce (allogreffe) ou d’une espèce différente (xénogreffe) est une approche clé qui permet l’étude de la tumorigénicité de ces cellules dans l’environnement d’un organisme entier. Les techniques de transplantation de cellules tumorales sont très bien établies chez les souris immunodéprimées (telles que les souris NOD/SCID/IL2rgtmWjl/sz)5. Néanmoins, le poisson zèbre se révèle être un modèle complémentaire très intéressant. Comme chez la souris, la transplantation de cellules tumorales chez le poisson adulte nécessite que son système immunitaire soit altéré (par radiation, chimiquement ou génétiquement comme chez les mutants rag2E450fs). Les poissons syngéniques permettent également de pratiquer des allogreffes sans rejet des implants. Les mutants translucides Casper [
35] (Figure 2A) permettent, quant à eux, un bon suivi du développement tumoral in vivo [
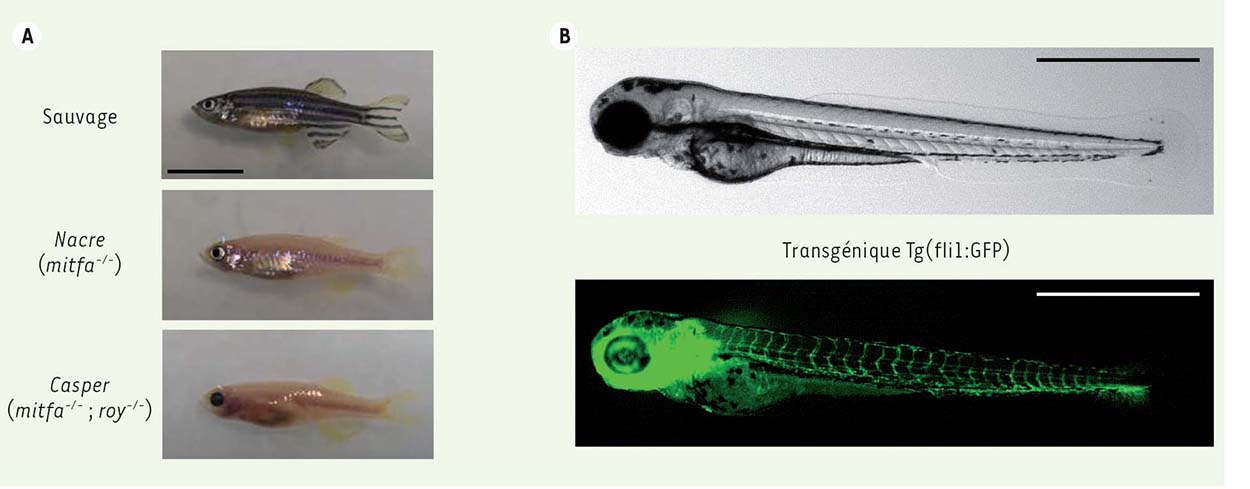
36].  | Figure 2
Exemples de poissons zèbres modèles utilisés pour la transplantation de cellules cancéreuses. A.
Plusieurs lignées de poissons zèbres possèdent des défauts de pigmentation. Le poisson mutant Nacre, porteur d’une mutation dans le gène mitfa, ne possède pas de mélanocytes mais un nombre augmenté d’iridophores, des chromatophores réfléchissants ne contenant pas de pigments. Le mutant Casper présente à la fois une déficience en mélanocytes et en iridophores. La barre d’échelle indique 1 cm (photographies : © P.O. Angrand). B. Photographie d’un embryon de poisson zèbre transgénique Tg(fli1:GFP) de 3 jours. En microscopie de fluorescence, la vascularisation, qui apparaît en vert, permet de suivre l’angiogenèse induite par les cellules tumorales en modèle de xénogreffe. La barre d’échelle correspond à 1 mm (photographies : © P. Völkel). |
Parmi les expériences de xénogreffe qui ont été réalisées chez le poisson zèbre, citons celles de Stoletov et al. [
37] dans lesquelles des cellules humaines de mélanome (la lignée MDA-MB-435) ou de sarcome (les cellules HT1080) ont été transplantées dans la cavité péritonéale de poissons zèbres âgés de 1 mois immunodéprimés par un traitement à la dexaméthasone. Dans cette étude, si les deux types cellulaires développent des tumeurs localement, seules les cellules sarcomateuses HT1080 ont un pouvoir métastatique, ce qui est également observé dans les modèles de xénogreffe chez la souris. En utilisant des poissons transgéniques Tg(fli1:GFP) [
38], chez qui le promoteur du gène fli1 dirige l’expression de la protéine fluorescente GFP dans les vaisseaux sanguins (Figure 2B), les auteurs ont également pu montrer que les cellules de mélanome MDA-MB-435 avaient un pouvoir angiogénique plus faible que celui des cellules de sarcome, probablement en raison de leur faible capacité métastatique. Dans une autre étude, Ignatius et al. [
39] ont réalisé une allogreffe de cellules tumorales chez des poissons zèbres « sauvages » marquées par différentes molécules fluorescentes selon leur degré de différenciation, et isolées de poissons transgéniques Tg(rag2:KRASG12V) qui développent des rhabdomyosarcomes [
40]. Des dilutions successives des cellules tumorales, avant transplantation, ont permis de montrer que les cellules qui possédaient le plus important pouvoir de propagation tumorale étaient les cellules les moins différenciées, qui expriment le marqueur myf5, mais qu’elles ne pénétraient pas dans les vaisseaux sanguins. À l’inverse, les cellules différenciées, qui expriment myog, présentaient, elles, un fort pouvoir d’intravasation. Ces observations peuvent être reliées à la notion que, chez l’homme, les rhabdomyosarcomes qui expriment la myogénine (MYOG), sont généralement associés à un plus mauvais pronostic. Cette étude suggère également que les cellules initiatrices de tumeur, les cellules métastatiques, et les populations plus différenciées, pourraient avoir des identités moléculaires distinctes et occuper des niches différentes [39]. La transplantation de cellules tumorales dans des embryons de poisson zèbre de 2 jours est également une approche extrêmement utilisée. À ce stade de développement, le système immunitaire du poisson est encore immature et la transparence des embryons permet un suivi aisé des cellules transplantées. Les propriétés tumorigène ou angiogénique de cellules tumorales peuvent ainsi être évaluées dans les jours qui suivent leur transplantation [
41]. De nombreuses lignées cellulaires humaines ont été analysées après leur injection en divers sites de l’embryon du poisson zèbre (Figure 3). En combinaison avec la manipulation ou le tri des cellules cancéreuses, cette approche de xénogreffe a permis d’étudier les facteurs moléculaires impliqués dans le processus métastasique ou dans le comportement des cellules souches cancéreuses [
42,
43]. Outre les lignées de cellules cancéreuses, la xénogreffe dans les embryons peut être utilisée pour l’étude des propriétés de tumeurs primaires issues de patients (PDX, patient-derived xenograft). Marques et al. [
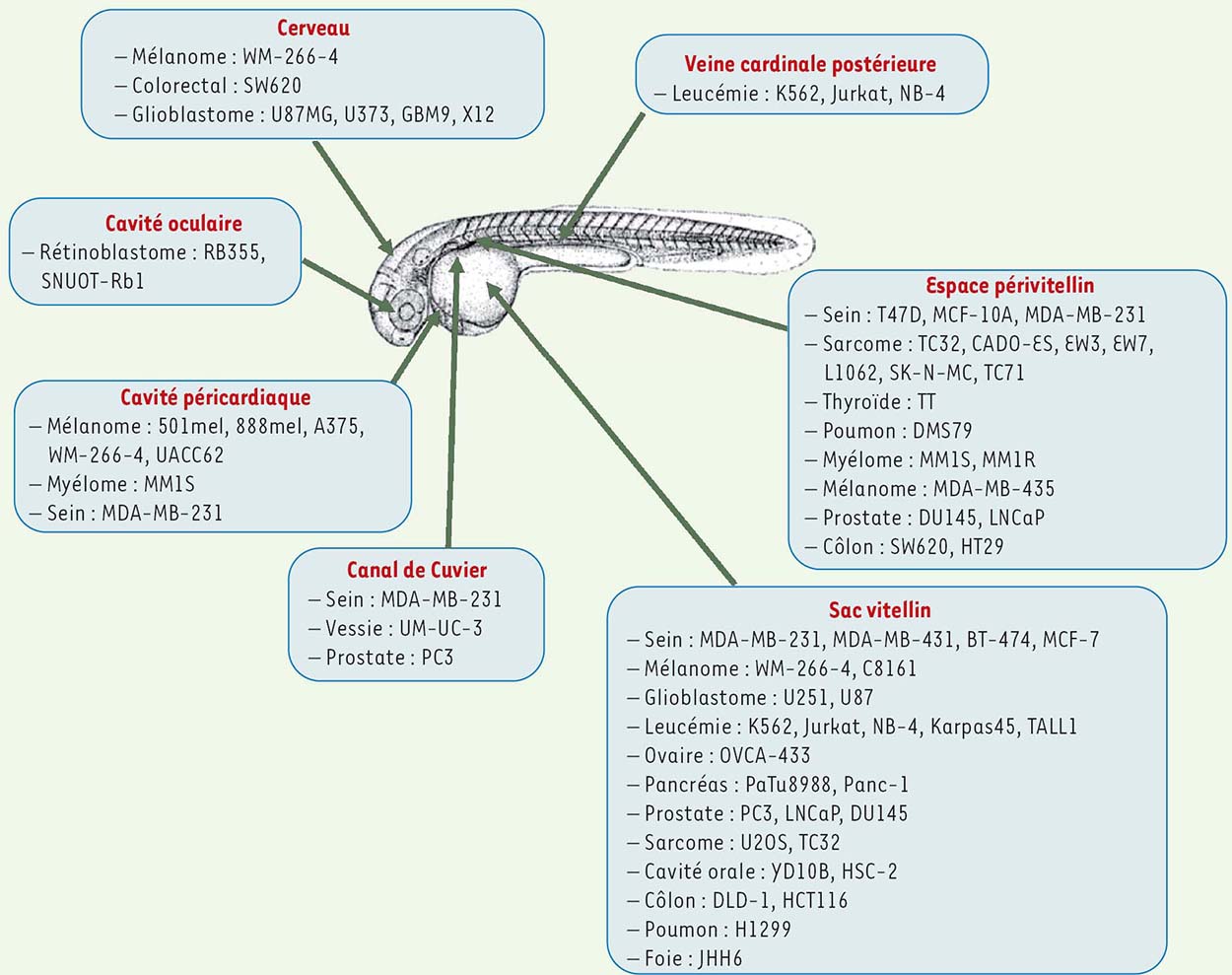
44] ont ainsi injecté des explants tumoraux provenant de patients porteurs de cancers gastro-intestinaux dans des embryons de poissons zèbre transgéniques Tg(fli1:GFP) de 2 jours et ont montré que les cellules cancéreuses se disséminent et forment des micrométastases principalement au niveau du foie et de l’intestin dans les 24 heures qui suivent la transplantation. En revanche, les cellules des explants d’origine péritumorale ne migrent pas [44].  | Figure 3
Illustration des sites d’injection les plus communs utilisés lors des expériences de xénotransplantation dans les embryons de poisson zèbre de 2 jours.
De nombreuses lignées cellulaires humaines issues de différents organes ont été utilisées et injectées en divers sites de l’embryon. |
La xénogreffe de cellules est donc utilisée pour prédire le pouvoir tumoral et métastatique des cellules cancéreuses. Ce type d’expériences constitue également une excellente plateforme pour les évaluations ou la recherche de molécules anticancéreuses. |
Identification de molécules anticancéreuses En raison de leur petite taille, les embryons et les larves de poisson zèbre constituent des systèmes idéaux pour les cribles de molécules pharmacologiques à grande échelle réalisables dans des plaques de culture à 96 puits. Dans le cadre de la recherche contre le cancer, plusieurs molécules d’intérêt ont ainsi pu être identifiées. L’expression par le poisson du gène crestin s’éteint lors de la différenciation terminale des cellules de la crête neurale à l’origine des mélanocytes. Chez les poissons transgéniques Tg(mitfa:BRAFV600E);tp5J-/-, qui développent des mélanomes, cette expression persiste au niveau de la tête, de l’épiderme dorsal et de la queue de l’embryon âgé de 72 heures. L’oncogène BRAF activé maintiendrait en effet l’état multipotent des progéniteurs de la crête neurale qui se disséminent lors de la tumorigénèse [
45]. Cette observation a conduit l’équipe de Leonard Zon à rechercher des molécules susceptibles de supprimer le développement des progéniteurs de la crête neurale, afin d’identifier des molécules qui seraient actives contre les mélanomes [45]. Partant d’un ensemble de 2 000 molécules, un composé, le leflunomide, capable d’inhiber le lignage Crestin+ au cours du développement embryonnaire du poisson zèbre a pu être identifié. Cette molécule qui bloque la croissance des cellules de mélanome humain en culture, et en modèle de xénogreffe chez la souris, est désormais en essai clinique de phase I/II, en combinaison avec le vermurafenib, un inhibiteur de BRAF. Le leflunomide est ainsi la première molécule en essai clinique pour la lutte contre le cancer initialement identifiée dans un crible chez le poisson zèbre. En se fondant sur la similitude des signatures moléculaires entre lymphoblastes T embryonnaires et blastes leucémiques, Ridges et al. [
46] ont cherché des molécules capables d’inhiber le développement des lymphoblastes, visibles chez les embryons de poissons transgéniques Tg(lck:GFP). Cette approche a permis d’identifier une molécule, le lenaldekar, qui bloque le développement des leucémies lymphoblastiques T aiguës in vitro et in vivo dans un modèle de xénogreffe chez la souris. Cette molécule inhibe la voie de signalisation PI3K-Akt-mTOR [46]. Un autre crible destiné à la recherche de molécules inhibant l’angiogenèse chez l’embryon de poisson zèbre transgénique Tg(flk1:GFP) a conduit à l’identification de la rosuvastatine capable de bloquer la croissance de cellules de cancer de la prostate dans un modèle de xénogreffe chez la souris [
47]. Ce dernier exemple montre ainsi que des molécules identifiées grâce au poisson zèbre peuvent en fait avoir une utilité dans le traitement de cancers touchant des organes dont il est pourtant dépourvu. |
Avantages et limites du modèle poisson zèbre en oncologie
| Avantages |
Limites |
| De nombreux embryons transparents se développent rapidement ex utero
|
La durée de vie du poisson zèbre est courte, limitant l’étude des cancers liés au vieillissement |
| Le poisson zèbre est un vertébré qui possède un système immunitaire proche de celui de l’homme |
Certains organes (poumon, sein, prostate) sont absent chez le poisson zèbre. D’autres (reins) en sont des versions simplifiées |
| De nombreux mutants sont disponibles |
L’incidence des cancers spontanés est faible |
| Des méthodes puissantes de génétique directe et de génétique inverse sont disponibles |
Le poisson zèbre possède deux orthologues pour certains gènes, à la suite d’une duplication du génome chez les téléostéens |
| De nombreuses lignées transgéniques sont disponibles |
Peu d’anticorps efficaces chez le poisson zèbre sont disponibles |
| Chez le poisson zèbre, les tumeurs sont similaires sur le plan histologique et moléculaire aux tumeurs humaines |
La taille des organes du poisson zèbre (vaisseaux sanguins) est plus petite que celle de l’homme |
| La transparence des embryons et les mutants sans pigmentation permettent le suivi de la croissance tumorale in vivo
|
Le poisson zèbre est poïkilotherme (animal à sang froid) et croît à 28 °C plutôt qu’à 37 °C; les études liées au rôle de l’homéostasie de la température dans les phénotypes oncogéniques sont donc limitées |
| La transplantation de cellules cancéreuses humaines dans l’embryon de poisson zèbre permet l’étude des propriétés de ces cellules |
Les embryons xénotransplantés sont maintenus à 35 °C. Cette température n’affecte pas le développement du poisson zèbre mais peut avoir des effets sur le résultat de l’étude |
| Le crible de molécules permet l’identification de composés anticancéreux |
Les composés pénètrent par le système digestif, la peau et les branchies |
|
|
Le modèle de xénogreffe de cellules tumorales humaines dans des embryons de poisson zèbre est un système qui permet la caractérisation ou l’identification de nouvelles molécules thérapeutiques actives contre les cancers [48-50]. Fior et al. [
51] ont ainsi récemment montré que la xénogreffe de cellules tumorales issues de patients pouvait être utilisée pour tester la réponse des cellules aux chimiothérapies. Cette approche place donc le modèle de xénogreffe dans l’embryon de poisson zèbre au sein des stratégies de lutte contre le cancer en médecine personnalisée. |
Alors que la culture cellulaire et les modèles murins restent les pièces maîtresses de la recherche contre le cancer, les caractéristiques du poisson zèbre en font un modèle particulièrement intéressant. Il présente cependant un certain nombre de limitations (voir Encadré). En particulier, le poisson zèbre possède deux orthologues pour certains gènes impliqués dans le cancer, comme NF1 ou PTEN, apparus à la suite d’une duplication du génome chez l’ancêtre commun des téléostéens, compliquant ainsi leur étude. D’autres gènes connus pour avoir un rôle dans le cancer comme BRCA1 ou CDKN2A sont absents chez le poisson zèbre [6]. Toutefois, de nombreuses données indiquent que les cancers des poissons zèbres sont similaires et révèlent différents aspects de la tumorigenèse humaine. Ce modèle est ainsi utilisé pour étudier les voies moléculaires impliquées dans le cancer, le rôle de l’environnement cellulaire dans la progression tumorale, et même pour identifier des molécules antitumorales. Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
2.
Harshbarger
JC
,
Slatick
MS.
Lesser known aquarium fish tumor models . Mar Biotechnol (NY).
2001;; 3 : :S115.-29. 3.
Driever
W
,
Solnica-Krezel
L
,
Schier
AF
, et al. . A genetic screen for mutations affecting embryogenesis in zebrafish . Development.
1996;; 123 : :37.-46. 4.
Haffter
P
,
Granato
M
,
Brand
M
, et al. . The identification of genes with unique and essential functions in the development of the zebrafish. , Danio rerio. Development.
1996;; 123 : :1.-36. 5.
Culp
P
, Nusslein-
Volhard
C
,
Hopkins
N.
High-frequency germ-line transmission of plasmid DNA sequences injected into fertilized zebrafish eggs . Proc Natl Acad Sci USA.
1991;; 88 : :7953.-7. 6.
Howe
K
,
Clark
MD
,
Torroja
CF
, et al. . The zebrafish reference genome sequence and its relationship to the human genome . Nature.
2013;; 496 : :498.-503. 7.
Stanton
MF.
Diethylnitrosamine-induced hepatic degeneration and neoplasia in the aquarium fish, Brachydanio rerio . J Natl Cancer Inst.
1965;; 34 : :117.-30. 8.
Amsterdam
A
,
Lai
K
,
Komisarczuk
AZ
, et al. . Zebrafish Hagoromo mutants up-regulate fgf8 postembryonically and develop neuroblastoma . Mol Cancer Res.
2009;; 7 : :841.-50. 9.
Spitsbergen
JM
,
Tsai
HW
,
Reddy
A
, et al. . Neoplasia in zebrafish (Danio rerio) treated with 7,12-dimethylbenz[a]anthracene by two exposure routes at different developmental stages . Toxicol Pathol.
2000;; 28 : :705.-15. 10.
Spitsbergen
JM
,
Tsai
HW
,
Reddy
A
, et al. . Neoplasia in zebrafish (Danio rerio) treated with N-methyl-N’-nitro-N-nitrosoguanidine by three exposure routes at different developmentalstages . Toxicol Pathol.
2000;; 28 : :716.-25. 11.
Moore
JL
,
Rush
LM
,
Breneman
C
, et al. . Zebrafish genomic instability mutants and cancer susceptibility . Genetics.
2006;; 174 : :585.-600. 12.
Lam
SH
,
Wu
YL
,
Vega
VB
, et al. . Conservation of gene expression signatures between zebrafish and human liver tumors and tumor progression . Nat Biotechnol.
2006;; 24 : :73.-5. 13.
Zhang
G
,
Hoersch
S
,
Amsterdam
A
, et al. . Highly aneuploid zebrafish malignant peripheral nerve sheath tumors have genetic alterations similar to human cancers . Proc Natl Acad Sci USA.
2010;; 107 : :16940.-5. 14.
Grunwald
DJ
,
Streisinger
G.
Induction of recessive lethal and specific locus mutations in the zebrafish with ethyl nitrosourea . Genet Res.
1992;; 59 : :103.-16. 15.
Choorapoikayil
S
,
Kuiper
RV
,
de Bruin
A
,
den Hertog
J.
Haploinsufficiency of the genes encoding the tumor suppressor Pten predisposes zebrafish to hemangiosarcoma . Dis Model Mech.
2012;; 5 : :241.-7. 16.
Haramis
AP
,
Hurlstone
A
,
van der Velden
Y
, et al. . Adenomatous polyposis coli-deficient zebrafish are susceptible to digestive tract neoplasia . EMBO Rep.
2006;; 7 : :444.-9. 17.
Feitsma
H
,
Kuiper
RV
,
Korving
J
, et al. . Zebrafish with mutations in mismatch repair genes develop neurofibromas and other tumors . Cancer Res.
2008;; 68 : :5059.-66. 18.
Shive
HR
,
West
RR
,
Embree
LJ
, et al. . brca2 in zebrafish ovarian development, spermatogenesis, and tumorigenesis . Proc Natl Acad Sci USA.
2010;; 107 : :19350.-5. 19.
Berghmans
S
,
Murphey
RD
,
Wienholds
E
, et al. . tp53 mutant zebrafish develop malignant peripheral nerve sheath tumors . Proc Natl Acad Sci USA.
2005;; 102 : :407.-12. 20.
Patton
EE
,
Widlund
HR
,
Kutok
JL
, et al. . BRAF mutations are sufficient to promote nevi formation and cooperate with p53 in the genesis of melanoma . Curr Biol.
2005;; 15 : :249.-54. 21.
Dovey
M
,
White
RM
,
Zon
LI.
Oncogenic NRAS cooperates with p53 loss to generate melanoma in zebrafish . Zebrafish.
2009;; 6 : :397.-404. 22.
Amsterdam
A
,
Sadler
KC
,
Lai
K
, et al. . Many ribosomal protein genes are cancer genes in zebrafish . PLoS Biol.
2004;; 2 : :E139.. 23.
Shin
J
,
Padmanabhan
A
,
de Groh
ED
, et al. . Zebrafish neurofibromatosis type 1 genes have redundant functions in tumorigenesis and embryonic development . Dis Model Mech.
2012;; 5 : :881.-94. 24.
Gjini
E
,
Mansour
MR
,
Sander
JD
, et al. . A zebrafish model of myelodysplastic syndrome produced through tet2 genomic editing . Mol Cell Biol.
2015;; 35 : :789.-804. 25.
Solin
SL
,
Shive
HR
,
Woolard
KD
, et al. . Rapid tumor induction in zebrafish by TALEN-mediated somatic inactivation of the retinoblastoma 1 tumor suppressor rb1 . Sci Rep.
2015;; 5 : :13745.. 26.
Basten
SG
,
Davis
EE
,
Gillis
AJ
, et al. . Mutations in LRRC50 predispose zebrafish and humans to seminomas . PLoS Genet.
2013;; 9 : :e1003384.. 27.
Langenau
DM
,
Traver
D
,
Ferrando
AA
, et al. . Myc-induced T cell leukemia in transgenic zebrafish . Science.
2003;; 299 : :887.-90. 28.
Sabaawy
HE
,
Azuma
M
,
Embree
LJ
, et al. . TEL-AML1 transgenic zebrafish model of precursor B cell acute lymphoblastic leukemia . Proc Natl Acad Sci USA.
2006;; 103 : :15166.-71. 29.
Li
Z
,
Zheng
W
,
Wang
Z
, et al. . A transgenic zebrafish liver tumor model with inducible Myc expression reveals conserved Myc signatures with mammalian liver tumors . Dis Model Mech.
2013;; 6 : :414.-23. 30.
Park
SW
,
Davison
JM
,
Rhee
J
, et al. . Oncogenic KRAS induces progenitor cell expansion and malignant transformation in zebrafish exocrine pancreas . Gastroenterology.
2008;; 134 : :2080.-90. 31.
Zhu
S
,
Lee
JS
,
Guo
F
, et al. . Activated ALK collaborates with MYCN in neuroblastoma pathogenesis . Cancer Cell.
2012;; 21: :362.-73. 32.
Chu
CY
,
Chen
CF
,
Rajendran
RS
, et al. . Overexpression of Akt1 enhances adipogenesis and leads to lipoma formation in zebrafish . PLoS One.
2012;; 7 : :e36474.. 33.
Lu
JW
,
Yang
WY
,
Tsai
SM
, et al. . Liver-specific expressions of HBx and src in the p53 mutant trigger hepatocarcinogenesis in zebrafish . PLoS One.
2013;; 8 : :e76951.. 34.
Leacock
SW
,
Basse
AN
,
Chandler
GL
, et al. . A zebrafish transgenic model of Ewing’s sarcoma reveals conserved mediators of EWS-FLI1 tumorigenesis . Dis Model Mech.
2012;; 5 : :95.-106. 35.
White
RM
,
Sessa
A
,
Burke
C
, et al. . Transparent adult zebrafish as a tool for in vivo transplantation analysis . Cell Stem Cell.
2008;; 2 : :183.-9. 36.
Moore
JC
,
Langenau
DM.
Allograft cancer cell transplantation in zebrafish . Adv Exp Med Biol.
2016;; 916 : :265.-87. 37.
Stoletov
K
,
Montel
V
,
Lester
RD
, et al. . High-resolution imaging of the dynamic tumor cell vascular interface in transparent zebrafish . Proc Natl Acad Sci USA.
2007;; 104 : :17406.-11. 38.
Lawson
ND
,
Weinstein
BM.
In vivo imaging of embryonic vascular development using transgenic zebrafish . Dev Biol.
2002;; 248 : :307.-18. 39.
Ignatius
MS
,
Chen
E
,
Elpek
NM
, et al. . In vivo imaging of tumor-propagating cells, regional tumor heterogeneity, and dynamic cell movements in embryonal rhabdomyosarcoma . Cancer Cell.
2012;; 21 : :680.-93. 40.
Langenau
DM
,
Keefe
MD
,
Storer
NY
, et al. . Effects of RAS on the genesis of embryonal rhabdomyosarcoma . Genes Dev.
2007;; 21 : :1382.-95. 41.
Haldi
M
,
Ton
C
,
Seng
WL
,
McGrath
P.
Human melanoma cells transplanted into zebrafish proliferate, migrate, produce melanin, form masses and stimulate angiogenesis in zebrafish . Angiogenesis.
2006;; 9 : :139.-51. 42.
Vlecken
DH
,
Bagowski
CP.
LIMK1 and LIMK2 are important for metastatic behavior and tumor cell-induced angiogenesis of pancreatic cancer cells . Zebrafish.
2009;; 6 : :433.-39. 43.
Eguiara
A
,
Holgado
O
,
Beloqui
I
, et al. . Xenografts in zebrafish embryos as a rapid functional assay for breast cancer stem-like cell identification . Cell Cycle.
2011;; 10 : :3751.-7. 44.
Marques
IJ
,
Weiss
FU
,
Vlecken
DH
, et al. . Metastatic behaviour of primary human tumours in a zebrafish xenotransplantation model . BMC Cancer.
2009;; 9 : :128.. 45.
White
RM
,
Cech
J
,
Ratanasirintrawoot
S
, et al. . DHODH modulates transcriptional elongation in the neural crest and melanoma . Nature.
2011;; 471 : :518.-22. 46.
Ridges
S
,
Heaton
WL
,
Joshi
D
, et al. . Zebrafish screen identifies novel compound with selective toxicity against leukemia . Blood.
2012;; 119 : :5621.-31. 47.
Wang
C
,
Tao
W
,
Wang
Y
, et al. . Rosuvastatin, identified from a zebrafish chemical genetic screen for antiangiogenic compounds, suppresses the growth of prostate cancer . Eur Urol.
2010;; 58 : :418.-26. 48.
Zhang
S
,
Cao
Z
,
Tian
H
, et al. . SKLB1002, a novel potent inhibitor of VEGF receptor 2 signaling, inhibits angiogenesis and tumor growth in vivo . Clin Cancer Res.
2011;; 17 : :4439.-50. 49.
Zhao
H
,
Tang
C
,
Cui
K
,
Ang
BT
,
Wong
ST.
A screening platform for glioma growth and invasion using bioluminescence imaging. Laboratory investigation . J Neurosurg.
2009;; 111 : :238.-46. 50.
Jung
DW
,
Oh
ES
,
Park
SH
, et al. . A novel zebrafish human tumor xenograft model validated for anticancer drug screening . Mol Biosyst.
2012;; 8 : :1930.-9. 51.
Fior
R
,
Póvoa
V
,
Mendes
RV
, et al. . Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts . Proc Natl Acad Sci USA.
2017;; 114 : :E8234.-43. 52.
Dupret
B
,
Angrand
PO.
L’ingénierie des génomes par les TALEN . Med Sci (Paris).
2014;; 30 : :186.-93. 53.
Gilgenkrantz
H.
La révolution des CRISPR est en marche . Med Sci (Paris).
2014;; 30 : :1066.-9. 54.
Ekker
M
,
Akimenko
MA.
Le poisson zèbre (Danio rerio), un modèle en biologie du développement . Med Sci (Paris).
1991;; 7 : :553.-60. 55.
Kissa
K
,
Murayama
E
,
Herbomel
P.
Le danio zébré révèle l’odyssée des précurseurs hématopoïétiques au cours du développement des embryons de vertébrés . Med Sci (Paris).
2007;; 23 : :698.-700. 56.
Ryckebüsch
L.
Le modèle poisson zèbre : un modèle d’étude des dystrophies musculaires congénitales . Med Sci (Paris).
2015;; 31 : :912.-9. |