| |
| Med Sci (Paris). 34(3): 267–274. doi: 10.1051/medsci/20183403016.Hémophilie : la thérapie génique, enfin… Chroniques Génomiques Bertrand Jordan1* 1UMR 7268 ADÉS, Aix-Marseille, Université/EFS/CNRS ; CoReBio PACA, case 901, Parc scientifique de Luminy, 13288MarseilleCedex 09, France MeSH keywords: Animaux, Dependovirus, Techniques de transfert de gènes, Thérapie génétique, Vecteurs génétiques, Hémophilie A, Histoire du 20ème siècle, Histoire du 21ème siècle, Humains, Résultat thérapeutique, génétique, histoire, tendances, méthodes, thérapie |

L’hémophilie est une des premières maladies héréditaires pour lesquelles le mécanisme pathologique ait été élucidé; les gènes impliqués, ceux du Facteur VIII de coagulation (FVIII) pour l’hémophilie A et du Facteur IX (FIX) pour l’hémophilie B, sont situés vers l’extrémité du bras long du chromosome X et ont été isolés dès le début des années 1980. Il s’agit là d’affections relativement fréquentes, 1 sur 5 000 garçons pour A et sur 20 000 pour B, et dont le pronostic en l’absence de traitement est sombre : le retard de coagulation du sang entraîne une détérioration des articulations au moindre saignement à ce niveau, et les patients deviennent rapidement infirmes [1]. Le traitement par injection de facteurs de coagulation purifiés, soit régulièrement à titre préventif, soit à la demande, permet de corriger cette déficience et aboutit à une qualité de vie et une longévité quasiment normales - pour autant que la préparation utilisée soit de bonne qualité, comme l’a montré a contrario l’affaire dite « du sang contaminé » due à l’emploi de facteurs contaminés par le VIH (virus de l’immunodéficience humaine) [1]. Ce type de problème a été réglé par l’emploi de FVIII et FIX recombinants; reste que le traitement est assez contraignant et très onéreux : son coût annuel est de l’ordre de 300 000 euros [2] (plus faible en France grâce à un procédé de fabrication original), ce qui le réserve aux patients bénéficiant d’un système de santé inclusif comme le nôtre ou, aux États-Unis, d’une très bonne assurance - sans parler des pays pauvres où le traitement est hors de portée de la plupart des malades. |
Un bon candidat, de multiples tentatives C’est donc tout naturellement que l’on a pensé à l’hémophilie dès que sont apparues les perspectives de thérapie génique vers la fin des années 1980. Cela d’autant plus que cette affection correspond a priori à un cas favorable : les facteurs de coagulation sont normalement produits dans plusieurs tissus accessibles dont le foie, ils sont ensuite libérés dans la circulation et leur concentration n’est pas critique. Il suffit qu’ils soient présents à 5 ou 10 % du niveau normal pour atténuer très fortement les symptômes de l’hémophilie, qui disparaissent complètement dès un niveau de 30 % de la normale [3]. On sait les doser de manière précise, ce qui permet d’évaluer objectivement le résultat d’une thérapie. Enfin leur gène est de taille raisonnable, surtout pour le FIX dont l’ADNc (ADN complémentaire) ne mesure que 1 400 nucléotides ce qui rend son transport par un vecteur relativement aisé. Pour le FVIII, la taille de l’ADNc (8 000 nucléotides) est moins favorable, ce qui explique que la plupart des premières tentatives aient porté sur le FIX bien que l’hémophilie B qui lui correspond soit nettement moins fréquente que l’hémophilie A. La première tentative de thérapie génique a eu lieu dès 1991, à Shanghai, avec des résultats peu probants (publiés en 1993 [4]) et accompagnés d’une polémique sur les conditions règlementaires dans lesquelles l’essai avait été effectué. De nombreux essais de phase I ont suivi, souvent précédés de travaux sur un modèle animal (généralement canin). Ils ont utilisé différents vecteurs dérivés de rétrovirus, d’adénovirus et de virus adénoassociés (AAV) en ciblant soit les cellules musculaires (avec injection dans le muscle), soit le foie avec des vecteurs incluant un promoteur spécifique de cet organe et une administration par la veine portale. Il n’est évidemment pas possible de décrire tous ces travaux dans le cadre d’une « Chronique Génomique »; on peut noter que dans l’ensemble les résultats ont été, jusqu’à tout récemment, encourageants mais limités et ne permettant pas encore d’envisager le passage à des essais de phase III et à un emploi de la technique en clinique [3]. Les problèmes rencontrés sont d’ailleurs communs à bien des tentatives de thérapie génique : réaction immunitaire du patient contre le vecteur viral employé, imposant une limite à la dose utilisable; expression à un niveau trop faible du gène introduit, n’aboutissant pas à une correction cliniquement significative du phénotype; et enfin extinction progressive de l’expression du transgène et retour à la situation de départ. S’y est rajouté, dans certains cas, un problème spécifique, l’apparition d’anticorps dirigés contre le facteur de coagulation, due au fait que ces molécules étant absentes chez les patients sont reconnues comme du non-soi et induisent une réponse immunitaire : ce phénomène, qui peut également se produire lors du traitement par injection de FVIII ou FIX, aboutit lui aussi à la perte de l’amélioration apportée par la thérapie génique [3]. Ce n’est que tout récemment (en décembre 2017) qu’ont été publiés les résultats d’essais cliniques (entamés en 2015) montrant de manière convaincante une correction de l’hémophilie A [5] ou B [6] par thérapie génique. Comme on le verra, ces succès, maintenant indéniables [7], ne reposent pas sur des approches radicalement nouvelles, mais sur une mise au point précise et sur l’emploi de quelques astuces permettant d’améliorer suffisamment le résultat pour le rendre indiscutable et cliniquement significatif. |
Un succès pour le Facteur IX (hémophilie B) Le premier article, paru début décembre 2017 [6], émane d’un ensemble de laboratoires Nord-Américains (États-Unis et Canada) et Australiens, associés à une entreprise, Spark Therapeutics (Philadelphie). Il présente les résultats intermédiaires pour un groupe de 10 patients hémophiles déficients en FIX traités par une construction à base de virus AAV contenant un ADNc correspondant au variant Padua du gène : il s’agit d’un variant naturel dont l’activité spécifique est environ 10 fois plus élevée que la normale1,. Cet ADNc est placé sous le contrôle d’un promoteur spécifique du foie et ses codons sont optimisés2, pour une meilleure expression. Parmi les critères de recrutement des patients, figure l’absence d’anticorps anti-AAV, afin de limiter le risque de réactions immunitaires contre le vecteur. La construction, appelée SPK-9001, est administrée par perfusion à la dose de 5 x 1011 génomes viraux par kg de poids. Les patients sont ensuite suivis durant une année avec la mesure de l’activité du FIX et de divers autres paramètres, notamment celle des aminotransférases hépatiques (signe d’une toxicité hépatique). La Figure 1 montre les niveaux plasmatiques de FIX mesurés chez chaque patient au fil des 52 semaines suivant le traitement, exprimés en pourcentage du niveau normal. On voit que l’on atteint rapidement un plateau qui se situe entre 20 et 45 % du niveau normal – suffisant a priori pour une correction phénotypique complète - et que ce plateau semble stable chez la majorité des malades. C’est donc un excellent résultat, qui est confirmé par le fait que le nombre d’épisodes de saignement, qui était supérieur à 10 en moyenne dans l’année précédant la thérapie, tombe à zéro pour tous les participants sauf un (4 épisodes) dans l’année suivant le traitement, tandis que l’utilisation de FIX injectable (librement disponible) tombe elle aussi à zéro sauf pour le même patient. Les auteurs font remarquer au passage que, pour ces dix malades, l’économie annuelle réalisée est de 3,6 millions de dollars [6] - on voit poindre l’amorce d’un débat sur le prix auquel cette thérapie sera commercialisée. Il n’a pas été observé de toxicité particulière à part une élévation des aminotransférases chez un patient; par ailleurs, des anticorps anti-capside d’AAV sont apparus chez deux patients.  | Figure 1.Niveaux plasmatiques de FIX chez chaque patient, exprimés en pourcentage du niveau normal, au cours des 52 semaines suivant la thérapie génique (certaines courbes s’arrêtent avant 52 semaines) (extrait remanié de la figure 1 de [ 6]). |
Au total, il s’agit indéniablement d’un résultat très positif, montrant une correction durable de l’hémophilie B chez tous les patients traités, sans effet secondaire notable. Ce succès est dû à une mise au point très sérieuse, à la chance que représente la découverte du variant Padua – qui fait gagner un facteur dix sur l’activité de la molécule ! - et à l’optimisation de tous les paramètres : les auteurs ont à l’évidence tiré parti du travail accumulé au fil des années pour mettre toutes les chances de leur côté. Reste que leur traitement ne peut s’appliquer qu’à des patients ne présentant pas d’immunité anti-AAV3 et que l’effectif de cet essai est faible, comme il convient pour une phase I : il va falloir confirmer ce succès, idéalement par une phase III si les résultats finaux de cet essai confirment ce qui est observé ici. Mais c’est indubitablement une belle réussite et Spark Therapeutics peut s’en féliciter. Notons que cette entreprise, de création récente (en 2013), a déjà réussi une belle performance : elle est la première à avoir obtenu, le 19 décembre 2017, l’aval de la Federal drug administration (FDA) pour la thérapie génique d’une affection héréditaire, en l’occurrence le traitement d’une forme de dystrophie de la rétine liée au gène RPE65 (codant la retinoid isomerohydrolase) grâce à un vecteur de type AAV [8]. Le prix de cette thérapie, baptisée Luxturna, vient d’être fixé à 850 000 dollars américains (425 000 dollars par œil)... |
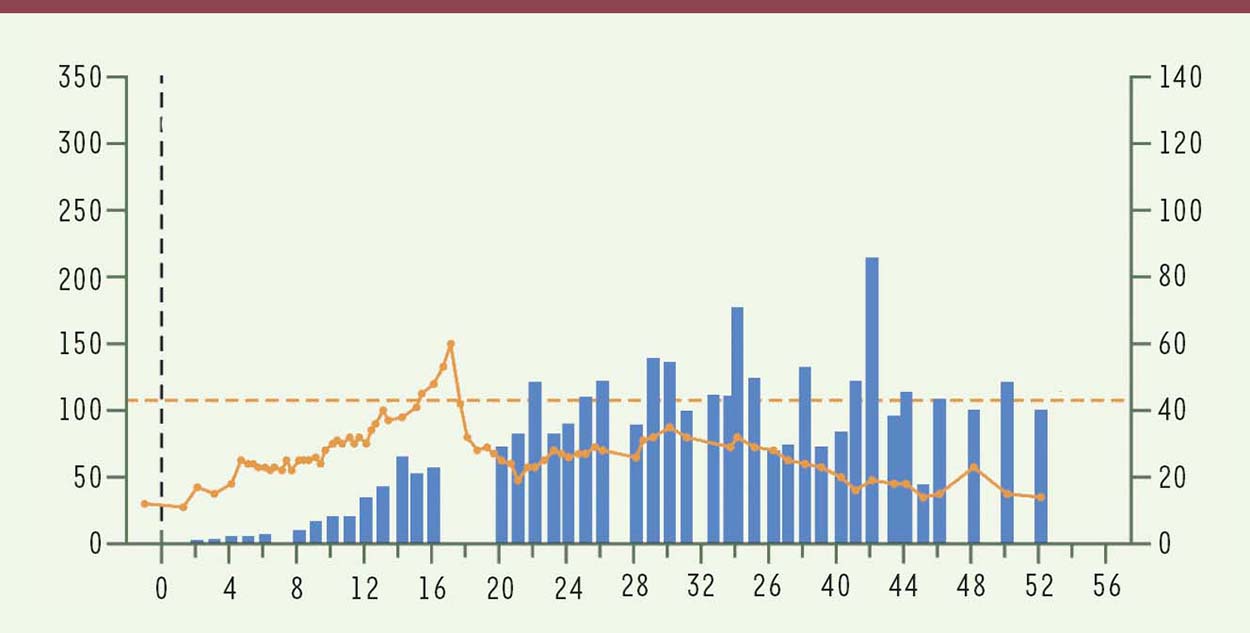
Et c’est le tour de l’hémophilie A (Facteur VIII) Quelques semaines plus tard (fin décembre 2017), des résultats tout aussi spectaculaires sont publiés dans la même revue pour la correction du déficit en facteur VIII [5]. L’article émane de plusieurs laboratoires britanniques associés à une entreprise californienne, BioMarin. Il s’agit là aussi des résultats intermédiaires d’un essai de phase I débuté en 2015 et qui a porté sur neuf patients. Le vecteur utilisé est un dérivé de type AAV5 (AAV sérotype 5) contenant un ADNc de FVIII raccourci par l’élimination des séquences correspondant au domaine B de la protéine4 (non nécessaire pour son activité), dont les codons ont été optimisés et qui est placé sous la direction d’un promoteur spécifique du foie. Les patients sont bien sûr déficients en FVIII et, par ailleurs, ils ne présentent pas de réactivité immunologique vis-à-vis de la capside du virus AAV5. Le virus recombinant est administré par une seule perfusion à trois doses différentes (6 x 1012, 2 x 1013 et 6 x 1013 génomes viraux par kg). Notons que ces doses sont très supérieures à celle (5 x 1011) utilisée dans le travail précédent (FIX) : c’est sans doute pour compenser une activité moins forte du FVIII transgénique, puisqu’on n’a pas ici la chance de disposer d’un variant à haute activité. En fait, les deux premières doses ont été échelonnées dans le temps et ne concernent chacune qu’un seul patient; en l’absence de problème constaté, les sept patients restants ont reçu la dose la plus forte. Ils ont, de fait, présenté une élévation notable du niveau d’aminotransférase (signant une atteinte hépatique) et ont été traités avec succès par l’administration de glucocorticoïdes. Les patients ont été suivis sur une année et le niveau plasmatique de FVIII a été régulièrement mesuré : tous les patients ayant reçu la dose élevée de virus recombinant ont présenté une activité de FVIII mesurable et, pour six d’entre eux, dans la gamme des valeurs physiologiques (de 50 à 150 unités par décilitre). La Figure 2 montre les résultats pour l’un de ces patients : on voit que le niveau de FVIII augmente régulièrement dans les semaines suivant l’injection puis se stabilise vers 100 unités par décilitre, un niveau excellent et susceptible d’apporter une correction complète du phénotype. La Figure 2 montre également le niveau d’alanine aminotransferase, qui dépasse la limite normale puis redescend vers la semaine 18 après traitement par glucocorticoïdes. Les deux patients traités à plus faible dose ne présentent pas d’activité FVIII, ce qui montre bien que la dose injectée est critique. C’est au total un excellent résultat, qui est confirmé par les données fonctionnelles : le nombre moyen d’épisodes de saignement, pour chacun de ces six patients, tombe de 16 par année avant traitement, à 2 après, et le nombre d’infusions de FVIII de 138 à 2. Autant dire qu’ils sont pratiquement guéris, pour autant que l’expression du facteur de coagulation se poursuive durablement au-delà de la première année. 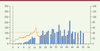 | Figure 2.Niveaux plasmatiques de FVIII (barres bleues, échelle de gauche en unités par décilitre) et d’alanine aminotransferase (ligne jaune, échelle de droite en unités par litre) chez le patient 3 au cours des 52 semaines suivant le traitement. La ligne pointillée indique la valeur limite normale pour l’aminotransferase (extrait partiel remanié de la figure 1 de [ 5]). |
D’autres paramètres méritent d’être mentionnés. Tous les patients présentent, après traitement, des anticorps anti-AAV5 : cela poserait problème s’il s’avérait nécessaire de répéter la thérapie… Par ailleurs, les auteurs ont réalisé une étude assez complète de la libération du vecteur AAV5 dans les différents tissus, et ont montré sa présence persistante au fil du temps : il n’a atteint la limite de détection par PCR quantitative qu’au bout de 52 semaines chez les deux patients traités aux faibles doses. Chez les sept autres, il est encore présent dans le sang et, de manière variable, dans quelques tissus au bout de 52 semaines - notamment dans le sperme chez trois d’entre eux. Cela soulève le risque de transmission involontaire (« thérapie génique germinale par inadvertance ») même si la purification de spermatozoïdes montre que ceux-ci ne contiennent pas de séquences virales. Ce souci est illustré par une phrase un peu sibylline : « les membres du foyer des participants n’ont pas été analysés »5. |
Un succès indéniable, et quelques inconnues Ces résultats sont très positifs et ont été salués par toute la presse – et par la Bourse… les actions de BioMarin ont monté de 10 dollars le jour de prépublication de l’article. La guérison de l’hémophilie est-elle en vue, comme l’annonce l’éditorial du New England Journal of Medicine du 28 décembre (A cure for hemophilia within reach) ? [7]. Il semble bien que oui, car pour la première fois une correction significative et durable des hémophilies A et B est obtenue sur la quasi-totalité des patients participant à un essai de thérapie génique. Reste qu’il s’agit là d’essais de phase I (ou I/II), avec un effectif très faible, et qu’ils doivent impérativement être suivis d’essais de phase III portant sur des dizaines de malades. De fait, un essai de phase III dont le sponsor est BioMarin a déjà débuté, il doit inclure 40 malades (essai NCT03370913). Il sera particulièrement important d’étudier l’évolution à long terme de ces patients afin de savoir si leur guérison est définitive : cela prendra beaucoup de temps, et ce n’est pas gagné puisque le vecteur AAV ne s’intègre pas dans l’ADN du malade mais reste sous forme d’un épisome qui pourrait, à la longue, être perdu ou inactivé. Compte tenu de la qualité des résultats déjà obtenus, on peut néanmoins prévoir que cette nouvelle thérapie génique va être assez rapidement approuvée et mise sur le marché, c’est en tous cas ce qu’attendent les industriels impliqués, … ainsi que de nombreux malades. Se posera alors la question du prix auquel le « SPK-9001 » (Spark Therapeutics) ou le « valoctocogene roxaparvovec » (BioMarin) vont être commercialisés. On peut prévoir que les entreprises prendront argument du coût élevé des traitements actuels (environ 300 000 euros par an, rappelons-le) pour annoncer des montants à sept chiffres, justifiés d’après eux par l’économie réalisée grâce à l’arrêt de l’emploi de facteurs FIX ou FVIII recombinants - sans parler de l’amélioration de la qualité de vie des patients. Ces arguments ont un certain poids, on peut pourtant remarquer que les succès actuels s’appuient sur des dizaines d’années de travaux largement réalisés dans le secteur public. Notons aussi qu’une fois la mise au point des vecteurs et des transgènes effectuée, la mise en œuvre d’un tel traitement (une injection intraveineuse et un suivi des aminotransférases) est bien moins complexe et onéreuse que celle des thérapies anticancéreuses fondées sur l’utilisation des CAR-T, dont le prix n’atteint pourtant pas le demi-million de dollars [9] ( ). ). ( )Voir la Chronique génomique de B. Jordan, m/s n° 11, novembre 2017, page 1003 )Voir la Chronique génomique de B. Jordan, m/s n° 11, novembre 2017, page 1003 Ces points vont faire l’objet de discussions et sans doute de polémiques, il n’en reste pas moins qu’une étape décisive est (enfin) franchie et que les approches de thérapie génique deviennent réellement opérationnelles. ♢ |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Franchini M, Mannucci PM. Past, present and future of hemophilia: a narrative review. Orphanet J Rare Dis. 2012;; 7 : :24.. 2. Fischer K, Steen Carlsson K, Petrini P, et al. Intermediate-dose versus high-dose prophylaxis for severe hemophilia: comparing outcome and costs since the 1970s. Blood. 2013;; 122 : :1129.-36. 3. Murphy SL, High KA. Gene therapy for haemophilia. Br J Haematol. 2008;; 140 : :479.-87. 4. Lu DR1, Zhou JM, Zheng B, et al. Stage I clinical trial of gene therapy for hemophilia B. Sci China B. 1993;; 36 : :1342.-51. 5. Rangarajan S, Walsh L, Lester W, et al. AAV5-factor VIII gene transfer in severe hemophilia A. N Engl J Med. 2017;; 377 : :2519.-30. 6. George LA, Sullivan SK, Giermasz A, et al. Hemophilia B gene therapy with a high-specific-activity factor IX variant. N Engl J Med. 2017;; 377 : :2215.-27. 7. Van den Berg. A cure for hemophilia within reach. N Engl J Med. 2017;; 377 : :2592.-3. 9. Jordan B. Immunothérapie « CAR-T » : une autorisation qui fait date. Med Sci (Paris). 2017;; 33 : :1003.-6. |



 ).
).