| |
| Med Sci (Paris). 34(3): 253–260. doi: 10.1051/medsci/20183403014.Les bactéries anaérobies, ces inconnues du microbiote pulmonaire Charles-Antoine Guilloux,1 Claudie Lamoureux,1,2 and Geneviève Héry-Arnaud1,2* 1UMR1078, Génétique, Génomique Fonctionnelle et Biotechnologies, Inserm, Université de Brest, EFS, IBSAM, 22, avenue Camille Desmoulins, 29238Brest, France 2Unité de Bactériologie, Pôle de Biologie-Pathologie, Hôpital La Cavale Blanche, CHRU de Brest, 29238Brest, France |
Vignette (Photo © Inserm/CEA - Stéphanie Bouillot). La médecine a longtemps considéré le poumon comme un organe stérile. Il est désormais évident qu’il est colonisé par des microorganismes, y compris chez les sujets sains. Parmi les bactéries présentes dans le microbiote pulmonaire, une part importante est anaérobie (strictes ou facultatives). Si l’intérêt et l’impact du microbiote, en général, et pulmonaire en particulier, vont grandissant, peu d’études s’intéressent à ces inconnues que représentent ces bactéries anaérobies résidentes des poumons. Cette synthèse bibliographique décrit la biodiversité des anaérobies en situation physiologique et dans différentes maladies respiratoires chroniques (mucoviscidose, BPCO, asthme), abordant tour à tour leurs rôles dans l’effet de flore barrière, dans l’inflammation, ou encore comme potentiel biomarqueur de certaines maladies pulmonaires. Pendant plus d’un siècle, la médecine humaine a considéré le poumon sain comme un organe stérile. Ce dogme de la stérilité du poumon est récemment tombé et force est de constater qu’il ne reposait que sur un rationnel très ténu, voire inexistant [1]. Il s’avère en vérité que conformément à ce qui est décrit pour toutes les muqueuses, les bactéries colonisent la muqueuse broncho-pulmonaire où elles constituent une communauté complexe qui participe au microbiote pulmonaire aux côtés des virus et des champignons [2-5]. Parmi les espèces bactériennes observées, une part importante (environ 50 %) [6, 7] regroupe des bactéries anaérobies. Parmi celles-ci, 73 % sont anaérobies strictes (dont 28 % sont capnophiles1) et 27 % sont anaérobies facultatives [8]. À ce jour, aucune bactérie EOS (extremely oxygen sensitive), des bactéries incapables de tolérer plus de 0,5 % de pression d’oxygène (comme Faecalibacterium), n’a été détectée parmi les bactéries anaérobies strictes du poumon. En bactériologie médicale, les prélèvements de poumon, organe dédié aux échanges de gaz vitaux comme l’oxygène, sont pourtant pour la plupart ensemencés en aérobiose [9], ce qui explique en partie la méconnaissance de ces bactéries anaérobies et de leur présence dans cet organe. Un autre écueil dans l’étude du microbiote pulmonaire est sa difficulté d’accès, qui complique les analyses : il est, en effet, difficile de distinguer les bactéries qui proviennent d’une contamination salivaire lors des prélèvements respiratoires, et celles qui sont réellement présentes dans les voies aériennes inférieures, d’autant qu’il existerait une continuité de la colonisation bactérienne entre les voies aériennes supérieures et inférieures [10]. L’application des techniques dites « culture-indépendantes » n’a révélé que récemment l’existence d’un microbiote pulmonaire en conditions physiologiques [11, 51, 52]( ) ) ( ) voir la Nouvelle de L. Nguyen et L. Delhaes, m/s n°11, novembre 2015, page 945, et la Synthèse de C. Andréjak et L. Delhaes, m/s n°11, novembre 2015, page 971 ) voir la Nouvelle de L. Nguyen et L. Delhaes, m/s n°11, novembre 2015, page 945, et la Synthèse de C. Andréjak et L. Delhaes, m/s n°11, novembre 2015, page 971 L’élément le plus frappant de cette observation est qu’une part importante des communautés bactériennes résidentes est, en fait, composée de bactéries anaérobies. L’objectif de cette synthèse est de décrire ces inconnues du poumon, aussi bien dans leur biodiversité que dans leurs potentialités en médecine respiratoire. |
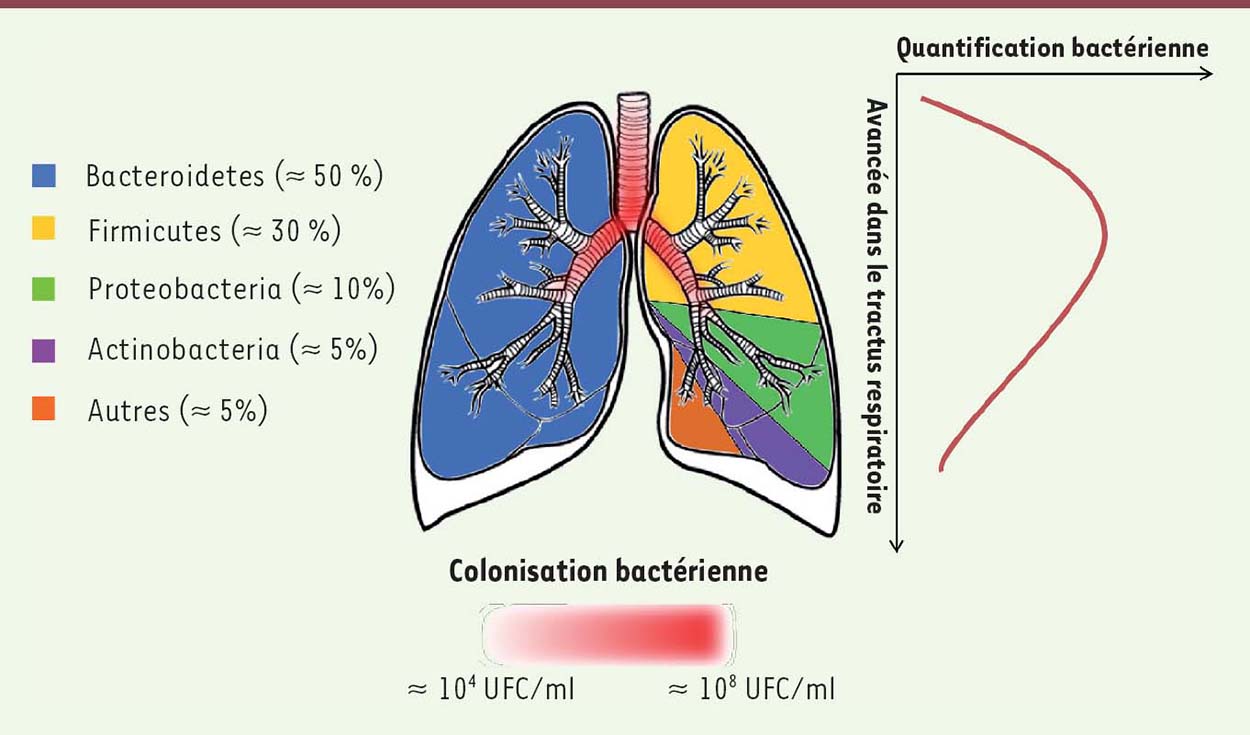
Le microbiote pulmonaire du sujet sain : importance des anaérobies À la naissance et dans les 5 minutes qui suivent, des communautés microbiennes peuvent être détectées dans la cavité orale et le nasopharynx des nouveau-nés [12]. Lors du premier jour de vie, les phylums dominants dans le poumon sont les Firmicutes et les Proteobacteria avec la présence d’Actinobacteria, de Bacteroidetes, de Tenericutes, de Fusobacterium, de Cyanobacteria et de Verrucomicrobia [13]. La colonisation des poumons commence donc très tôt dans la vie et possiblement avant même la naissance puisque le placenta arborerait lui-même un microbiote [14]. Chez l’adulte sain, la charge bactérienne totale du poumon est estimée à environ 105 unités formant colonies (UFC) par millilitre d’expectoration [15,16]. Les principaux phylums bactériens regroupant les bactéries anaérobies retrouvées dans le poumon adulte sont les Bacteroidetes (environ 50 % de la diversité bactérienne totale), les Firmicutes (environ 30 %) ainsi que les Proteobacteria (environ 10 %) et les Actinobacteria dans une moindre mesure (Figure 1). Les principaux genres sont Streptococcus, Prevotella, Fusobacterium, Veillonella et Porphyromonas [7]. 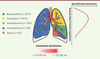 | Figure 1. Principaux phylums bactériens présents dans le poumon sain et densité bactérienne le long du tractus pulmonaire. UFC : unité formant colonies. |
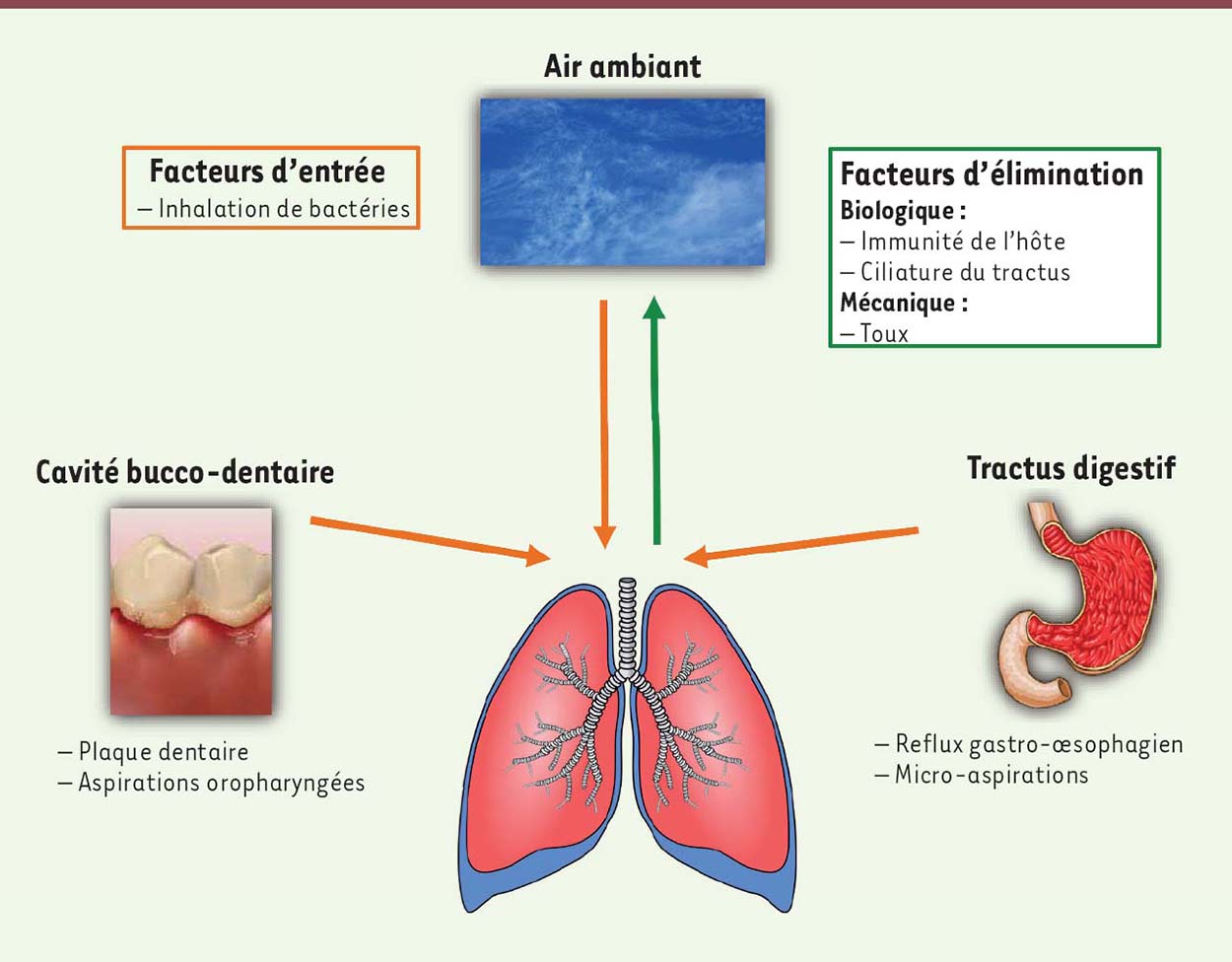
L’origine de ces communautés et leur dynamique semblent régulées par trois composantes (Figure 2). La première est l’entrée de nouvelles bactéries dans les voies aériennes. Les bactéries des voies respiratoires parviennent dans les poumons par inhalation de l’air ambiant qui contient à lui seul environ 100 000 bactéries par litre d’air [17]. L’impact de l’environnement extérieur sur la colonisation des poumons est donc important. Le réservoir bucco-dentaire constitue une autre source d’entrée où l’on retrouve les principaux phylums du poumon (Firmicutes, Actinobacteria, Bacteroidetes) [18]. L’estomac représente également un réservoir pour les bactéries colonisant la muqueuse broncho-pulmonaire. Par un processus d’aspiration non intentionnelle, appelée microaspiration, qui est majorée en cas de reflux gastro-œsophagien, l’aspiration de liquide gastrique peut être l’une des voies d’entrée des bactéries anaérobies dans les poumons [19]. Le liquide gastrique contient en effet une communauté bactérienne dont certaines espèces sont également retrouvées dans le poumon [20]. La seconde composante est l’élimination des bactéries, soit par un mécanisme mécanique soit par des processus cellulaires, dans les voies aériennes. Cette élimination peut être modulée par plusieurs facteurs comme la toux, les défenses immunitaires locales et les cellules ciliées qui participent à l’épuration pulmonaire en assurant la clairance mucociliaire. Une élimination des bactéries peut également s’opérer par compétition entre les différents microorganismes présents et aboutir à la sélection in situ d’une partie de la population bactérienne [2, 21]. La troisième composante regroupe les conditions abiotiques de l’écosystème broncho-pulmonaire comme le pH, la température ou la concentration en oxygène, qui peuvent influencer la croissance bactérienne in situ [2]. 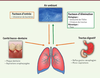 | Figure 2. Facteurs d’entrée/sortie des anaérobies dans les poumons. |
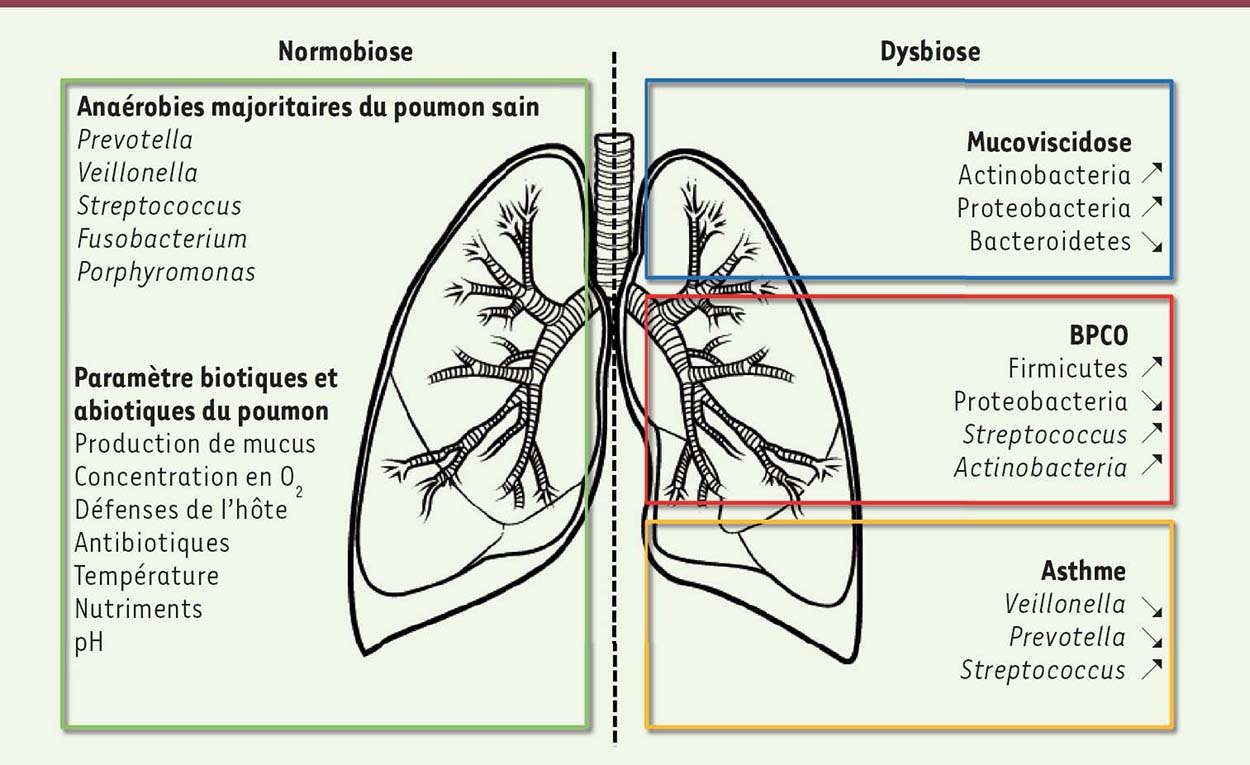
Une particularité du microbiote pulmonaire est sa topobiogéographie qui peut être la cause de biais dans les études, en fonction des modalités de recueil des sécrétions broncho-pulmonaires (invasif versus non invasif), et le site de prélèvement. Sur ce point, il n’existe que très peu de données et les rares études réalisées se contredisent. Pour certaines, la densité bactérienne diminuerait de manière continue le long du tractus pulmonaire, aboutissant à un microbiote broncho-pulmonaire dont l’origine serait les voies aériennes [10]. Pour d’autres, on observerait un pic de concentration bactérienne au niveau de la carène, la bifurcation trachéale [19]. Cette augmentation de la concentration bactérienne serait due aux microaspirations issues du tube digestif qui viendraient enrichir cette partie du tractus respiratoire. L’écosystème pulmonaire reste stable [22] mais il peut être soumis à des perturbations à la suite de certains traitements (antibiotiques par exemple), voire dans certains cas, subir un déséquilibre profond (dysbiose) en cas de pathologies sous-jacentes (Figure 3). Cet état dysbiotique est démontré dans un certain nombre de maladies comme la mucoviscidose, la broncho-pneumopathie chronique obstructive (BPCO) ou l’asthme [7]. Cependant, il est difficile de déterminer si cette dysbiose est une cause ou une conséquence de la maladie. En revanche, toutes ces pathologies pulmonaires chroniques partagent un point commun : une diminution de l’abondance relative des bactéries anaérobies [23-25]. 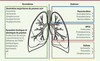 | Figure 3. Communautés microbiennes anaérobies du poumon sain et modifications observées dans la mucoviscidose, la BPCO et l’asthme. BPCO : bronchopneumopathie chronique obstructive; ↗ : abondance plus élevée dans la maladie; ↘ : abondance moins élevée dans la maladie. |
|
Les bactéries anaérobies dans un poumon mucoviscidosique La mucoviscidose est une maladie génétique récessive liée à une mutation du gène CFTR (cystic fibrosis transmembrane conductance regulator) situé sur le chromosome 7. Cette mutation a pour conséquence le dysfonctionnement ou l’absence d’un canal ionique qui engendre des anomalies importantes des propriétés physico-chimiques et rhéologiques du mucus. Les voies respiratoires sont particulièrement touchées. L’hyperviscosité du mucus associée à une inefficacité de la réponse immunitaire innée sont autant de facteurs favorables pour le développement bactérien. Dans certaines zones du poumon, un gradient d’oxygène apparaît dans lequel sa concentration diminue, avec en parallèle une augmentation de l’épaisseur de la couche de mucus, jusqu’à atteindre une anaérobiose [ 26]. Plusieurs études s’appuyant sur la métagénomique, ainsi que sur des cultures pratiquées en anaérobiose, ont confirmé la présence, dans des lavages broncho-alvéolaires de patients atteints de mucoviscidose, de bactéries anaérobies [6, 19, 27-29], parmi lesquelles certaines sont anaérobies strictes et d’autres anaérobies facultatives (Tableau I). Les genres bactériens les plus courants sont Prevotella, Veillonella, Porphyromonas et Actinomyces [28]. Contrairement à ce que l’on observe chez le sujet sain, les bactéries anaérobies représentent une proportion significativement moins importante du microbiote respiratoire que les bactéries aérobies, mais elles sont loin d’être inexistantes [6, 27]. La densité de bactéries anaérobies est estimée entre 104 et 9 x 107 UFC/ ml d’expectoration [27, 28, 30]. Une étude réalisée par Rogers et al., comparant le microbiote présent dans des lavages buccaux à celui des expectorations, montre que ces bactéries anaérobies n’ont pas seulement pour origine l’aspiration du microbiote oral [29]. Cette observation renforce donc l’hypothèse d’une origine par microaspirations [19], phénomène accentué par le reflux gastro- œsophagien fréquent chez les patients atteints de mucoviscidose. Cette hypothèse est également étayée par les travaux d’Almomani et al. [20] qui ont comparé le microbiote pulmonaire et le microbiote gastrique de patients atteints de mucoviscidose et de sujets sains, et ont mis en évidence la présence de bactéries anaérobies communes, telles que les streptocoques, ainsi que la présence de souches de Pseudomonas aeruginosa, dans les deux organes réservoirs. Certaines observations tendent également à montrer que le microbiote intestinal pourrait être prédictif des colonisations bactériennes pulmonaires [19, 20, 31]. |
Rôle potentiel des bactéries anaérobies dans la mucoviscidose Le rôle des bactéries anaérobies dans la mucoviscidose a été révélé par plusieurs études dans lesquelles une réduction de la diversité bactérienne touchant notamment les anaérobies a été décrite [37]. Cette diminution des anaérobies peut être liée à l’action conjointe de différents facteurs : l’antibiothérapie - le méropénème ou les associations amoxicilline-acide clavulanique, pipéracilline/tazobactam (antibiotiques utilisés dans la mucoviscidose) présentent une activité anti-anaérobie (notamment sur Prevotella); l’âge du patient; et l’état de la fonction pulmonaire [23]. Il a également été mis en évidence que la diminution des fonctions pulmonaires et l’augmentation de l’inflammation étaient associées à une réduction de la quantité des bactéries anaérobies chez les patients [6]. Certaines populations de bactéries anaérobies pourraient jouer un rôle dans l’inflammation des voies aériennes basses. Ces bactéries, comme Prevotella melaninogenica, Actinomyces odontolyticus, Veillonella parvula, Fusobacterium nucleatum ou encore Streptococcus sanguinis sont capables de sécréter in vitro, mais également in vivo, des acides gras à chaînes courtes, détectés lors de la réalisation de lavages broncho-alvéolaires, et qui sont corrélés à la sécrétion d’IL(interleukine)-8 (marqueur de l’inflammation), une chimiokine spécifique des polynucléaires neutrophiles à l’origine de leur recrutement dans la lumière bronchique. La réponse IL-8 dépend directement de la proportion d’acides gras. Elle contribue à une exacerbation de l’inflammation en activant les polynucléaires neutrophiles [38]. Ces données obtenues pour le poumon apparaissent en contradiction avec celles concernant l’intestin dans lequel les acides gras à chaînes courtes synthétisés par les bactéries, telles que Faecalibacterium prausnitzii, seraient bénéfiques, voire protecteurs, dans le contexte des maladies inflammatoires de l’intestin (MICI) comme la maladie de Crohn [39]. Tableau I.
| Type respiratoire |
Phylum |
Genre |
Forme |
Gram |
Contexte d’isolement (en dehors du tractus broncho-pulmonaire) |
Spécificités bactériologiques |
Références bibliographiques |
| Anaérobies stricts |
Actinobacteria |
Actinomyces |
Bacille droit ou incurvé |
+/- |
Abcès cérébral humain, maladies parodontales, pleurésies, cavité buccale, intestin |
|
[7, 23, 27, 28, 30, 32-35] |
|
Bacteroidetes |
Prevotella |
Bacille |
- |
Cavité buccale, tractus intestinal |
Peut produire des acides gras à chaines courtes en petites quantités, de la porphyrine par les espèces pigmentées/genre discriminant la BPCO du sujet sain |
[7, 23, 27, 28, 30, 32, 35, 36] |
|
|
Porphyromonas |
Bacille/coccobacille |
- |
Isolé d’infections buccales |
Produit de l’acide n-butyrique et de l’acide acétique/genre discriminant la BPCO du sujet sain |
[7, 23, 30, 32, 33, 36] |
|
|
Tannerella |
Bacille fusiforme |
- |
Cavité buccale humaine |
Produit de l’acide acétique, butyrique, propionique, isovalérique et phénylacétique |
[30, 32, 35] |
|
|
Flavobacterium |
Bacille droit ou incurvé |
- |
Sol, eau douce, eau marine, environnement salin chaud, froid ou tempéré |
Genre discriminant la BPCO et le sujet sain |
[32, 36] |
|
Firmicutes |
Veillonella |
Coque |
- |
Cavité buccale, génito-urinaire, tractus intestinal |
Produit du gaz et des acides acétique et propionique |
[7, 23, 27, 28, 30, 32, 33, 35] |
|
|
Parvimonas |
Coque |
+ |
Cavité buccale, abcès humains |
Produit de l’acide acétique |
[32, 35] |
|
|
Catonella |
Bacille |
- |
Crevasse gingivale humaine, poche parodontale |
Produit des acides acétique, formique et propionique |
[32, 35] |
|
|
Dialister |
Coccobacille |
- |
Cavité buccale |
Produit des acides acétique, formique et propionique /genre discriminant la BPCO du sujet sain |
[35] |
|
|
Anaerococcus |
Coque |
+ |
Vagin, sécrétions purulentes |
Produit des acides butyrique et lactique |
[32] |
|
|
Peptococcus |
Coque |
+ |
Intestin humain, vagin, ombilic humain |
Métabolise le peptone et les acides aminés en acide acétique, acide butyrique et acide isocaproïque |
[25] |
|
|
Pontibacillus |
Bacille |
+ |
Lac salin |
Augmentation chez les patients avec une BPCO sévère |
[35] |
|
|
Oribacterium |
Bacille/coccobacille |
+ |
Bouche, tractus respiratoire haut |
|
[23, 32, 33, 35] |
|
|
Filifactor |
Bacille |
- |
Cavité buccale |
Produit des acides acétique et butyrique |
|
|
|
Butyvibrio |
Bacille incurvé |
- |
Rumen des ruminants, fèces des humains, lapins et chevaux |
Produit de l’acide butyrique |
[35] |
|
|
Clostridium |
Bacille |
+ |
Sol, tractus digestif humain |
Augmentation chez les patients avec BPCO sévère |
[35] |
|
Fusobacteria |
Fusobacterium |
Bacille |
- |
Cavité gingivale, intestin, tractus génital, ulcérations |
Produit de l’acide butyrique |
[7, 23, 27, 28, 30, 32, 35] |
| Anaérobies facultatifs |
Actinobacteria |
Atopobium |
Bacille court |
+ |
Tractus vaginal et intestinal, homme et animaux |
|
[30, 35] |
|
Firmicutes |
Gemella |
Coque |
+ |
Abcès, sang humain |
|
[23, 32] |
|
|
Streptococcus |
Coque |
+ |
Membranes muqueuses de la bouche, tractus respiratoire haut |
Produit de l’acide lactique /genre discriminant la BPCO du sujet sain |
[7, 23, 27, 28, 30, 32, 33, 35, 36] |
|
|
Granulicatella |
Coque |
+ |
Flore normale du pharynx, de l’appareil urogénital et du tractus intestinal humain |
|
[32, 33] |
|
Proteobacteria |
Aeromonas |
Bacille/coccobacille |
- |
Eau, impliquée dans des maladies d’animaux à sang froid et chaud dont l’homme |
Augmentation chez les patients avec BPCO sévère |
[35] |
Principaux genres bactériens anaérobies retrouvés dans les études ciblant la mucoviscidose, la BPCO et l’asthme. BPCO : broncho-pneumopathie chronique obstructive; CF : cystic fibrosis (mucoviscidose). |
En interagissant avec d’autres bactéries, les bactéries anaérobies ont une influence sur l’atteinte pulmonaire au cours de la mucoviscidose. Certaines espèces sont en effet capables de favoriser l’action d’autres microorganismes dont l’incidence est péjorative sur la maladie. Chez la souris, une co-infection à P. aeruginosa et V. parvula, se traduit par une augmentation de la charge en P. aeruginosa et une détérioration de l’état clinique de l’animal, comparé à une infection par P. aeruginosa seul [40]. Il en est de même pour les souches de P. aeruginosa productrices de pyocyanine. Dans le cas d’association mixte, sous la forme de biofilm, de P. aeruginosa avec certaines espèces de Streptococcus (comme S. oralis), la bactérie exprime plus de facteurs de virulence que lorsqu’elle est seule [41]. Ces observations dépendent cependant des espèces de streptocoques étudiées [33]. |
La broncho-pneumopathie chronique obstructive La broncho-pneumopathie chronique obstructive (BPCO) est un désordre inflammatoire caractérisé par une obstruction irréversible des voies respiratoires. Cette obstruction est causée par l’association de deux facteurs : une diminution du calibre des bronchioles et une destruction des alvéoles pulmonaires. Le tabac, qui est la principale cause de cette maladie dans les pays développés, entraîne un troisième facteur : une hyperinflammation pulmonaire provoquée par la fumée du tabac [ 42]. Il semblerait qu’une modification du microbiote pulmonaire soit corrélée à la maladie et à son évolution [ 34, 42]. Les caractéristiques de cette dysbiose ne sont cependant pas identiques selon les études. Une diminution de la diversité microbienne a en effet été observée dans une étude portant sur des patients atteints d’une BPCO sévère [ 36], avec une signature microbienne caractéristique comprenant 10 OTU ( operational taxonomic unit)1 les distinguant du groupe contrôle [ 36]. Parmi ces OTU, 7 sont des bactéries anaérobies telles que les genres Prevotella, Flavobacterium ou Porphyromonas. Cependant, une autre étude a mis en évidence une augmentation de la diversité microbienne au cours du développement de la BPCO, dont les phylums principaux étaient les Actinobacteria, les Firmicutes et les Proteobacteria [ 35]. Il est en fait particulièrement difficile d’établir des corrélations entre microbiote pulmonaire et BPCO en raison de la complexité et la diversité des tableaux cliniques de cette maladie multifactorielle. L’étude de Pragman et al. [ 35], qui compare des patients atteints de BPCO modérée et sévère, révèle une sur-représentation des espèces bactériennes anaérobies, notamment le genre Clostridium, chez les patients avec une BPCO sévère en comparaison des patients avec une BPCO modérée. Ainsi l’abondance des bactéries anaérobies semble dépendre du stade et de la sévérité de la maladie. Dans une autre étude [ 42], qui compare les communautés microbiennes présentes dans les poumons de patients fumeurs atteints de BPCO à celles de poumons de sujets sains fumeurs et non-fumeurs, Einarsson et al. ont observé que les bactéries du phylum Bacteroidetes, qui comprend de nombreux genres anaérobies comme Prevotella, étaient significativement moins abondantes chez les patients atteints de BPCO, comparativement aux sujets sains non-fumeurs. Les proportions de certaines bactéries anaérobies qui sont retrouvées dans les différents groupes, comme les genres Prevotella, Veillonella et Actinomyces, sont réduites chez les patients atteints de BPCO, suggérant que ces bactéries pourraient jouer un rôle bénéfique. |
GLOSSAIRE Anaérobies strictes : bactéries pour qui l’air est toxique, mais à un moindre degré que les EOS (extremely oxygen sensitive). Anaérobies préférentiels : bactéries qui peuvent se développer en présence d’oxygène, mais moins rapidement qu’en anaérobiose (comme les Streptocoques). Anaérobies capnophiles : bactéries anaérobies qui ne peuvent vivre que dans un environnement où la teneur en gaz carbonique est supérieure à celle de l’atmosphère, ou dont le développement est facilité dans ce type de milieu. Topobiogéographie pulmonaire : distribution de la biodiversité au sein du tractus respiratoire pulmonaire. Carène : site anatomique correspondant à la division de la trachée pour donner les deux bronches souches gauche et droite. OTU :
operational taxonomic unit. Une OTU est un regroupement d’individus d’une même espèce dont les séquences codant l’ARNr 16S présentent une similitude de plus de 97 % (seuil habituellement utilisé). Médecine des 4 P : médecine prédictive, préventive, personnalisée et participative. Médecine proposant de traiter chaque patient de façon individualisée en fonction de ses spécificités génétiques et environnementales.
|
L’asthme L’asthme est une maladie respiratoire chronique. Le lien entre cette pathologie et la diversité bactérienne du microenvironnement broncho-pulmonaire est aujourd’hui clairement établi et le rôle de certaines bactéries anaérobies dans la pathologie a été montré [43]. Ainsi, le microbiote des enfants asthmatiques est différent de celui des enfants sains [16, 44, 45]. Une plus grande proportion de Bacteroidetes et Firmicutes est en effet retrouvée chez les enfants sains. En revanche, chez les asthmatiques, une plus grande proportion des genres Haemophilus et Neisseria (Proteobacteria), ainsi que Staphylococcus, est observée. Le microbiote pulmonaire des patients asthmatiques est donc caractérisé par une augmentation des Proteobacteria [16] et celui des sujets sains, par une présence importante des bactéries du genre Prevotella [16, 44]. Les patients asthmatiques semblent avoir une diversité bactérienne plus importante que les patients non asthmatiques [45], et dans l’asthme sévère, une altération du microbiote distincte de celle de l’asthme modéré, est retrouvée, avec une présence plus importante de Firmicutes, particulièrement des streptocoques, associée à une diminution des Bacteroidetes, notamment de Prevotella [24]. |
Les autres pathologies pulmonaires Les bactéries anaérobies sont également associées à d’autres pathologies pulmonaires infectieuses ou non infectieuses. Chez les patients atteints de tuberculose pulmonaire, l’abondance de Mycobacterium et de Porphyromonas serait augmentée significativement en présence de lésions pulmonaires (granulome-like) [46]. De même, l’implication de bactéries anaérobies à été démontrée dans le cas de la fibrose pulmonaire idiopathique. Dans cette pathologie, les genres bactériens les plus abondamment retrouvés sont Prevotella, Veillonella et Chronobacter. Veillonella, Neisseria, Streptococcus et Haemophilus semblent être significativement corrélés à la maladie, avec une présence plus importante de ces genres bactériens chez les malades [47]. |
Les bactéries anaérobies sont-elles des bactéries incontournables dans la physiopathologie pulmonaire ? Contrairement à ce qui était admis, nos poumons ne sont pas stériles et cet écosystème peut être perturbé lors de certaines pathologies respiratoires. L’étude de la dysbiose pulmonaire a révélé l’implication des bactéries anaérobies dans le cas de plusieurs maladies : la mucoviscidose, la BPCO ou l’asthme. Ces bactéries restent cependant les méconnues du poumon malgré leurs rôles potentiels : elles pourraient avoir un rôle dans l’inflammation et interagir avec d’autres bactéries en accroissant le potentiel (bénéfique ou néfaste) de certaines espèces; elles pourraient avoir ainsi un rôle prédictif dans l’apparition ou dans l’évolution de certaines pathologies et ainsi servir de « biomarqueurs » [16, 24, 33, 36, 40, 44, 48, 49]. À l’heure de la médecine des 4 P (prédictive, préventive, personnalisée, participative), qui nécessite de nouveaux outils pronostiques et de précision pour la prise en charge de ces maladies émergentes2[50] de diagnostic difficile, les bactéries anaérobies méritent toute notre attention dans le futur.♢ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Veillon A. Sur un microcoque anaérobe trouvé dans des suppurations fétides . CRSoc Biol. 1893;; 5 : :807.-9. 2. Dickson RP, Huffnagle GB. The lung microbiome: new principles for respiratory bacteriology in health and disease . PLoS Pathog. 2015;; 11 : :e1004923.. 3. Wylie KM. The virome of the human respiratory tract . Clin Chest Med. 2017;; 38 : :11.-9. 4. Mitchell AB, Oliver BGG, Glanville AR. Translational aspects of the human respiratory virome . Am J Respir Crit Care Med. 2016;; 194 : :1458.-64. 5. Nguyen LDN, Viscogliosi E, Delhaes L. The lung mycobiome: an emerging field of the human respiratory microbiome . Front Microbiol. 2015;; 6 : :89.. 6. O'Neill K, Bradley JM, Johnston E, et al. . Reduced bacterial colony count of anaerobic bacteria is associated with a worsening in lung clearance index and inflammation in cystic fibrosis . PloS One. 2015;; 10 ::e0126980.. 7. Marsland BJ, Gollwitzer ES. Host-microorganism interactions in lung diseases . Nat Rev Immunol. 2014;; 14 : :827.-35. 8. Sibley CD, Grinwis ME, Field TR, et al. . Culture enriched molecular profiling of the cystic fibrosis airway microbiome . PLoS One. 2011;; 6 : :e22702.. 9. Société Française de Microbiologie . Référentiel en microbiologie médicale. Paris: : SFM; , 2015 : :390. p. 10. Charlson ES, Bittinger K, Haas AR, et al. . Topographical continuity of bacterial populations in the healthy human respiratory tract . Am J Respir Crit Care Med. 2011;; 184 : :957.-63. 11. Charlson ES, Chen J, Custers-Allen R, et al. . Disordered microbial communities in the upper respiratory tract of cigarette smokers . PloS One. 2010;; 5 : :e15216.. 12. Dominguez-Bello MG, Costello EK, Contreras M, et al. . Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns . Proc Natl Acad Sci USA. 2010;; 107 : :11971.-75. 13. Lal CV, Travers C, Aghai ZH, et al. . The airway microbiome at birth . Sci Rep. 2016;; 6 : :31023.. 14. Aagaard K, Ma J, Antony KM, et al. . The placenta harbors a unique microbiome . Sci Transl Med. 2014;; 6 : 237ra65. 15. Pezzulo AA, Kelly PH, Nassar BS, et al. . Abundant DNase I-sensitive bacterial DNA in healthy porcine lungs and its implications for the lung microbiome . Appl Environ Microbiol. 2013;; 79 : :5936.-41. 16. Hilty M, Burke C, Pedro H, et al. . Disordered microbial communities in asthmatic airways . PloS One. 2010;; 5 : :e8578.. 17. Bowers RM, Sullivan AP, Costello EK, et al. . Sources of bacteria in outdoor air across cities in the midwestern United States . Appl Environ Microbiol. 2011;; 77 : :6350.-56. 18. Lemon KP, Klepac-Ceraj V, Schiffer HK, et al. . Comparative analyses of the bacterial microbiota of the human nostril and oropharynx . mBio. 2010;; 1 : :e00129-10.. 19. Dickson RP, Erb-Downward JR, Freeman CM, et al. . Bacterial topography of the healthy human lower respiratory tract . mBio. 2017;; 8 : :e02287-16.. 20. Al-momani H, Perry A, Stewart CJ, et al. . Microbiological profiles of sputum and gastric juice aspirates in Cystic Fibrosis patients . Sci Rep. 2016;; 6 : :26985.. 21. Young VB. The role of the microbiome in human health and disease: an introduction for clinicians . BMJ. 2017;; 356 : :j831.. 22. Kostric M, Milger K, Krauss-Etschmann S, et al. . Development of a stable lung microbiome in healthy neonatal mice . Microb Ecol. 2018;; 75 : :529.-42. 23. Coburn B, Wang PW, Diaz Caballero J, et al. . Lung microbiota across age and disease stage in cystic fibrosis . Sci Rep. 2015;; 5 : :10241.. 24. Zhang Q, Cox M, Liang Z, et al. . Airway microbiota in severe asthma and relationship to asthma severity and phenotypes . PloS One. 2016;; 11 : :e0152724.. 25. Sze MA, Hogg JC, Sin DD. Bacterial microbiome of lungs in COPD. Int J Chron Obstruct Pulmon Dis. 2014;; 9 : :229.-38. 26. Worlitzsch D, Tarran R, Ulrich M, et al. . Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients . J Clin Invest. 2002;; 109 : :317.-25. 27. Worlitzsch D, Rintelen C, Bohm K, et al. . Antibiotic-resistant obligate anaerobes during exacerbations of cystic fibrosis patients . Clin Microbiol Infect. 2009;; 15 : :454.-60. 28. Tunney MM, Field TR, Moriarty TF, et al. . Detection of anaerobic bacteria in high numbers in sputum from patients with cystic fibrosis . Am J Respir Crit Care Med. 2008;; 177 : :995.-1001. 29. Rogers GB, Carroll MP, Serisier DJ, et al. . Use of 16S rRNA gene profiling by terminal restriction fragment length polymorphism analysis to compare bacterial communities in sputum and mouthwash samples from patients with cystic fibrosis . J Clin Microbiol. 2006;; 44 : :2601.-4. 30. Lambiase A, Catania MR, Rossano F. Anaerobic bacteria infection in cystic fibrosis airway disease . New Microbiol. 2010;; 33 : :185.-94. 31. Madan JC. Neonatal gastrointestinal and respiratory microbiome in cystic fibrosis: potential interactions and implications for systemic health . Clin Ther. 2016;; 38 : :740.-6. 32. Erb-Downward JR, Thompson DL, Han MK, et al. . Analysis of the lung microbiome in the "healthy" smoker and in COPD . PloS One. 2011;; 6 : :e16384.. 33. Bernarde C, Keravec M, Mounier J, et al. . Impact of the CFTR-potentiator ivacaftor on airway microbiota in cystic fibrosis patients carrying a G551D mutation. PloS One. 2015; 10 : e0124124. 34. Sze MA, Dimitriu PA, Hayashi S, et al. . The lung tissue microbiome in chronic obstructive pulmonary disease . Am J Respir Crit Care Med. 2012;; 185 : :107380.. 35. Pragman AA, Kim HB, Reilly CS, et al. The lung microbiome in moderate and severe chronic obstructive pulmonary disease . PloS One. 2012;; 7 : :e47305.. 36. Sze MA, Dimitriu PA, Suzuki M, et al. Host response to the lung microbiome in chronic obstructive pulmonary disease . Am J Respir Crit Care Med. 2015;; 192 : :438.-45. 37. Stokell JR, Gharaibeh RZ, Hamp TJ, et al. Analysis of changes in diversity and abundance of the microbial community in a cystic fibrosis patient over a multiyear period . J Clin Microbiol. 2015;; 53 : :237.-47. 38. Mirkovic B, Murray MA, Lavelle GM, et al. The role of short-chain fatty acids, produced by anaerobic bacteria, in the cystic fibrosis airway . Am J Respir Crit Care Med. 2015;; 192 : :1314.-24. 39. Sun M, Wu W, Liu Z, et al. Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases . J Gastroenterol. 2017;; 52 : :1.-8. 40. Pustelny C, Komor U, Pawar V, et al. Contribution of Veillonella parvula to Pseudomonas aeruginosa-mediated pathogenicity in a murine tumor model system . infect immun. 2015;; 83 : :417.-29. 41. Whiley RA, Fleming EV, Makhija R, et al. . Environment and colonisation sequence are key parameters driving cooperation and competition between Pseudomonas aeruginosa cystic fibrosis strains and oral commensal streptococci . PloS One. 2015;; 10 : e0115513. 42. Einarsson GG, Comer DM, McIlreavey L, et al. . Community dynamics and the lower airway microbiota in stable chronic obstructive pulmonary disease, smokers and healthy non-smokers . Thorax. 2016;; 71 : :795.-803. 43. Braun-Fahrländer C, Riedler J, Herz U, et al. . Environmental exposure to endotoxin and its relation to asthma in school-age children . N Engl J Med. 2002;; 347 : :869.-77. 44. Hauptmann M, Schaible UE. Linking microbiota and respiratory disease . FEBS Lett. 2016;; 590 : :3721.-38. 45. Huang YJ, Nelson CE, Brodie EL, et al. . Airway microbiota and bronchial hyperresponsiveness in patients with suboptimally controlled asthma . J Allergy Clin Immunol. 2011;; 127 : :372.-81. 46. Zhou Y, Lin F, Cui Z, et al. . Correlation between either Cupriavidus or Porphyromonas and primary pulmonary tuberculosis found by analysing the microbiota in patients’ bronchoalveolar lavage fluid . PloS One. 2015;; 10 : :e0124194.. 47. Molyneaux PL, Cox MJ, Will is-Owen SAG, et al. . The role of bacteria in the pathogenesis and progression of idiopathic pulmonary fibrosis . Am J Respir Crit Care Med. 2014;; 190 : :906.-13. 48. Cuthbertson L, Rogers GB, Walker AW, et al. . Respiratory microbiota resistance and resilience to pulmonary exacerbation and subsequent antimicrobial intervention . iSME J. 2016;; 10 : :1081.-91. 49. Skolnik K, Nguyen A, Somayaji R, et al. . Clinical implications and characterization of Group A Streptoccoccus infections in adults with cystic fibrosis . BMC Pulm Med. 2015;; 15 : :161.. 50. Cookson WOCM, Cox MJ, Moffatt MF. New opportunities for managing acute and chronic lung infections . Nat Rev Microbiol. 2018;; 16 : :111.-120. 51. Nguyen L, Delhaes L. Un nouveau concept : le mycobiome pulmonaire . Med Sci (Paris). 2015;; 31 : :945.-7. 52. Andréjak C, Delhaes L. Le microbiome pulmonaire en 2015 : une fenêtre ouverte sur les pathologies pulmonaires chroniques . Med Sci (Paris). 2015;; 31 : :971.-8. |

 )
) ) voir la Nouvelle de L. Nguyen et L. Delhaes, m/s n°11, novembre 2015, page 945, et la Synthèse de C. Andréjak et L. Delhaes, m/s n°11, novembre 2015, page 971
) voir la Nouvelle de L. Nguyen et L. Delhaes, m/s n°11, novembre 2015, page 945, et la Synthèse de C. Andréjak et L. Delhaes, m/s n°11, novembre 2015, page 971