| |
| Med Sci (Paris). 34(3): 238–246. doi: 10.1051/medsci/20183403012.La motivation dans tous ses K Approche computationnelle des pathologies neuropsychiatriques Raphaël Le Bouc1,2,3* and Mathias Pessiglione1,2 1Motivation, Brain and Behavior (MBB) lab, institut du cerveau et de la moelle épinière (ICM), hôpital de la Pitié-Salpêtrière, 47, boulevard de l’hôpital, 75013Paris, France 2Inserm U1127, CNRS U9225, université Pierre et Marie Curie (UPMC-Paris 6), Paris, France 3Urgences cérébro-vasculaires, hôpital de la Pitié-Salpêtrière, université Pierre et Marie Curie, Paris, France |
La motivation peut être définie comme la fonction qui oriente et active le comportement. Nous résumons dans cette revue les acquis récents des neurosciences concernant les bases cérébrales des fonctions motivationnelles. En clinique neuropsychiatrique, les troubles de la motivation sont fréquents et actuellement évalués par des échelles qui ne renseignent pas sur les mécanismes sous-jacents. Nous présentons ici une nouvelle approche, dite computationnelle. Elle consiste à phénotyper le comportement des patients dans des tests de motivation, au moyen de modèles computationnels. Ces phénotypes computationnels caractérisent l’état du patient et pourraient aider au suivi et à la personnalisation du traitement. Dans cette revue, nous exposerons, dans un premier temps, le cadre général de la théorie de la décision, dans laquelle s’intègrent les tests comportementaux et les modèles computationnels développés dans la suite. Un modèle computationnel est un algorithme mathématique qui réalise les tests de motivation selon les mêmes opérations logiques que le patient de façon à produire des réponses comportementales similaires. Nous présenterons ensuite brièvement les travaux identifiant des bases neurales potentielles pour les processus motivationnels. Enfin nous aborderons les principales pathologies neuropsychiatriques pour lesquelles pourraient s’appliquer l’approche computationnelle des troubles de la motivation. < |
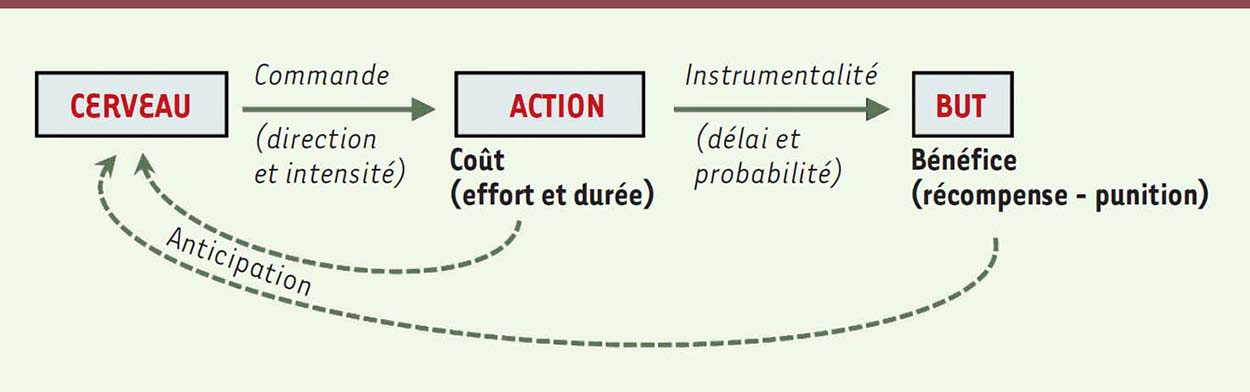
Questionner les motivations réelles à l’origine d’un comportement revient à rechercher des causes en termes de buts implicites. Mais dire de quelqu’un qu’il est très motivé sous-entend que la motivation peut se quantifier, et que cette grandeur peut prédire le comportement. La motivation peut ainsi être construite comme un concept à deux attributs : un contenu et une quantité. La motivation détermine donc deux aspects du comportement, sa direction, en fonction du contenu (c’est-à-dire le but, ou la récompense), et son intensité, en fonction de la quantité (c’est-à-dire la valeur du but). Ainsi, l’apathie peut être définie comme un déficit de motivation, conduisant à une réduction des comportements dirigés vers un but. Les limites des échelles psychométriques L’évaluation clinique des troubles de la motivation s’intéresse principalement à son intensité. Les échelles cliniques [ 1] consistent en des questionnaires qui fournissent un score d’apathie. Elles sont utiles pour donner une estimation clinique globale, mais souffrent de limitations intrinsèques. D’une part, elles dépendent des capacités d’introspection des patients, qui peuvent être altérées dans des pathologies cognitives, ou de l’évaluation subjective des familles. D’autre part, elles ne renseignent pas sur les mécanismes à l’origine des troubles de la motivation. Pour dépasser ces limitations, nous proposons une stratégie alternative : (1) compléter ces évaluations par des tests comportementaux objectifs et (2) caractériser les performances comportementales en s’appuyant sur la théorie de la décision (Figure 1).  | Figure 1. Représentation schématique de la motivation. Ce schéma boîte-flèches illustre les comportements dirigés vers un but. Le cerveau ajuste l’orientation et l’intensité du comportement pour diminuer le délai ou augmenter la probabilité d’atteindre le but. La théorie de la décision postule qu’un individu devrait maximiser la valeur nette de son comportement, correspondant à la différence entre les coûts (l’effort et le temps consacré) et les bénéfices (c’est-à-dire de combien les aspects appétitifs dépassent les aspects aversifs du but). Pour réaliser cette optimisation, le cerveau doit anticiper les coûts et les bénéfices de l’action. Dans ce cadre, la motivation peut avoir trois significations différentes : la motivation comme contenu se réfère à l’identité du but, la motivation comme quantité se réfère à la valeur du but, et la motivation comme processus se réfère aux ajustements du comportement dirigé vers le but. |
Les promesses de la théorie de la décision La théorie de la décision s’intéresse aux mécanismes qui déterminent les choix d’un individu et en propose un formalisme mathématique. Elle repose sur l’hypothèse que les individus attribuent une valeur aux différentes options d’un choix et qu’ils choisissent préférentiellement l’option qui a la plus grande valeur. On parle de valeur nette lorsque les coûts liés à l’action sont soustraits aux bénéfices liés au but de l’action selon la formule (1) : L’individu s’engagera dans l’action seulement si sa valeur nette est positive. Il préfèrera ne rien faire dans le cas contraire. Lorsqu’il compare différentes actions entre elles, il s’engagera dans celle qui a la plus grande valeur nette. La même équation permet de choisir l’intensité avec laquelle l’action sera menée : à nouveau, celle qui donne le meilleur bilan coût/bénéfice (voir plus loin l’équation 2). Nos actions ne mènent cependant pas toujours au but escompté de manière immédiate et certaine. Les individus ont ainsi tendance à décompter la valeur des récompenses en fonction de la probabilité ou du délai nécessaire pour atteindre le but [2]. Le coût des actions est lié à l’allocation de ressources nécessaires à leur exécution. C’est intuitif dans le cas de l’effort physique qui consomme des ressources énergétiques et fatigue les muscles. Mais cela reste moins évident pour l’effort mental pour lequel l’hypothèse d’une ressource biologique qui serait consommée reste encore débattue [3]. Quoiqu’il en soit, les individus ont tendance à éviter l’effort mental s’ils le peuvent [4]. Il faut donc supposer que celui-ci comporte aussi un coût, dont la nature biologique et/ou fonctionnelle reste à identifier. Finalement, le coût des actions peut être considéré comme une mesure de l’intensité de la motivation. Puisqu’un individu ne s’engage dans une action que si sa valeur nette est positive, le coût maximum qu’il acceptera d’endurer est égal à la valeur du but à atteindre. Les recherches récentes ont ainsi permis le développement de différents tests comportementaux fondés sur le conflit entre effort et récompense et qui permettent d’évaluer la motivation. |
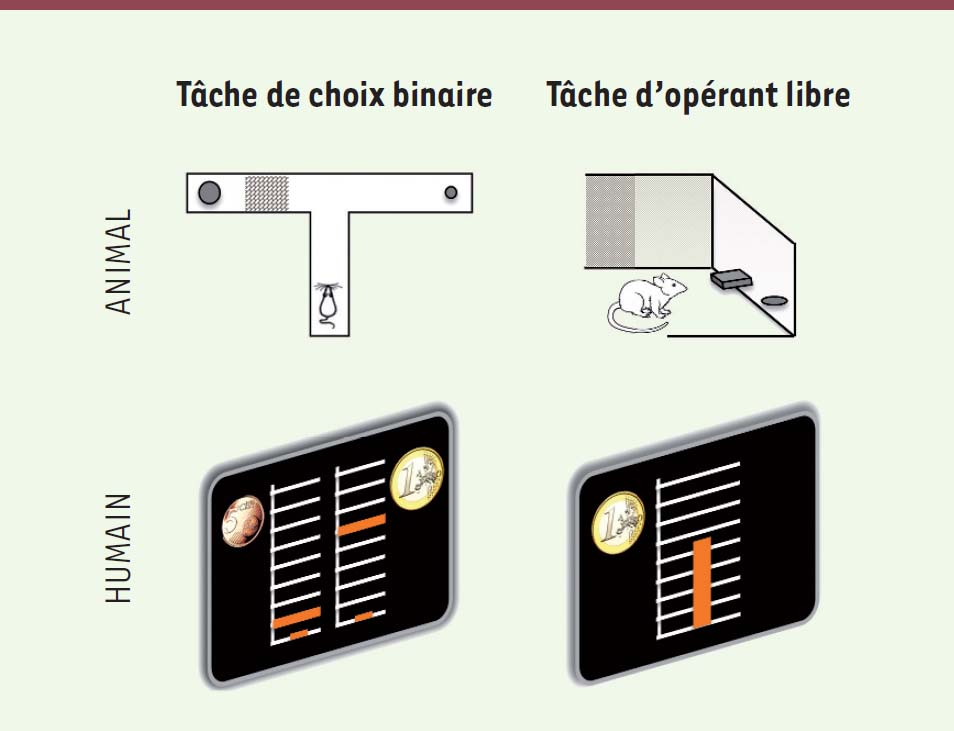
Les premiers tests expérimentaux ont été développés chez l’animal avant d’être adaptés chez l’homme. Ils sont appelés tests de « décision basée sur l’effort » ou tests de « motivation incitative » selon qu’il faille réaliser un choix explicitement ou implicitement, mais tous ces tests ont en commun de manipuler des niveaux d’efforts et de récompenses. Les tâches de décision basées sur l’effort consistent à choisir entre deux options : produire un petit effort pour obtenir une petite récompense, ou réaliser un effort plus important pour une récompense plus grande. Dans la tâche du « labyrinthe en T » (Figure 2, haut) utilisée chez les rongeurs, plusieurs boulettes de nourriture sont placées dans un bras du labyrinthe, derrière une barrière, l’autre bras menant sans obstacle à une plus faible quantité de nourriture [5]. Une autre implementation utilise une cage contenant deux leviers, dont l’un nécessite un plus grand nombre de pressions, mais libère une plus grande quantité de nourriture [6] (Figure 2). Les quantités de nourriture (bénéfice) et d’effort (coût) peuvent être manipulées pour déterminer le coût qu’un animal accepte, fournissant une mesure de la valeur subjective de la récompense.  | Figure 2. Tâches comportementales évaluant la motivation comme un compromis effort/récompense. L’intensité de la motivation peut être quantifiée comme la quantité d’effort qu’un individu accepte de dépenser pour obtenir une récompense. Ce compromis entre effort et récompense peut être évalué dans des tâches de choix binaires (à gauche) ou des tâches de motivation incitative (à droite). Chez les animaux (en haut), les choix binaires sont typiquement implémentés dans un labyrinthe en T, offrant une petite récompense pour un faible effort dans un bras, et une grande récompense (plus de nourriture) pour un grand effort (une barrière à escalader) dans l’autre bras. La motivation par incitation est classiquement testée dans une boite de Skinner, dans laquelle de la nourriture est délivrée proportionnellement au nombre de pressions exercées sur un levier, de telle sorte que les niveaux d’effort/récompense sont sélectionnés librement par l’animal. Chez l’homme (en bas), ces tâches ont été adaptées en utilisant une pince manuelle mesurant l’effort produit, et des récompenses monétaires. La figure montre un écran de l’animation visuelle présentée au participant au cours d’un essai. La barre orange verticale fournit un retour visuel sur la force produite, dans une grille dont le haut représente la force maximale du participant. Dans la tâche de motivation par incitation, tous les niveaux de force entre zéro et la force maximale peuvent être sélectionnés, pour une récompense proportionnelle, entre zéro et la totalité de l’enjeu monétaire (1 € dans l’exemple illustré). Dans la version des choix binaires, seulement deux combinaisons d’effort-récompense sont disponibles (les niveaux de force requis sont indiqués par une barre orange horizontale et les incitations monétaires par des pièces). Ce paradigme comportemental peut aussi être adapté pour mesurer le taux d’acceptation pour une combinaison récompense-effort donnée. Dans ce cas (non illustré), une seule option est présentée à l’écran, que le participant peut accepter ou refuser. |
Dans les tâches de motivation incitative, il n’y a pas de choix explicite dans le sens où les différentes options ne sont pas explicitement présentées. Dans les tâches à « ratio progressif », par exemple, le nombre nécessaire de pressions sur un levier, pour délivrer une certaine quantité de nourriture, est augmenté d’une session à l’autre jusqu’à ce que l’animal refuse de participer. Le niveau d’effort maximal accepté par l’animal est alors pris comme mesure de la motivation [7]. Dans les tâches à « ratio fixe », l’animal peut choisir de produire n’importe quel niveau d’effort, entre zéro et un effort maximal, et la quantité de nourriture délivrée est proportionnelle au nombre de pressions effectuées. Chez l’homme, l’effort est habituellement implémenté sous la forme d’un dynamomètre qu’il faut serrer avec la main (Figure 2, bas), ou d’un nombre de clics à exercer sur une souris d’ordinateur [8, 9]. La pince manuelle (reliée au dynamomètre) a l’avantage de dissocier l’intensité et la durée de l’action, puisque le coût (lié aux pics de forces) peut être modulé en conservant une durée relativement constante. Ceci évite de confondre l’effet d’un effort plus coûteux avec l’effet de décompte lié à l’arrivée retardée de la récompense en raison d’un effort plus long. Les récompenses alimentaires sont généralement remplacées par des sommes d’argent faciles à quantifier et qui n’induisent pas de satiété. |
Même dans ces tests simples, plusieurs facteurs peuvent affecter la motivation. Choisir de travailler plus pour gagner plus pourrait ainsi être lié soit à une sensibilité accrue pour les récompenses, soit à une sensibilité moindre aux efforts. Les modèles computationnels peuvent aider à distinguer ces explications alternatives. Modélisation du compromis coût/bénéfice Les modèles computationnels sont des algorithmes qui simulent le comportement grâce à une série d’opérations mathématiques appliquées aux facteurs expérimentaux. Pour simuler le comportement dans des tests de motivation, il est possible, par exemple, d’utiliser des modèles issus de la théorie de la décision - voir plus haut et l’équation (1). Les contingences entre l’effort et la récompense sont directement déterminées par la règle du jeu suivie dans le test : par exemple, atteindre 80 % de sa force maximale peut être associé à un gain de 10 €. Avec l’argent, le niveau des récompenses est une quantité objective (comme 10 €) qui peut être directement intégrée à l’équation. Il en va différemment avec l’effort puisque le coût subjectif peut s’éloigner notablement de la quantité objective d’effort à fournir (80 % de la force par exemple). Pour illustrer ce propos, nous décrivons ici un modèle simple objectivé par la formule (2), simulant le comportement dans une tâche de motivation incitative dans laquelle la récompense reçue est proportionnelle à la fois à l’enjeu monétaire et à l’effort fourni, et où le coût de l’effort est une fonction explosive (c’est-à-dire qui croît plus rapidement qu’une augmentation linéaire) de la quantité objective d’effort (Figure 2).
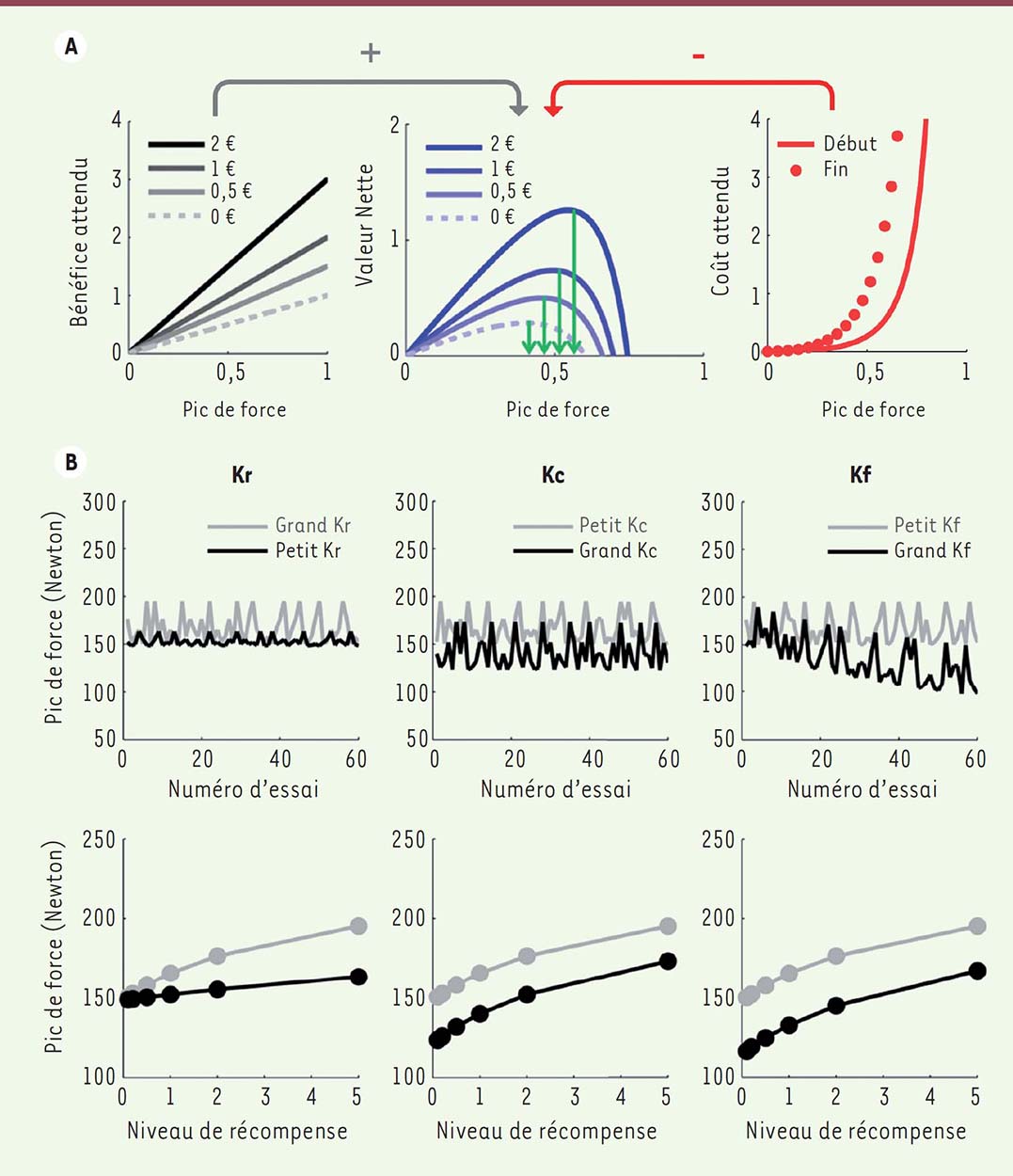
Dans ce modèle, V est la valeur nette de l’action, Fi est la force envisagée, R est la récompense potentielle (l’incitation monétaire), et T le temps (numéro de l’essai). Le temps est introduit pour reproduire la fatigue (le fait que le coût augmente en fonction de la répétition des efforts). Notez que cette équation n’est autre que l’équation (1), qui donne la formulation générale, adaptée aux spécificités du test. Une simulation des bénéfices, des coûts, et de la valeur nette liés aux différentes forces que peut produire le sujet est représentée Figure 3. 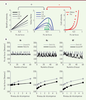 | Figure 3.Simulation d’un modèle de motivation. Les simulations ont été réalisées à partir d’un modèle approximé par l’équation (2), et appliqué à la tâche de motivation incitative illustrée Figure 2 (bas, droite) avec 6 niveaux de récompenses présentés aléatoirement au cours de 60 essais (selon [ 33]). A. Variables cachées. Dans un essai donné, le modèle anticipe pour chaque pic de force possible le bénéfice associé (gauche) et le coût associé (droite). Le bénéfice attendu est proportionnel au pic de force, avec une pente qui dépend de l’enjeu monétaire présenté à cet essai (seuls 4 niveaux sont illustrés). Le coût attendu est une fonction supra-linéaire du pic de force, dont la pente dépend du niveau de fatigue (c’est-à-dire du nombre d’essai réalisés jusque-là). Deux niveaux de fatigue sont illustrés, montrant le coût de l’effort au début et à la fin de la tâche. La valeur nette est obtenue par soustraction des coûts aux bénéfices. Le comportement prédit par le modèle est le pic de force optimal (pour lequel la valeur nette est maximale), comme illustré par les flèches vertes. La force optimale augmente avec le niveau de récompense, reproduisant l’effet de motivation incitative. B. Simulations du comportement. Les graphiques montrent l’influence sur le comportement de deux facteurs : le niveau de récompense en jeu (bas) et le numéro de l’essai (haut). Les différentes colonnes montrent les modifications du comportement lorsqu’on fait varier un seul paramètre libre du modèle (ligne grise versus noire). Augmenter la sensibilité aux récompenses (Kr) relève la pente de la relation entre force et récompense, tandis qu’augmenter la sensibilité au coût de l’effort (Kc) déplace globalement la production de force vers le bas, et qu’augmenter la sensibilité à la fatigue (K f) abaisse la pente de la variation au travers des essais. Pour exemple, l’effet des traitements dopaminergiques utilisés dans la maladie de Parkinson correspond à une élévation du Kr (colonne de gauche). |
|
Ajustement des paramètres libres du modèle La fonction de valeur nette (équation (2) et Figure 3) illustre comment ce modèle permet, en principe, de sélectionner le comportement optimal, qui maximise les bénéfices tout en minimisant les coûts : il s’agit de la force dégageant la plus grande valeur nette. Bien sûr, chaque individu peut varier dans sa manière d’aborder les récompenses et les efforts. Cette subjectivité est permise dans le modèle par des constantes (paramètres libres k) qui pondèrent la valeur des récompenses (kr), le coût des efforts (kc) et l’impact de la fatigue (kf). Ajuster ces paramètres libres, de sorte que le modèle reproduise le plus fidèlement possible le comportement d’un sujet, permet d’obtenir un phénotypage computationnel qui caractérise l’état du sujet par son attitude vis-à-vis de différentes dimensions comme les efforts et les récompenses. Les variations de ces paramètres permettent ainsi de capturer les différences entre individus, ou les fluctuations chez un même individu. En clinique, ces paramètres peuvent caractériser les dysfonctions liées à certaines pathologies cérébrales, ou l’effet de traitements. |
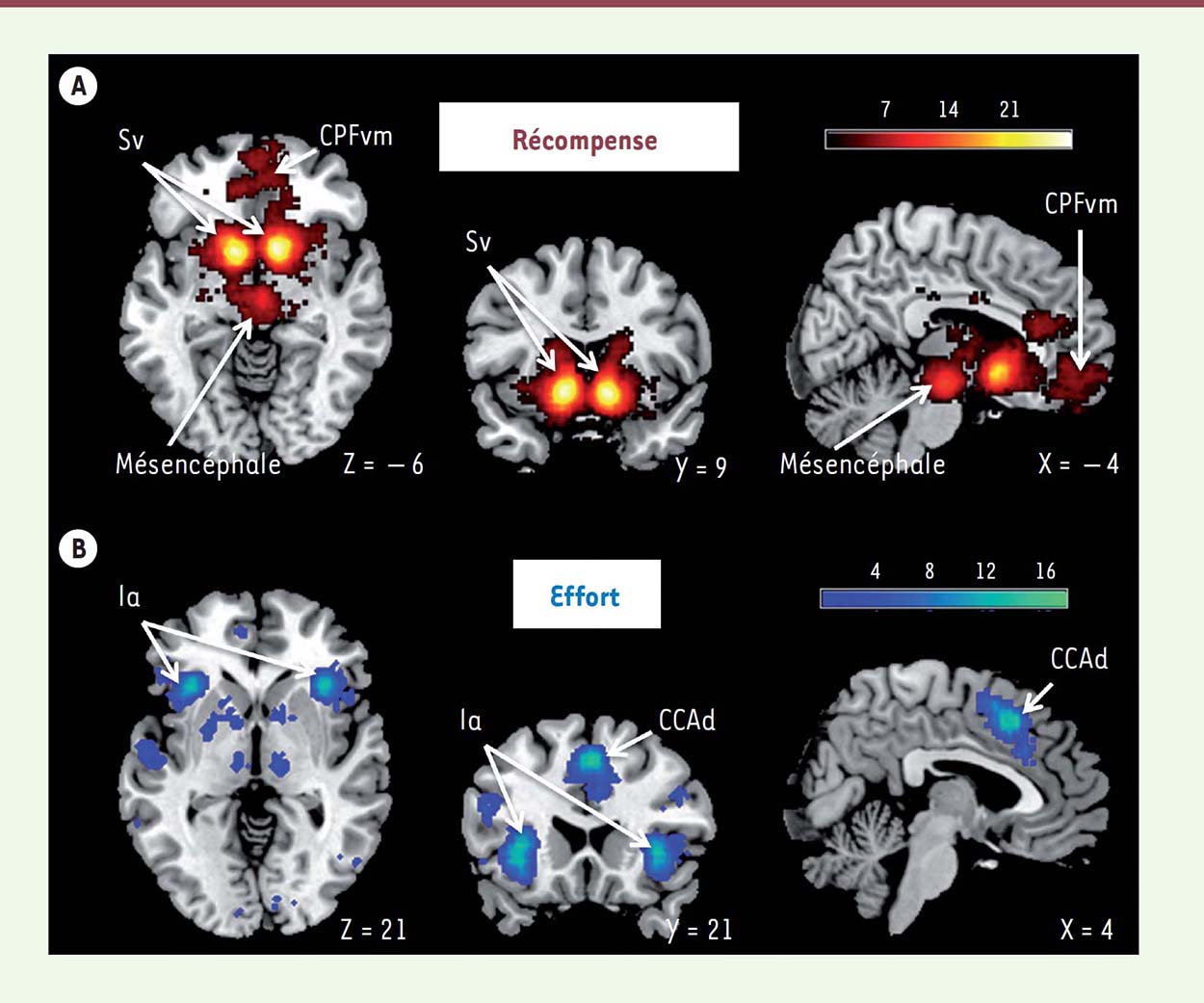
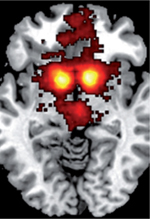
Nous résumerons ici les travaux qui ont étudié les bases neurales de la motivation en tant que compromis effort/récompense. Nous aborderons successivement les structures corticales, sous-corticales, et les neuromodulateurs qui participent à ces processus. Une méta-analyse, réalisée grâce à la plateforme neurosynth.org, illustre les principales aires cérébrales impliquées dans le traitement des récompenses et des efforts (Figure 4). Le réseau des récompenses implique le cortex orbitofrontal (COF), le striatum ventral, et les régions dopaminergiques du mésencéphale. Le réseau des efforts concerne principalement les portions antérieures du cortex cingulaire et de l’insula.  | Figure 4. Méta-analyse des représentations neurales des récompenses et des efforts. Cartes statistiques des régions cérébrales associées en imagerie par résonance magnétique (IRM) fonctionnelle aux termes « récompense » (A) et « effort » (B), réalisées sur la plateforme Neurosynth.org. Les coupes ont été sélectionnées pour illustrer les clusters principaux. Les coordonnées [X, Y, Z] renvoient au référentiel du Montreal Neurological Institute (MNI). la : insula antérieure; CCAd : cortex angulaire antérieur dorsal; CPFvm : cortex préfrontal ventro-médian; Sv : striatum ventral. |
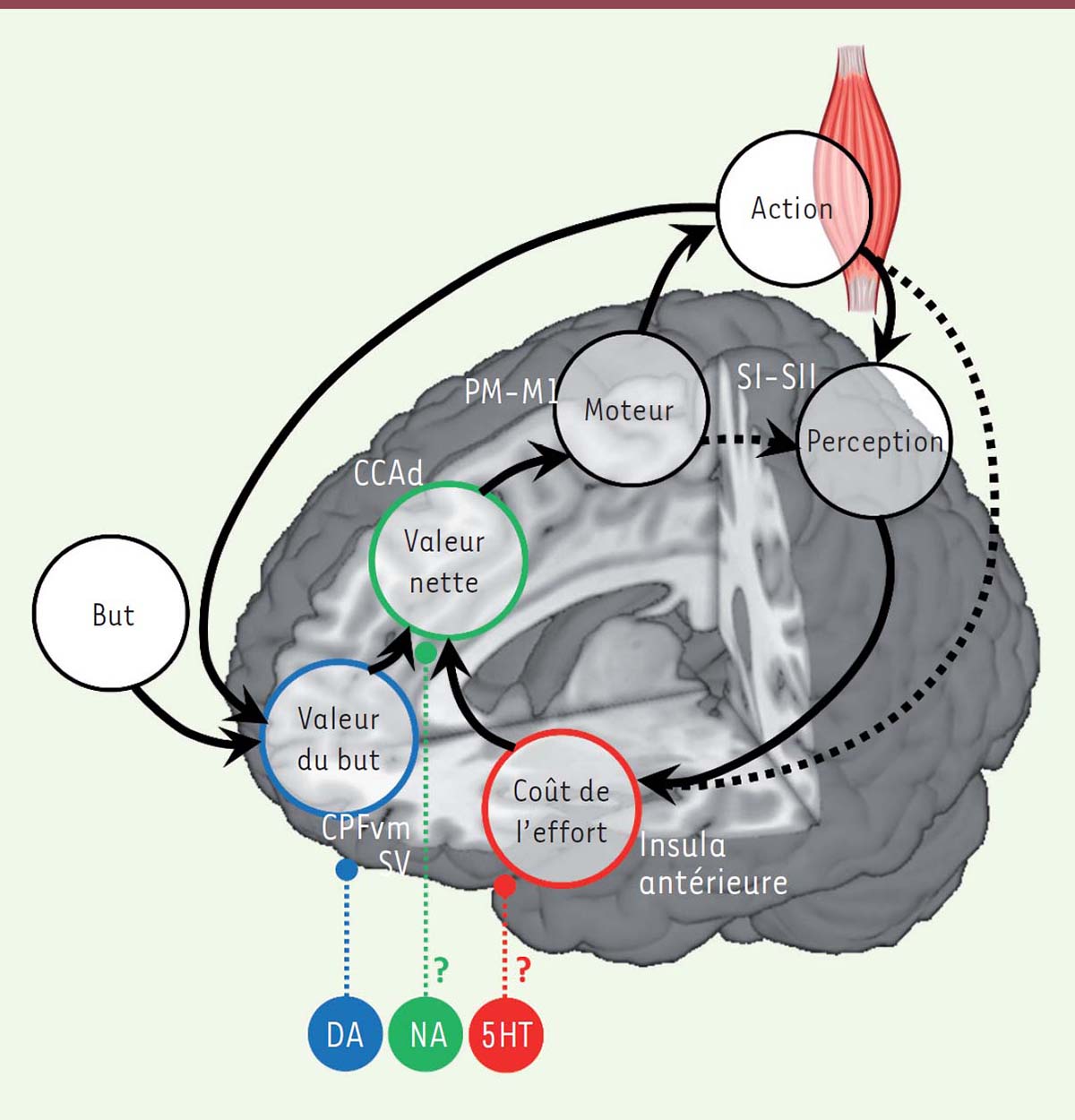
Les structures corticales En imagerie fonctionnelle, la partie médiane du COF, ou cortex préfrontal ventro-médian (CPFvm), a été identifiée chez l’homme comme la région dont l’activité était corrélée avec la valeur subjective des récompenses, quel que soit leur domaine (argent, nourriture, récompense sociale, etc.) [ 10]. À l’inverse, les efforts physiques d’intensité croissante activent l’insula antérieure, comme le font des situations aversives 1, telles que la douleur ou les punitions [ 9, 11]. Finalement, le coût des efforts physiques est positivement corrélé à l’activité du cortex cingulaire antérieure dorsal (CCAd) situé au-dessus du genou du corps calleux. L’activité de cette région est aussi corrélée négativement à la valeur du but de l’action [ 11, 12], ce qui suggère un rôle du CCAd dans l’intégration des bénéfices et des coûts et le calcul d’une valeur nette. De manière intéressante, l’effort mental semble impliquer les mêmes régions que l’effort physique, en particulier le CCAd [ 13]. Les structures sous-corticales Dans les tâches de motivation incitative, analysées en imagerie par résonance magnétique (IRM) fonctionnelle, le striatum ventral et le pallidum ventral s’activent en réponse aux récompenses et entraînent la production d’effort physique ou mental [ 14, 15], même quand les récompenses sont présentées de façon subliminale [ 16]. Ces régions reçoivent des projections directes du COF [ 17]. Elles sont considérées comme la voie de sortie du système motivationnel puisque leur activité augmente lorsque les humains, ou les singes [ 18], produisent plus d’effort pour obtenir plus de récompenses. Pour autant, le striatum paraît aussi coder la valeur nette, correspondant au bénéfice déduit du coût, dans des tâches de décision dans lesquelles il faut intégrer les récompenses et les efforts pour faire un choix [ 19]. Les neuromodulateurs Des concentrations accrues de dopamine dans le nucleus accumbens, une structure homologue au striatum ventral chez le rongeur [ 5], biaisent les choix vers les grands efforts pour de grandes récompenses. En revanche, une déplétion en dopamine favorise le choix de petits efforts pour de petites récompenses. Chez l’homme, des effets positifs et négatifs sur la motivation ont été observés avec des agonistes dopaminergiques [ 20] (voir plus loin) ou une déplétion dopaminergique obtenue par ingestion de phénylalanine/tyrosine [ 21]. Chez l’animal, cet effet de la libération de dopamine paraît lié à une augmentation du pouvoir attractif des récompenses, et non à une diminution de la sensibilité au coût des efforts [ 22, 23]. D’autres neuromodulateurs, comme la noradrénaline et la sérotonine, pourraient être impliqués dans le codage et la modulation du coût des efforts. Si le locus coeruleus2,, qui produit la noradrénaline, ne semble pas activé au moment de décider de l’action, le taux de décharge de ses neurones est en revanche proportionnel à l’intensité de l’action au moment de son exécution [23]. Par ailleurs, un traitement antidépresseur qui augmente les niveaux de sérotonine permet de maintenir un effort plus longtemps dans une tâche de motivation incitative, en diminuant le coût des efforts [24]. Finalement, il faut noter qu’en dehors d’explorations en IRM à très haut champ, il reste difficile d’identifier des activations de régions comme l’aire tegmentale ventrale ou le locus coeruleus par exemple, qui participent à la synthèse de ces neuromodulateurs. Il est ici tentant d’établir des liens entre l’équation de la valeur nette (2) et les résultats présentés dans cette section. Une proposition spéculative mais raisonnable (Figure 5) pourrait se résumer ainsi : (1) certaines régions, comme le CPFvm, représentent le terme de bénéfice, (2) d’autres régions, comme le CCAd, intègrent le coût des efforts et calculent la valeur nette, (3) les neuromodulateurs ajustent le poids des récompenses et des efforts dans l’estimation de cette valeur nette. 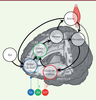 | Figure 5. Une implémentation plausible des processus motivationnels dans le cerveau humain. La figure illustre les mécanismes que le cerveau pourrait implémenter pour générer le comportement dans une tâche de motivation incitative, ainsi que les localisations anatomiques des représentations des variables du modèle computationnel. La région charnière serait le CCAd, qui intègrerait la valeur du but transmise par les circuits fronto-striataux ventraux et le coût de l’effort transmis par les insulas antérieures. Le CCAd transmettrait ensuite la valeur nette aux régions pré-motrices et motrices, permettant l’élaboration de la commande motrice pour les muscles. La contraction musculaire permettrait d’un côté d’augmenter le bénéfice attendu, et, d’autre part, elle entraînerait un coût, qui seraient intégrés dans les régions cérébrales correspondantes. À chaque essai, le comportement serait généré après plusieurs boucles, au cours desquelles chacune des représentations serait actualisée. Il est à noter que les boucles peuvent être simulées de manière interne (sans mouvement) si les régions motrices informent directement (par une copie efférente de la commande motrice) les régions sensorielles, à partir desquelles le coût de l’effort pourrait être estimé. Il n’existe pas de consensus sur le rôle des neuromodulateurs dans ce système – nous illustrons ici une proposition de répartition fonctionnelle dans laquelle la DA module la valeur du but, la 5HT le coût de l’effort, et la NA la valeur nette. la : insula antérieure; CCAd : cortex cingulaire antérieur dorsal; CPFvm : cortex préfrontal ventro-médian; SV : striatum ventral; PM : cortex prémoteur; Ml : cortex moteur primaire; SI–SII : cortex sensoriel primaire et secondaire; DA : dopamine; NA : noradrénaline; 5HT : sérotonine. |
|
En neurologie Les troubles de la motivation ont une prévalence élevée dans les pathologies neurologiques. L’apathie en particulier, c’est-à-dire la réduction des comportements dirigés vers un but, se rencontre dans près de 35 % des cas après un accident vasculaire cérébral (AVC) [ 25], 40 % dans la maladie de Parkinson [ 1], et 50 % dans la maladie d’Alzheimer [ 26] ou les traumatismes crâniens [ 27]. Elle a un retentissement important sur la récupération fonctionnelle [ 25], le taux de dépendance [ 28], et la qualité de vie des patients et de leurs aidants [ 29]. La maladie de Parkinson (MP) est probablement la pathologie dans laquelle les processus motivationnels ont été le plus étudiés [51] (➔) (➔) Voir la Nouvelle de M. Favier et al., m/s n° 10, octobre 2017, page 822 La dégénérescence des neurones dopaminergiques s’accompagne de symptômes moteurs, comme un ralentissement (akinésie) et des tremblements, ainsi que de symptômes non moteurs comme l’apathie. Dans la MP, l’apathie pourrait résulter de la déplétion dopaminergique de la voie méso-cortico-limbique par dégénérescence des neurones de l’aire tégmentale ventrale qui se projettent, entre autres, vers le striatum ventral, et les cortex orbitofrontaux et cingulaire antérieurs [30]. Chez ces patients, les traitements dopaminergiques augmentent la propension à accepter des efforts pour remporter des récompenses réelles [31] ou fictives [32]; ils biaisent les choix vers les options associant grand effort/grande récompense par rapport aux options associant petit effort/petite récompense [33]; et ils augmentent la production d’effort dans les tâches de motivation incitative où la récompense est proportionnelle à l’effort fourni [33]. D’un point de vue computationnel, l’effet des traitements dopaminergiques sur la motivation semble correspondre à une augmentation de la sensibilité aux récompenses et non à une diminution de la sensibilité aux efforts [33]. Les traitements dopaminergiques entraînent également une amélioration de la vitesse avec laquelle les actions sont réalisées. L’effet moteur et l’effet motivationnel des traitements dopaminergiques semblent indépendants l’un de l’autre, et prédisent, respectivement, les améliorations cliniques des symptômes moteurs et de l’apathie [33]. L’analyse computationnelle pourrait ainsi aider à quantifier les atteintes motrices et motivationnelles qui restent parfois difficiles à distinguer dans la MP, et qui pourraient refléter l’altération respective des voies dopaminergiques nigro-striatales et méso-cortico-limbiques. Au sein de chaque dimension clinique (comme l’apathie), les paramètres computationnels pourraient de plus dissocier les mécanismes élémentaires en cause (comme l’hyposensibilité aux récompenses versus l’hypersensibilité aux efforts). Le syndrome de perte d’auto-activation psychique est caractérisé par une apathie sévère consécutive à des lésions bilatérales du complexe striato-pallidal [34]. Les patients présentent une perte complète des comportements spontanés qui contraste avec des capacités motrices et cognitives préservées lorsqu’ils sont stimulés par une autre personne [34]. Dans la tâche de motivation incitative, ces patients ont une réponse végétative (augmentation de la conductance cutanée) préservée lors de la présentation visuelle des incitations monétaires, mais ils sont incapables de moduler leur force en fonction des enjeux monétaires, alors qu’ils le font parfaitement sur instruction [35]. Ces résultats suggèrent que les lésions striato-pallidales n’affectent ni le contrôle moteur, ni l’évaluation affective des récompenses, mais plutôt le processus qui transforme des récompenses attendues en activation motrice [35]. Les traitements dopaminergiques semblent aider à améliorer les fonctions motivationnelles chez ces patients [36], suggérant que leur apathie est qualitativement similaire, mais quantitativement plus sévère que dans la MP. En psychiatrie Les troubles de la motivation sont fréquents en psychiatrie. Des aspects déficitaires de la motivation font ainsi partie des critères diagnostiques de la schizophrénie (avolition) ou de la dépression (anhédonie) 3, mais la motivation peut être excessive dans les épisodes maniaques, et déviante dans l’addiction (récompenses artificielles) ou les troubles autistiques (centre d’intérêts atypiques). Dans la schizophrénie, le déficit de motivation est un composant majeur des symptômes négatifs [37]. Bien que moins spectaculaire que les symptômes positifs (hallucinations et délires), l’avolition est l’un des meilleurs prédicteurs du retentissement fonctionnel, et cela, dès le premier épisode délirant [38] ou même chez les patients à très haut risque de développer une schizophrénie [39]. L’avolition pourrait être également responsable d’une part des déficits cognitifs que présentent les patients souffrant de schizophrénie dans les tests neuropsychologiques [40]. Dans les tests motivationnels, un déficit du traitement des récompenses est rapporté de façon reproductible chez les patients souffrant de schizophrénie [41]. Plus récemment, des tests impliquant des efforts ont également mis en évidence une moindre motivation à l’effort physique, ou à l’effort cognitif [42]. L’intensité de ce déficit de motivation à l’effort est généralement bien corrélée aux symptômes négatifs [43]. En revanche, la valeur prédictive de ce type de déficit sur la réponse thérapeutique reste controversée [43]. Le déficit de motivation est également un symptôme très fréquent dans la dépression. Il affecte les capacités fonctionnelles et la qualité de vie des patients et répond moins aux antidépresseurs que d’autres dimensions de la dépression [44]. Les patients déprimés montrent un excès de sensibilité aux stimulus négatifs, comme les punitions, et une sensibilité réduite aux stimulus positifs, comme les récompenses, avec une sensation de plaisir atténuée (anhédonie) et une moindre activation du striatum ventral [45]. Des tests de motivation à l’effort ont montré récemment que les patients déprimés, à l’inverse des sujets sains, ne produisent pas d’effort supplémentaire lorsque des incitations monétaires plus importantes leur sont proposées [46], ce profil se normalisant chez les patients en rémission [47]. Cette moindre motivation à l’effort en réponse aux récompenses a depuis été régulièrement observée chez les patients déprimés, unipolaires ou bipolaires [48], et chez les patients nouvellement diagnostiqués et non encore traités [49]. Elle semble être mieux corrélée aux échelles cliniques d’apathie [12, 47] qu’aux échelles globales de dépression qui évaluent également l’anhédonie [48, 49]. L’allocation d’effort pourrait donc représenter une dimension spécifique dans la dépression, et reposer sur des mécanismes en partie distincts de ceux de l’anhédonie, bien que les relations entre ces deux dimensions restent encore débattues [50]. |
Conclusions et perspectives Comparé aux échelles psychométriques qui évaluent la motivation dans son ensemble, le phénotypage computationnel propose une voie prometteuse aux neurosciences cliniques en distinguant des sous-composants de la motivation qui pourraient avoir une spécificité anatomo-fonctionnelle au niveau cérébral. Le phénotypage computationnel pourrait ainsi permettre de distinguer différents déficits de la motivation, comme une moindre sensibilité aux bénéfices, une sensibilité accrue aux coûts, ou une sensibilité anormale à la fatigue. Au niveau cérébral, l’évaluation des bénéfices a été associée à des régions corticales comme le CPFvm, tandis que d’autres régions comme l’insula semblent liées à l’évaluation des coûts, et le CCAd à l’intégration des bénéfices et des coûts. Enfin, les poids relatifs des bénéfices et des coûts pourraient être modulés sous l’action de différents neuromodulateurs comme la dopamine, la sérotonine ou la noradrénaline. L’un des objectifs de la neuropsychiatrie computationnelle pourrait être la construction d’un modèle quantitatif de la motivation, intégrant les niveaux de description neural et algorithmique. Ce type de modèle pourrait ainsi permettre de prédire les troubles du comportement spécifiques attendus devant certaines lésions, et de façon réciproque, pourrait permettre d’inférer le déficit motivationnel sous-jacent à partir du comportement observé chez les patients. L’espoir de cette approche est ainsi de fournir un éclairage inédit sur les mécanismes physiopathologiques des troubles de la motivation, et d’améliorer le diagnostic et l’orientation thérapeutique (dans la mesure où, par exemple, une hyposensibilité aux récompenses ne requiert pas le même traitement qu’une hypersensibilité aux efforts).♢ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Starkstein SE, Mayberg HS, Preziosi TJ, et al. . Reliability, validity, and clinical correlates of apathy in Parkinson’s disease . J Neuropsychiatry Clin Neurosci. 1992;; 4 : :134.-9. 2. Green L, Myerson J. A discounting framework for choice with delayed and probabilistic rewards . Psychol Bull. 2004;; 130 : :769.-92. 3. Inzlicht M, Schmeichel BJ, Macrae CN. Why self-control seems (but may not be) limited . Trends Cogn Sci. 2014;; 18 : :127.-33. 4. Kool W, McGuire JT, Rosen ZB, Botvinick MM. Decision making and the avoidance of cognitive demand . J Exp Psychol Gen. 2010;; 139 : :665.-82. 5. Salamone JD, Correa M, Farrar A, Mingote SM. Effort-related functions of nucleus accumbens dopamine and associated forebrain circuits . Psychopharmacology. 2007;; 191 : :461.-82. 6. Walton ME, Kennerley SW, Bannerman DM, et al. . Weighing up the benefits of work: behavioral and neural analyses of effort-related decision making . Neural Netw. 2006;; 19 : :1302.-14. 7. Minamimoto T, Hori Y, Richmond BJ. Is working more costly than waiting in monkeys. ? PLoS One. 2012;; 7 : :e48434.. 8. Treadway MT, Buckholtz JW, Schwartzman AN, et al. . Worth the ‘EEfRT’? The effort expenditure for rewards task as an objective measure of motivation and anhedonia . PLoS One. 2009;; 4 : :e6598.. 9. Prevost C, Pessiglione M, Metereau E, et al. . Separate valuation subsystems for delay and effort decision costs . J Neurosci. 2010;; 30 : :14080.-90. 10. Bartra O, McGuire JT, Kable JW. The valuation system: a coordinate-based meta-analysis of BOLD fMRI experiments examining neural correlates of subjective value . Neuroimage. 2013;; 76 : :412.-27. 11. Skvortsova V, Palminteri S, Pessiglione M. Learning to minimize efforts versus maximizing rewards: computational principles and neural correlates . J Neurosci. 2014;; 34 : :15621.-30. 12. Bonnelle V, Veromann KR, Burnett Heyes S, et al. . Characterization of reward and effort mechanisms in apathy . J Physiol Paris. 2015;; 109 : :16.-26. 13. Massar SA, Libedinsky C, Weiyan C, et al. . Separate and overlapping brain areas encode subjective value during delay and effort discounting . Neuroimage. 2015;; 120 : :104.-13. 14. Knutson B, Fong GW, Adams CM, et al. . Dissociation of reward anticipation and outcome with event-related fMRI . Neuroreport. 2001;; 12 : :3683.-7. 15. Schmidt L, Lebreton M, Clery-Melin ML, et al. . Neural mechanisms underlying motivation of mental versus physical effort . PLoS Biol. 2012;; 10 : :e1001266.. 16. Pessiglione M, Schmidt L, Draganski B, et al. . How the brain translates money into force: a neuroimaging study of subliminal motivation . Science. 2007;; 316 : :904.-6. 17. Haber SN. The primate basal ganglia: parallel and integrative networks . J Chem Neuroanat. 2003;; 26 : :317.-30. 18. Tachibana Y, Hikosaka O. The primate ventral pallidum encodes expected reward value and regulates motor action . Neuron. 2012;; 76 : :826.-37. 19. Botvinick MM, Huffstetler S, McGuire JT. Effort discounting in human nucleus accumbens . Cogn Affect Behav Neurosci. 2009;; 9 : :16.-27. 20. Wardle MC, Treadway MT, Mayo LM, et al. . Amping up effort: effects of d-amphetamine on human effort-based decision-making . J Neurosci. 2011;; 31 : :16597.-602. 21. Venugopalan VV, Casey KF, O’Hara C, et al. . Acute phenylalanine/tyrosine depletion reduces motivation to smoke cigarettes across stages of addiction . Neuropsychopharmacology. 2011;; 36 : :2469.-76. 22. Gan JO, Walton ME, Phillips PE. Dissociable cost and benefit encoding of future rewards by mesolimbic dopamine . Nat Neurosci. 2010;; 13 : :25.-7. 23. Varazzani C, San-Galli A, Gilardeau S, Bouret S. Noradrenaline and dopamine neurons in the reward/effort trade-off: a direct electrophysiological comparison in behaving monkeys . J Neurosci. 2015;; 35 : :7866.-77. 24. Meyniel F, Goodwin GM, Deakin JW, et al. . A specific role for serotonin in overcoming effort cost . Elife. 2016; :5.. 25. Caeiro L, Ferro JM, Costa J. Apathy secondary to stroke: a systematic review and meta-analysis . Cerebrovasc Dis. 2013;; 35 : :23.-39. 26. Landes AM, Sperry SD, Strauss ME. Prevalence of apathy, dysphoria, and depression in relation to dementia severity in Alzheimer’s disease . J Neuropsychiatry Clin Neurosci. 2005;; 17 : :342.-9. 27. Arnould A, Rochat L, Azouvi P, Van der Linden M. A multidimensional approach to apathy after traumatic brain injury . Neuropsychol Rev. 2013;; 23 : :210.-33. 28. van Almenkerk S, Smalbrugge M, Depla MF, et al. . Apathy among institutionalized stroke patients: prevalence and clinical correlates . Am J Geriatr Psychiatry. 2015;; 23 : :180.-8. 29. Samus QM, Rosenblatt A, Steele C, et al. . The association of neuropsychiatric symptoms and environment with quality of life in assisted living residents with dementia . Gerontologist. 2005;; 45 (S1) : :19.-26. 30. Thobois S, Ardouin C, Lhommee E, et al. . Non-motor dopamine withdrawal syndrome after surgery for Parkinson’s disease: predictors and underlying mesolimbic denervation . Brain. 2010;; 133 : :1111.-27. 31. Porat O, Hassin-Baer S, Cohen OS, et al. . Asymmetric dopamine loss differentially affects effort to maximize gain or minimize loss . Cortex. 2014;; 51 : :82.-91. 32. Chong TT, Bonnelle V, Husain M. Quantifying motivation with effort-based decision-making paradigms in health and disease . Prog Brain Res. 2016;; 229 : :71.-100. 33. Le Bouc R, Rigoux L, Schmidt L, et al. . Computational dissection of dopamine motor and motivational functions in humans . J Neurosci. 2016;; 36 : :6623.-33. 34. Laplane D, Dubois B. Auto-Activation deficit: a basal ganglia related syndrome . Mov Disord. 2001;; 16 : :810.-4. 35. Schmidt L, d’Arc BF, Lafargue G, et al. Disconnecting force from money: effects of basal ganglia damage on incentive motivation . Brain. 2008;; 131 : :1303.-10. 36. Adam R, Leff A, Sinha N, et al. Dopamine reverses reward insensitivity in apathy following globus pallidus lesions . Cortex. 2013;; 49 : :1292.-303. 37. Foussias G, Remington G. Negative symptoms in schizophrenia: avolition and Occam’s razor . Schizophr Bull. 2010;; 36 : :359.-69. 38. Evensen J, Rossberg JI, Barder H, et al. . Apathy in first episode psychosis patients: a ten year longitudinal follow-up study . Schizophr Res. 2012;; 136 : :19.-24. 39. Lam M, Abdul Rashid NA, Lee SA, et al. . Baseline social amotivation predicts 1-year functioning in UHR subjects: a validation and prospective investigation . Eur Neuropsychopharmacol. 2015;; 25 : :2187.-96. 40. Fervaha G, Zakzanis KK, Foussias G, et al. . Motivational deficits and cognitive test performance in schizophrenia . JAMA Psychiatry. 2014;; 71 : :1058.-65. 41. Gold JM, Waltz JA, Prentice KJ, et al. . Reward processing in schizophrenia: a deficit in the representation of value . Schizophr Bull. 2008;; 34 : :835.-47. 42. Culbreth A, Westbrook A, Barch D. Negative symptoms are associated with an increased subjective cost of cognitive effort . J Abnorm Psychol. 2016;; 125 : :528.-36. 43. Gold JM, Waltz JA, Frank MJ. Effort cost computation in schizophrenia: a commentary on the recent literature . Biol Psychiatry. 2015;; 78 ::747.-53. 44. Calabrese JR, Fava M, Garibaldi G, et al. . Methodological approaches and magnitude of the clinical unmet need associated with amotivation in mood disorders . J Affect Disord. 2014;; 168 : :439.-51. 45. Eshel N, Roiser JP. Reward and punishment processing in depression . Biol Psychiatry. 2010;; 68 : :118.-24. 46. Cléry-Melin M-L, Schmidt L, Lafargue G, et al. . Why don’t you try harder? An investigation of effort production in major depression . PLoS One. 2011;; 6 : :e23178.. 47. Mauras T, Masson M, Fossati P, Pessiglione M. Incentive sensitivity as a behavioral marker of clinical remission from major depressive episode . J Clin Psychiatry. 2016;; 77 : :e697.-703. 48. Hershenberg R, Satterthwaite TD, Daldal A, et al. . Diminished effort on a progressive ratio task in both unipolar and bipolar depression . J Affect Disord. 2016;; 196 : :97.-100. 49. Yang XH, Huang J, Zhu CY, et al. . Motivational deficits in effort-based decision making in individuals with subsyndromal depression, first-episode and remitted depression patients . Psychiatry Res. 2014;; 220 : :874.-82. 50. Treadway MT, Zald DH. Reconsidering anhedonia in depression: lessons from translational neuroscience . Neurosci Biobehav Rev. 2011;; 35 : :537.-55. 51. Favier M, Carcenac C, Marc Savasta M, Carnicella S. Motivation et apathie parkinsonienne : rôle des récepteurs dopaminergiques RD3 . Med Sci (Paris). 2017;; 33 : :822.-4. |