La prolifération accrue de cellules tumorales exige une forte consommation d’oxygène appauvrissant le centre des tumeurs qui contient moins de 0,7 % d’oxygène et devient ainsi hypoxique. En dépit d’améliorations significatives, telles la pégylation1 des nanovecteurs qui permet une meilleure rétention dans la circulation sanguine et un meilleur ciblage tumoral, les plus récents nanovecteurs pharmaceutiques, comme les liposomes, les micelles et les nanoparticules polymériques ne parviennent cependant pas à rejoindre ces régions hypoxiques. Ainsi, même si 5 % de la dose administrée de nanovecteurs pégylés sont encore présents dans la circulation sanguine douze heures après son administration, seuls environ 2 % de ce médicament atteindront la tumeur [1]. Latrajectoire des nanovecteurs est influen cée par la circulation systémique [2] et leur manque de propulseur empêche leur pénétration tumorale vers les zones hypoxiques. (➔)
➔ Voir la Brève de L. Coulombel, m/s n° 10, octobre 2012 page 833
Face à cette problématique, nous avons exploité les caractéristiques et fonctions d’un agent naturel, la bactérie Magnetococcus marinus (MC-1), qui utilise la magnéto-aérotaxie2 pour se déplacer et se maintenir dans des zones pauvres en oxygène. Nous avons examiné la possibilité que les MC-1, guidées par une source magnétique externe, pourraient exploiter des zones de transition au sein des tumeurs, entre les régions oxiques, c’està-dire le réseau angiogénique des vaisseaux sanguins, et les régions anoxiques, donc les zones nécrotiques. La possibilité de guidage magnétique de MC-1 présentait l’avantage de minimiser leur exposition dans la circulation systémique, ce qui représentait une nette amélioration comparée aux thérapies bactériennes précédentes [3]. Ce guidage a été rendu possible grâce aux magnétosomes de MC-1, constitués d’un enchaînement de nanoparticules de tétraoxyde ferrique endogène [4]. En l’absence de champ magnétique externe, MC-1 adopte un mouvement aléatoire, sauf lorsque la bactérie rencontre un gradient d’oxygène, en particulier au sein d’une tumeur. Nous avons d’abord confirmé que les bactéries MC-1, injectées à la périphérie tumorale, pouvaient pénétrer la tumeur, si un champ magnétique tridimensionnel d’une puissance un peu plus élevée que le champ magnétique terrestre, était appliqué. Après pénétration dans la tumeur, et en l’absence du champ magnétique directionnel, les MC-1, utilisant leurs senseurs d’oxygène, se dirigeaient alors vers les zones hypoxiques (Figure 1). Cette expérience a démontré que les MC-1 pouvaient emprunter des voies normales de circulation, comme le réseau irrégulier et désorganisé des vaisseaux sanguins, les espaces interstitiels et traverser des pores intercellulaires, de rayon de moins de 2 mm, établis entre cellules endothéliales [5].
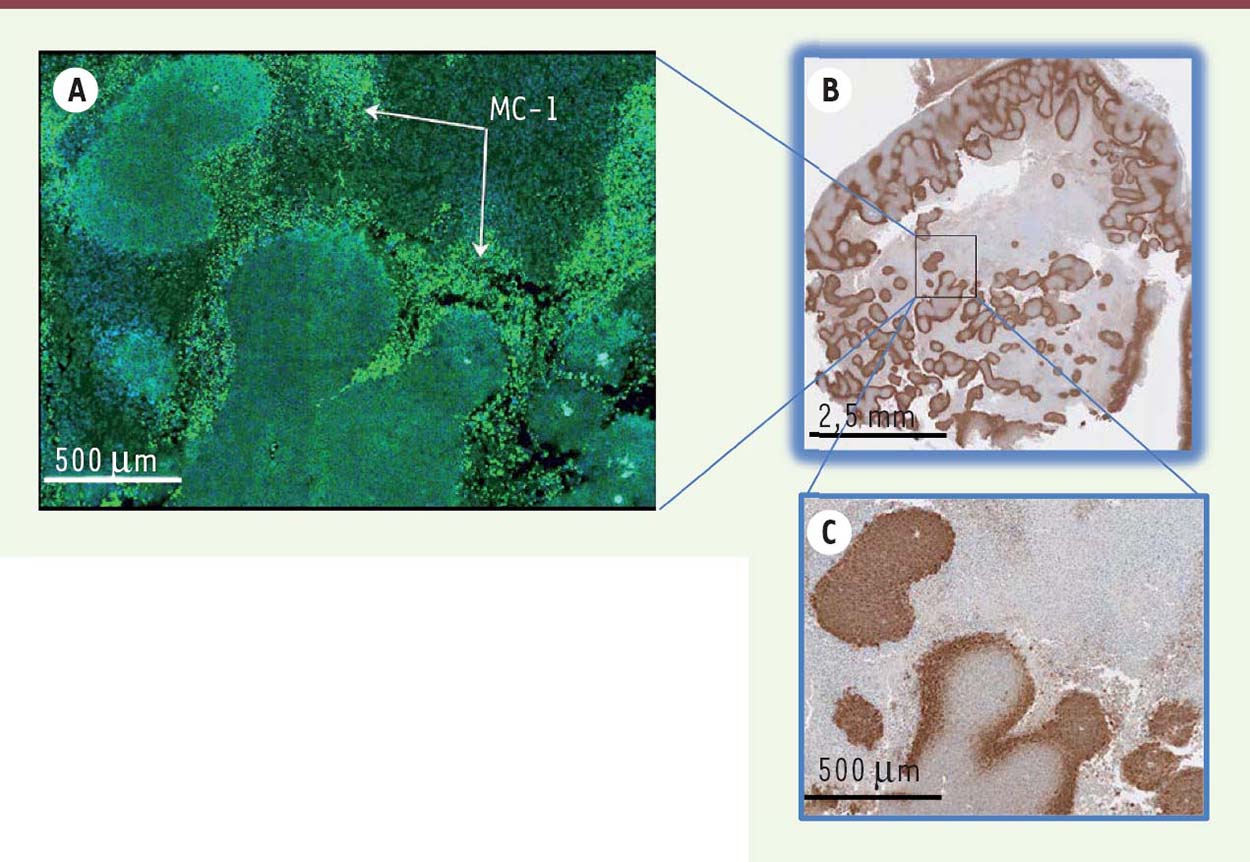
Plusieurs expériences ont ensuite été réalisées chez des souris immunodéficientes portant des xénogreffes de cellules humaines de la lignée HCT116, établie à partir d’un carcinome colique. À la suite d’une injection péritumorale de MC-1, et d’un guidage magnétique directionnel de 30 minutes, nous avons pu localiser, par immunohistochimie grâce à un anticorps spécifique, les bactéries au niveau des régions hypoxiques centrales des tumeurs (Figure 1). Nous avons ainsi démontré une pénétration plus profonde des bactéries MC-1 magnéto-guidées qu’en présence d’agents passifs (comme les microsphères de polymère) ou des bactéries mortes, ou même qu’en absence de guidage [6](➔)
(➔)Voir la Synthèse de J. Nicolas et p. Couvreur, m/s n° 1, janvier 2017, page 11
Nous avons ensuite couplé de façon covalente [7] à la surface des bactéries MC-1 des liposomes encapsulant le SN-38, un agent chimiothérapeutique, et un métabolite actif de l’irinotecan (l’un des traitements conventionnels du cancer colorectal). Nous avons choisi d’utiliser des liposomes pour une démonstration de faisabilité car ils sont biocompatibles, flexibles, peu immunogéniques et, également, parce qu’ils protègent des effets systémiques nocifs de SN-38. L’utilisation des liposomes empêche en effet la dégradation prématurée de cet agent chimiothérapeutique et contrôle également la cinétique de libération. Les liposomes peuvent, de plus, encapsuler plusieurs agents pharmaceutiques hydrophiles ou hydrophobes. L’addition de ces liposomes à la surface des MC-1 n’a pas altéré leur efficacité de ciblage au centre des tumeurs dans les régions hypoxiques et nécrotiques.
| Figure 1 Les cellules MC-1 sont recrutées préférentiellement dans les régions hypoxiques des xénogreffes de cellules HCT116. A. Des sections adjacentes de xénogreffes HCT116 incubées en présence d’un anticorps spécifique des bactéries MC-1 et d’un anticorps secondaire conjugué à la fluorescéine-isothio-cyanate (FITC) ont permis de localiser ces bactéries. Les bactéries MC-1 (coloration verte, 10x) se retrouvent dans les régions hypoxiques telles que révélées dans les panneaux B. (10x) et C. (40x). En B et C, les régions hypoxiques (colorées en brun) proches des régions nécrotiques de la tumeur sont révélées par un anticorps spécifique de l’Hydroxyprobe® couplé à la biotine. Ces images en haute résolution sont acquises à l’aide d’une caméra digitale DP71 couplée à un microscope de fluorescence Olympus BX61 motorisé. Elles sont représentatives de sections obtenues à partir de 10 tumeurs isolées de 10 souris différentes provenant de 3 expériences in vivo indépendantes. |
Les bactéries MC-1 vivantes, chargées d’agents chimiothérapeutiques encapsulés dans des liposomes, et soumises à un guidage magnétique, ciblent le centre des tumeurs. Cette stratégie représente donc un potentiel clinique significatif. La biosécurité de ces bactéries a été vérifiée dans des essais de cytoxicité chez des souris et des rats, et cette procédure s’est révélée sans danger.
En se fondant sur cette technologie, outre les agents de chimiothérapie conventionnels, d’autres composés, tels des radiosensibilisateurs pourraient donc être délivrés au centre des tumeurs. La combinaison du guidage magnétotactique, qui dépend d’un faible champ magnétique avec la capacité motrice intrinsèque des bactéries MC-1, permet donc de cibler des tumeurs internes de divers organes du corps humain, à la différence des nanoparticules magnétiques ou des transporteurs actuellement utilisés dans la lutte contre le cancer. Ces bactéries possèdent des détecteurs de gradients d’oxygène couplés à un système de propulsion hydrodynamique efficace dans le milieu tumoral permettant à la bactérie de se diriger selon son environnement, le tout enrobé dans un volume de moins de 2 mm. Ces bactéries ont la capacité d’être magnétiquement guidées par une source externe. Elles sont donc des émules de nanorobots médicaux artificiels ou de transporteurs, qui présenteront des caractéristiques et des fonctionnalités bien supérieures à la faisabilité technique actuelle. Les possibilités de modifications génétiques de ces bactéries [8, 9] et le développement de meilleurs algorithmes de guidage magnétotactique devraient permettre d’améliorer leur index thérapeutique. Ces données publiées dans la revue Nature Nanotechnology [6, 10], renforcent donc non seulement les concepts d’ingénierie et d’interventions médicales, mais elles sont le fondement d’opportunités de développement pour de meilleurs traitements thérapeutiques, d’imageries ou de vectorisations à des fins diagnostiques.