| |
| Med Sci (Paris). 34(2): 120–122. doi: 10.1051/medsci/20183402006.Tax : une oncoprotéine virale qui aime les CREB sucrés ! Claudine Pique1,2,3* and Tarik Issad1,2,3** 1Inserm, U1016, Institut Cochin, 22, rue Méchain, 75014Paris, France 2CNRS, UMR8104, Paris, France 3Université Paris Descartes, Sorbonne Paris Cité, Paris, France |
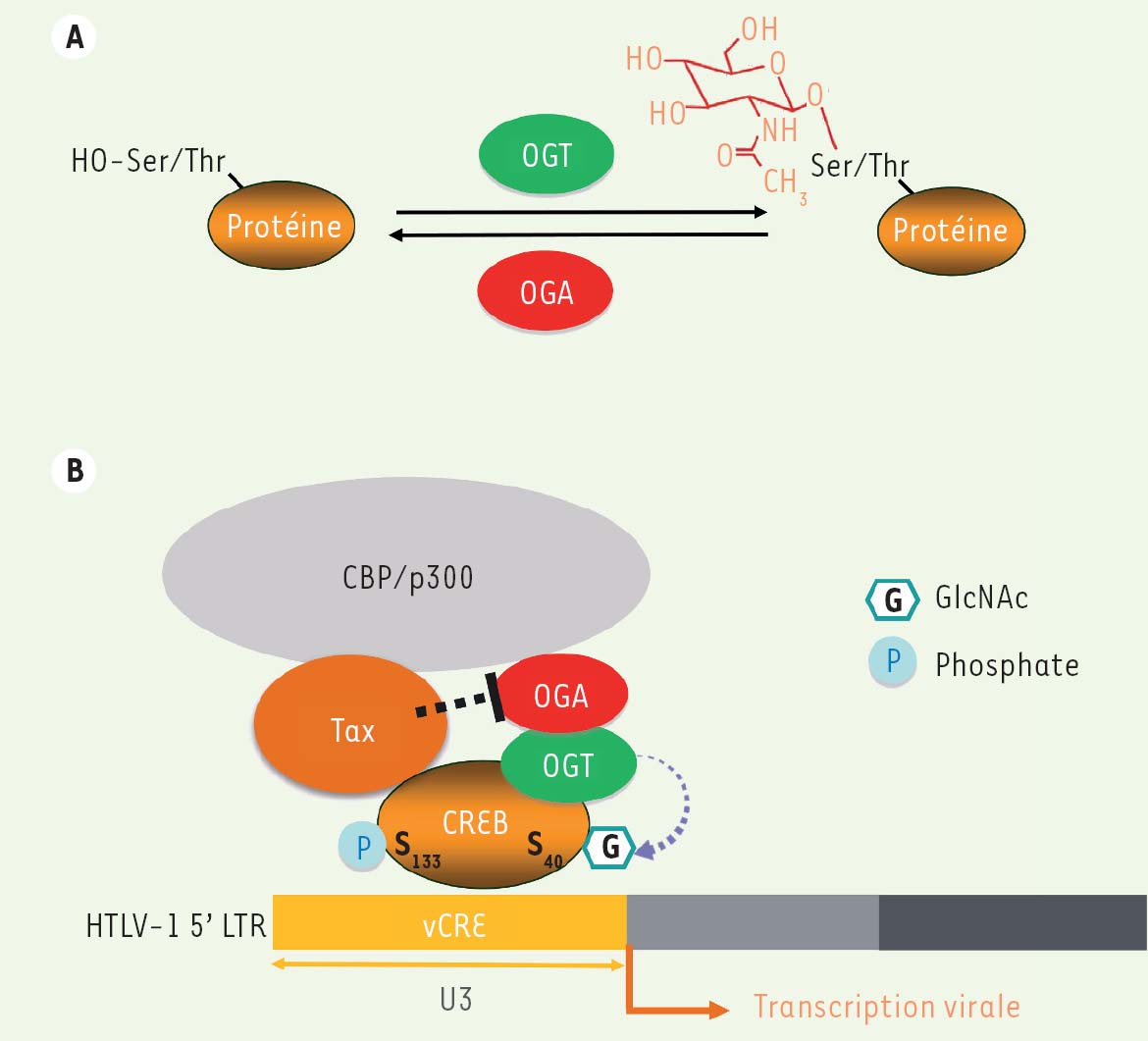
Le virus HTLV-1 (human T-cell lymphotropic virus type 1), agent étiologique de la leucémie à cellules T de l’adulte et de pathologies inflammatoires, est le seul rétrovirus associés à un cancer chez l’homme. On estime à environ 15 millions le nombre de personnes actuellement porteuses du virus HTLV-1 à travers le monde, les principaux foyers étant localisés en Afrique centrale, dans les Caraïbes, en Amérique Centrale et du Sud et au Japon [1]. L’HTLV-1 peut entraîner une lymphoprolifération maligne très agressive touchant les lymphocytes TCD4+, qui se déclare de manière tardive chez des patients ayant généralement été contaminés de nombreuses années avant l’apparition des premiers symptômes [2]. Par sa capacité à perturber de nombreuses voies et machineries cellulaires, l’oncoprotéine virale Tax (transactivator of pX region) joue un rôle majeur dans les processus prolifératifs et anti-apoptotiques associés à la transformation induite par le virus [3]. L’expression du génome viral, ellemême contrôlée par Tax, active le promoteur positionné dans la séquence terminale répétée en 5’ du génome, ou LTR (long terminal repeat 5’), via le recrutement du facteur de transcription CREB (cAMP-response elementbinding protein) (Figure 1). Tax stimule également l’activité transcriptionnelle de CREB, en induisant la phosphorylation de la sérine 133 de la protéine [4]. En terme de modifications post-transcriptionnelles, CREB est également la cible d’une glycosylation particulière, la O-GlcNac glycosylation (ou O-Glc-NAcylation) [5].  | Figure 1 Régulation de la transcription du génome viral par la machinerie de O-GlcNAcylation. A. La O-GlcNAcylation des protéines correspond à l’addition d’une molécule de N-acétylglucosamine sur les résidus sérine ou thréonine des protéines. Uniquement deux enzymes, l’OGT et l’OGA, régulent le niveau de O-GlcNAcylation des protéines. B. Tax trans-active la transcription d’HTLV-1 en recrutant CREB sur les séquences vCRE localisées dans la région U3 (pour unique en 3’) du 5’LTR (long terminal repeat). Des travaux antérieurs avaient montré que Tax stimulait l’activité transcriptionnelle de CREB en facilitant sa phosphorylation sur la Ser133. Nos résultats actuels révèlent que Tax facilite également la O-GlcNAcylation de CREB sur la Ser40 via une inhibition de l’activité OGA au sein du complexe OGT/ OGA, entraînant une stimulation supplémentaire de l’activité transcriptionnelle de CREB sur le promoteur d’HTLV-1. OGT : O-GlcNAc transferase; OGA : O-GlcNAcase; CREB : cAMP-response element-binding protein; vCRE : viral cyclic AMP-response element; CBP: CREB-binding protein. |
|
La O-GlcNAcylation correspond à l’addition enzymatique, sur le résidu hydroxyle d’une sérine ou d’une thréonine, du monosaccharide N-acétyl-Dglucosamine (GlcNAc) (Figure 1) [6]. Cette modification réversible s’accomplit essentiellement dans le cytoplasme et le noyau de la cellule, contrairement aux glycosylations complexes, qui sont réalisées dans le reticulum endoplasmique et l’appareil de Golgi, et concernent surtout des protéines membranaires ou sécrétées. De façon analogue aux phosphorylations, les O-GlcNAcylations cytosoliques ou nucléaires peuvent moduler l’activité, la localisation ou même la stabilité des protéines [6]. À la différence de la pléiade de kinases et de phosphatases qui régulent les phosphorylations, seules deux enzymes sont impliquées dans le contrôle de la O-GlcNAcylation (Figure 1). L’enzyme qui permet la réaction de O-GlcNAcylation est la O-linked N-acetyl-glucosamine transferase (OGT). Les protéines O-GlcNAcylées peuvent être rapidement déglycosylées par une autre enzyme, la β-N-acétylglucosaminidase (OGA). Ces deux enzymes sont présentes dans la cellule sous la forme d’un complexe appelé « O-GlcNAczyme », et la perturbation de l’interaction physique entre OGT et OGA au sein de ce complexe affecte leurs activités régulatrices vis-à-vis des processus transcriptionnels [7]. Des perturbations de la O-GlcNAcylation des protéines ont été impliquées dans un large spectre de maladies, en particulier les cancers [6] (➔). (➔)Voir la Synthèse de T. Issad,m/s n° 8-9, août-septembre 2010, page 753 Lors d’une étude récente [8], nous avons exploré pour la première fois le statut de la O-GlcNAcylation dans les lymphocytes T transformés par le virus HTLV-1. |
La protéine Tax perturbe la machinerie de O-GlcNAcylation de la cellule hôte Nous avons tout d’abord observé que l’expression des ARN messagers et de la protéine OGA était augmentée dans les lignées de lymphocytes T transformés par l’HTLV-1, en comparaison à des lignées T contrôles. Cependant, de façon intéressante, l’activité enzymatique spécifique de l’OGA (activité globale de l’OGA normalisée en fonction de son niveau d’expression) était diminuée dans les cellules T transformées par l’HTLV-1. Ceci suggérait que l’augmentation d’expression de l’OGA pouvait correspondre à un phénomène compensatoire consécutif à une inhibition de son activité (phénomène qui avait déjà été décrit lors de l’inhibition pharmacologique de l’OGA [9]). En revanche, l’expression de l’OGT demeurait similaire dans les cellules contrôles et les cellules T transformées par l’HTLV-1. Nous avons alors montré que l’expression de la protéine Tax dans les cellules de la lignée HEK-293T, ou dans des lymphocytes T transformés par l’HTLV-1 mais dépourvus de Tax, était suffisante pour inhiber l’activité de l’OGA, et pour induire une augmentation globale de la O-GlcNAcylation des protéines sans changement d’activité de l’OGT. À l’aide de la technique de BRET1 [10], nous avons établi que cette inhibition impliquait une interaction directe de Tax avec le O-GlcNAczyme, qui perturbe l’activité de l’OGA dans ce complexe. |
La 0-GlcNAcylation de CREB augmente la transactivation par Tax du LTR 5’ du HTLV-1 Nous avons observé que l’inhibition pharmacologique de l’OGA à l’aide d’une drogue spécifique (thiamet G) augmentait la O-GlcNAcylation de CREB, le recrutement de CREB sur le LTR, et la transactivation de celui-ci par Tax. Ceci suggérait qu’une augmentation de O-GlcNAcylation de CREB pouvait donc favoriser l’expression du génome de l’HTLV-1. Il restait à démontrer que l’expression de Tax induisait une augmentation spécifique de la O-GlcNAcylation de CREB et ainsi de son activité transcriptionnelle. Nous avons en effet mis en évidence que l’expression de Tax dans des cellules de la lignée HEK-293T était suffisante pour induire une augmentation de la O-Glc-NAcylation de la forme sauvage de CREB, mais pas d’une forme de CREB mutée sur la sérine 40 (site de O-GlcNAcylation précédemment identifié sur CREB par d’autres auteurs [5]). En outre, la transactivation du LTR 5’ par Tax était significativement plus faible lorsque les cellules exprimaient la protéine CREB mutée sur son site de O-GlcNAcylation. Ensuite, des expériences d’immunoprécipitation de la chromatine nous ont permis de documenter les recrutements de l’OGT et de l’OGA sur le LTR 5’ de l’HTLV-1, confirmant l’implication du complexe O-GlcNaczyme dans la régulation du génome viral. L’ensemble de ces résultats (Figure 1) révèle une nouvelle activité de l’oncoprotéine Tax au sein de la cellule hôte, à savoir sa capacité à détourner la machinerie de O-GlcNAcylation pour favoriser l’expression du génome viral. Cette nouvelle propriété suggère que la machinerie de O-GlcNAcylation pourrait représenter une nouvelle cible thérapeutique pour le traitement des pathologies associées à l’HTLV-1. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Gessain A, Cassar O. Epidemiological aspects and world distribution of HTLV-1 infection. Front Microbiol. 2012;; 3 : :388.. 2. Nasr R, Marcais A, Hermine O, Bazarbachi A. Overview of targeted therapies for adult T-cell leukemia/ lymphoma. Methods Mol Biol. 2017;; 1582 : :197.-216. 3. Kfoury Y, Nasr R, Journo C, et al. The multifaceted oncoprotein Tax: subcellular localization, posttranslational modifications, and NF-kappaB activation. Adv Cancer Res. 2012;; 113 : :85.-120. 4. Kim YM, Ramirez JA, Mick JE, et al. Molecular characterization of the Tax-containing HTLV-1 enhancer complex reveals a prominent role for CREB phosphorylation in Tax transactivation. J Biol Chem. 2007;; 282 : :18750.-7. 5. Rexach JE, Rogers CJ, Yu SH, et al. Quantification of O-glycosylation stoichiometry and dynamics using resolvable mass tags. Nat Chem Biol. 2010;; 6 : :645.-51. 6. Issad T. O-GlcNAc glycosylation et régulation de la signalisation cellulaire. Med Sci (Paris). 2010;; 26 : :753.-9. 7. Whisenhunt TR, Yang X, Bowe DB, et al. Disrupting the enzyme complex regulating O-GlcNAcylation blocks signaling and development. Glycobiology. 2006;; 16 : :551.-63. 8. Groussaud D, Khair M, Tollenaere AI, et al. Hijacking of the O-GlcNAcZYME complex by the HTLV-1 Tax oncoprotein facilitates viral transcription. PLoS Pathog. 2017;; 13 : e1006518.. 9. Zhang Z, Tan EP, VandenHull NJ, et al. O-GlcNAcase expression is sensitive to changes in O-GlcNAc homeostasis. Front Endocrinol (Lausanne). 2014;; 5 : :206.. 10. Lacasa D, Boute N, Issad T. Interaction of the insulin receptor with the receptor-like protein tyrosine phosphatases PTPalpha and PTPepsilon in living cells. Mol Pharmacol. 2005;; 67 : :1206.-13. |