| |
| Med Sci (Paris). 34(1): 37–40. doi: 10.1051/medsci/20183401011.Manger et dormir Deux objectifs vitaux permettant aux cellules tumorales d'échapper aux traitements anticancéreux Guillaume Wassmer,1* Zohra Hmitti,1 Laurent Voisin,2 and Jean-Luc Perfettini2 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Unité de radiothérapie moléculaire, Inserm U1030, Université Paris-Sud, Institut Gustave Roussy, 94800Villejuif, France MeSH keywords: Mort cellulaire, Consommation alimentaire, Entose, Humains, Tumeurs, Sommeil, Échec thérapeutique, physiologie, thérapie |
L’actualité scientifique
vue par les étudiants
du Master Biologie Santé,
module physiopathologie
de la signalisation,
Université Paris-Saclay Cette année encore, dans le cadre du module d’enseignement « Physiopathologie de la signalisation » proposé par l’université Paris-sud, les étudiants du Master « Biologie Santé » de l’université Paris- Saclay se sont confrontés à l’écriture scientifique. Ils ont sélectionné 12 articles scientifiques récents dans le domaine de la signalisation cellulaire présentant des résultats originaux, via des approches expérimentales variées, sur des thèmes allant des interactions hôte-pathogène au métabolisme, en passant par la compétition cellulaire et le microbiote. Après un travail préparatoire réalisé avec l’équipe pédagogique, les étudiants, organisés en binômes/trinômes, ont ensuite rédigé, guidés par des chercheurs, une Nouvelle soulignant les résultats majeurs et l’originalité de l’article étudié. Ils ont beaucoup apprécié cette initiation à l’écriture d’articles scientifiques et, comme vous pourrez le lire, se sont investis dans ce travail avec enthousiasme !

Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Olivier Guittet (maître de conférences, université Paris-Sud)
Boris Julien (maître de conférences, université Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
Philippe Robin (maître de conférences, université Paris-Sud)
karim.benihoud@u-psud.fr
Série coordonnée par Laure Coulombel. Malgré les avancées majeures réalisées en cancérologie (avec notamment l’utilisation de l’immunothérapie en clinique), la compréhension des mécanismes biologiques impliqués dans la résistance des cellules tumorales aux traitements représente toujours un enjeu central dans la lutte contre le cancer. La dormance cellulaire a récemment été proposée comme pouvant être l’un des processus biologiques impliqués dans la rechute des patients observée à la suite des traitements anticancéreux [1]. La majorité des traitements anticancéreux conventionnels (comme la chimiothérapie et la radiothérapie) visent à éliminer les cellules tumorales en ciblant préférentiellement les cellules à forte activité mitotique. Il a ainsi été proposé que des cellules cancéreuses dont l’activité mitotique est plus faible, les « cellules dormantes », seraient moins sensibles aux thérapies anticancéreuses et pourraient, à la suite de leur « réveil », être à l’origine de l’échappement des tumeurs aux traitements et de la rechute tumorale. Le cannibalisme cellulaire est une nouvelle forme de mort cellulaire au cours de laquelle une cellule vivante « mange » une autre cellule vivante et l’élimine après l’avoir internalisée [2, 3] ; ce processus biologique a récemment été identifié comme pouvant conduire à la dormance cellulaire [4]. |
Les cellules cancéreuses mangent les cellules mésenchymateuses stromales Afin d’apprécier les interactions entre des cellules cancéreuses mammaires connues pour être douées d’activités cannibales [5] et des cellules mésenchymateuses obtenues à partir du stroma de la moelle osseuse [4], T.J. Bartosh et ses collaborateurs (Texas A&M College of Medicine, Temple, Texas, États-Unis) ont observé, au cours d’expériences de culture cellulaire en trois dimensions, la capacité des cellules mésenchymateuses à interagir avec les cellules cancéreuses, à s’organiser avec ces dernières sous la forme de sphéroïdes et à finalement être « mangées » par les cellules cancéreuses. Lors de ces expériences, les auteurs soulignent la capacité des cellules cancéreuses à internaliser des cellules mésenchymateuses vivantes et à les éliminer selon un processus de mort cellulaire atypique. Bien que mal caractérisé et peu étudié, ce processus biologique létal participe à l’émergence d’un nouveau type de mort cellulaire, la mort cellulaire de type IV [6]. Contrairement aux morts cellulaires qui s’exécutent de façon autonome, telles que l’apoptose (type I), la mort cellulaire autophagique (type II) et la mort cellulaire nécrotique (type III), la mort cellulaire de type IV survient de façon non autonome et nécessite l’interaction entre deux cellules vivantes. Un certain nombre de morts cellulaires définies précédemment comme atypiques car elles ne présentent que partiellement (ou pas) les caractéristiques morphologiques et biochimiques des morts cellulaires typiques, sont regroupées actuellement dans ce groupe des morts cellulaires de type IV. Il s’agit notamment du cas de l’entose [3], l’empéripolèse [7], l’empériptose [8] et la phagoptose [9]. |
Le cannibalisme cellulaire réduit la progression tumorale Les auteurs ont voulu caractériser le devenir des cellules cannibales : ils ont observé, lors d’expériences in vitro, une diminution transitoire de la prolifération des cellules cancéreuses à la suite de la consommation de cellules mésenchymateuses [4], révélant l’impact possible du cannibalisme cellulaire des cellules cancéreuses sur la capacité de ces cellules à proliférer et à former des tumeurs. Afin d’éprouver cette hypothèse de travail, ils ont analysé l’influence du cannibalisme des cellules cancéreuses sur la croissance tumorale in vivo. L’implantation de cellules cancéreuses cannibales humaines chez des souris immunodéficientes aboutissait à une réduction de la prise et de la taille des tumeurs xénogreffées comparativement à l’implantation de cellules cancéreuses non cannibales [4]. Ces résultats soulignent donc la capacité du cannibalisme des cellules cancéreuses à engager le processus de dormance cellulaire et à réduire la croissance tumorale in vivo. |
Le cannibalisme cellulaire confère aux cellules cancéreuses une grande résistance aux stress environnementaux Sachant que le processus de dormance cellulaire pouvait conférer aux cellules cancéreuses la capacité de résister à des stress émanant du microenvironnement tumoral (comme la privation de nutriments cellulaires) [10], Bartosh et ses collaborateurs ont apprécié l’influence du cannibalisme cellulaire sur la survie de cellules cancéreuses cultivées dans un milieu pauvre en sérum [4]. L’étude de l’apparition de marqueurs apoptotiques (tels que l’exposition sur le feuillet externe de la membrane plasmique des phosphatidylsérines) a révélé une diminution significative du nombre d’évènements apoptotiques détectés sur des cellules cancéreuses mélangées avec des cellules stromales mésenchymateuses par rapport à des cellules cancéreuses cultivées seules [4]. L’ensemble de ces travaux suggèrent que la survenue du cannibalisme cellulaire pourrait contribuer, via l’acquisition des composants de la cellule ingérée et dégradée par les cellules cannibales, à augmenter la résistance des cellules cancéreuses dormantes aux stress environnementaux. |
Le cannibalisme cellulaire modifie le phénotype des cellules cancéreuses Afin de définir les conséquences biologiques associées au déclenchement du cannibalisme cellulaire, les chercheurs ont déterminé la capacité des cellules cancéreuses cannibales à exprimer des marqueurs, d’une part, de la transition épithélio-mésenchymateuse (TEM), et, d’autre part, de cellules souches cancéreuses, deux processus biologiques associés à la progression tumorale et la récidive du cancer [11-13]. Bien que l’expression de facteurs de transcription (tels que TWIST1, ou SNAIL) et de récepteurs membranaires (comme CD44 et CD1662,) connus pour être respectivement associés à la TEM et aux cellules souches cancéreuses, soit augmentée de façon significative à la suite du cannibalisme cellulaire, l’analyse de l’ensemble des marqueurs associés à ces deux processus ne révèle pas de modifications sensibles des cellules cancéreuses « cannibales ». Dans le but de mieux comprendre les mécanismes moléculaires reliant le cannibalisme cellulaire et la dormance des cellules cancéreuses, les auteurs ont analysé le transcriptome des cellules cancéreuses cannibales [4] via l’utilisation de puces à ADN et de PCR quantitatives. Ils ont mis en évidence une augmentation de l’expression de 204 gènes (d’un facteur supérieur à 10 pour 30 d’entre eux). Ces gènes contrôlent l’expression de facteurs biologiques intervenant dans le développement des réponses inflammatoires et immunitaires (tels que les interleukines, les chimiokines et leurs récepteurs). Une modification de l’expression de facteurs participant à la régulation de la mort (tels que la protéine anti-apoptotique IFI6 [pour interferon alpha inducible protein 6]) ou à la suppression de la croissance tumorale (comme le suppresseur de tumeur EGR1 [early growth response protein 1]) a également été observée. De plus, l’augmentation de la sécrétion de cytokines et de chimiokines par les cellules cancéreuses après cannibalisme cellulaire a également été confirmée par ELISA, mais aussi in vivo lors d’expériences de xénogreffes [4]. Le profil de sécrétion de cellules cannibales est semblable à un profil de sécrétion caractéristique de cellules sénescentes, également connu sous le nom de SASP (senescence-associated secretion phenotype) [14-16]. L’ensemble de ces travaux révèlent pour la première fois l’existence d’une signature moléculaire unique induite à la suite du cannibalisme cellulaire et qui associe des facteurs de survie, des suppresseurs de tumeurs et des médiateurs de l’inflammation. |
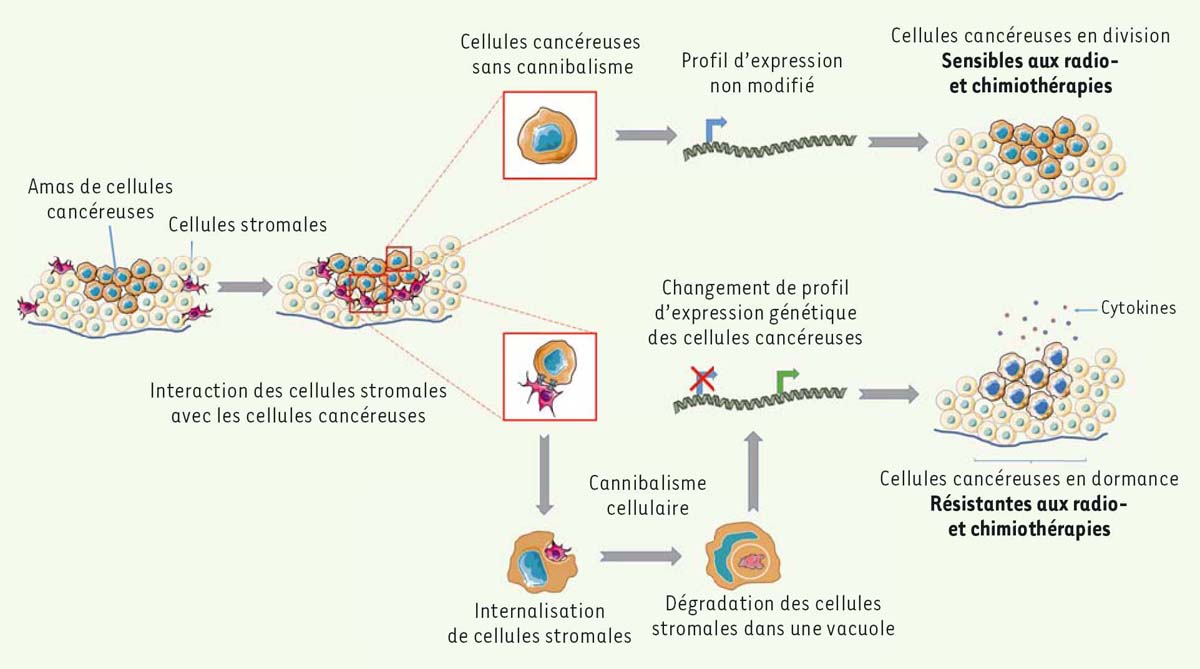
Conclusion et perspectives À la suite du développement d’un modèle cellulaire visant à étudier les conséquences de la dissémination de cellules cancéreuses mammaires au niveau des os [5] ou du recrutement de cellules mésenchymateuses au niveau de tumeurs primaires [4], l’équipe de T.J. Bartosh a révélé la capacité de cellules tumorales mammaires à internaliser des cellules mésenchymateuses issues de la moelle osseuse et à les éliminer selon un processus de cannibalisme cellulaire. Il faut rapprocher de ces travaux de recherche ceux révélant le rôle du cannibalisme cellulaire dans la compétition des cellules cancéreuses pour coloniser une niche tumorale [17]. Au cours du travail présenté ici, les auteurs suggèrent que le cannibalisme des cellules cancéreuses pourrait être un facteur d’agressivité tumorale en favorisant la dormance des cellules cancéreuses (Figure 1). Cependant, étant donné la grande hétérogénéité cellulaire et génétique des tumeurs, il semble intéressant de déterminer si le cannibalisme cellulaire aboutit systématiquement à la dormance des cellules cancéreuses et à la progression tumorale, ou, au contraire, pourrait participer à la suppression des tumeurs. Il paraît également important de déterminer si ce processus biologique peut être déclenché dans toutes les cellules cancéreuses et indépendamment du contexte tumoral, et s’il peut être augmenté ou réprimé dans certaines situations physiopathologiques. L’influence des traitements anticancéreux sur la survenue de ce processus biologique doit également être explorée. La caractérisation des bases moléculaires et cellulaires impliquées dans le déclenchement et l’exécution du cannibalisme cellulaire nous paraît être désormais une étape indispensable à franchir afin de mieux définir les processus de mort cellulaire de type IV [5]. L’influence des modifications du transcriptome des cellules cancéreuses détectées à la suite du cannibalisme cellulaire mérite également une attention particulière. En effet, il est indispensable de caractériser les voies de signalisation cellulaire impliquées dans le contrôle de la mort, l’activité suppressive de tumeurs et la capacité des cellules cannibales à induire une réponse inflammatoire. Une meilleure compréhension de ces processus biologiques associés au cannibalisme cellulaire devrait sans aucun doute aider à identifier de nouvelles cibles thérapeutiques dont la modulation biologique pourrait permettre d’augmenter l’efficacité des chimioet radiothérapies actuelles et de réduire le risque de rechute clinique.  | Figure 1. Le cannibalisme cellulaire contribue à la dormance et à la résistance des cellules cancéreuses aux chimio-et radiothérapies. Au sein d’une masse tumorale, l’interaction entre les cellules cancéreuses et les cellules du stroma tumoral (telles que les cellules mésenchymateuses stromales) peut aboutir à l’internalisation des cellules mésenchymateuses stromales par les cellules cancéreuses. Ce processus biologique également connu sous le nom de cannibalisme cellulaire cause l’élimination des cellules internalisées et aboutit à la dormance des cellules cannibales, un processus biologique impliqué dans la résistance des cellules cancéreuses aux traitements du cancer telles que la chimiothérapie et la radiothérapie. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Ghajar CM. Metastasis prevention by targeting the dormant niche . Nat Rev Cancer. 2015;; 15 : :238.-47. 2. Sharma N, Dey P. Cell cannibalism and cancer . Diagn Cytopathol. 2011;; 39 : :229.-33. 3. Overholtzer M, Mailleux AA, Mouneimne G, et al. . A nonapoptotic cell death process, entosis, that occurs by cell-in-cell invasion . Cell. 2007;; 131 : :966.-79. 4. Bartosh TJ, Ullah M, Zeitouni S, et al. . Cancer cells enter dormancy after cannibalizing mesenchymal stem/stromal cells (MSCs) . Proc Natl Acad Sci USA. 2016;; 113 : :6447.-56. 5. Walker ND, Patel J, Munoz JL, et al. . The bone marrow niche in support of breast cancer dormancy . Cancer Lett. 2016;; 380 : :263.-71. 6. Martins I, Raza SQ, Voisin L, et al. . Entosis: the emerging face of non-cell-autonomous type IV programmed death . Biomed J. 2017;; 40 : :133.-40. 7. Burns ER. Tumor cell-tumor cell emperipolesis . Exp Cell Res. 1967;; 48 : :229.-31. 8. Wang S, He MF, Chen YH, et al. . Rapid reuptake of granzyme B leads to emperitosis: an apoptotic cell-in-cell death of immune killer cells inside tumor cells . Cell Death Dis. 2013;; 4 : :e856. 9. Brown GC, Neher JJ. Eaten alive! Cell death by primary phagocytosis: phagoptosis . Trends Biochem Sci. 2012;; 37 : :325.-32. 10. Sharma N, Dey P. Cell Cannibalism . Diagn Cytopathol. 2011;; 39 : :229.-33. 11. Osisami M, Keller ET. Mechanism of metastatic tumor dormancy . J Clin Med. 2013;; 2 : :136.-50. 12. Giancotti FG. Mechanisms governing metastatic dormancy and reactivation . Cell. 2013;; 155 : :750.-64. 13. Mitra A, Mishra L, Li S. EMT, CTCs and CSCs in tumor relapse and drug-resistance . Oncotarget. 2015;; 1 : :10697.-711. 14. Perez-Mancera PA, Young AR, Narita M. Inside and out: the activities of senescence in cancer . Nat Rev Cancer. 2014;; 14 : :547.-58. 15. Coppé JP. The senescence-associated secretory phenotype: the dark side of tumor suppression . Annu Rev Pathol. 2010;; 5 : :99.-118. 16. Rodier F, Campisi J. Four faces of cellular senescence . J Cell Biol. 2011;; 192 : :547.-56. 17. Kroemer G, Perfettini JL. Entosis, a key player in cancer cell competition . Cell Res. 2014;; 24 : :1280.-1. |