Où suis-je ? Où est-ce ? Et comment y arrive-t-on ? En visite dans un endroit peu familier, vous vous êtes souvent posé consciemment ces questions; votre cerveau y répond toutefois quotidiennement sans que vous y prêtiez garde. Se repérer dans l’espace fait partie des capacités partagées par de nombreuses espèces et qui sont cruciales pour notre survie. S’il est aisé de se déplacer vers un but visible (par exemple, marcher jusqu’au bout du couloir), dès lors qu’il faut se déplacer vers un but invisible (comme par exemple, se rendre à un autre point de la ville), une navigation efficace doit reposer sur des processus complexes qui nous permettent, d’une part, de forger un schéma interne de notre environnement et, d’autre part, d’y représenter nos déplacements passés et futurs. Toutefois, en l’absence de boussole interne dont sont équipées certaines espèces migratoires, et du GPS dont sont pourvus nos téléphones et nos voitures, c’est un ensemble important de zones cérébrales qui effectuent ces calculs complexes et guident nos déplacements. Parmi ces aires cérébrales, on compte l’hippocampe, les cortex entorhinal et parahippocampique, et le cortex pariétal [1, 2]. Ces aires cérébrales sont mutuellement reliées en réseau, et chacune résoud, de manière complémentaire aux autres, un des éléments nécessaires à la navigation. Les patients qui souffrent de lésions de l’une ou l’autre de ces aires cérébrales présentent ainsi des désorientations topographiques sévères, prouvant l’implication de ces aires dans l’orientation spatiale [3, 4]. Il est connu que la maladie d’Alzheimer, qui touche en particulier l’hippocampe et le cortex entorhinal, s’accompagne d’une grande désorientation spatiale ainsi que de troubles de la mémoire [5, 6]. La question qui nous intéresse ici est de comprendre précisément les mécanismes par lesquels les neurones de ces aires cérébrales nous permettent de nous orienter efficacement dans l’environnement.
Depuis plusieurs années, on en sait un peu plus grâce à de nombreuses études menées chez le rongeur [7-9] (➔)
(➔) Voir la Nouvelle de S. Trouche et D. Dupret, m/s n° 3, mars 2017, page 349
À l’aide d’électrodes placées dans l’hippocampe de rats, de nombreux chercheurs ont en effet étudié les variations de l’activité électrique en fonction de divers corrélats comportementaux pendant que l’animal se déplace dans un petit environnement. Ces études ont ainsi permis d’identifier certains neurones spécifiques, appelés cellules de lieu, comme étant des acteurs majeurs du système permettant la navigation.
Ces cellules augmentent leur activité électrique lorsque le rat est à un endroit particulier de l’environnement. Chaque cellule a ainsi un endroit préféré, différent de celui d’une autre cellule. L’environnement se trouve donc représenté par un ensemble de cellules qui sont activées en fonction des différents endroits visités par l’animal. Ces résultats ont fait l’objet de l’attribution du prix Nobel à leurs découvreurs, John O’Keefe, May-Britt Moser et Edvard Moser (en 2014) [10] (➔)
(➔) Voir le Repère (Nobel) de L. Rondi-Reig, m/s n° 2, février 2015, page 203
Ce prix témoigne de l’importance de la compréhension des mécanismes cellulaires ayant lieu dans les zones cérébrales essentielles à la mémoire et altérées, entre autres, par la maladie d’Alzheimer. Peut-on, toutefois, transposer directement ces résultats au primate et à l’homme ? Le rat et le primate ont des systèmes sensoriels très différents. Par exemple, contrairement au rat, le primate a une acuité visuelle très fine et une vision binoculaire en relief, grâce à des yeux placés frontalement sur le visage [11]. Inversement, le rat a une acuité visuelle médiocre mais un champ visuel très étendu (de 270 degrés environ), grâce à des yeux placés sur le côté de la tête. Ces différences ont des répereussions comportementales : le singe, ou l’homme, peut explorer une scène visuelle du regard, en gardant le corps immobile, alors que le rat ne voit que très faiblement à distance et doit donc se déplacer pour explorer son environnement. Le rat se fie énormément aux indices olfactifs et tactiles (grâce à ses vibrisses ou « moustaches ») présents dans l’environnement, alors que ces modalités sensorielles sont peu exploitées par le primate pour se repérer spatialement. Du fait de l’ensemble de ces différences qui font que pour le primate l’exploration visuelle est primordiale, peut-on s’attendre à trouver, chez le primate, des cellules de lieu semblables à celle du rat ? Très peu d’études avaient jusqu’à présent tenté de répondre à cette question et leurs résultats étaient contradictoires, pointant soit un codage positionnel similaire à celui décrit chez rat [12], soit un codage des éléments visuels de l’environnement qui n’est pas observé chez le rongeur [13].
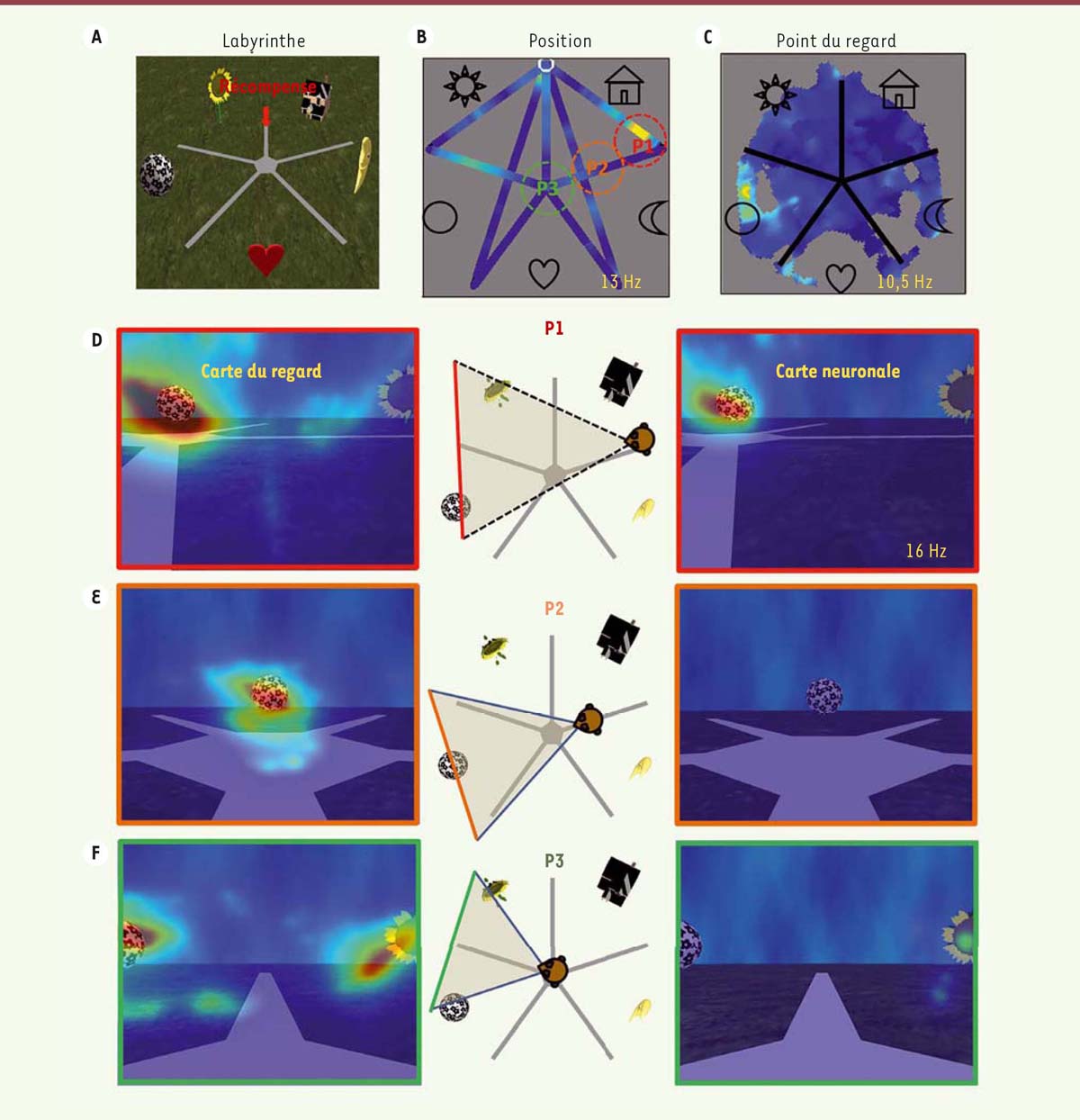
Pour résoudre cette controverse, nous avons caractérisé la nature de l’activité de cellules de l’hippocampe chez des singes (macaques rhésus, macaca mulatta) qui se déplacent dans un environnement virtuel, afin de localiser un but [14]. Les environnements virtuels permettent de tester la nature des représentations spatiales de manière contrôlée tout en mesurant les mouvements des yeux et l’activité du cerveau. Nous avons ainsi entraîné deux macaques rhésus à se déplacer dans un large labyrinthe simplifié, en forme d’étoile à cinq branches, grâce à une manette ou joystick. L’animal était placé en face d’un grand écran sur lequel la scène visuelle était présentée en trois dimensions grâce à des lunettes spéciales afin de faciliter l’immersion et la perception de mouvement propre. L’environnement présentait cinq repères visuels qui pouvaient être utilisés pour localiser la position d’une récompense invisible cachée à l’extrémité d’un des bras du labyrinthe, entre deux repères (Figure 1A). Ainsi, durant les séances d’enregistrement, les animaux se déplaçaient en manipulant le joystick d’un point à l’autre du labyrinthe afin de récolter des récompenses sous la forme de jus de fruit. Pour gagner à ce jeu, ils devaient mémoriser la position de la récompense et savoir y retourner, depuis différents points de départ. Pendant qu’ils réalisaient la tâche, nous avons enregistré l’activité électrique de cellules au sein de l’hippocampe. Nous avons pris en compte plusieurs variables pour analyser l’activité neuronale, comme la position de l’animal dans l’environnement, l’orientation de sa tête, et surtout la cible de son regard, c’est-à-dire ce que l’animal examine du regard dans la scène visuelle. Nos résultats montrent que de nombreuses cellules présentent une activité modulée par la position de l’animal dans l’environnement (77 cellules sur 189) tout comme la cellule dont l’activité est indiquée en fonction de la position de l’animal dans la Figure 1B. Cette cellule présente une forte activité lorsque l’animal se trouve sur une portion du segment nommé P1 sur la Figure 1. Toutefois, une mesure de l’activité, en fonction du point de regard, permet de mettre en évidence que la majorité de ces cellules (57 %) présentent une activité modulée par ce que l’animal regarde dans l’environnement. C’est le cas de la cellule présentée en Figure 1B, dont l’activité, en fonction du point de regard, est représentée en Figure 1C. Celle-ci est active lorsque l’animal regarde le repère en forme de ballon. Une analyse précise de l’activité des cellules montre que celles-ci allient position et vue d’un repère. Ceci est illustré dans les Figures 1D, E et F qui révèlent une forte activité neuronale lorsque l’animal regarde le ballon depuis la position 1, mais pas s’il se trouve en position 2 ou 3.
| Figure 1. Le codage neuronal de l’espace révélé par la réalité virtuelle chez le singe. A. Vue du haut du labyrinthe. La récompense est placée à l’extrémité du chemin situé entre deux repères (représentés par la fleur et la maison). B. Carte d’activité d’un neurone en fonction de la position de l’animal dans l’environnement. La cellule est active lorsque l’animal est dans la position P1 entourée en rouge. C. Carte d’activité de la même cellule qu’en B, mais en fonction de la position du regard. La cellule est active lorsque l’animal dirige son regard vers le repère en forme de ballon. D. Panneau de gauche : carte de densité de regard superposée sur la vue qu’a l’animal depuis la position P1 schématisée sur le panneau du milieu. À droite, densité de l’activité neuronale en fonction de la position du regard. La cellule s’active alors que l’animal regarde le ballon. E, F. Mêmes conventions que pour le panneau D, mais depuis les positions P2 et P3. L’animal regarde le ballon, mais la cellule ne présente pas d’activité. Le cas échéant, l’activité maximale du neurone dans la carte est mentionnée en potentiel d’action par seconde (Hz). |
L’emploi d’une tâche nécessitant une navigation nous a permis, par ailleurs, de mettre en évidence que l’hippocampe code une combinaison de variables de vue, de position et d’informations liées à la tâche. Certaines cellules n’étaient actives que lorsque l’animal prenait une trajectoire particulière vers le but. Ainsi, une représentation d’état, un concept emprunté aux champs de l’automatique et de la robotique, permet de décrire au mieux la population des cellules [14]. La représentation d’état différencie chaque trajectoire dans le labyrinthe. Elle montre que les cellules peuvent discriminer des segments communs à plusieurs trajectoires même lorsque la vue et la position au sein du labyrinthe sont identiques. Ce résultat suggère que les cellules codent de l’information cognitive qui reflète la progression sur une trajectoire de l’animal vers le but, plutôt qu’uniquement une vue ou une position. Il semble ainsi que les neurones de l’hippocampe, chez le singe, présentent des différences et des similarités avec le codage décrit chez le rongeur. Chez le singe, l’information codée n’est pas seulement la position de l’animal, mais également, au moins, une combinaison de ce que l’animal regarde et de sa position par rapport à ce qu’il regarde, puisque l’information de position est ancrée sur ce que l’animal fixe du regard. Des éléments contextuels de plus haut niveau, liés au parcours effectué ou à effectuer, sont également codés, faisant de ces « représentations », plutôt un support à la construction d’une trajectoire orientée vers un but.