| |
| Med Sci (Paris). 34(1): 17–20. doi: 10.1051/medsci/20183401005.La plasticité axonale révélée par l'imagerie super-résolution STED Ronan Chéreau,1,2,3 Julie Angibaud,1,2 and U. Valentin Nägerl1,2* 1Département des sciences de la vie, université de Bordeaux, 33077Bordeaux, France. 2Institut interdisciplinaire de neurosciences, CNRS UMR 5297, 146, rue Léo Saignat, 33077BordeauxFrance 3Département des neurosciences fondamentales, université de Genève, Genève, Suisse MeSH keywords: Potentiels d'action, Axones, Microscopie de fluorescence, Plasticité neuronale, Transmission synaptique, physiologie, instrumentation, méthodes |
Le cerveau des mammifères possède une organisation anatomique unique de complexité et de dynamisme, reflétant une grande capacité de traitement et de stockage d’information. À l’échelle microscopique, cela se traduit par des modifications incessantes touchant les milliards de connexions synaptiques des neurones qui le composent. Durant ces dernières décennies, l’imagerie photonique à fluorescence s’est imposée comme une méthode de choix pour étudier la dynamique morphologique des neurones. En effet, le marquage des neurones par des molécules fluorescentes, ou des fluorophores, comme la GFP (green fluorescent protein) dans des tissus vivants (ex vivo) ou directement dans le cerveau intact (in vivo), a permis de visualiser un remodelage des connexions synaptiques lié à une activité, à une nouvelle expérience, ou à un apprentissage [1, 2]. Les remodelages observés se traduisent par l’apparition et la disparition de connexions synaptiques, mais également par le changement de taille des éléments synaptiques, qui est corrélé avec une modification de la force synaptique de connexions existantes. Les microscopes confocaux ou à 2-photons sont les seuls à avoir un pouvoir résolutif suffisant pour observer la dynamique des éléments synaptiques, comme les boutons présynaptiques ou les épines postsynaptiques, qui ont une taille de l’ordre du micromètre. Ces microscopies ne permettent cependant pas d’étudier la dynamique morphologique d’éléments encore plus fins, tels que le cou des épines dendritiques (ou spine neck, en anglais) ou les axones, dont les diamètres peuvent atteindre 70 à 80 nanomètres. Grâce à la technologie STED (stimulated emission depletion), il est désormais possible d’observer la dynamique structurelle des neurones et de leurs compartiments les plus fins, et d’établir de nouvelles corrélations entre l’activité neuronale et les modifications morphologiques. |
La microscopie STED sur tissu vivant Pour comprendre comment fonctionne un microscope STED, il est important de rappeler quelques notions concernant la fluorescence. Le processus de fluorescence repose sur l’absorption d’un photon émis à une certaine longueur d’onde par le fluorophore, transférant un de ses électrons dans un état énergétique plus élevé, dit « excité ». La molécule retrouve son état fondamental par l’émission spontanée d’un photon, de longueur d’onde différente de celle de l’excitation (Figure 1A). La microscopie photonique conventionnelle, de type confocale ou 2-photons, utilise un laser pour exciter les molécules fluorescentes. Ce laser d’excitation est focalisé en un point de l’échantillon. En balayant ce point d’excitation et en récoltant l’intensité de fluorescence à chaque position par « laser-scanning », on peut ainsi créer une image. Comme la focalisation d’une source lumineuse, telle qu’un laser, ne concentre pas les photons en un point infinitésimal, mais plutôt en une tâche, la résolution optique d’un tel microscope est donc limitée. Cette limite de diffraction de la lumière, décrite par Ernst Abbe en 1873, correspond à environ la moitié de la longueur d’onde d’excitation du laser, et limite la microscopie photonique à une résolution de 250 à 350 nanomètres. La microscopie STED permet de contourner cette contrainte physique en utilisant une autre propriété intéressante des molécules fluorescentes, l’émission stimulée, qui n’avait pas été exploitée, jusqu’à présent, en imagerie. Dans ce cas, un photon d’une certaine longueur d’onde peut interagir avec le fluorophore dans son état « excité ». Son retour à l’état fondamental induit l’émission d’un photon de longueur d’onde identique. On parle alors de déplétion de la fluorescence (Figure 1A).  | Figure. 1 Figure 1. Principe de la microscopie à super-résolution STED. A. Diagramme de Jablonski expliquant le phénomène de fluorescence. La protéine GFP, (green fluorescent protein) illuminée par un laser de couleur bleue (lumière d’excitation, 485 nm), absorbe l’énergie des photons de cette lumière et atteint un état dit « excité ». Son excitation est transitoire et le retour à l’état fondamental s’accompagne d’une émission de fluorescence de couleur verte (510 nm). La protéine GFP peut également retrouver son état fondamental sans émettre de fluorescence verte. Ce phénomène, appelé émission stimulée, permet d’« éteindre » la fluorescence émise dans le vert en illuminant la protéine GFP excitée par un laser de déplétion (laser de couleur orange, 595 nm). B. Le principe de la microscopie STED est d’illuminer l’échantillon simultanément avec un laser d’excitation et un laser de déplétion. Le laser de déplétion est en forme d’anneau. Ainsi à son centre, les fluorophores présents sont illuminés uniquement par le laser d’excitation et donc émettent de la fluorescence. En revanche, ceux présents en périphérie sont « éteints » par émission stimulée. Cette technique permet d’atteindre une résolution d’environ 50 nm. L’augmentation de l’intensité du laser de déplétion permet de réduire la taille de la zone de fluorescence effective et ainsi, d’améliorer la résolution. C. Image de dendrites de neurones obtenue par microscopie confocale et STED. D. Photographie des composants optiques du microscope à super-résolution STED construit dans notre laboratoire. |
La technologie STED utilise deux lasers pour balayer l’échantillon biologique : un laser d’excitation et un laser dit de « déplétion » formant un anneau au plan focal, qui se superpose au point d’excitation. La fluorescence sera donc émise uniquement au centre de l’anneau, ce qui permet d’obtenir une meilleure résolution. Cette résolution dépend alors de l’intensité de déplétion. Elle devient, en théorie, infinie pour une puissance de laser de déplétion infinie (Figure 1B-C). Pour la description du principe en 1994 [3] puis la démonstration expérimentale du microscope STED en 2000 [4, 5] (➔), son inventeur Stefan W. Hell a reçu le prix Nobel de Chimie en 2014. (➔) Voir le Repère (Nobel) de M. Moreau et P. Cochard, m/s n° 12, décembre 2014, page 1169 Dans notre laboratoire, nous avons repris l’architecture initialement décrite et avons construit un microscope STED adapté à l’imagerie de tissus vivants (Figure 1D) [6]. Un microscope équipé d’un objectif à grande ouverture numérique a servi de base pour cette installation. Afin de réduire le temps effectif d’illumination de l’objet et ainsi préserver l’intégrité du tissu biologique, nous utilisons deux lasers pulsés : un laser d’excitation à une longueur d’onde de 485 nm, et un faisceau de déplétion à 595 nm. Les deux sources de lumière qui se recouvrent totalement sont synchronisées. Un système de scanner permet de diriger les faisceaux sur l’échantillon à travers l’objectif. La fluorescence émise est détectée par une photodiode à haute sensibilité. Les longueurs d’ondes choisies pour l’excitation et la déplétion permettent d’utiliser des fluorophores absorbant dans le vert et le jaune, comme les protéines naturellement fluorescentes GFP, ou YFP (yellow fluorescent protein) ou des colorants organiques (Alexa Fluor 488). |
Un nouveau type de plasticité axonale Dans notre étude, publiée dans le journal PNAS en décembre 2016 [7], nous avons focalisé notre attention sur la dynamique structurelle, chez la souris, des axones de l’hippocampe, une région du cerveau fortement plastique impliquée dans l’apprentissage et la mémorisation. Ces axones fins et nonmyélinisés ont longtemps été considérés comme statiques car conduisant les potentiels d’actions (PA) de manière sûre et invariable (Figure 2A). Cette vision réductrice s’est imposée plutôt par un manque de connaissance, dû à des limitations techniques, que par une démonstration expérimentale. De récentes études ont cependant montré que les boutons présynaptiques, portés par les axones, peuvent apparaître et disparaître en fonction de l’activité du neurone [8]. Les PA, souvent considérés comme stéréotypés, qui se propagent le long des axones, peuvent, par ailleurs, être influencés par la topologie [9] et l’environnement de l’axone [10]. En conséquence, ils peuvent moduler l’intensité de la transmission synaptique. Les axones de l’hippocampe ne peuvent être visualisés par les techniques de microscopie photonique conventionnelle avec une résolution suffisante. L’impact de l’activité neuronale sur les axones n’a donc pas pu être étudié. 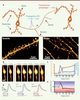 | Figure. 2 Figure 2. Changements morphologiques de l’axone et impact sur la transmission nerveuse. A. Représentation schématique d’une connexion entre neurones montrant la transmission neuronale, et exemples d’images de dendrites et d’axones réalisées en microscopie STED. B. Images STED d’un bouton présynaptique et son axone, avant et après une stimulation électrique à haute fréquence. C. Évolution au cours du temps des changements morphologiques des boutons synaptiques (en bleu) et de l’axone (en orange), avant et après une stimulation à haute fréquence. D. Changements de la latence (Δ de latence) des potentiels d’action (PA) induits par une stimulation à haute fréquence. E. Changements temporels de la latence des PA obtenus par simulation informatique en se fondant sur les résultats morphologiques décrits en STED. |
En combinant l’imagerie STED avec des techniques d’électrophysiologie, nous avons étudié l’effet d’une forte activité neuronale sur la morphologie des axones de l’hippocampe de souris. Pour visualiser la morphologie des axones, nous avons utilisé un vecteur viral permettant de cibler l’expression de la GFP dans une sous-population de neurones. Après 24 à 48 heures d’expression du fluorophore, nous avons pu acquérir des images en super-résolution afin de suivre l’évolution des axones rendus ainsi fluorescents au cours du temps. Nos résultats montrent qu’immédiatement après la stimulation des neurones, les boutons présynaptiques enflent de façon transitoire, le diamètre global des axones s’élargit ensuite de manière graduelle, pendant plusieurs dizaines de minutes (Figure 2B-C). Pour comprendre l’impact de telles modifications morphologiques sur la conduction des PA, nous avons réalisé des simulations informatiques qui ont permis de révéler un effet prononcé de ces modifications sur la vitesse de conduction. En effet, le gonflement des boutons présynaptiques ralentit la vitesse de propagation des PA. Le passage d’un PA dans les boutons nécessite des charges ioniques plus importantes qui correspondent à des augmentations locales de volume le long de l’axone. Un élargissement des boutons nécessite plus de charges et, également, un temps de dépolarisation accru qui se traduit par un ralentissement de la vitesse de propagation du PA. Au contraire, lorsque l’on augmente le diamètre de l’axone de manière uniforme, la propagation des PA est accélérée. Dans ce cas, un axone élargi sur sa longueur a une plus faible résistance interne, ce qui va faciliter la propagation du PA. Nous avons évalué expérimentalement ces simulations. Pour cela, nous avons mesuré le temps de conduction des PA en stimulant électriquement l’axone et en mesurant le temps d’arrivée, ou latence du PA, au soma. En concordance avec nos résultats précédents, le temps de latence moyen du PA augmente juste après la stimulation à haute fréquence. Ceci est suivi, environ 10 minutes plus tard, par une diminution soutenue de la latence (Figure 2D-E). |
Dans cette étude, la microscopie STED a permis de montrer, pour la première fois, que les axones non-myélinisés de l’hippocampe peuvent subir d’importants changements morphologiques en fonction de l’activité, qui affectent la vitesse de propagation des PA. Quelles sont les conséquences d’un changement de vitesse de transmission des PA sur un réseau de neurones ? Plusieurs mécanismes connus des réseaux neuronaux de l’hippocampe et du cortex sont sensibles aux variations de rythme de la communication neuronale. Le renforcement ou l’affaiblissement des synapses peut, par exemple, se décider au moment où le PA arrive à la synapse [11]. Dans ce mécanisme, une arrivée du PA à la synapse différée de quelques millisecondes peut induire, de manière permanente, soit une diminution de la force synaptique pouvant conduire à une perte de connexion, soit à un renforcement de la synapse. La microscopie STED nous a ainsi permis de montrer que les axones fins de l’hippocampe sont des structures dynamiques qui peuvent influencer grandement l’activité des réseaux neuronaux. Ce résultat rappelle la régulation du cou des épines dendritiques qui est dépendante de l’activité, mais également compartimente biochimiquement les épines [12]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Engert F, Bonhoeffer T. Dendritic spine changes associated with hippocampal long-term synaptic plasticity . Nature. 1999;; 399 : :66.-70. 2. Holtmaat A, Wilbrecht L, Knott GW, et al. Experiencedependent and cell-type-specific spine growth in the neocortex . Nature. 2006;; 441 : :979.-83. 3. Hell SW, Wichmann J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy . Opt Lett. 1994;; 19 : :780.-2. 4. Klar TA, Jakobs S, Dyba M, et al. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission . Proc Natl Acad Sci USA. 2000;; 97 : :8206.-10. 5. Moreau M, Cochard P. De la microscopie à la nanoscopie : une révolution en résolution . Prix Nobel de Chimie 2014 : Stefan W. Hell, Eric Betzig et William E. Moerner.. Med Sci (Paris). 2014;; 30 : :1169.-76. 6. Tonnesen J, Nadrigny F, Willig KI, et al. Two-color STED microscopy of living synapses using a single laserbeam pair . BiophysJ. 2011;; 101 : :2545.-52. 7. Chereau R, Saraceno GE, Angibaud J, et al. Superresolution imaging reveals activity-dependent plasticity of axon morphology linked to changes in action potential conduction velocity . Proc Natl Acad Sci USA. 2017;; 114 : :1401.-6. 8. Becker N, Wierenga CJ, Fonseca R, et al. LTD induction causes morphological changes of presynaptic boutons and reduces their contacts with spines . Neuron. 2008;; 60 : :590.-7. 9. Sasaki T, Matsuki N, Ikegaya Y. Effects of axonal topology on the somatic modulation of synaptic outputs . J Neurosci. 2012;; 32 : :2868.-76. 10. Sasaki T, Matsuki N, Ikegaya Y. Action-potential modulation during axonal conduction . Science. 2011;; 331 : :599.-601. 11. Markram H, Lubke J, Frotscher M, Sakmann B. Regulation of synaptic efficacy by coincidence of postsynaptic APs and EPSPs . Science. 1997;; 275 : :213.-5. 12. Tonnesen J, Katona G, Rozsa B, Nägerl UV. Spine neck plasticity regulates compartmentalization of synapses . Nat Neurosci. 2014;; 17 : :678.-85. |



