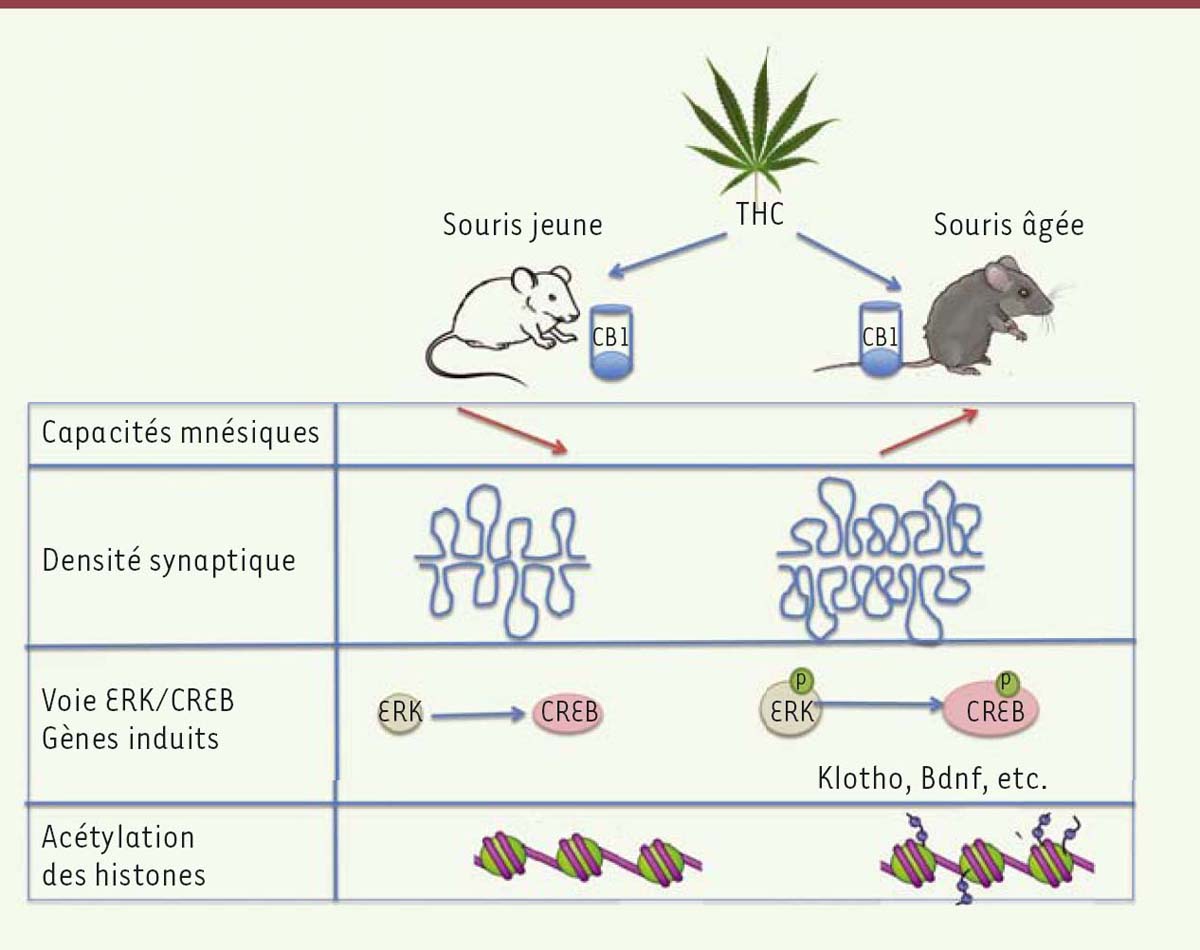
L’activité du système endocannabinoïde, déjà décrite dans ces colonnes [1, 2] (➔) diminue avec l’âge, de même que l’expression du récepteur CB1, qui relaie ses principaux effets. Existe-t-il pour autant un lien direct entre cette baisse d’activité du système endocannabinoïde et la diminution des capacités cognitives associées au vieillissement ? En cherchant à répondre à cette question, une équipe germano-israélienne a obtenu des résultats étonnants [3] permettant de revisiter la chanson de Georges Brassens « le temps ne fait rien à l’affaire » ! Mais revenons à certaines notions préliminaires pour comprendre ce que ces résultats ont de surprenant. Le delta-9-tetrahydrocannabinoid (ou THC) est le principal composant psycho-actif du cannabis. Pour déterminer si une exposition chronique à de faibles doses de THC avait des effets comparables sur les performances de mémorisation, les auteurs ont implanté chez des souris jeunes ou âgées une pompe osmotique délivrant dans l’hippocampe une dose quotidienne de THC à 3 mg/kg ou un substrat neutre servant de contrôle, ceci pendant 28 jours. Ils ont ensuite soumis les souris ainsi traitées au test de la piscine de Morris. Dans ce test de mémorisation spatiale, le rongeur est placé dans un bassin d’eau dans lequel se trouve une plateforme. Il doit apprendre à utiliser des indices spatiaux situés dans la pièce pour naviguer jusqu’à la plateforme. Plus la mémoire de l’animal est affectée, plus il prend du temps à trouver la plateforme. Le traitement par le THC aggrave les capacités cognitives de l’animal âgé de 2 mois. Ce résultat était attendu. En effet, on savait que l’activation du récepteur CB1 par les cannabinoïdes, administrés de façon aiguë chez la souris, entraîne une baisse de la transmission synaptique dans les circuits neuronaux de l’hippocampe et une altération des capacités d’apprentissage et de mémorisation [4]. De plus, des travaux qui ne sont pourtant pas cités dans cet article avaient rapporté un lien entre cannabinoïdes et mémorisation passant par le récepteur CB1 mitochondrial [5, 6] (➔).
(➔) Voir les Nouvelles de L. Venanee et al., m/s n° 1’ janvier 2004, page 45 et de N. Leuleu-Chavain et al.,m/s n° 3, mai 2013, page 523
(➔) Voir la Nouvelle de E. Hebert-Chatelain et G. Marsicano, m/s n° 6-7, juin-juillet 2017, page 579
Cependant, ici, l’administration chronique de THC permet à la souris âgée (12 à 18 mois) de retrouver une capacité de mémorisation comparable à celle de la souris jeune non traitée. Deux autres tests ont été utilisés visant à évaluer les capacités cognitives des animaux par la reconnaissance d’objets ou de partenaires et ont donné des résultats similaires. Pour comprendre les mécanismes responsables de ces effets paradoxaux entre souris jeunes et âgées, les auteurs ont alors étudié en détail l’hippocampe de ces rongeurs tant sur le plan morphologique que sur le profil d’expression de ses gènes. La densité synaptique et l’expression de marqueurs protéiques de la synapse sont diminuées chez la souris âgée et restaurées après traitement par THC. Ce dernier, en revanche, n’a pas d’effet sur l’hippocampe de la souris jeune. Les améliorations cognitives induites par le THC chez la souris âgée sont associées à une modification du profil d’expression, en particulier des gènes impliqués dans la durée de vie comme Klotho -celle des trois Parques qui fabrique et tient le fil sur le fuseau de la vie avant que Lachésis ne le file et qu’Atropos ne le coupe- dont l’invalidation est connue pour entraîner un raccourcissement de la longévité et un vieillissement prématuré chez la souris [7]. Des gènes impliqués dans la plasticité synaptique comme BDNF (brainderived neurotrophic factor) voient également leur niveau d’expression modifié. En revanche, le patron global d’expression de l’hippocampe des souris âgées traitées est très voisin de celui des souris jeunes non traitées. De même, celui de souris jeunes traitées s’apparente à celui des souris âgées non traitées. Il est connu que le THC active la protéine CREB (cAMP response element- binding protein), une protéine qui joue un rôle essentiel dans la mémorisation et participe à l’amélioration des capacités cognitives de la souris âgée exposée à du sang de souris jeunes [8]. Effectivement, seules les souris âgées traitées au THC présentent une augmentation de la phosphorylation de CREB dans l’hippocampe ainsi qu’une acétylation accrue des histones (Figure 1). L’activation de cette protéine stimule la transcription de différents gènes comme BDNF et facilite l’acétylation des histones H3 et H4. Un lien entre l’acétylation des histones et l’amélioration des fonctions cognitives de la souris âgée avait déjà été démontré [9]. Ces nouveaux résultats suggèrent donc que la stimulation chronique et à bas bruit du système endocannabinoïde provoque des modifications épigénétiques susceptibles d’améliorer la mémorisation de la souris âgée. En effet, aucun bénéfice n’est observé après administration chronique de THC chez les souris invalidées pour le récepteur CB1. De plus, l’administration concomitante de THC et d’un inhibiteur de l’acétyl-transférase annule les effets bénéfiques du THC chez la souris âgée, en même temps qu’elle bloque l’induction de Klotho et de Bdnf. Si ces résultats étaient transposables à l’homme, ils pourraient trouver une nouvelle utilisation médicale du cannabis. Commercialisées seulement dans certains pays, les formulations pharmaceutiques du cannabis ont un usage limité aux soins antalgiques, en particulier pour soulager les douleurs neuropathiques de la sclérose en plaques, ou les nausées induites par certaines chimiothérapies. Plus récemment, leur effet neuro-protecteur in vitro sur les plaques amyloïdes observées dans la maladie d’Alzheimer a ouvert de nouvelles pistes [10]. Les résultats rapportés ici permettent d’avancer des arguments scientifiques justifiant de continuer à proscrire le cannabis pour les plus jeunes mais de le proposer désormais aux plus âgés d’entre nous pour améliorer nos performances ! En attendant la recherche de substances dérivées du cannabis qui récapituleraient les effets bénéfiques du THC mais seraient plus sélectifs, pour éviter ses effets secondaires, et pour plagier la chanson sus-citée « Moi qui balance entre deux âges… », je ne refuserais pas une petite cure de jouvence…
| Figure. 1 Figure 1. Effets comparatifs du cannabis chez les souris en fonction de l’âge. Effet paradoxal du THC (delta-9-tetrahydrocannabinoid), le principe actif du cannabis sur les capacités mnésiques des souris selon qu’elles soient jeunes ou âgées. Ces effets passent par le récepteur CB1 (récepteur cannabinoïde de type 1). Seules les souris âgées voient leur densité synaptique de l’hippocampe augmenter, ainsi que la phosphorylation des facteurs ERK (extracellular signalregulated kinase) et CREB (cAMP response element-binding protein), et le niveau d’acétylation des histones. Bdnf : brain-derived neurotrophic factor. |