| |
| Med Sci (Paris). 34(1): 12–14. doi: 10.1051/medsci/20183401003.La GTPase RhoB, un nouvel acteur de la résistance adaptative aux inhibiteurs de la tyrosine kinase du récepteur de l'EGF dans les cancers du poumon Olivier Calvayrac,1 Anne Pradines,1,2 Julien Mazières,1,3 and Gilles Favre1,2* 1Inserm U1037, centre de recherches en cancérologie de Toulouse, université Paul Sabatier, F-31057, Toulouse, France 2Institut Claudius Regaud, Institut universitaire du cancer-oncopole, F-31057, Toulouse, France 3CHU de Toulouse, Institut universitaire du cancer - Rangueil Larrey, F-31057, Toulouse, France MeSH keywords: Résistance aux médicaments antinéoplasiques, Récepteurs ErbB, Humains, Tumeurs du poumon, Inhibiteurs de protéines kinases, Protein-tyrosine kinases, Carcinome pulmonaire à petites cellules, Protéine G RhoB, physiologie, antagonistes et inhibiteurs, traitement médicamenteux, enzymologie, usage thérapeutique |
Les cancers broncho-pulmonaires, notamment les cancers bronchiques non à petites cellules (CBNPC), sont la principale cause de décès par cancer dans le monde. La survie à 10 ans n’a progressé que de 3,1 % en 1971 à 5 % en 2011, reflétant les faibles progrès obtenus dans le traitement des patients. Ces dix dernières années, les thérapies ciblées ont apporté un avantage notoire aux patients porteurs de mutations activatrices d’oncogènes [1]. Les inhibiteurs de l’activité tyrosine kinase (ou TKI) du récepteur de l’EGF (epidermal growth factor) ou EGFR, tels que l’erlotinib ou le gefitinib, sont ainsi utilisés en première ligne de traitement. Pour les patients porteurs d’une mutation activatrice de l’EGFR dans le domaine tyrosine kinase, telle que L858R (leucine 858 mutée en arginine) ou Del19 (délétion de l’exon 19), qui représentent 10 à 20 % des adénocarcinomes bronchiques [2], des taux de réponses objectives entre 70 et 80 % ont été obtenus. C’est l’un des meilleurs exemples de réussite des thérapies ciblées. Cependant, le traitement par ces inhibiteurs se heurte systématiquement à l’apparition de mécanismes de résistance à l’origine de la rechute des patients après un an en moyenne, limitant ainsi les effets de ces traitements sur la survie globale. Il n’existe, à ce jour, aucun biomarqueur cliniquement validé, permettant de prédire la durée de réponse et d’anticiper la résistance à ce type de thérapie. |
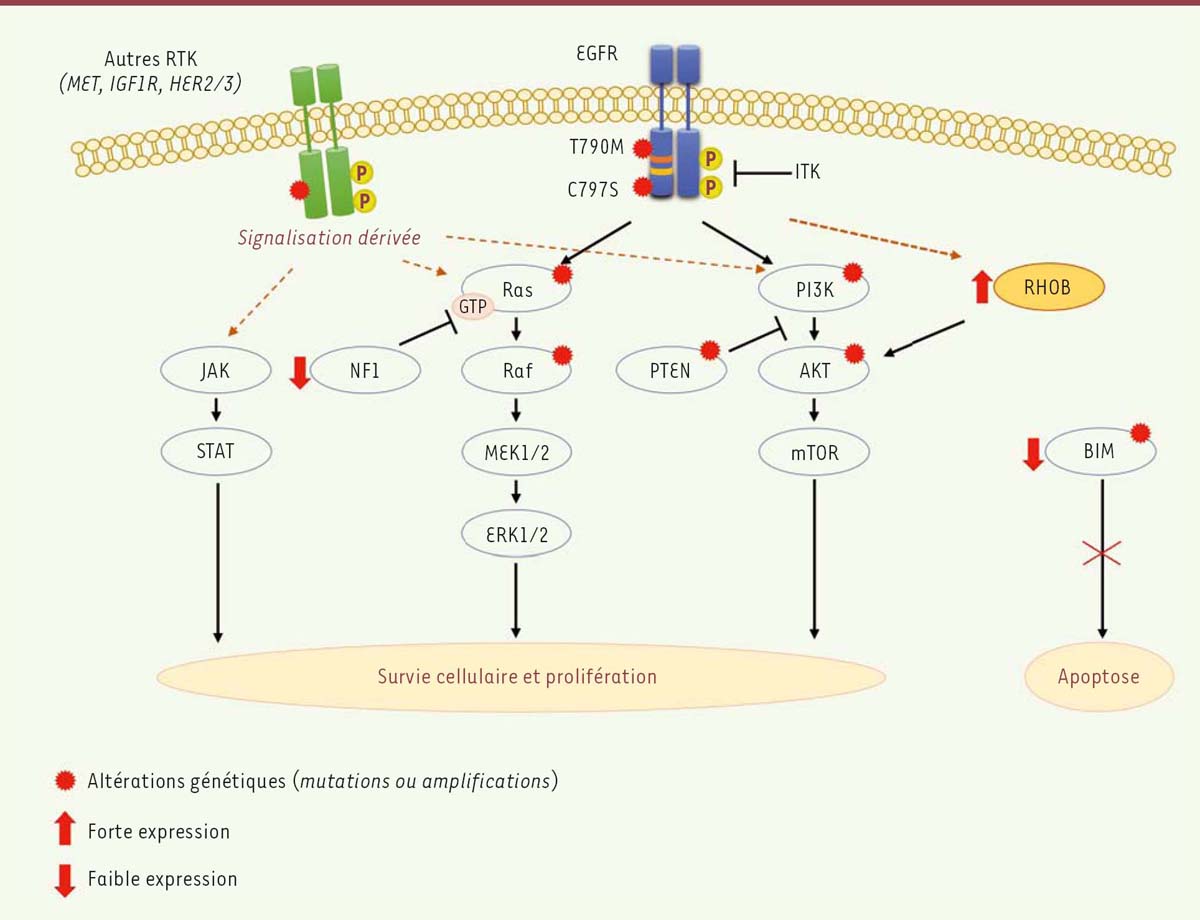
Les mécanismes de résistances aux EGFR-TKI sont multiples et complexes Les mécanismes de résistance aux inhibiteurs de l’activité tyrosine kinase du récepteur de l’EGF (EGFR-TKI) sont pour la plupart identifiés [3]. L’apparition d’une deuxième mutation dans le domaine tyrosine kinase de l’EGFR (T790M, thréonine 790 mutée en méthionine) est ainsi le mécanisme le plus fréquent ; il représente près de 50 % des cas de résistance. Des inhibiteurs actifs sur cette mutation, tels que l’osimertinib, ont été récemment synthétisés et sont déjà utilisés en clinique. Cependant cette nouvelle classe d’inhibiteurs n’échappe pas, elle-même, à l’apparition de nouvelles résistances, reflétant l’extraordinaire capacité des cellules tumorales à s’adapter. Parmi les autres mécanismes de résistance, on peut également citer l’amplification du récepteur tyrosine kinase MET (hepatocyte growth factor receptor) dans environ 5 % des cas, celle du récepteur HER2 (human epidermal growth factor receptor-2) avec une fréquence de 10 à 15 %, ou encore l’acquisition d’un phénotype mésenchymateux (dans 3 à 5 % des cas). Une faible expression de neurofibromine 1 (impliquée dans la neurofibromatose de type 1, NF1), un régulateur négatif de la GTPase Ras, ou une altération (mutations ou perte d’expression) de la protéine pro-apoptotique BIM (Bcl2-like protein), limitent les effets pharmacologiques des EGFR-TKI [4, 5] en maintenant la survie cellulaire (Figure 1). De façon surprenante, une transformation histologique en carcinome bronchique à petites cellules (CBPC) a été observée dans environ 5 % des rechutes.  | Figure 1. Mécanismes de résistance aux EGFR-TKI dans des cellules bronchiques possédant une mutation sensibilisatrice de l’EGFR. Les mécanismes de résistance aux EGFR-TKI comprennent une réactivation de voies de survie telles que MEK/ERK, PI3K/AKT ou JAK/STAT, des altérations génétiques (par mutations ou amplifications), et une reprogrammation transcriptionnelle des cellules. De façon surprenante, la grande majorité de ces altérations (représentée par des étoiles rouges) ne sont détectables qu’au moment de la rechute (comme la mutation secondaire de l’EGFR [Thr 790 mutée en Met] présente dans la moitié des rechutes après un traitement aux EGFR-TKI de première génération, mais absente ou non détectable avant traitement). Chez les patients atteints d’adénocarcinomes pulmonaires avec mutation de l’EGFR, une forte expression de la GTPase RhoB, une faible expression de l’inhibiteur de Ras, NF1 ou encore une altération de la protéine pro-apoptotique BIM (soit par polymorphisme, soit par inhibition d’expression) se sont révélées être de bons indicateurs de rechute précoce chez ces patients. L’ajout d’un inhibiteur de la voie AKT dans le cas d’une forte expression de RhoB ou d’un inhibiteur de la voie des MAPK dans le cas d’une faible expression de NF1 a été proposé pour restaurer la sensibilité des cellules au traitement. Les tyrosines sont symbolisées par des ronds jaunes et les récepteurs membranaires MET (hepatocyte growth factor receptor), IGF1R (insuline growth factor-1 receptor), et Her2/3 (human epidermal growth factor receptor-2/3) sont en vert tandis que l’EGFR est en bleu. AKT : protein kinase B ; BIM : Bcl2-like protein ; ITK : inhibiteur de tyrosine kinase ; JAK/STAT : Janus kinase 2/signal transducer and activator of transcription ; MAPK : mitogen-activated protein kinase ; MEK-ERK : mitogen-activated protein kinase kinase/extracellular signal-regulated kinase ; NF1 : neurofibromine ; RTK : récepteur à activité tyrosine kinase. |
L’origine de ces résistances fait actuellement l’objet de débats qui confrontent deux théories. La première est en faveur de la présence, au sein de la tumeur, de sous-clones résistants qui préexistent et ne sont pas détectés par les techniques actuelles, et qui seraient sélectionnés par le traitement de façon « darwinienne » générant ainsi des tumeurs résistantes. La deuxième stipule que certaines cellules seraient capables de s’adapter au traitement, en favorisant des voies de survie et l’engagement dans un état de quiescence, leur permettant de tolérer la présence de l’inhibiteur, le temps suffisant pour développer des mécanismes de résistance de novo. Ainsi, la voie MEK-ERK (mitogen-activated protein kinase kinas - extracellular signal-regulated kinase) peut être paradoxalement activée en présence d’EGFR-TKI par la perte des rétrocontrôles de la voie elle-même [6]. Cette découverte a conduit à utiliser des combinaisons d’inhibiteurs des kinases MEK et de l’EGFR avec des résultats précliniques prometteurs [6]. Deux articles récents ont montré, in vitro, que ces deux théories sont pertinentes et peuvent coexister au sein d’une même population cellulaire [7, 8]. Aucune information n’est néanmoins, à ce jour, disponible pour vérifier la proportion, ou même l’existence, de chacun de ces phénomènes in vivo. Des études sont encore nécessaires pour comprendre à la fois au niveau moléculaire, mais également chez les patients, ces mécanismes de résistance. |
RhoB, une protéine aux multiples facettes dans les cancers du poumon RhoB est une GTPase monomérique de la superfamille Ras, dont les fonctions cellulaires les plus étudiées sont impliquées dans l’organisation du cytosquelette, l’adhérence cellulaire, l’angiogenèse ou le trafic de l’EGFR [9] (➔). (➔) Voir la Synthèse de M. Primeau et N. Lamarche-Vane, m/s n° 2, février 2008, page 157 Contrairement à ses proches homologues, RhoA et RhoC, RhoB présente des caractéristiques de suppresseur de tumeur, notamment dans les cancers bronchiques. Son expression est inversement corrélée au stade de la maladie, et la perte de son expression est la plupart du temps de mauvais pronostic pour les patients [10]. Un faible taux de RhoB augmente l’agressivité et le potentiel invasif des cellules tumorales in vitro et in vivo, induisant notamment un phénotype mésenchymateux via l’activation de la voie AKT (protein kinase B) [11, 12]. La valeur pronostique de RhoB peut cependant être radicalement opposée dans un contexte thérapeutique, comme le révèle une étude récente de notre laboratoire. Nous avons mis en évidence, chez 96 patients porteurs d’une mutation activatrice de l’EGFR et traités par EGFR-TKI, que la survie sans progression évolue de 5,6 mois chez ceux dont la biopsie révélait une forte expression de RhoB, contre 15,3 mois chez les patients dont la biopsie présentait une faible expression [12]. De plus, sur onze biopsies réalisées au moment de la rechute, huit présentaient une expression de RhoB supérieure à celle observée avant le traitement, confortant le rôle de la GTPase dans la résistance à ce type de thérapeutique. Nous avons montré que RhoB active la voie PI3K(phosphoinositide 3-kinase)/AKT en présence d’EGFR-TKI, et que le traitement concomitant avec un inhibiteur d’AKT (AKTi) restaure la sensibilité des cellules tumorales in vitro, sur des lignées cellulaires tumorales, mais également, in vivo chez la souris [13]. Ces résultats sont en faveur de l’utilisation de la combinaison EGFR-TKI/AKTi pour les patients dont les tumeurs expriment fortement RhoB (Figure 1). Cette étude souligne le rôle complexe de RhoB qui peut soit réprimer, soit activer, la voie AKT selon le contexte cellulaire. En effet, nous avons également montré que la perte d’expression de RhoB dans des lignées cellulaires bronchiques inhibe la protéine phosphatase PP2A, en favorisant la dissociation des sousunités régulatrice et catalytique PP2Ac [11]. La protéine phosphatase ne peut alors plus déphosphoryler AKT qui se maintient sous sa forme active. Dans un contexte de thérapie anti-EGFR, le rôle de la voie RhoB/PP2A dans la modulation de l’activation d’AKT reste toutefois encore à déterminer. |
La lutte contre les rechutes : perspectives Il est maintenant admis que les monothérapies ciblées, même si leur taux de réponse initial est excellent, ne permettent pas la guérison des patients, à cause de l’apparition quasi systématique de résistances. L’une des causes est la réactivation d’au moins une des trois voies majeures induites en aval de l’EGFR : PI3K/AKT, MEK/ERK et JAK/STAT. Il parait ainsi nécessaire d’envisager des combinaisons de thérapies ciblées. Cependant, l’hétérogénéité tumorale et les nombreux rétrocontrôles qu’exercent ces voies de signalisation entre elles rendent difficile leur mise en place. La découverte de biomarqueurs de résistance s’avère donc indispensable. Évaluer le niveau d’expression de RhoB dans la tumeur, avant traitement, est une piste prometteuse pour identifier les patients pouvant bénéficier de la combinaison d’inhibiteurs d’EGFR et d’AKT, afin de limiter l’apparition de rechutes précoces. Des essais cliniques seront nécessaires pour confirmer cette hypothèse. Comprendre comment les cellules tumorales s’adaptent précocement aux thérapies ciblées est un enjeu majeur de la recherche en cancérologie. L’identification des vulnérabilités des cellules résistantes permettra ainsi de proposer des solutions thérapeutiques ciblant ces mécanismes avant même que la résistance ne se développe. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Calvayrac O, Pradines A, Pons E, et al. . Molecular biomarkers for lung adenocarcinoma. Eur Respir J. 2017;; 49. pii: :1601734.. 2. Rosell R, Carcereny E, Gervais R, et al. . Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial . LancetOncol. 2012;; 13 : :239.-46. 3. Cortot AB, Janne PA. Molecular mechanisms of resistance in epidermal growth factor receptor-mutant lung adenocarcinomas. Eur Respir Rev. 2014;; 23 : :356.-66. 4. Faber AC, Corcoran RB, Ebi H, et al. . BIM expression in treatment-naive cancers predicts responsiveness to kinase inhibitors . Cancer Discov. 2011;; 1 : :352.-65. 5. de Bruin EC, Cowell C, Warne PH, et al. . Reduced NF1 expression confers resistance to EGFR inhibition in lung cancer . Cancer Discov. 2014;; 4 : :606.-19. 6. Tricker EM, Xu C, Uddin S, et al. . Combined EGFR/MEK inhibition prevents the emergence of resistance in EGFR-mutant lung cancer . Cancer Discov. 2015;; 5 : :960.-71. 7. Hata AN, Niederst MJ, Archibald HL, et al. . Tumor cells can follow distinct evolutionary paths to become resistant to epidermal growth factor receptor inhibition . Nat Med. 2016;; 22 : :262.-9. 8. Ramirez M, Rajaram S, Steininger RJ, et al. . Diverse drug-resistance mechanisms can emerge from drug-tolerant cancer persister cells. Nat Commun. 2016;; 7 : :10690.. 9. Primeau M, Lamarche-Vane N. Coup d’œil sur les petites GTPases Rho. Med Sci (Paris). 2008;; 24 : :15762.. 10. Mazieres J, Antonia T, Daste G, et al. . Loss of RhoB expression in human lung cancer progression . Clin Cancer Res. 2004;; 10 : :2742.-50. 11. Bousquet E, Calvayrac O, Mazieres J, et al. . RhoB loss induces Rac1-dependent mesenchymal cell invasion in lung cells through PP2A inhibition . Oncogene. 2016;; 35 : :1760.-9. 12. Calvayrac O, Pradines A, Raymond-Letron I, et al. . RhoB determines tumor aggressiveness in a murine EGFRL858R-induced adenocarcinoma model and is a potential prognostic biomarker for Lepidic lung cancer . Clin Cancer Res. 2014;; 20 : :6541.-50. 13. Calvayrac O, Mazieres J, Figarol S, et al. . The RAS-related GTPase RHOB confers resistance to EGFR-tyrosine kinase inhibitors in non-small-cell lung cancer via an AKT-dependent mechanism . EMBO Mol Med. 2017;; 9 : :238.-50. |