I. Approches transversales
2019
6-
Mécanismes moléculaires
du déconditionnement musculaire et des adaptations musculaires
à l’exercice dans les pathologies chroniques
L’homéostasie musculaire, qui définit la capacité du tissu musculaire à conserver son équilibre de fonctionnement, est indispensable à la vie de relation et à l’autonomie fonctionnelle. Cependant, l’homéostasie musculaire peut être compromise dans de nombreuses situations physiologiques ou pathologiques. Modéré, le déconditionnement musculaire causé par l’âge, l’alitement prolongé ou un mode de vie sédentaire, augmentera l’incidence et la gravité de nombreuses pathologies. Plus sévère, le déconditionnement musculaire sera une des principales causes de décès chez de nombreux patients atteints de pathologies chroniques et génétiques. Le déconditionnement musculaire est à l’origine d’une réduction progressive des capacités fonctionnelles de l’organisme, d’une sédentarisation croissante et d’une perte d’autonomie imposant une prise en charge institutionnelle des personnes affectées. La pratique régulière d’une activité physique constitue une stratégie efficace pour reconditionner le tissu musculaire, lui permettre de retrouver son équilibre de fonctionnement ou limiter les effets du déconditionnement associés à l’évolution de pathologies chroniques.
Ce chapitre a pour objet de présenter les éléments de la littérature permettant de :
• caractériser le déconditionnement musculaire au niveau moléculaire et cellulaire dans les pathologies chroniques ;
• déterminer par quels mécanismes l’activité physique permet d’agir sur le déconditionnement musculaire pour en limiter les effets ;
• caractériser les adaptations physiologiques et moléculaires à l’activité physique dans le muscle squelettique et le tissu adipeux, ainsi que leur impact sur les symptômes des pathologies chroniques.
Cachexie versus sarcopénie
Le déconditionnement musculaire se caractérise par une perte de masse et de force musculaire. On doit cependant caractériser le déconditionnement musculaire en fonction de sa vitesse d’évolution, de l’existence ou non d’une pathologie associée, ou encore de l’âge des personnes affectées. En fonction de ces caractéristiques, on peut identifier deux processus bien distincts : la cachexie et la sarcopénie.
Cachexie
Le terme cachexie signifie littéralement mauvaise condition (du grec
kakos pour mauvaise et
hexis pour condition). Si on se réfère à la définition donnée en 2006 par un panel d’experts scientifiques et cliniciens (Evans et coll., 2008

), la cachexie est définie comme « un syndrome métabolique complexe associé à une pathologie sous-jacente, et caractérisé par une perte de masse musculaire sévère associée ou non à une perte de tissu adipeux. La caractéristique majeure de la cachexie est la perte de poids chez l’adulte ». Le critère diagnostique principal pour la cachexie est une perte de poids corporel supérieure à 5 % sur les 12 derniers mois ou moins (Evans et coll., 2008

). Le délai dépendra de la pathologie, plus court pour le cancer (6 mois) et plus long pour l’insuffisance cardiaque, rénale ou respiratoire (12 mois). Un indice de masse corporelle < 20 kg.m
-2 est également considéré suffisant pour établir le diagnostic de la cachexie (Evans et coll., 2008

; Rolland et coll., 2011

). Associée à ce critère principal, la présence d’au moins 3 des critères suivants doit également être retrouvée :
• une perte de force musculaire (tertile le plus bas) (Rantanen et coll., 2000

) ;
• une fatigue (incapacité à réaliser un exercice habituellement réalisé et entraînant une baisse de performance) (Evans et coll., 2008

) ;
• une anorexie (< 70 % des apports caloriques) (Evans et coll., 2008

) ;
• un indice de masse maigre faible (indice de masse musculaire appendiculaire inférieure à 5,45 kg.m
-2 pour les femmes et 7,25 kg.m
-2 pour les hommes ; Schutz et coll., 2002

) ;
• une biochimie sanguine anormale : inflammation (CRP > 5,0 mg.l
-1), anémie (< 12 g.dl
-1), albumine sérique basse (< 3,2 g.dl
-1) (Evans et coll., 2008

).
Sarcopénie
Le terme de sarcopénie (du grec
sarx pour chair et
penia pour manque) a été proposé pour la première fois en 1989 par Rosenberg qui établissait « qu’il n’y avait probablement pas de perte structurale et de fonction aussi importante que celle de la masse musculaire au cours des décennies de la vie » (Rosenberg, 1989

). La sarcopénie est donc caractérisée par une perte progressive et généralisée de la masse et de la force musculaire squelettique avec un risque d’effets indésirables comme le handicap physique, la mauvaise qualité de la vie et de façon ultime, la mort (Delmonico et coll., 2007

). La perte de masse musculaire se produit approximativement à partir de l’âge de 30-40 ans. Cette perte qui est estimée à 1 % par an jusqu’à l’âge de 70 ans, s’accélère par la suite pour atteindre 25-40 % par décennie (Goodpaster et coll., 2006

; Grimby et Saltin, 1983

; Hughes et coll., 2001

). La caractéristique majeure de la sarcopénie est d’être un syndrome gériatrique : prévalence élevée chez les sujets âgés, origine multifactorielle, et coexistence fréquente avec d’autres syndromes gériatriques comme les chutes, la fragilité ou l’anorexie (Cruz-Jentoft et coll., 2010

). La prévalence de la sarcopénie est d’environ 25 % chez la population des plus de 65 ans et même supérieure à 40 % chez la population des plus de 80 ans (Iannuzzi-Sucich et coll., 2002

). L’
European Working Group in Older People recommande l’utilisation de la présence simultanée d’une perte de masse musculaire et d’une perte de fonction musculaire (force, performance) pour diagnostiquer la sarcopénie (Cruz-Jentoft et coll., 2010

). En effet, la force musculaire ne dépend pas uniquement de la masse musculaire, et la relation entre masse et force musculaire n’est pas linéaire, la perte de force musculaire étant plus rapide que la perte de masse musculaire avec l’avancée en âge (Goodpaster et coll., 2006

; Janssen et coll., 2004

). Le diagnostic de la sarcopénie repose sur la présence combinée des 2 critères suivants (Kim et Choi, 2013

; Muscaritoli et coll., 2010

; Muscaritoli et coll., 2013

) :
• un indice de masse musculaire squelettique faible, c’est-à-dire un pourcentage de masse musculaire supérieur ou égal à deux déviations standard sous la moyenne mesurée chez de jeunes adultes de même sexe et de même origine ethnique (Janssen et coll., 2002

) ;
• une vitesse de marche inférieure à 0.8 m.s
-1 sur un test de marche de quatre mètres (Rolland et coll., 2011

).
Différences entre cachexie et sarcopénie
De ces données, il ressort que bien que définissant tous les deux une perte de masse et de force musculaire, les termes de cachexie et sarcopénie se distinguent par un certain nombre de caractéristiques (tableau 6.I

).
Tableau 6.I Caractéristiques cliniques de la cachexie et de la sarcopénie
| |
Cachexie
|
Sarcopénie
|
|
Nature du syndrome
|
Métabolique
|
Gériatrique
|
|
Perte de poids
|
Oui
|
Oui
|
|
Perte de masse musculaire
|
Oui (rapide), mais qui peut être masquée par un état d’obésité (Friedrichsen et coll., 2013  ; Prado et coll., 2008  ) |
Oui (lente), mais très souvent masquée par un état d’obésité (Janssen et coll., 2002  ) |
|
Diminution de la force musculaire
|
Oui
|
Oui
|
|
Perte de masse grasse
|
Oui
|
Non
|
|
Existence d’une pathologie sous-jacente
|
Oui
|
Non (pas nécessairement)
|
|
Associée au vieillissement
|
Non (pas nécessairement)
|
Oui
|
|
Anorexie
|
Oui
|
Non (pas nécessairement)
|
Déconditionnement musculaire dans les pathologies chroniques
Avant d’aborder plus spécifiquement les mécanismes moléculaires liés à l’évolution des pathologies chroniques, il est important dans un premier temps de définir si ces pathologies chroniques sont associées à des modifications de la fonction musculaire, et si c’est le cas, quelle est l’ampleur de ces modifications.
Bronchopneumopathie chronique obstructive
En 2002, Marquis et coll. décrivaient que la surface musculaire de section transversale de la cuisse mesurée par CT-scan était un facteur prédictif de la mortalité chez des patients atteints de bronchopneumopathie chronique obstructive (BPCO) (Marquis et coll., 2002

). Pour un même volume expiratoire maximal par seconde (VEMS < 50 % des valeurs prédites), ces auteurs montraient que les patients ayant une surface de section transversale de la cuisse supérieure à 70 cm
2 avaient une mortalité considérablement inférieure à celle de patients pour lesquels la surface de section transversale de la cuisse était inférieure à 70 cm
2. Dans une étude plus récente, Jones et coll. montraient que la prévalence du déconditionnement musculaire chez les patients BPCO était de 14,5 %, la prévalence augmentant avec l’âge et le stade de la pathologie, mais ne différait pas en fonction du sexe ou en fonction de la présence d’une diminution de force musculaire (Jones et coll., 2015

). Cette atteinte musculaire affecte principalement les muscles locomoteurs antigravitaires, notamment le quadriceps (Antoun et coll., 2010

), avec une atrophie préférentielle des fibres musculaires de type IIa/IIx et IIx (Gosker et coll., 2002

). Comparativement à des sujets de même âge et de même sexe, la force isométrique du quadriceps est également réduite d’environ 20 % à 30 % chez des patients BPCO, une réduction expliquée par une baisse de la surface de section transversale du quadriceps (Bernard et coll., 1998

; Donaldson et coll., 2012

). Enfin, le risque de mortalité augmente avec la réduction de la force maximale volontaire de contraction du quadriceps (Swallow et coll., 2007

).
Cancers
La diminution de la force et de la masse musculaire squelettique constitue une affection courante chez les patients atteints de cancer, indépendamment du stade de la maladie et de l’état nutritionnel. Il est généralement admis que le syndrome cachectique, conséquence du processus tumoral et des traitements, affecte de 40 % à 80 % des patients cancéreux (Argiles et coll., 2014

; Tisdale, 2009

et 2010

). Cela concerne notamment les patients atteints de cancers pancréatique, gastrique, de la sphère ORL ou bronchopulmonaire (Porporato, 2016

). Les patients cancéreux en surpoids ou obèses peuvent aussi être touchés par la perte de masse musculaire. Toutefois, la cachexie chez ces patients est souvent masquée par leur indice de masse corporelle élevé. Une publication récente a étudié la prévalence et les conséquences cliniques de l’obésité cachectique à partir de données issues de 14 études. Il ressort de cette analyse que la prévalence de la cachexie est comprise entre 15 % et 36 % chez les patients cancéreux obèses (Carneiro et coll., 2016

). Ce syndrome cachectique a des répercussions extrêmement importantes pour le patient. Un certain nombre d’études ont montré, de façon consistante, une augmentation de la cytotoxicité des traitements anti-tumoraux chez des patients cancéreux cachectiques (Antoun et coll., 2010

; Prado et coll., 2009

; Sjoblom et coll., 2015

) ou un arrêt plus précoce du traitement (Antoun et coll., 2010

). Les patients cancéreux obèses présentent un risque plus important de toxicité induite par le traitement (Antoun et coll., 2013

). La cachexie associée au cancer est également associée à une augmentation du risque chirurgical (Lieffers et coll., 2012

). Enfin, il est maintenant bien établi que le risque de mortalité augmente chez les patients cachectiques (Friedrichsen et coll., 2013

; Imai et coll., 2015

; Iritani et coll., 2015

; Martin et coll., 2013

). Par exemple, dans une étude récente, il a été montré que des patients cancéreux cumulant 3 indicateurs de cachexie (perte de poids, atrophie musculaire et index d’atténuation musculaire
1
Mesure de la densité musculaire, une faible valeur reflète une augmentation de la présence de lipides au sein du muscle.
bas) survivaient 8,4 mois alors que les patients ne présentant aucun de ces indicateurs survivaient 29,9 mois, et ceci indépendamment de la valeur de l’indice de masse corporelle (Martin et coll., 2013

). De façon similaire, la perte de masse musculaire lors d’un traitement chimiothérapique chez des patients atteints d’un cancer colorectal métastatique était prédictive d’une faible survie (Blauwhoff-Buskermolen et coll., 2016

). Enfin, on notera que la mortalité est globalement supérieure chez les patients obèses cachectiques comparativement aux patients de corpulence normale ou en insuffisance pondérale (Antoun et coll., 2013

). Globalement, on considère que la cachexie associée au cancer serait responsable du décès d’environ 20 % des patients (Argiles et coll., 2014

; Tisdale, 2010

). L’atrophie musculaire est également associée à une réduction de force musculaire (Chen et coll., 2011

; Kilgour et coll., 2013

). Dans la dernière étude, les patients pour lesquels la force musculaire, appréciée à l’aide d’un dynamomètre de main, était inférieure au 10
e percentile avaient une durée de vie plus courte, une prévalence de l’atrophie musculaire plus importante et un niveau de fatigue supérieur (Kilgour et coll., 2013

). On notera toutefois qu’une méta-analyse récente ne permettait pas de montrer qu’une force musculaire basse était un facteur prédictif de la mortalité associée au cancer (Volaklis et coll., 2015

).
Accident vasculaire cérébral
L’accident vasculaire cérébral (AVC) s’accompagne d’une perte de masse musculaire de l’ordre de 4 % dans le membre inférieur et de 8 % dans le membre supérieur au minimum 6 mois après l’AVC, quel que soit le type ou la sévérité de l’AVC (English et coll., 2010

). Il n’existe à notre connaissance aucune étude clinique pour des temps post-AVC plus précoces, qui permettrait d’évaluer si l’ampleur de cette atrophie pourrait être encore supérieure dans les jours ou les premières semaines qui suivent l’AVC. En raison de la décussation pyramidale, l’atteinte est plus prononcée pour les muscles de l’hémicorps opposé à la lésion cérébrale (Dowlati et coll., 2010

; English et coll., 2010

; Ryan et coll., 2011

; Ryan et coll., 2000

; Ryan et coll., 2002

), c’est-à-dire du côté parétique. D’un point de vue histologique, l’atrophie musculaire se traduit par une baisse de la surface de section transversale des fibres entre le membre parétique et le membre non parétique, mais également entre le membre parétique et celui d’un sujet sain apparié en âge (Hachisuka et coll., 1997

; Landin et coll., 1977

). L’atrophie musculaire affecterait préférentiellement les fibres de type IIb (Hachisuka et coll., 1997

; Toffola et coll., 2001

) même si ce résultat n’est pas systématiquement retrouvé (Jakobsson et coll., 1991

). On notera cependant que les patients ayant subi un AVC avec des déficiences motrices relativement peu importantes et qui poursuivent une activité physique quotidienne conséquente ne présentent aucune modification de la surface de section transversale des fibres musculaires (Sunnerhagen et coll., 1999

). Des déficits marqués de force musculaire allant jusqu’à 60 % comparativement à des sujets sains (Teixeira-Salmela et coll., 1999

) ont été rapportés, mais ceux-ci doivent être pour l’essentiel attribués à l’altération de la commande motrice consécutive à l’AVC. Ceci explique aussi pourquoi l’ampleur de la perte de force musculaire excède largement l’atrophie musculaire chez les patients ayant eu un AVC.
Insuffisance cardiaque
L’insuffisance cardiaque est à l’origine d’un déconditionnement musculaire particulièrement marqué. Dès 1992, Mancini et coll.

rapportaient une réduction du volume musculaire du mollet chez des patients insuffisants cardiaques (Mancini et coll., 1992

). Plus tard, Harrington et coll. montraient également une réduction de la surface de section transversale de la cuisse supérieure à 10 % chez des patients insuffisants cardiaques comparativement à des sujets contrôles appariés en âge (Harrington et coll., 1997

). D’un point de vue histologique, l’atrophie musculaire chez le patient insuffisant cardiaque est associée à une réduction de la taille des fibres musculaires et à une augmentation du pourcentage de fibres de type II, notamment de type IIb (Mancini et coll., 1989

). Il a également été rapporté une réduction de la force de contraction maximale isométrique du quadriceps de plus de 20 % comparativement à celle de sujets témoins sains (Anker et coll., 1997b

). De façon intéressante, la force musculaire spécifique (ramenée à la surface de section du muscle) était elle aussi abaissée (Anker et coll., 1997b

) suggérant que la perte de force musculaire n’était pas uniquement due à une perte de masse musculaire mais pouvait également impliquer une altération des propriétés contractiles du tissu musculaire. Des études plus récentes ont établi, chez des patients insuffisants cardiaques, une prévalence du déconditionnement musculaire de 10-20 % (Christensen et coll., 2013

; Fulster et coll., 2013

), et que ce déconditionnement musculaire était associé à une réduction de la force du quadriceps et du pic de consommation d’oxygène (Fulster et coll., 2013

). La présence du syndrome cachectique a des conséquences particulièrement importantes pour les patients : il a ainsi été montré que la cachexie était directement associée à une augmentation de la mortalité des patients insuffisants cardiaques (Anker et coll., 1997a

; Narumi et coll., 2015

), et ce d’autant plus que le niveau de consommation d’oxygène des patients était faible (Anker et coll., 1997a

).
Diabète de type 2
Les patients diabétiques de type 2 font l’expérience d’une perte de masse et de fonction musculaires malgré un indice de masse corporelle généralement élevé (Batsis et coll., 2014

; Kim et coll., 2010

). Le concept d’obésité sarcopénique a ainsi été proposé pour définir un syndrome présent chez des sujets âgés, chez qui l’état d’obésité est accompagné d’une sarcopénie et d’une résistance à l’insuline (Baumgartner, 2000

). Dans une étude états-unienne, il a été estimé que la prévalence de l’obésité sarcopénique chez des personnes d’environ 70 ans était de 18 % dans la population féminine et supérieure à 40 % dans la population masculine. Le déconditionnement musculaire du patient diabétique de type 2 a été généralement attribué au vieillissement, à l’immobilité ou à l’existence de pathologies chroniques associées (Muscaritoli et coll., 2010

; Sayer et coll., 2005

). Ce déconditionnement n’était donc pas, jusqu’à très récemment, considéré comme une complication spécifique du diabète. Toutefois, des données récentes semblent remettre en cause cette affirmation. Guerrero et coll. montrent ainsi une détérioration de la masse et de la force musculaires directement associée à la condition diabétique, indépendamment de la durée de la maladie, du contrôle métabolique des patients ou de l’existence de complications microvasculaires (Guerrero et coll., 2016

). Le processus sarcopénique semble également plus rapide chez le patient diabétique. Park et coll. ont ainsi montré dans le cadre d’un suivi longitudinal de 3 ans que la perte de masse et de force musculaires des membres inférieurs était plus importante chez des patients diabétiques de type 2 comparativement à des sujets non diabétiques appariés en âge (Park et coll., 2007

). De façon importante, cette accélération du processus sarcopénique chez le patient diabétique de type 2 était toujours retrouvée après correction pour un certain nombre de covariables, notamment la présence de pathologies chroniques associées (Park et coll., 2007

). L’accélération de la perte de masse et force musculaires chez les patients diabétiques âgés a également été rapportée par d’autres auteurs (Leenders et coll., 2013

).
Dépression
La relation entre déconditionnement musculaire et dépression est à ce jour très peu étudiée. Une étude transversale coréenne impliquant des hommes et des femmes de 60 ans et plus a mis en évidence que les patients sous antidépresseurs ou ayant subi des épisodes dépressifs avaient une masse musculaire plus faible que les individus ne prenant pas d’antidépresseurs ou n’ayant pas eu d’épisodes dépressifs (-4,2 % pour les hommes et -3,7 % pour les femmes) (Kim et coll., 2011

). Dans une autre étude impliquant des patients âgés hospitalisés, les patients sarcopéniques présentaient un taux plus élevé de symptômes dépressifs que des patients non sarcopéniques (Gariballa et Alessa, 2013

). Il est probable dans cette dernière étude que la sarcopénie, responsable d’une réduction de la mobilité et d’une augmentation de la fragilité des sujets, alimente le syndrome dépressif par cette spirale de déconditionnement.
Schizophrénie
Même si la littérature dans ce domaine n’est pas très abondante, il semble y avoir un consensus pour indiquer que la schizophrénie est associée à une réduction de masse musculaire (Nilsson et coll., 2006

; Saarni et coll., 2009

; Sugawara et coll., 2012

). Par exemple, une étude réalisée au Japon mettait en évidence une augmentation du pourcentage de masse grasse et une réduction de la masse et de la force musculaires chez des patients schizophrènes après ajustement pour l’âge, le sexe et l’indice de masse corporelle (Sugawara et coll., 2012

). De façon intéressante, le traitement pharmacologique de la schizophrénie augmente le pourcentage de masse maigre, cette augmentation étant également associée à une augmentation de la masse grasse et de façon générale à une augmentation de l’indice de masse corporelle (Kivircik et coll., 2003

). D’un point de vue histologique, il a été rapporté la présence de fibres musculaires atrophiées dans le muscle de patients schizophrènes (Borg et coll., 1987

; Flyckt et coll., 2000

).
Polyarthrite rhumatoïde
Certains patients atteints de polyarthrite rhumatoïde présentent une réduction de la surface musculaire du mollet associée à une réduction de force musculaire des membres inférieurs (Baker et coll., 2015

). Toutefois, le déficit de force n’était plus observé lorsque la force musculaire était ajustée à la surface musculaire (Baker et coll., 2015

), indiquant ici que le déficit fonctionnel était essentiellement dû à la perte de masse musculaire. Ce déconditionnement musculaire était le plus prononcé pour les patients ayant le pourcentage de masse grasse le plus faible (Baker et coll., 2015

). Il a aussi été montré que le déficit en masse maigre était plus important chez les hommes que chez les femmes atteints de polyarthrite rhumatoïde (Baker et coll., 2015

). Dans une autre étude, Kramer et coll. ont montré que la densité musculaire chez des patients atteints de polyarthrite rhumatoïde était associée à l’état d’incapacité, et de façon moins surprenante, au niveau de performance physique des patients (Kramer et coll., 2012

). De façon intéressante, une étude expérimentale chez le singe indiquait que le déconditionnement musculaire exacerbait l’inflammation de l’articulation dans un modèle de polyarthrite rhumatoïde induite (Horai et coll., 2013

), suggérant l’existence d’une interaction moléculaire réciproque entre le tissu musculaire et l’articulation.
En résumé, il ressort de cette analyse que le déconditionnement musculaire est une manifestation clinique commune à de nombreuses pathologies chroniques. L’ampleur et les conséquences de ce déconditionnement dépendront de l’existence ou non d’un terrain pathologique sous-jacent et de l’âge des personnes affectées par le déconditionnement. Le déconditionnement musculaire contribuera inéluctablement, à la réduction de la qualité de vie des personnes affectées (réduction de la mobilité, augmentation de la fragilité). Dans les stades plus avancés de certaines pathologies, le déconditionnement musculaire peut mettre en jeu le pronostic vital des personnes affectées.
Mécanismes moléculaires du déconditionnement musculaire dans les pathologies chroniques
Les études fondamentales conduites ces 15 dernières années sur des modèles animaux de déconditionnement musculaire ont permis d’identifier de nombreux acteurs moléculaires de ce déconditionnement (figure 6.1

). Même si le rôle de nombreux facteurs reste encore à préciser dans un contexte clinique, nous pouvons aujourd’hui, sur la base de ces données, présenter un schéma global cohérent des acteurs moléculaires du déconditionnement musculaire pour de nombreuses pathologies chroniques.
Bronchopneumopathie chronique obstructive
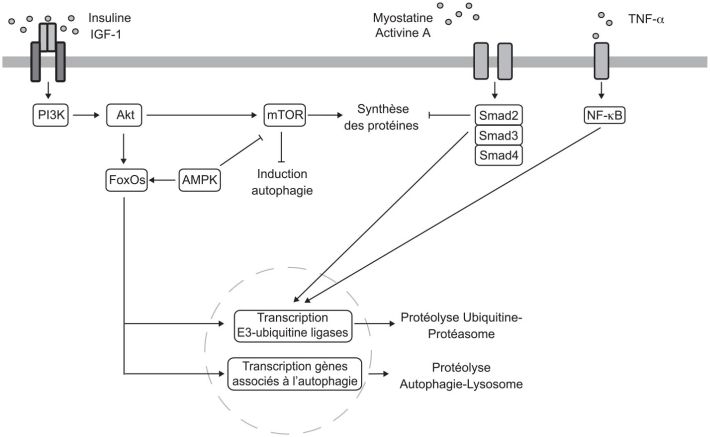
Le système ubiquitine-protéasome de dégradation des protéines est activé dans les muscles de patients BCPO comparativement à des sujets témoins, comme en témoignent l’augmentation de l’expression des E3-ubiquitines ligases MuRF-1 (
muscle ring finger protein-1) et MAFbx (
muscle atrophy-F box/atrogin1), et l’augmentation du niveau d’ubiquitination des protéines (Fermoselle et coll., 2012

; Lemire et coll., 2012

; Puig-Vilanova et coll., 2015

). Dans l’étude de Doucet et coll.

, l’expression de MuRF-1 et de MAFbx était plus élevée chez les patients BPCO ayant une faible masse musculaire comparativement aux patients présentant une masse musculaire normale (Doucet et coll., 2007

). Paradoxalement, il a été rapporté à plusieurs reprises une activation de la voie de signalisation Akt-mTOR (
mammalian target of rapamycin) (Doucet et coll., 2007

; Vogiatzis et coll., 2010

), voie qui contrôle positivement l’initiation de la traduction des protéines, suggérant ici une activation de la synthèse des protéines chez les patients BPCO. Ces données ont été interprétées comme étant une tentative vaine de l’organisme pour restaurer la masse musculaire ou pour au moins limiter la perte de masse musculaire liée à l’évolution de la pathologie (Remels et coll., 2013

). Les mécanismes en amont à l’origine de ces régulations ne sont pas encore clairement identifiés, mais le stress oxydant, l’inflammation et la myostatine (un régulateur négatif de la masse musculaire) sont des candidats particulièrement intéressants. Il a été montré que des marqueurs de stress oxydant sont négativement corrélés avec la masse maigre et la force musculaire chez le patient BPCO (Barreiro et coll., 2008

). De plus, la production d’espèces réactives de l’oxygène est supérieure chez des patients BPCO cachectiques comparativement à des patients non cachectiques ou des sujets témoins (Fermoselle et coll., 2012

), ce qui pourrait contribuer au processus atrophique
via la régulation de l’équilibre entre synthèse et dégradation des protéines. La BPCO est souvent associée à un état inflammatoire à bas bruit, notamment à une augmentation du taux circulant de TNF-α (
Tumor necrosis factor-α) (Nussbaumer-Ochsner et Rabe, 2011

) qui pourrait contribuer à activer la protéolyse musculaire. Même si l’expression musculaire du TNF-α dans le muscle squelettique de patients BPCO est controversée (Remels et coll., 2013

), l’activation du facteur de transcription NF-κB (
nuclear factor-kappa B) dans le muscle des patients BPCO (Fermoselle et coll., 2012

) suggère fortement l’implication d’un axe TNF-α-NF-κB dans le syndrome cachectique chez le patient BPCO. L’expression de la myostatine est également supérieure dans le muscle de patients BPCO comparativement à celui de sujets témoins (Hayot et coll., 2011

; Plant et coll., 2010

). De plus, l’expression de la myostatine est inversement corrélée à la force du muscle quadriceps et l’endurance de patients BPCO (Allen et coll., 2010

).
Cancers
Différentes modifications métaboliques contribuent à la perte de la masse musculaire associée à la cachexie cancéreuse, notamment une rupture de l’équilibre entre la synthèse et la dégradation des protéines, associée à des altérations du métabolisme des acides aminés (transport et oxydation) (Argilès et coll., 2014

). Les mécanismes moléculaires mis en jeu dans le déconditionnement musculaire associés au cancer ont particulièrement bien été décrits dans différents modèles murins. En support à ces études fondamentales, des études cliniques ont permis pour l’essentiel de valider les données obtenues chez l’animal. De nombreuses études ont ainsi mis en évidence l’implication du système ubiquitine-protéasome dans la perte de masse musculaire associée au cancer chez l’animal (Acharyya et coll., 2004

; Busquets et coll., 2004

; Gallot et coll., 2014

; Khal et coll., 2005

; Lecker et coll., 2004

; Llovera et coll., 1994

), mais également dans le cadre d’études cliniques (Bossola et coll., 2003

; DeJong et coll., 2005

; Khal et coll., 2005

). Le second système protéolytique majeur du tissu musculaire, le système autophagie-lysosome, est lui aussi activé dans des modèles murins de cachexie associée au cancer (Lecker et coll., 2004

; Penna et coll., 2013

; White et coll., 2011

), mais également chez l’humain (Op den Kamp et coll., 2013

). En accord avec ces données, il a été montré que la dégradation des protéines musculaires est également activée chez le patient cancéreux (Bonetto et coll., 2011

; Williams et coll., 2012

). Les facteurs de transcription NF-κB et FoxO (
forkhead box) seraient mis en jeu dans la régulation transcriptionnelle en amont de ces deux systèmes protéolytiques, aussi bien dans les modèles animaux (Cai et coll., 2004

; Eley et Tisdale, 2007

; Gallot et coll., 2014

; Lecker et coll., 2004

; Liu et coll., 2007

; Tisdale, 2010

) que chez le patient cancéreux (Puig-Vilanova et coll., 2015

; Rhoads et coll., 2010

; Schmitt et coll., 2007

). La voie de signalisation Akt-mTOR, voie qui contrôle positivement l’initiation de la traduction des protéines, est également inhibée chez l’animal (Gallot et coll., 2014

; MacDonald et coll., 2015

) et l’humain (Schmitt et coll., 2007

), même si la mise en évidence d’une réduction de la synthèse des protéines chez l’humain est plus controversée. Ces données suggèrent que l’activation de la protéolyse serait un des mécanismes majeurs mis en jeu dans la perte de masse musculaire associée au cancer. Les concentrations circulantes ainsi que l’expression musculaire de nombreuses cytokines pro-inflammatoires sont augmentées comme les interleukines 1β et 6 (IL1β et IL-6) et le TNF-α. Ces observations expérimentales (Baltgalvis et coll., 2008

; Tisdale, 2010

) et cliniques (Batista et coll., 2013

; Puig-Vilanova et coll., 2015

) laissent suggérer un rôle important de ces cytokines dans la régulation en amont de l’équilibre entre synthèse et dégradation des protéines. De plus, la myostatine serait également impliquée dans cette régulation, comme en témoignent expérimentalement l’augmentation de sa production musculaire (Costelli et coll., 2008

; Liu et coll., 2008

; Tisdale, 2010

) et le rôle majeur de son inhibition dans la prévention expérimentale de la cachexie associée au cancer (Gallot et coll., 2014

; Liu et coll., 2008

; Tisdale, 2010

). L’importance fonctionnelle de la myostatine en clinique mérite toutefois d’être explorée plus avant. En effet, Loumaye et coll. ont récemment montré que la concentration circulante de myostatine était similaire chez des patients cancéreux cachectiques et non-cachectiques, contrairement à la concentration circulante d’activine, qui était supérieure chez les patients cachectiques (Loumaye et coll., 2015

). Enfin, le stress oxydatif pourrait aussi contribuer à l’étiologie du déconditionnement associée au cancer. Une étude récente a ainsi montré que l’oxydation des protéines musculaires était supérieure chez des patients cancéreux comparativement à des sujets témoins, et que cette augmentation était positivement corrélée à l’activation de voies de signalisation (NF-κB et FoxO) sensibles à l’état oxydatif, et connues pour être impliquées dans le contrôle de la synthèse et de la dégradation des protéines (Puig-Vilanova et coll., 2015

).
Accident vasculaire cérébral
Il n’existe à ce jour que deux études expérimentales chez l’animal qui ont exploré les mécanismes moléculaires du déconditionnement musculaire après une ischémie cérébrale (modèle d’occlusion de l’artère cérébrale moyenne chez la souris). Ces études mettent en évidence une activation du système ubiquitine-protéasome de dégradation des protéines jusqu’à 7 jours après l’ischémie, comme en témoignent l’augmentation du niveau en ARNm des E3-ubiquitine ligases (MuRF-1, MAFbx, et Musa1) ou encore l’augmentation des activités enzymatiques du protéasome (Desgeorges et coll., 2015

; Springer et coll., 2014

). La voie de signalisation Akt-mTOR, qui contrôle positivement l’initiation de la traduction des protéines, est également inhibée (Desgeorges et coll., 2015

), suggérant l’existence d’une réduction de la synthèse des protéines dans ce modèle. L’ischémie cérébrale est également à l’origine d’une augmentation de l’expression de la myostatine (Desgeorges et coll., 2015

; Springer et coll., 2014

), un régulateur négatif de la masse musculaire. En accord avec ces données expérimentales obtenues chez l’animal, Ryan et coll. ont rapporté une augmentation de l’expression de la myostatine dans le muscle
vastus lateralis chez les patients ayant eu un AVC (délai post-AVC > 6 mois) (Ryan et coll., 2011

), mais qui n’était pas retrouvée lorsque l’analyse était réalisée plus de 9 mois après l’AVC (von Walden et coll., 2012

). D’autres études ont également décrit, dans le même modèle de muscle
vastus lateralis de patients ayant eu un AVC (délai post-AVC > 6 mois), une augmentation cette fois du niveau en ARNm de TNF-α (Hafer-Macko et coll., 2005

), qui de la même façon n’était pas retrouvée lorsque l’analyse était réalisée plus de 9 mois après l’AVC (von Walden et coll., 2012

). Ces données suggèrent un rôle important pour les cytokines d’origine musculaire (myokines) dans le déconditionnement musculaire du patient ayant eu un AVC, plusieurs mois après la survenue de l’AVC. Associée à la réponse inflammatoire systémique (Lambertsen et coll., 2012

), l’augmentation de la production de ces facteurs circulants (myokines et cytokines) pourrait contribuer largement au déconditionnement musculaire du patient ayant eu un AVC.
Insuffisance cardiaque
Gielen et coll. ont montré que le niveau d’expression musculaire de l’E3-ubiquitin ligase MuRF-1 (ARNm et protéine) était supérieur chez des patients insuffisants cardiaques par rapport à des sujets témoins (Gielen et coll., 2012

), suggérant l’activation du système protéolytique ubiquitine-protéasome dans ce contexte. L’expression de la myostatine (ARNm et protéine) était supérieure chez les patients insuffisants cardiaques comparativement à des sujets témoins (Gielen et coll., 2012

). De façon intéressante, il a été montré, dans un modèle murin d’insuffisance cardiaque, que la production de myostatine par le myocarde pouvait contribuer directement à la cachexie musculaire (Heineke et coll., 2010

), suggérant un rôle important de la myostatine dans la cachexie associée à l’insuffisance cardiaque. À l’inverse, le niveau en ARNm d’IGF-1 (
insulin-like growth factor-1), un régulateur positif de la voie de signalisation Akt-mTOR, était inférieur chez des patients insuffisants cardiaques comparativement à des sujets témoins (Gielen et coll., 2012

; Hambrecht et coll., 2002

). Ces observations suggèrent que l’initiation de la traduction des protéines musculaires était réduite chez ces patients. L’expression musculaire d’IL-1β, IL-6, TNF-α est supérieure chez des patients insuffisants respiratoires par rapport à celle observée chez des sujets témoins (Gielen et coll., 2003

), suggérant encore une fois, dans ce contexte pathologique, l’intervention de ces myokines dans le contrôle de la cachexie. On soulignera également le rôle plus particulier joué ici par l’angiotensine II. En effet, les patients cachectiques à des stades avancés d’insuffisance cardiaque ont fréquemment un niveau élevé d’angiotensine II (Roig et coll., 2000

). De plus, le traitement par des inhibiteurs de l’enzyme de conversion de l’angiotensine diminue le risque de perte de poids chez ces patients (Anker et coll., 2003

). Chez l’animal, un traitement par l’angiotensine II augmente la dégradation musculaire des protéines (Brink et coll., 2001

). Ceci met notamment en jeu une réduction de l’expression musculaire d’IGF-1 (Brink et coll., 2001

; Song et coll., 2005

) et la régulation de l’expression des E3-ubiquitines ligases MuRF-1 et MAFbx,
via la régulation de l’axe Akt-FoxO (Yoshida et coll., 2010

). L’activation du stress oxydant chez les patients insuffisants cardiaques (Radovanovic et coll., 2012

) doit également être considérée comme un facteur potentiel du contrôle de l’équilibre entre synthèse et dégradation des protéines musculaires (Powers et coll., 2012

). Enfin, on notera également qu’il a été rapporté l’existence d’une mort nucléaire
2
On parle ici de mort nucléaire car, compte tenu du caractère multinucléé de la fibre musculaire, ce n’est pas la fibre qui meurt par apoptose, mais le petit volume de la fibre contrôlé par le noyau (domaine myonucléaire).
dans les fibres musculaires de patients insuffisants cardiaques (Adams et coll., 1999

), mécanisme pouvant également contribuer à la cachexie chez ces patients.
Diabète de type 2
La caractéristique principale du diabète de type 2 est l’état de résistance des tissus périphériques, et notamment du tissu musculaire, à l’action de l’insuline. Chez l’humain au repos, l’extraction musculaire du glucose est principalement contrôlée par un axe Akt-TBC1D4 (
TBC1 domain family member 4 ou
Akt Substrate of 160 kDa, AS160). Akt contrôle également l’initiation de la traduction des protéines (axe Akt-mTOR) (Bodine et coll., 2001

) et la dégradation des protéines (axe Akt-FoxO) (Sandri et coll., 2004

). Akt est donc au carrefour du contrôle du métabolisme du glucose et du métabolisme anabolique. Pereira et coll. ont montré que des patients diabétiques de type 2 de sexe masculin présentaient un état de résistance à l’action anabolique de l’insuline (Pereira et coll., 2008

), suggérant que le métabolisme protéique, comme celui du glucose, serait insulino-résistant chez les patients diabétiques de type 2. Ce mécanisme pourrait contribuer à l’obésité sarcopénique chez ces patients. Concernant la protéolyse, si les modèles expérimentaux du diabète chez l’animal mettent clairement en évidence une activation du système ubiquitine-protéasome (Rom et Reznick, 2016

), il n’existe à notre connaissance aucune étude qui a exploré ce mécanisme chez le patient diabétique de type 2. Les mécanismes sous-jacents à l’insulino-résistance sont en partie associés au développement d’une réponse inflammatoire, qui pourrait aussi contribuer à l’évolution du processus sarcopénique chez les patients diabétiques de type 2, notamment par la modulation de l’activité transcriptionnelle du facteur de transcription NF-κB (Tantiwong et coll., 2010

). Par ailleurs, il a été montré d’une part que l’expression musculaire de la myostatine (Hittel et coll., 2009

; Palsgaard et coll., 2009

) ainsi que sa concentration circulante étaient augmentées chez des patients diabétiques de type 2 (Hittel et coll., 2009

), et d’autre part que le niveau de myostatine était corrélé avec la sévérité de l’insulino-résistance (Hittel et coll., 2009

). Ces données suggèrent un rôle de la myostatine dans l’étiologie de l’insulino-résistance, et de façon plus classique, une contribution à l’obésité sarcopénique. Des marqueurs de stress oxydant (peroxydation lipidique) sont également augmentés dans le muscle squelettique de patients diabétiques de type 2 (Ingram et coll., 2012

), pouvant ainsi contribuer au processus atrophique
via la régulation de l’équilibre entre synthèse et dégradation des protéines. On notera également que le stress oxydant était associé à la sévérité de l’état d’insulino-résistance chez ces patients (Ingram et coll., 2012). D’une façon générale, l’ensemble de ces données souligne la nature commune de certains mécanismes moléculaires impliqués à la fois dans le contrôle de la sensibilité à l’insuline et dans l’homéostasie musculaire chez le patient diabétique.
Dépression
Il n’existe à notre connaissance aucune donnée traitant des mécanismes du déconditionnement musculaire dans la dépression. Toutefois, l’existence d’un état inflammatoire à bas bruit dans les syndromes dépressifs (augmentation de l’expression de TNF-α et d’IL-6), laisse suggérer que celui-ci pourrait éventuellement contribuer à réguler en amont et à long terme le déconditionnement musculaire chez ces patients (Dowlati et coll., 2010

). Chez l’animal, il a été montré expérimentalement que l’application d’un stress psychologique était à l’origine d’une augmentation de l’expression des E3-ubiquitines ligases MuRF-1 et MAFbx, d’une sous-unité du facteur de transcription NF-κB et de la myostatine (Allen et coll., 2010

). Bien que ce modèle expérimental n’induise pas à proprement parler d’état dépressif chez l’animal, ces données soulignent l’importance du stress psychologique sur le contrôle de l’homéostasie musculaire.
Schizophrénie
Il n’existe à notre connaissance aucune donnée traitant des mécanismes du déconditionnement musculaire dans la schizophrénie. Toutefois, il a été rapporté un niveau circulant d’IL-6 plus élevé chez les patients schizophrènes (Potvin et coll., 2008

), qui pourrait éventuellement contribuer à réguler en amont le déconditionnement musculaire chez ces patients.
Polyarthrite rhumatoïde
Le liquide synovial et le sérum de patients atteints de polyarthrite rhumatoïde contiennent des concentrations élevées en TNF-α et IL-1β (Morley et coll., 2006

). Même si l’action de ces cytokines pro-inflammatoires sur le tissu musculaire reste à déterminer, ces données laissent suggérer que dans cette situation pathologique également, l’état inflammatoire pourrait contribuer au déconditionnement musculaire des patients.
En résumé, il ressort de cette analyse que le déconditionnement musculaire dans les pathologies chroniques met en jeu un contrôle strict de la synthèse et de la dégradation des protéines (tableau 6.II

). Même si certaines données méritent indiscutablement d’être consolidées, la régulation de l’état inflammatoire systémique et local, au niveau musculaire, apparaît comme étant un des facteurs clés de régulation en amont de ces mécanismes. Le stress oxydatif pourrait également jouer un rôle important.
Adaptations physiologiques et moléculaires de l’activité physique dans le muscle squelettique et le tissu adipeux
Comme évoqué précédemment, on retrouve souvent une perte de masse musculaire et une augmentation de la masse grasse dans les maladies chroniques, en partie dues à une mobilité réduite et à une baisse de l’activité physique quotidienne (Pedersen et Saltin, 2006

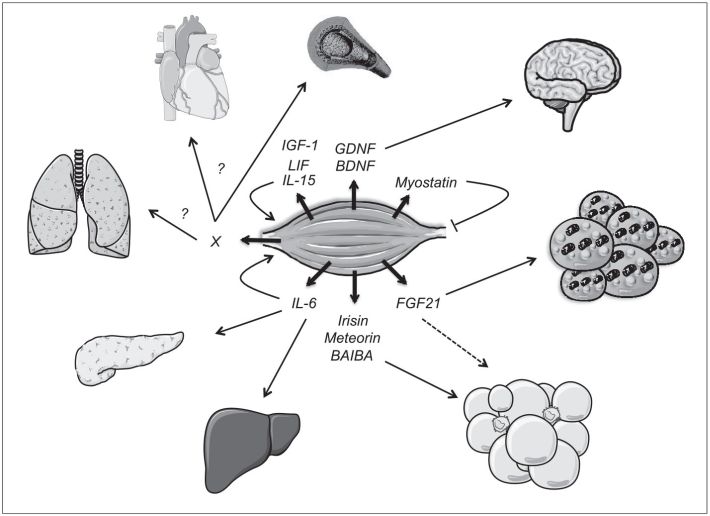
). L’activité physique induit un certain nombre d’adaptations physiologiques et moléculaires dans le muscle squelettique et le tissu adipeux que nous allons décrire ci-dessous, qui directement et indirectement relayent les bénéfices de l’activité physique sur les autres organes. En effet, des données récentes des dix dernières années suggèrent que les muscles produisent des signaux de communication à distance avec d’autres organes appelés myokines (Pedersen et Febbraio, 2012

) (figure 6.2

).
Tableau 6.II Mécanismes moléculaires du déconditionnement musculaire dans les pathologies chroniques
|
Pathologies
|
Protéolyse
|
Protéosynthèse
|
Myokine, Hormone, Inflammation
|
Stress oxydatif
|
|
Bronchopneumopathie chronique obstructive
|
⇑ Ubiquitine-protéasome
|
⇑ Akt-mTOR
|
⇑ Myostatine
⇑ TNF-α
|
⇑
|
|
Cancers
|
⇑ Ubiquitine-protéasome
⇑ Autophagie-lysosome
|
⇓ Akt-mTOR
|
⇑ Myostatine
⇑ IL-1β, MIL-6,
⇑ TNF-α
|
⇑
|
|
Accident vasculaire cérébral
|
⇑ Ubiquitine-protéasome*
|
⇓ Akt-mTOR*
|
⇑ Myostatine
⇑ TNF-α
|
n.d.
|
|
Insuffisance cardiaque
|
⇑ Ubiquitine-protéasome
|
⇓ Akt-mTOR
|
⇑ Myostatine
⇓ Angiotensine II
⇑ IL-1β, ⇑ IL-6,
⇑ TNF-α, ⇓ IGF-1
|
⇑
|
|
Diabète de type 2
|
⇑ Ubiquitine-protéasome*
|
⇓ Akt-mTOR
|
⇑ Myostatine
⇑ TNF-α
|
⇑
|
|
Dépression
|
⇑ Ubiquitine-protéasome*
|
n.d.
|
⇑ Myostatine*
|
n.d.
|
|
Schizophrénie
|
n.d.
|
n.d.
|
⇑ IL-6
|
n.d.
|
|
Polyarthrite rhumatoïde
|
⇑ Ubiquitine-protéasome*
|
n.d.
|
= Myostatine*
⇑ IL-1β, ⇑ TNF-α
|
n.d.
|
n.d. : non déterminé ; * mécanismes identifiés dans des modèles animaux mais non explorés à ce jour chez l’humain.
Dans le tissu musculaire strié squelettique
De manière générale, les exercices aérobies induisent des adaptations musculaires visant à augmenter l’extraction d’oxygène, le stockage et l’utilisation des substrats énergétiques, notamment les lipides, et la capacité d’endurance. Ces effets résultent d’une augmentation de la densité capillaire médiée par le VEGF (
vascular endothelial growth factor), de la synthèse de myoglobine (protéine de transport de l’oxygène dans le muscle) et d’une augmentation de la densité mitochondriale et des enzymes de la β-oxydation (Hawley et coll., 2014

). Au niveau moléculaire, ces adaptations physiologiques sont relayées par différents effecteurs notamment la p38 MAPK (
mitogen-activated protein kinase), l’AMPK (
5’-AMP-activated protein kinase), les sirtuines-1/3 et la CaMK-II (
calmoduline kinase-II). Ces effecteurs intracellulaires réagissent respectivement à l’état d’oxydo-réduction, aux ratios AMP/ATP, NAD+/NADH, et aux variations calciques de la fibre musculaire (Egan et Zierath, 2013

). Ces protéines modulent ensuite l’expression et l’activité d’un coactivateur transcriptionnel clé du métabolisme oxydatif appelé PGC1α (
peroxisome proliferator activated receptor coactivator-1α) (Lin et coll., 2002

). PGC1α stimule par ailleurs l’expression de myokines comme l’irisine (Bostrom et coll., 2012

). La contraction musculaire induit également la sécrétion de myokines ayant des effets pléiotropes, à la fois sur le muscle lui-même et sur des organes à distance. Parmi ces myokines, certaines ont des propriétés anti-inflammatoires comme l’interleukine-6 (IL-6) (Carey et coll., 2006

), d’autres des propriétés trophiques comme l’IL-15, le LIF (
leukemia inhibitory factor), et l’IGF-1 (Benatti et Pedersen, 2015

), ou encore des propriétés anti-hypertrophiques sur le muscle comme la célèbre myostatine (McPherron et coll., 1997

) (figure 6.2

).
Par ailleurs, les exercices de résistance favorisent l’augmentation de la masse et de la force musculaires (Wilson et coll., 2012

). Ces effets sont médiés par des hormones anaboliques produites pendant l’activité physique comme l’IGF-1 et l’hormone de croissance, et par le stress mécanique généré sur les fibres musculaires pendant la contraction. Ces systèmes activent une voie de signalisation Akt/mTOR qui stimule l’initiation de la traduction des protéines
via la protéine p70-S6K1 (
Ribosomal protein S6 kinase beta-1) et le facteur de transcription eIF4E (
eukaryotic translation initiation factor 4E) (Goodman, 2014

). L’activation de la voie Akt inhibe également la protéine FOXO3 qui régule la dégradation des protéines par les E3 ubiquitines ligases MuRF1 et atrogin-1/MAFbx. Il est à noter que l’AMPK, activée par les exercices d’endurance, bloque l’activation du complexe mTOR, ce qui explique l’interférence entre les exercices aérobies et de résistance décrite précédemment (Hawley et coll., 2014

).
Dans le tissu adipeux
Les études transversales sur adipocytes sous-cutanés abdominaux ont suggéré une meilleure sensibilité β-adrénergique chez des hommes et des femmes entraînés en endurance par rapport à des sujets témoins sédentaires (Crampes et coll., 1986

; Riviere et coll., 1989

). Des données similaires ont été obtenues au cours d’études longitudinales d’entraînement aérobie montrant une amélioration de la réponse lipolytique β-adrénergique sur adipocytes isolés de sujets obèses, indépendamment de la taille adipocytaire (De Glisezinski et coll., 1998

). Des améliorations fonctionnelles au niveau récepteur et post-récepteur ont été rapportées (De Glisezinski et coll., 1998

; Moro et coll., 2009

). Il a été montré par microdialyse
in situ dans le tissu adipeux que 4 mois d’entraînement aérobie améliore la lipolyse β-adrénergique et ANP (
atrial natriuretic peptide)-dépendante chez des hommes jeunes en surpoids (Moro et coll., 2005

). Des résultats similaires ont été obtenus chez des femmes obèses atteintes d’un syndrome des ovaires polykystiques (Moro et coll., 2009

). Ces effets pourraient impliquer une meilleure efficacité des protéines dépendantes de l’AMPc et du GMPc. On observe également une amélioration de la lipolyse induite par un exercice aigu après 4 mois d’entraînement aérobie chez des hommes en surpoids (De Glisezinski et coll., 2003

). Ce résultat pourrait s’expliquer en partie par une réduction de l’effet anti-lipolytique α2-adrénergique dans le tissu adipeux, suite à la diminution des niveaux circulant d’adrénaline, le ligand physiologique principal des récepteurs α2-adrénergiques. Ainsi il a été montré que l’activité anti-lipolytique α2-adrénergique était réduite après 3 mois d’entraînement en endurance (Richterova et coll., 2004

). Des adaptations similaires de lipolyse du tissu adipeux ont été observées en réponse à un entraînement en résistance chez des sujets obèses (Polak et coll., 2005

).
L’activité physique diminue la sécrétion de cytokines pro-inflammatoires TNFα, IL-1β, IL-8, MCP1 (monocyte chemoattractant protein-1) et augmente celle de cytokines anti-inflammatoires par le tissu adipeux (IL-1ra [IL-1 receptor antagonist], IL-10, sTNF-R [soluble TNFα receptor]), ce qui contribue à diminuer les niveaux circulants de protéines de la phase aiguë de l’inflammation comme la serum amyloid protein-A et la protéine C-réactive. Ces effets pourraient être dus à une action directe sur les cellules immunitaires qui s’accumulent dans le tissu adipeux, dans un contexte d’obésité.
L’entraînement en endurance semble également augmenter la sécrétion de myokines comme l’irisine (Bostrom et coll., 2012

), la météorine (Rao et coll., 2014

), le β-aminoisobutyric acid (BAIBA) (Roberts et coll., 2014

) et FGF-21 (
fibroblast growth factor-21) (Kharitonenkov et coll., 2005

), en partie
via l’induction de PGC1α. Ces myokines activent la conversion du tissu adipeux blanc en tissu adipeux beige, qui possède un potentiel oxydatif et une respiration cellulaire accentués en raison de l’induction de la protéine découplante-1 (UCP1) (Bostrom et coll., 2012

; Fisher et coll., 2012

; Rao et coll., 2014

; Roberts et coll., 2014

). Une des conséquences de ce phénotype est une plus grande consommation d’acides gras issus de la lipolyse et de glucose par ces adipocytes beiges (figure 6.2

). Ces adaptations du tissu adipeux permettent de lutter contre la prise de poids et corrigent le déséquilibre glycémique chez les souris rendues obèses par un régime riche en graisses (Bostrom et coll., 2012

; Kharitonenkov et coll., 2005

).
Mécanismes moléculaires par lesquels l’activité physique améliore les symptômes et la qualité de vie dans les maladies chroniques
Au cours de ces 50 dernières années, de nombreuses connaissances importantes se sont accumulées concernant les effets bénéfiques de l’activité physique sur la santé en général et la prévention des maladies chroniques en particulier (Pedersen et Saltin, 2006

). Comme déjà évoqué dans les différents chapitres de cette expertise, l’activité physique devrait être prescrite dans la prise en charge d’un certain nombre d’affections chroniques d’origine métabolique (obésité, diabète de type 1 et 2, insulino-résistance, dyslipidémies), cardiovasculaire (hypertension, maladie coronarienne, insuffisance cardiaque, claudication intermittente), pulmonaire (broncho-pneumopathie chronique obstructive, asthme), ostéo-articulaire (arthrose, polyarthrite rhumatoïde, ostéoporose, fibromyalgie, syndrome de fatigue chronique), neurologique (dépression, schizophrénie), et des cancers (Pedersen et Saltin, 2015

). Les effets bénéfiques de l’activité physique sont donc très largement multifactoriels. Nous allons traiter les mécanismes physiologiques et moléculaires potentiellement impliqués dans les effets bénéfiques de l’activité physique pour chaque pathologie chronique.
Maladies cardiovasculaires
L’activité physique améliore la fonction endothéliale, en particulier la vasodilatation médiée par le monoxyde d’azote (NO) dépendante de l’endothélium, augmente le tonus parasympathique, diminue le taux de catécholamines circulantes, ainsi que la pression artérielle moyenne en augmentant la perfusion des muscles locomoteurs et la compliance des artères (Ash et coll., 2013

). L’activité physique augmente aussi la production de facteurs vasodilatateurs comme le peptide atrial natriurétique ayant une activité antagoniste du système rénine-angiotensine-aldostérone (Coats et coll., 1992

). L’activité physique exerce par ailleurs un effet anti-athéromateux en prévenant la formation des thrombus et en inhibant l’inflammation (Pedersen et Febbraio, 2012

). La prévention des thrombus s’explique par une augmentation de la fibrinolyse et une diminution de l’agrégation plaquettaire. Au niveau cardiaque, l’activité physique augmente le volume d’éjection systolique et la force de contraction du myocarde, tout en limitant l’hypertrophie induite par une surcharge de pression (Demopoulos et coll., 1997

). En augmentant le potentiel oxydatif des muscles locomoteurs, l’activité physique repousse le seuil anaérobie et améliore la tolérance à l’exercice des patients insuffisants cardiaques (Meyer et coll., 1996

).
Dépression
La dépression et la schizophrénie s’accompagnent sur le plan clinique d’une atrophie de l’hippocampe et du gyrus denté, deux structures corticales impliquées dans le contrôle de l’humeur et de la mémoire. Il est désormais bien établi que l’activité physique stimule la neurogenèse de l’hippocampe et du gyrus denté en particulier
via l’induction du neuropeptide VGF (nom acronymique) régulé par le BDNF (
brain-derived neurotrophic factor) et la sérotonine (Hunsberger et coll., 2007

). Une diminution locale de l’inflammation et du stress oxydant serait également observée. L’activité physique active aussi la production de facteurs neurotrophiques dans l’hippocampe et dans les muscles comme le BDNF, le GDNF (
glial cell-derived neurotrophic factor) et l’IGF-1 (Aguiar et coll., 2014

; Wrann et coll., 2013

). Ces facteurs stimulent la prolifération et la survie des neurones, la plasticité neuronale, et l’expression de protéines synaptiques (
synaptophysin, postsynaptic density protein 95) et de β-endorphine dans l’hippocampe (Knaepen et coll., 2010

). L’activité physique induit également la libération de VEGF, qui augmente la vascularisation et le flux sanguin cérébral (Arany et coll., 2008

). Enfin, l’activité physique augmente les concentrations cérébrales de sérotonine en induisant la tryptophane hydroxylase dans le noyau du Raphé et en augmentant la biodisponibilité en tryptophane libre, acide aminé précurseur de la sérotonine. Les activités physiques de type aérobie augmentent également l’expression de la kynurénine aminotransférase
via le coactivateur transcriptionnel PGC1α dans les muscles (Agudelo et coll., 2014

), ce qui diminue les concentrations circulantes de kynurénine, un métabolite du tryptophane induisant des troubles dépressifs. Il semble aussi que les activités physiques de type Qi gong s’opposent à l’hyperactivité de l’axe corticotrope en diminuant les influences cognitives et affectives au niveau du système limbique (Tsang et Fung, 2008

). Les exercices de type résistance ne semblent pas quant à eux modifier les concentrations hippocampiques de BDNF.
Schizophrénie
L’activité physique réduit les hallucinations, l’anxiété et la détresse psychologique tout en augmentant l’attention et la qualité de vie chez les patients schizophrènes (Firth et coll., 2015

). Comme dans la dépression, ces effets sont corrélés à une augmentation de la neurogenèse et des concentrations de BDNF dans l’hippocampe.
Cancers
Plusieurs études ont montré que l’activité physique diminue la perception de fatigue chronique et améliore la mobilité en augmentant la condition physique, l’équilibre et la force musculaire (voir chapitre « Cancers »). Quelques études expérimentales, notamment chez la souris, ont mis en évidence que l’activité physique réduit la taille des tumeurs en diminuant l’état inflammatoire systémique, le stress oxydant et les dommages cellulaires (péroxydation lipidique, carbonylation des protéines, dommages de l’ADN). Une étude récente démontre également que l’activité physique augmente la sécrétion de facteurs anti-tumoraux par les muscles, comme SPARC (
secreted protein, acidic and rich in cysteine), qui inhibe la tumorigenèse dans les cryptes du côlon (Aoi et coll., 2013

). Les stades avancés de cancer évoluent vers une cachexie, c’est-à-dire une perte de masse musculaire (Gould et coll., 2013

).
Via l’induction de systèmes anti-oxydants et anti-inflammatoires au niveau systémique et hypothalamique, l’activité physique atténue l’anorexie associée à l’état cachectique (Lira et coll., 2011

). Elle contribue également au maintien de la masse musculaire en stimulant la synthèse des protéines et la production d’hormones anaboliques comme l’hormone de croissance et l’IGF-1. Ces bénéfices restent à confirmer sur le plan clinique (Grande et coll., 2014

; Stene et coll., 2013

) (voir chapitre « Cancers »).
Bronchopneumopathie chronique obstructive/Asthme
Il n’y a pas, à notre connaissance, de preuves directes que l’activité physique améliore la fonction pulmonaire. Cependant, en augmentant la capacité aérobie et la puissance musculaire, l’activité physique diminuerait la demande ventilatoire pendant un exercice physique et réduirait ainsi le risque de survenue d’une crise d’asthme et la perception de dyspnée (McCarthy et coll., 2015

). L’activité physique augmente les concentrations circulantes de cytokines anti-inflammatoires (IL-10, IL-1Ra) et diminue l’inflammation locale dans le parenchyme pulmonaire (Silva et coll., 2010

). Les muscles actifs produisent également de l’interleukine-6 qui s’oppose aux effets délétères du TNFα sur les voies aériennes et sur la fonte musculaire (cachexie) (Petersen et coll., 2008

).
Diabète
Étant donné la forte prévalence du diabète de type 2 dans le monde, de nombreuses études ont évalué les bénéfices de l’activité physique dans la prévention et le traitement du diabète de type 2 (Knowler et coll., 2002

; LaMonte et coll., 2005

; Tuomilehto et coll., 2001

). Les mécanismes par lesquels un programme adapté d’activité physique corrige en partie le déséquilibre glycémique et l’hémoglobine glyquée (HbA1c) sont multiples. Un des effets majeurs de l’activité physique est l’amélioration de la sensibilité à l’insuline des tissus périphériques, notamment du muscle squelettique (Bruce et coll., 2006

; Polak et coll., 2005

). Ceci implique une augmentation de la translocation du transporteur de glucose GLUT4 à la membrane chez des patients diabétiques ayant suivi un programme d’entraînement (Hussey et coll., 2012

). On observe également une potentialisation de la signalisation insulinique dans le muscle, reflétée en partie par une augmentation de la phosphorylation d’Akt et d’AS160 (
Akt substrate of 160 kDa) ou TBC1D4 (
TBC1 domain family member 4) (Sylow et coll., 2014

), une Rab GTPase impliquée dans le transport vésiculaire de GLUT4 (Pehmoller et coll., 2012

). Ceci pourrait s’expliquer par une diminution des concentrations intramyocellulaires de diacylglycérols et céramides (Dube et coll., 2011

), des lipides toxiques capables d’inhiber la signalisation de l’insuline au niveau d’IRS1 (
insulin receptor substrate-1) et d’Akt respectivement (Samuel et Shulman, 2012

). Cette baisse des diacylglycérols et céramides ferait suite à une augmentation de la capacité oxydative musculaire et de l’oxydation des lipides. Ceci implique une augmentation de la densité mitochondriale et des enzymes de la β-oxydation médiée par le coactivateur transcriptionnel PGC1α (Sparks et coll., 2013

). Il est aussi largement admis aujourd’hui que la contraction musculaire augmente le transport de glucose et la translocation de GLUT4
via l’AMPK (Friedrichsen et coll., 2013

). Par ailleurs, une augmentation de la densité capillaire par fibre musculaire facilite la diffusion et le captage de glucose par les muscles en réponse à l’activité physique (Akerstrom et coll., 2014

). Ces effets se retrouvent à la fois dans des exercices d’endurance, de résistance ou une combinaison des deux. Il semblerait, pour finir, que l’activité physique facilite la sécrétion de myokines capables de stimuler le transport de glucose au niveau des muscles et potentiellement du tissu adipeux, comme l’IL-6, l’apeline et le FGF-21 (Besse-Patin et coll., 2014

). Ces adaptations métaboliques à l’activité physique sont également observées dans le diabète de type 1. Les exercices par intervalles de haute intensité et de sprint semblent également efficaces pour améliorer la sensibilité à l’insuline
via PGC1α et une augmentation de la protéine GLUT4 musculaire, malgré un faible volume hebdomadaire (< 75 min/semaine) (Gillen et coll., 2016

; Little et coll., 2011

).
Obésité
L’obésité, qui caractérise un excès de masse grasse, résulte d’un déséquilibre chronique de la balance énergétique. L’activité physique constitue un composant majeur de la dépense énergétique (Church, 2011

). Plusieurs études épidémiologiques ont mis en évidence qu’une diminution de la dépense énergétique liée aux activités physiques quotidiennes est très fortement corrélée à l’augmentation du poids moyen des populations aux États-Unis (Church et coll., 2011

). L’activité physique prescrite seule ne semble pas suffisante pour induire une perte de poids significative en raison d’une compensation par la prise alimentaire. Cependant, en association avec une restriction calorique, l’activité physique potentialise la perte de poids et facilite le maintien à long terme de la perte de poids (Church et coll., 2009

). Au-delà de l’aspect strictement calorique, l’activité physique induit également des adaptations facilitant la mobilisation des graisses par le tissu adipeux et leur oxydation par les muscles locomoteurs (Horowitz, 2003

). L’entraînement en endurance améliore la sensibilité lipolytique du tissu adipeux aux principales hormones lipolytiques (adrénaline et peptide atrial natriurétique) et restaure en partie les défauts de lipolyse constatés chez des sujets en surpoids ou obèses (Moro et Lafontan, 2013

). Pour ce qui est de l’oxydation des lipides, ces effets semblent largement relayés au niveau moléculaire par l’induction de PGC1α et l’activation des sirtuines 1 et 3 dans le muscle squelettique (Hawley et coll., 2014

). L’activité physique stimule aussi la production de LPL (lipase des lipoprotéines) par les muscles, ce qui facilite la clairance et l’extraction des triglycérides circulants contenus dans les VLDL (Seip et coll., 1995

). En diminuant la lipolyse basale des adipocytes, notamment au niveau viscéral, l’activité physique diminue le flux d’acides gras vers le foie et la stéatose hépatique (Bacchi et coll., 2013

). Ces adaptations fonctionnelles concourent à diminuer les taux de triglycérides circulants et corriger en partie la dyslipidémie accompagnant les diabètes, l’obésité et le syndrome métabolique dans un certain nombre d’affections chroniques (Earnest et coll., 2013

).
Troubles ostéo-articulaires
Quelques études montrent que l’activité physique freine la perte de cartilage en stimulant la production de l’un de ses constituants, le glycosaminoglycane, et en inhibant l’inflammation du cartilage. Plusieurs études démontrent également l’effet analgésique de l’activité physique par l’augmentation des concentrations de β-endorphine, de BDNF et de substance P (Benatti et Pedersen, 2015

).
Polyarthrite rhumatoïde
De la même manière que dans les troubles ostéo-articulaires, l’activité physique diminue l’inflammation systémique (TNFα et IL-1β) (Benatti et Pedersen, 2015

). En stimulant la force musculaire et l’équilibre, l’activité physique augmente les contraintes mécaniques sur l’os et la densité osseuse en facilitant la production de l’ostéocalcine par les ostéoblastes et la fixation du calcium (Coiro et coll., 2012

; Iwamoto et coll., 2004

).
Conclusion
On retrouve quasi systématiquement une perte de masse musculaire et souvent une augmentation de la masse grasse dans les maladies chroniques, en partie dues à une mobilité réduite et à une baisse de l’activité physique quotidienne, mais aussi à l’activation de processus cataboliques spécifiques à certaines pathologies. Ce déconditionnement musculaire plus ou moins marqué va déterminer une réduction progressive des capacités fonctionnelles de l’organisme, à l’origine d’une réduction de la qualité de vie des patients et de leur autonomie. Différents mécanismes moléculaires de ce déconditionnement ont été identifiés selon les pathologies (dérégulation du contrôle de l’équilibre entre la synthèse et la dégradation des protéines, augmentation du stress oxydatif, augmentation de l’expression de la myostatine).
En revanche, l’activité physique induit un certain nombre d’adaptations physiologiques et moléculaires dans le muscle squelettique et le tissu adipeux, qui relayent les bénéfices de l’activité physique sur les autres organes. Des données récentes suggèrent que les muscles produisent des signaux de communication à distance avec d’autres organes, appelés myokines : certaines sont capables de cibler l’hippocampe, pour influer sur la mémoire et la dépression (BDNF, GDNF), le foie, pour moduler la production hépatique de glucose (IL-6), les muscles, pour moduler la sensibilité à l’insuline (apeline), ainsi que de nombreux autres tissus et organes.
Une partie des effets bénéfiques de l’activité physique s’explique également par son effet anti-inflammatoire au niveau systémique et par la production de facteurs analgésiques (β-endorphines, substance P). Des mécanismes physiologiques et moléculaires potentiellement impliqués dans les effets bénéfiques de l’activité physique ont donc été identifiés dans chaque pathologie chronique et des études récentes ont montré que ces mécanismes pouvaient être modulés par le type d’activité physique (endurance ou force).
À partir de ces connaissances, une prochaine étape de recherche consistera à identifier les types d’exercices les mieux adaptés en termes de réponses cellulaires et moléculaires du tissu musculaire, afin d’optimiser la prise en charge de chaque pathologie chronique.
Références
[1] Acharyya S, Ladner KJ, Nelsen LL, et al . Cancer cachexia is regulated by selective targeting of skeletal muscle gene products.
J Clin Invest. 2004;
114:370
-8

[2] Adams V, Jiang H, Yu J, et al . Apoptosis in skeletal myocytes of patients with chronic heart failure is associated with exercise intolerance.
J Am Coll Cardiol. 1999;
33:959
-65

[3] Agudelo LZ, Femenia T, Orhan F, et al . Skeletal muscle PGC-1alpha1 modulates kynurenine metabolism and mediates resilience to stress-induced depression.
Cell. 2014;
159:33
-45

[4] Aguiar AS Jr, Stragier E, Da Luz Scheffer D, et al . Effects of exercise on mitochondrial function, neuroplasticity and anxio-depressive behavior of mice.
Neuroscience. 2014;
271:56
-63

[5] Akerstrom T, Laub L, Vedel K, et al . Increased skeletal muscle capillarization enhances insulin sensitivity.
Am J Physiol Endocrinol Metab. 2014;
307:E1105
-16

[6] Allen DL, Mccall GE, Loh AS, et al . Acute daily psychological stress causes increased atrophic gene expression and myostatin-dependent muscle atrophy.
Am J Physiol Regul Integr Comp Physiol. 2010;
299:R889
-98

[7] Anker SD, Negassa A, Coats AJ, et al . Prognostic importance of weight loss in chronic heart failure and the effect of treatment with angiotensin-converting-enzyme inhibitors: an observational study.
Lancet. 2003;
361:1077
-83

[8] Anker SD, Ponikowski P, Varney S, et al . Wasting as independent risk factor for mortality in chronic heart failure.
Lancet. 1997a;
349:1050
-3

[9] Anker SD, Swan JW, Volterrani M, et al . The influence of muscle mass, strength, fatigability and blood flow on exercise capacity in cachectic and non-cachectic patients with chronic heart failure.
Eur Heart J. 1997b;
18:259
-69

[10] Antoun S, Birdsell L, Sawyer MB, et al . Association of skeletal muscle wasting with treatment with sorafenib in patients with advanced renal cell carcinoma: results from a placebo-controlled study.
J Clin Oncol. 2010;
28:1054
-60

[11] Antoun S, Borget I, Lanoy E. Impact of sarcopenia on the prognosis and treatment toxicities in patients diagnosed with cancer.
Curr Opin Support Palliat Care. 2013;
7:383
-9

[12] Aoi W, Naito Y, Takagi T, et al . A novel myokine, secreted protein acidic and rich in cysteine (SPARC), suppresses colon tumorigenesis via regular exercise.
Gut. 2013;
62:882
-9

[13] Arany Z, Foo SY, Ma Y, et al . HIF-independent regulation of VEGF and angiogenesis by the transcriptional coactivator PGC-1alpha.
Nature. 2008;
451:1008
-12

[14] Argiles JM, Busquets S, Stemmler B, et al . Cancer cachexia: understanding the molecular basis.
Nat Rev Cancer. 2014;
14:754
-62

[15] Ash GI, Eicher JD, Pescatello LS. The promises and challenges of the use of genomics in the prescription of exercise for hypertension: the 2013 update.
Curr Hypertens Rev. 2013;
9:130
-47

[16] Bacchi E, Negri C, Targher G, et al . Both resistance training and aerobic training reduce hepatic fat content in type 2 diabetic subjects with nonalcoholic fatty liver disease (the RAED2 randomized trial).
Hepatology. 2013;
58:1287
-95

[17] Baker JF, Long J, Ibrahim S, et al . Are men at greater risk of lean mass deficits in rheumatoid arthritis?.
Arthritis Care Res (Hoboken). 2015;
67:112
-9

[18] Baltgalvis KA, Berger FG, Pena MM, et al . Interleukin-6 and cachexia in ApcMin/+ mice.
Am J Physiol Regul Integr Comp Physiol. 2008;
294:R393
-401

[19] Barreiro E, Schols AM, Polkey MI, et al . Cytokine profile in quadriceps muscles of patients with severe COPD.
Thorax. 2008;
63:100
-7

[20] Batista ML, Jr. , Olivan M, Alcantara PS, et al.
Adipose tissue-derived factors as potential biomarkers in cachectic cancer patients. Cytokine. 2013;
61:532
-9

[21] Batsis JA, Mackenzie TA, Barre LK, et al . Sarcopenia, sarcopenic obesity and mortality in older adults: results from the National health and nutrition examination survey III.
Eur J Clin Nutr. 2014;
68:1001
-7

[22] Baumgartner RN. Body composition in healthy aging.
Ann NY Acad Sci. 2000;
904:437
-48

[23] Benatti FB, Pedersen BK. Exercise as an anti-inflammatory therapy for rheumatic diseases-myokine regulation.
Nat Rev Rheumatol. 2015;
11:86
-97

[24] Bernard S, Leblanc P, Whittom F, et al . Peripheral muscle weakness in patients with chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 1998;
158:629
-34

[25] Besse-Patin A, Montastier E, Vinel C, et al . Effect of endurance training on skeletal muscle myokine expression in obese men: identification of apelin as a novel myokine.
Int J Obes (Lond). 2014;
38:707
-13

[26] Blauwhoff-Buskermolen S, Versteeg KS, De Van Der Schueren MA, et al . Loss of muscle mass during chemotherapy is predictive for poor survival of patients with metastatic colorectal cancer.
J Clin Oncol. 2016;
34:1339
-44

[27] Bodine SC, Stitt TN, Gonzalez M, et al . Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo.
Nat Cell Biol. 2001;
3:1014
-9

[28] Bonetto A, Aydogdu T, Kunzevitzky N, et al . STAT3 activation in skeletal muscle links muscle wasting and the acute phase response in cancer cachexia.
PLoS One. 2011;
6:e22538

[29] Borg J, Edstrom L, Bjerkenstedt L, et al . Muscle biopsy findings, conduction velocity and refractory period of single motor nerve fibres in schizophrenia.
J Neurol Neurosurg Psychiatry. 1987;
50:1655
-64

[30] Bossola M, Muscaritoli M, Costelli P, et al . Increased muscle proteasome activity correlates with disease severity in gastric cancer patients.
Ann Surg. 2003;
237:384
-9

[31] Bostrom P, Wu J, Jedrychowski MP, et al . A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis.
Nature. 2012;
481:463
-8

[32] Brink M, Price SR, Chrast J, et al . Angiotensin II induces skeletal muscle wasting through enhanced protein degradation and down-regulates autocrine insulin-like growth factor I.
Endocrinology. 2001;
142:1489
-96

[33] Bruce CR, Thrush AB, Mertz VA, et al . Endurance training in obese humans improves glucose tolerance and mitochondrial fatty acid oxidation and alters muscle lipid content.
Am J Physiol Endocrinol Metab. 2006;
291:E99
-107

[34] Busquets S, Figueras MT, Fuster G, et al . Anticachectic effects of formoterol: a drug for potential treatment of muscle wasting.
Cancer Res. 2004;
64:6725
-31

[35] Cai D, Frantz JD, Tawa NE Jr, et al . IKKbeta/NF-kappaB activation causes severe muscle wasting in mice.
Cell. 2004;
119:285
-98

[36] Carey AL, Steinberg GR, Macaulay SL, et al . Interleukin-6 increases insulin-stimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP-activated protein kinase.
Diabetes. 2006;
55:2688
-97

[37] Carneiro IP, Mazurak VC, Prado CM. Clinical implications of sarcopenic obesity in cancer.
Curr Oncol Rep. 2016;
18:62

[38] Chen CH, Ho C, Huang YZ, et al . Hand-grip strength is a simple and effective outcome predictor in esophageal cancer following esophagectomy with reconstruction: a prospective study.
J Cardiothorac Surg. 2011;
6:98

[39] Christensen HM, Kistorp C, Schou M, et al . Prevalence of cachexia in chronic heart failure and characteristics of body composition and metabolic status.
Endocrine. 2013;
43:626
-34

[40] Church T. Exercise in obesity, metabolic syndrome, and diabetes.
Prog Cardiovasc Dis. 2011;
53:412
-8

[41] Church TS, Martin CK, Thompson AM, et al . Changes in weight, waist circumference and compensatory responses with different doses of exercise among sedentary, overweight postmenopausal women.
PLoS One. 2009;
4:e4515

[42] Church TS, Thomas DM, Tudor-Locke C, et al . Trends over 5 decades in US occupation-related physical activity and their associations with obesity.
PLoS One. 2011;
6:e19657

[43] Coats AJ, Adamopoulos S, Radaelli A, et al . Controlled trial of physical training in chronic heart failure.
Exercise performance, hemodynamics, ventilation, and autonomic function. Circulation. 1992;
85:2119
-31

[44] Coiro V, Volpi R, Cataldo S, et al . Effect of physiological exercise on osteocalcin levels in subjects with adrenal incidentaloma.
J Endocrinol Invest. 2012;
35:357
-8

[45] Costelli P, Muscaritoli M, Bonetto A, et al . Muscle myostatin signalling is enhanced in experimental cancer cachexia.
Eur J Clin Invest. 2008;
38:531
-8

[46] Crampes F, Beauville M, Riviere D, et al . Effect of physical training in humans on the response of isolated fat cells to epinephrine.
J Appl Physiol (1985). 1986;
61:25
-9

[47] Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al . Sarcopenia : European consensus on definition and diagnosis: Report of the European working group on sarcopenia in older people.
Age Ageing. 2010;
39:412
-23

[48] De Glisezinski I, Crampes F, Harant I, et al . Endurance training changes in lipolytic responsiveness of obese adipose tissue.
Am J Physiol. 1998;
275:E951
-6

[49] De Glisezinski I, Moro C, Pillard F, et al . Aerobic training improves exercise-induced lipolysis in SCAT and lipid utilization in overweight men.
Am J Physiol Endocrinol Metab. 2003;
285:E984
-90

[50] Dejong CH, Busquets S, Moses AG, et al . Systemic inflammation correlates with increased expression of skeletal muscle ubiquitin but not uncoupling proteins in cancer cachexia.
Oncol Rep. 2005;
14:257
-63

[51] Delmonico MJ, Harris TB, Lee JS, et al . Alternative definitions of sarcopenia, lower extremity performance, and functional impairment with aging in older men and women.
J Am Geriatr Soc. 2007;
55:769
-74

[52] Demopoulos L, Bijou R, Fergus I, et al . Exercise training in patients with severe congestive heart failure: enhancing peak aerobic capacity while minimizing the increase in ventricular wall stress.
J Am Coll Cardiol. 1997;
29:597
-603

[53] Desgeorges MM, Devillard X, Toutain J, et al . Molecular mechanisms of skeletal muscle atrophy in a mouse model of cerebral ischemia.
Stroke. 2015;
46:1673
-80

[54] Donaldson AV, Maddocks M, Martolini D, et al . Muscle function in COPD: a complex interplay.
Int J Chron Obstruct Pulmon Dis. 2012;
7:523
-35

[55] Doucet M, Russell AP, Leger B, et al . Muscle atrophy and hypertrophy signaling in patients with chronic obstructive pulmonary disease.
Am J Respir Crut Care Med. 2007;
176:261
-9

[56] Dowlati Y, Herrmann N, Swardfager W, et al . A meta-analysis of cytokines in major depression.
Biol Psychiatry. 2010;
67:446
-57

[57] Dube JJ, Amati F, Toledo FG, et al . Effects of weight loss and exercise on insulin resistance, and intramyocellular triacylglycerol, diacylglycerol and ceramide.
Diabetologia. 2011;
54:1147
-56

[58] Earnest CP, Johannsen NM, Swift DL, et al . Dose effect of cardiorespiratory exercise on metabolic syndrome in postmenopausal women.
Am J Cardiol. 2013;
111:1805
-11

[59] Egan B, Zierath JR. Exercise metabolism and the molecular regulation of skeletal muscle adaptation.
Cell Metab. 2013;
17:162
-84

[60] Eley HL, Tisdale MJ. Skeletal muscle atrophy, a link between depression of protein synthesis and increase in degradation.
J Biol Chem. 2007;
282:7087
-97

[61] English C, Mclennan H, Thoirs K, et al . Loss of skeletal muscle mass after stroke: a systematic review.
Int J Stroke. 2010;
5:395
-402

[62] Evans WJ, Morley JE, Argiles J, et al . Cachexia: a new definition.
Clin Nutr. 2008;
27:793
-9

[63] Fermoselle C, Rabinovich R, Ausin P, et al . Does oxidative stress modulate limb muscle atrophy in severe COPD patients?.
Eur Respir J. 2012;
40:851
-62

[64] Firth J, Cotter J, Elliott R, et al . A systematic review and meta-analysis of exercise interventions in schizophrenia patients.
Psychol Med. 2015;
45:1343
-61

[65] Fisher FM, Kleiner S, Douris N, et al . FGF21 regulates PGC-1alpha and browning of white adipose tissues in adaptive thermogenesis.
Genes Dev. 2012;
26:271
-81

[66] Flyckt L, Borg J, Borg K, et al . Muscle biopsy, macro EMG, and clinical characteristics in patients with schizophrenia.
Biol Psychiatry. 2000;
47:991
-9

[67] Friedrichsen M, Mortensen B, Pehmoller C, et al . Exercise-induced AMPK activity in skeletal muscle: role in glucose uptake and insulin sensitivity.
Mol Cell Endocrinol. 2013;
366:204
-14

[68] Fulster S, Tacke M, Sandek A, et al . Muscle wasting in patients with chronic heart failure: results from the studies investigating co-morbidities aggravating heart failure (SICA-HF).
Eur Heart J. 2013;
34:512
-9

[69] Gallot YS, Durieux AC, Castells J, et al . Myostatin gene inactivation prevents skeletal muscle wasting in cancer.
Cancer Res. 2014;
74:7344
-56

[70] Gariballa S, Alessa A. Sarcopenia: prevalence and prognostic significance in hospitalized patients.
Clin Nutr. 2013;
32:772
-6

[71] Gielen S, Adams V, Mobius-Winkler S, et al . Anti-inflammatory effects of exercise training in the skeletal muscle of patients with chronic heart failure.
J Am Coll Cardiol. 2003;
42:861
-8

[72] Gielen S, Sandri M, Kozarez I, et al . Exercise training attenuates MuRF-1 expression in the skeletal muscle of patients with chronic heart failure independent of age: the randomized Leipzig exercise intervention in chronic heart failure and aging catabolism study.
Circulation. 2012;
125:2716
-27

[73] Gillen JB, Martin BJ, Macinnis MJ, et al . Twelve weeks of sprint interval training improves indices of cardiometabolic health similar to traditional endurance training despite a five-fold lower exercise volume and time commitment.
PLoS One. 2016;
11:e0154075

[74] Goodman CA. The role of mTORC1 in regulating protein synthesis and skeletal muscle mass in response to various mechanical stimuli.
Rev Physiol Biochem Pharmacol. 2014;
166:43
-95

[75] Goodpaster BH, Park SW, Harris TB, et al . The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study.
J Gerontol A Biol Sci Med Sci. 2006;
61:1059
-64

[76] Gosker HR, Engelen MP, Van Mameren H, et al . Muscle fiber type IIX atrophy is involved in the loss of fat-free mass in chronic obstructive pulmonary disease.
Am J Clin Nutr. 2002;
76:113
-9

[77] Gould DW, Lahart I, Carmichael AR, et al . Cancer cachexia prevention via physical exercise: molecular mechanisms.
J Cachexia, Sarcopenia Muscle. 2013;
4:111
-24

[78] Grande AJ, Silva V, Riera R, et al . Exercise for cancer cachexia in adults.
Cochrane Database Syst Rev. 2014;
11:Cd010804

[79] Grimby G, Saltin B. The ageing muscle.
Clin Physiol. 1983;
3:209
-18

[80] Guerrero N, Bunout D, Hirsch S, et al . Premature loss of muscle mass and function in type 2 diabetes.
Diabetes Res Clin Pract. 2016;
117:32
-8

[81] Hachisuka K, Umezu Y, Ogata H. Disuse muscle atrophy of lower limbs in hemiplegic patients.
Arch Phys Med Rehabil. 1997;
78:13
-8

[82] Hafer-Macko CE, Yu S, Ryan AS, et al . Elevated tumor necrosis factor-alpha in skeletal muscle after stroke.
Stroke. 2005;
36:2021
-3

[83] Hambrecht R, Schulze PC, Gielen S, et al . Reduction of insulin-like growth factor-I expression in the skeletal muscle of noncachectic patients with chronic heart failure.
J Am Coll Cardiol. 2002;
39:1175
-81

[84] Harrington D, Anker SD, Chua TP, et al . Skeletal muscle function and its relation to exercise tolerance in chronic heart failure.
J Am Coll Cardiol. 1997;
30:1758
-64

[85] Hawley JA, Hargreaves M, Joyner MJ, et al . Integrative biology of exercise.
Cell. 2014;
159:738
-49

[86] Hayot M, Rodriguez J, Vernus B, et al . Myostatin up-regulation is associated with the skeletal muscle response to hypoxic stimuli.
Mol Cell Endocrinol. 2011;
332:38
-47

[87] Heineke J, Auger-Messier M, Xu J, et al . Genetic deletion of myostatin from the heart prevents skeletal muscle atrophy in heart failure.
Circulation. 2010;
121:419
-25

[88] Hittel DS, Berggren JR, Shearer J, et al . Increased secretion and expression of myostatin in skeletal muscle from extremely obese women.
Diabetes. 2009;
58:30
-8

[89] Horai N, Nagaoka T, Higuchi I, et al . Muscle wasting associated with pathologic change is a risk factor for the exacerbation of joint swelling in collagen-induced arthritis in cynomolgus monkeys.
BMC Musculoskelet Disord. 2013;
14:205

[90] Horowitz JF. Fatty acid mobilization from adipose tissue during exercise.
Trends Endocrinol Metab. 2003;
14:386
-92

[91] Hughes VA, Frontera WR, Wood M, et al . Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health.
J Gerontol A Biol Sci Med Sci. 2001;
56:B209
-17

[92] Hunsberger JG, Newton SS, Bennett AH, et al . Antidepressant actions of the exercise-regulated gene VGF.
Nat Med. 2007;
13:1476
-82

[93] Hussey SE, Mcgee SL, Garnham A, et al . Exercise increases skeletal muscle GLUT4 gene expression in patients with type 2 diabetes.
Diabetes Obes Metab. 2012;
14:768
-71

[94] Iannuzzi-Sucich M, Prestwood KM, Kenny AM. Prevalence of sarcopenia and predictors of skeletal muscle mass in healthy, older men and women.
J Gerontol A Biol Sci Med Sci. 2002;
57:M772
-7

[95] Imai K, Takai K, Hanai T, et al . Skeletal muscle depletion predicts the prognosis of patients with hepatocellular carcinoma treated with sorafenib.
Int J Mol Sci. 2015;
16:9612
-24

[96] Ingram KH, Hill H, Moellering DR, et al . Skeletal muscle lipid peroxidation and insulin resistance in humans.
J Clin Endocrinol Metab. 2012;
97:E1182
-6

[97] Iritani S, Imai K, Takai K, et al . Skeletal muscle depletion is an independent prognostic factor for hepatocellular carcinoma.
J Gastroenterol. 2015;
50:323
-32

[98] Iwamoto J, Shimamura C, Takeda T, et al . Effects of treadmill exercise on bone mass, bone metabolism, and calciotropic hormones in young growing rats.
J Bone Miner Metab. 2004;
22:26
-31

[99] Jakobsson F, Edstrom L, Grimby L, et al . Disuse of anterior tibial muscle during locomotion and increased proportion of type II fibres in hemiplegia.
J Neurol Sci. 1991;
105:49
-56

[100] Janssen I, Baumgartner RN, Ross R, et al . Skeletal muscle cutpoints associated with elevated physical disability risk in older men and women.
Am J Epidemiol. 2004;
159:413
-21

[101] Janssen I, Heymsfield SB, Ross R. Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability.
J Am Geriatr Soc. 2002;
50:889
-96

[102] Jones SE, Maddocks M, Kon SS, et al . Sarcopenia in COPD : prevalence, clinical correlates and response to pulmonary rehabilitation.
Thorax. 2015;
70:213
-8

[103] Khal J, Hine AV, Fearon KC, et al . Increased expression of proteasome subunits in skeletal muscle of cancer patients with weight loss.
Int J Biochem Cell Biol. 2005;
37:2196
-206

[104] Kharitonenkov A, Shiyanova TL, Koester A, et al . FGF-21 as a novel metabolic regulator.
J Clin Invest. 2005;
115:1627
-35

[105] Kilgour RD, Vigano A, Trutschnigg B, et al . Handgrip strength predicts survival and is associated with markers of clinical and functional outcomes in advanced cancer patients.
Support Care Cancer. 2013;
21:3261
-70

[106] Kim NH, Kim HS, Eun CR, et al . Depression is associated with sarcopenia, not central obesity, in elderly korean men.
J Am Geriatr Soc. 2011;
59:2062
-8

[107] Kim TN, Choi KM. Sarcopenia : definition, epidemiology, and pathophysiology.
J Bone Metab. 2013;
20:1
-10

[108] Kim TN, Park MS, Yang SJ, et al . Prevalence and determinant factors of sarcopenia in patients with type 2 diabetes: the Korean sarcopenic obesity study (KSOS).
Diabetes Care. 2010;
33:1497
-9

[109] Kivircik BB, Alptekin K, Caliskan S, et al . Effect of clozapine on serum leptin, insulin levels, and body weight and composition in patients with schizophrenia.
Prog Neuropsychopharmacol Biol Psychiatry. 2003;
27:795
-9

[110] Knaepen K, Goekint M, Heyman EM, et al . Neuroplasticity – exercise-induced response of peripheral brain-derived neurotrophic factor: a systematic review of experimental studies in human subjects.
Sports Med. 2010;
40:765
-801

[111] Knowler WC, Barrett-Connor E, Fowler SE, et al . Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin.
N Engl J Med. 2002;
346:393
-403

[112] Kramer HR, Fontaine KR, Bathon JM, et al . Muscle density in rheumatoid arthritis: associations with disease features and functional outcomes.
Arthritis Rheum. 2012;
64:2438
-50

[113] Lambertsen KL, Biber K, Finsen B. Inflammatory cytokines in experimental and human stroke.
J Cereb Blood Flow Metab. 2012;
32:1677
-98

[114] LaMonte MJ, Blair SN, Church TS. Physical activity and diabetes prevention.
J Appl Physiol. 2005;
99:1205
-13

[115] Landin S, Hagenfeldt L, Saltin B, et al . Muscle metabolism during exercise in hemiparetic patients.
Clin Sci Mol Med. 1977;
53:257
-69

[116] Lecker SH, Jagoe RT, Gilbert A, et al . Multiple types of skeletal muscle atrophy involve a common program of changes in gene expression.
Faseb J. 2004;
18:39
-51

[117] Leenders M, Verdijk LB, Van Der Hoeven L, et al . Patients with type 2 diabetes show a greater decline in muscle mass, muscle strength, and functional capacity with aging.
J Am Med Dir Assoc. 2013;
14:585
-92

[118] Lemire BB, Debigare R, Dube A, et al . MAPK signaling in the quadriceps of patients with chronic obstructive pulmonary disease.
J Appl Physiol (1985). 2012;
113:159
-66

[119] Lieffers JR, Bathe OF, Fassbender K, et al . Sarcopenia is associated with postoperative infection and delayed recovery from colorectal cancer resection surgery.
Br J Cancer. 2012;
107:931
-6

[120] Lin J, Wu H, Tarr PT, et al . Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres.
Nature. 2002;
418:797
-801

[121] Lira FS, Yamashita AS, Rosa JC, et al . Hypothalamic inflammation is reversed by endurance training in anorectic-cachectic rats.
Nutr Metab (Lond). 2011;
8:60

[122] Little JP, Gillen JB, Percival ME, et al . Low-volume high-intensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes.
J Appl Physiol (1985). 2011;
111:1554
-60

[123] Liu CM, Yang Z, Liu CW, et al . Effect of RNA oligonucleotide targeting Foxo-1 on muscle growth in normal and cancer cachexia mice.
Cancer Gene Ther. 2007;
14:945
-52

[124] Liu CM, Yang Z, Liu CW, et al . Myostatin antisense RNA-mediated muscle growth in normal and cancer cachexia mice.
Gene Ther. 2008;
15:155
-60

[125] Llovera M, Garcia-Martinez C, Agell N, et al . Ubiquitin gene expression is increased in skeletal muscle of tumour-bearing rats.
FEBS Lett. 1994;
338:311
-8

[126] Loumaye A, De Barsy M, Nachit M, et al . Role of activin A and myostatin in human cancer cachexia.
J Clin Endocrinol Metab. 2015;
100:2030
-8

[127] MacDonald AJ, Johns N, Stephens N, et al . Habitual myofibrillar protein synthesis is normal in patients with upper GI cancer cachexia.
Clin Cancer Res. 2015;
21:1734
-40

[128] Mancini DM, Coyle E, Coggan A, et al . Contribution of intrinsic skeletal muscle changes to 31P NMR skeletal muscle metabolic abnormalities in patients with chronic heart failure.
Circulation. 1989;
80:1338
-46

[129] Mancini DM, Walter G, Reichek N, et al . Contribution of skeletal muscle atrophy to exercise intolerance and altered muscle metabolism in heart failure.
Circulation. 1992;
85:1364
-73

[130] Marquis K, Debigare R, Lacasse Y, et al . Midthigh muscle cross-sectional area is a better predictor of mortality than body mass index in patients with chronic obstructive pulmonary disease.
Am J Respir Crit Care Med. 2002;
166:809
-13

[131] Martin L, Birdsell L, Macdonald N, et al . Cancer cachexia in the age of obesity: skeletal muscle depletion is a powerful prognostic factor, independent of body mass index.
J Clin Oncol. 2013;
31:1539
-47

[132] McCarthy B, Casey D, Devane D, et al . Pulmonary rehabilitation for chronic obstructive pulmonary disease.
Cochrane Database Syst Rev. 2015;
2:CD003793

[133] McPherron AC, Lawler AM, Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member.
Nature. 1997;
387:83
-90

[134] Meyer K, Schwaibold M, Westbrook S, et al . Effects of short-term exercise training and activity restriction on functional capacity in patients with severe chronic congestive heart failure.
Am J Cardiol. 1996;
78:1017
-22

[135] Morley JE, Thomas DR, Wilson MM. Cachexia : pathophysiology and clinical relevance.
Am J Clin Nutr. 2006;
83:735
-43

[136] Moro C, Lafontan M. Natriuretic peptides and cGMP signaling control of energy homeostasis.
Am J Physiol Heart Circ Physiol. 2013;
304:H358
-68

[137] Moro C, Pasarica M, Elkind-Hirsch K, et al . Aerobic exercise training improves atrial natriuretic peptide and catecholamine-mediated lipolysis in obese women with polycystic ovary syndrome.
J Clin Endocrinol Metab. 2009;
94:2579
-86

[138] Moro C, Pillard F, De Glisezinski I, et al . Training enhances ANP lipid-mobilizing action in adipose tissue of overweight men.
Med Sci Sports Exerc. 2005;
37:1126
-32

[139] Muscaritoli M, Anker SD, Argiles J, et al . Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by Special interest groups (SIG) “cachexia-anorexia in chronic wasting diseases” and “nutrition in geriatrics”.
Clin Nutr. 2010;
29:154
-9

[140] Muscaritoli M, Lucia S, Molfino A, et al . Muscle atrophy in aging and chronic diseases: is it sarcopenia or cachexia ?.
Intern Emerg Med. 2013;
8:553
-60

[141] Narumi T, Watanabe T, Kadowaki S, et al . Sarcopenia evaluated by fat-free mass index is an important prognostic factor in patients with chronic heart failure.
Eur J Intern Med. 2015;
26:118
-22

[142] Nilsson BM, Forslund AH, Olsson RM, et al . Differences in resting energy expenditure and body composition between patients with schizophrenia and healthy controls.
Acta Psychiatr Scand. 2006;
114:27
-35

[143] Nussbaumer-Ochsner Y, Rabe KF. Systemic manifestations of COPD.
Chest. 2011;
139:165
-73

[144] Op Den Kamp CM, Langen RC, Snepvangers FJ, et al . Nuclear transcription factor kappa B activation and protein turnover adaptations in skeletal muscle of patients with progressive stages of lung cancer cachexia.
Am J Clin Nutr. 2013;
98:738
-48

[145] Palsgaard J, Brons C, Friedrichsen M, et al . Gene expression in skeletal muscle biopsies from people with type 2 diabetes and relatives: differential regulation of insulin signaling pathways.
PLoS One. 2009;
4:e6575

[146] Park SW, Goodpaster BH, Strotmeyer ES, et al . Accelerated loss of skeletal muscle strength in older adults with type 2 diabetes: the health, aging, and body composition study.
Diabetes Care. 2007;
30:1507
-12

[147] Pedersen BK, Febbraio MA. Muscles, exercise and obesity: skeletal muscle as a secretory organ.
Nat Rev Endocrinol. 2012;
8:457
-65

[148] Pedersen BK, Saltin B. Evidence for prescribing exercise as therapy in chronic disease.
Scand J Med Sci Sports. 2006;
16 (suppl 1):3
-63

[149] Pedersen BK, Saltin B. Exercise as medicine – evidence for prescribing exercise as therapy in 26 different chronic diseases.
Scand J Med Sci Sports. 2015;
25 (suppl 3):1
-72

[150] Pehmoller C, Brandt N, Birk JB, et al . Exercise alleviates lipid-induced insulin resistance in human skeletal muscle-signaling interaction at the level of TBC1 domain family member 4.
Diabetes. 2012;
61:2743
-52

[151] Penna F, Costamagna D, Pin F, et al . Autophagic degradation contributes to muscle wasting in cancer cachexia.
Am J Pathol. 2013;
182:1367
-78

[152] Pereira S, Marliss EB, Morais JA, et al . Insulin resistance of protein metabolism in type 2 diabetes.
Diabetes. 2008;
57:56
-63

[153] Petersen AM, Mittendorfer B, Magkos F, et al . Physical activity counteracts increased whole-body protein breakdown in chronic obstructive pulmonary disease patients.
Scand J Med Sci Sports. 2008;
18:557
-64

[154] Plant PJ, Brooks D, Faughnan M, et al . Cellular markers of muscle atrophy in chronic obstructive pulmonary disease.
Am J Respir Cell Mol Biol. 2010;
42:461
-71

[155] Polak J, Moro C, Klimcakova E, et al . Dynamic strength training improves insulin sensitivity and functional balance between adrenergic alpha 2A and beta pathways in subcutaneous adipose tissue of obese subjects.
Diabetologia. 2005;
48:2631
-40

[156] Porporato PE. Understanding cachexia as a cancer metabolism syndrome.
Oncogenesis. 2016;
5:e200

[157] Potvin S, Stip E, Sepehry AA, et al . Inflammatory cytokine alterations in schizophrenia: a systematic quantitative review.
Biol Psychiatry. 2008;
63:801
-8

[158] Powers SK, Smuder AJ, Judge AR. Oxidative stress and disuse muscle atrophy: cause or consequence?.
Curr Opin Clin Nutr Metab Care. 2012;
15:240
-5

[159] Prado CM, Baracos VE, Mccargar LJ, et al . Sarcopenia as a determinant of chemotherapy toxicity and time to tumor progression in metastatic breast cancer patients receiving capecitabine treatment.
Clin Cancer Res. 2009;
15:2920
-6

[160] Prado CM, Lieffers JR, Mccargar LJ, et al . Prevalence and clinical implications of sarcopenic obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study.
Lancet Oncol. 2008;
9:629
-35

[161] Puig-Vilanova E, Rodriguez DA, Lloreta J, et al . Oxidative stress, redox signaling pathways, and autophagy in cachectic muscles of male patients with advanced COPD and lung cancer.
Free Radic Biol Med. 2015;
79:91
-108

[162] Radovanovic S, Savic-Radojevic A, Pljesa-Ercegovac M, et al . Markers of oxidative damage and antioxidant enzyme activities as predictors of morbidity and mortality in patients with chronic heart failure.
J Card Fail. 2012;
18:493
-501

[163] Rantanen T, Harris T, Leveille SG, et al . Muscle strength and body mass index as long-term predictors of mortality in initially healthy men.
J Gerontol A Biol Sci Med Sci. 2000;
55:M168
-73

[164] Rao RR, Long JZ, White JP, et al . Meteorin-like is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis.
Cell. 2014;
157:1279
-91

[165] Remels AH, Gosker HR, Langen RC, et al . The mechanisms of cachexia underlying muscle dysfunction in COPD.
J Appl Physiol (1985). 2013;
114:1253
-62

[166] Rhoads MG, Kandarian SC, Pacelli F, et al . Expression of NF-kappaB and IkappaB proteins in skeletal muscle of gastric cancer patients.
Eur J Cancer. 2010;
46:191
-7

[167] Richterova B, Stich V, Moro C, et al . Effect of endurance training on adrenergic control of lipolysis in adipose tissue of obese women.
J Clin Endocrinol Metab. 2004;
89:1325
-31

[168] Riviere D, Crampes F, Beauville M, et al . Lipolytic response of fat cells to catecholamines in sedentary and exercise-trained women.
J Appl Physiol (1985). 1989;
66:330
-5

[169] Roberts LD, Bostrom P, O’sullivan JF, et al . Beta-aminoisobutyric acid induces browning of white fat and hepatic beta-oxidation and is inversely correlated with cardiometabolic risk factors.
Cell Metab. 2014;
19:96
-108

[170] Roig E, Perez-Villa F, Morales M, et al . Clinical implications of increased plasma angiotensin II despite ACE inhibitor therapy in patients with congestive heart failure.
Eur Heart J. 2000;
21:53
-7

[171] Rolland Y, Abellan Van Kan G, Gillette-Guyonnet S, et al . Cachexia versus sarcopenia.
Curr Opin Clin Nutr Metab Care. 2011;
14:15
-21

[172] Rom O, Reznick AZ. The role of E3 ubiquitin-ligases MuRF-1 and MAFbx in loss of skeletal muscle mass.
Free Radic Biol Med. 2016;
98:218
-30

[173] Rosenberg I. Summary comments: epidemiological and methodological problems in determining nutritional status of older persons.
Am J Clin Nutr. 1989;
50:1231
-3

[174] Ryan AS, Buscemi A, Forrester L, et al . Atrophy and intramuscular fat in specific muscles of the thigh: associated weakness and hyperinsulinemia in stroke survivors.
Neurorehabil Neural Repair. 2011;
25:865
-72

[175] Ryan AS, Dobrovolny CL, Silver KH, et al . Cardiovascular fitness after stroke: role of muscle mass and gait deficit severity.
J Stroke Cerebrovasc Dis. 2000;
9:185
-91

[176] Ryan AS, Dobrovolny CL, Smith GV, et al . Hemiparetic muscle atrophy and increased intramuscular fat in stroke patients.
Arch Phys Med Rehabil. 2002;
83:1703
-7

[177] Saarni SE, Saarni SI, Fogelholm M, et al . Body composition in psychotic disorders: a general population survey.
Psychol Med. 2009;
39:801
-10

[178] Samuel VT, Shulman GI. Mechanisms for insulin resistance: common threads and missing links.
Cell. 2012;
148:852
-71

[179] Sandri M, Sandri C, Gilbert A, et al . Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy.
Cell. 2004;
117:399
-412

[180] Sayer AA, Dennison EM, Syddall HE, et al . Type 2 diabetes, muscle strength, and impaired physical function: the tip of the iceberg ?.
Diabetes Care. 2005;
28:2541
-2

[181] Schmitt TL, Martignoni ME, Bachmann J, et al . Activity of the Akt-dependent anabolic and catabolic pathways in muscle and liver samples in cancer-related cachexia.
J Mol Med. 2007;
85:647
-54

[182] Schutz Y, Kyle UU, Pichard C. Fat-free mass index and fat mass index percentiles in Caucasians aged 18-98 y.
Int J Obes Relat Metab Disord. 2002;
26:953
-60

[183] Seip RL, Angelopoulos TJ, Semenkovich CF. Exercise induces human lipoprotein lipase gene expression in skeletal muscle but not adipose tissue.
Am J Physiol. 1995;
268:E229
-36

[184] Silva RA, Vieira RP, Duarte AC, et al . Aerobic training reverses airway inflammation and remodelling in an asthma murine model.
Eur Respir J. 2010;
35:994
-1002

[185] Sjoblom B, Gronberg BH, Benth JS, et al . Low muscle mass is associated with chemotherapy-induced haematological toxicity in advanced non-small cell lung cancer.
Lung Cancer. 2015;
90:85
-91

[186] Song YH, Li Y, Du J, et al . Muscle-specific expression of IGF-1 blocks angiotensin II-induced skeletal muscle wasting.
J Clin Invest. 2005;
115:451
-8

[187] Sparks LM, Johannsen NM, Church TS, et al . Nine months of combined training improves ex vivo skeletal muscle metabolism in individuals with type 2 diabetes.
J Clin Endocrinol Metab. 2013;
98:1694
-702

[188] Springer J, Schust S, Peske K, et al . Catabolic signaling and muscle wasting after acute ischemic stroke in mice : indication for a stroke-specific sarcopenia.
Stroke. 2014;
45:3675
-83

[189] Stene GB, Helbostad JL, Balstad TR, et al . Effect of physical exercise on muscle mass and strength in cancer patients during treatment: a systematic review.
Critical Rev Oncol Hematol. 2013;
88:573
-93

[190] Sugawara N, Yasui-Furukori N, Tsuchimine S, et al . Body composition in patients with schizophrenia: Comparison with healthy controls.
Ann Gen Psychiatry. 2012;
11:11

[191] Sunnerhagen KS, Svantesson U, Lonn L, et al . Upper motor neuron lesions: their effect on muscle performance and appearance in stroke patients with minor motor impairment.
Arch Phys Med Rehabil. 1999;
80:155
-61

[192] Swallow EB, Reyes D, Hopkinson NS, et al . Quadriceps strength predicts mortality in patients with moderate to severe chronic obstructive pulmonary disease.
Thorax. 2007;
62:115
-20

[193] Sylow L, Kleinert M, Pehmoller C, et al . Akt and Rac1 signaling are jointly required for insulin-stimulated glucose uptake in skeletal muscle and downregulated in insulin resistance.
Cell Signal. 2014;
26:323
-31

[194] Tantiwong P, Shanmugasundaram K, Monroy A, et al . NF-kappaB activity in muscle from obese and type 2 diabetic subjects under basal and exercise-stimulated conditions.
Am J Physiol Endocrinol Metab. 2010;
299:E794
-801

[195] Teixeira-Salmela LF, Olney SJ, Nadeau S, et al . Muscle strengthening and physical conditioning to reduce impairment and disability in chronic stroke survivors.
Arch Phys Med Rehabil. 1999;
80:1211
-8

[196] Tisdale MJ. Mechanisms of cancer cachexia.
Physiol Rev. 2009;
89:381
-410

[197] Tisdale MJ. Reversing cachexia.
Cell. 2010;
142:511
-2

[198] Toffola ED, Sparpaglione D, Pistorio A, et al . Myoelectric manifestations of muscle changes in stroke patients.
Arch Phys Med Rehabil. 2001;
82:661
-5

[199] Tsang HW, Fung KM. A review on neurobiological and psychological mechanisms underlying the anti-depressive effect of qigong exercise.
J Health Psychol. 2008;
13:857
-63

[200] Tuomilehto J, Lindstrom J, Eriksson JG, et al . Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance.
N Engl J Med. 2001;
344:1343
-50

[201] Vogiatzis I, Simoes DC, Stratakos G, et al . Effect of pulmonary rehabilitation on muscle remodelling in cachectic patients with COPD.
Eur Respir J. 2010;
36:301
-10

[202] Volaklis KA, Halle M, Meisinger C. Muscular strength as a strong predictor of mortality: a narrative review.
Eur J Intern Med. 2015;
26:303
-10

[203] Von Walden F, Jakobsson F, Edstrom L, et al . Altered autophagy gene expression and persistent atrophy suggest impaired remodeling in chronic hemiplegic human skeletal muscle.
Muscle Nerve. 2012;
46:785
-92

[204] White JP, Baynes JW, Welle SL, et al . The regulation of skeletal muscle protein turnover during the progression of cancer cachexia in the Apc(Min/+) mouse.
PLoS One. 2011;
6:e24650

[205] Williams JP, Phillips BE, Smith K, et al . Effect of tumor burden and subsequent surgical resection on skeletal muscle mass and protein turnover in colorectal cancer patients.
Am J Clin Nutr. 2012;
96:1064
-70

[206] Wilson JM, Marin PJ, Rhea MR, et al . Concurrent training: a meta-analysis examining interference of aerobic and resistance exercises.
J Strength Cond Res. 2012;
26:2293
-307

[207] Wrann CD, White JP, Salogiannnis J, et al . Exercise induces hippocampal BDNF through a PGC-1alpha/FNDC5 pathway.
Cell Metab. 2013;
18:649
-59

[208] Yoshida T, Semprun-Prieto L, Sukhanov S, et al . IGF-1 prevents ANG II-induced skeletal muscle atrophy via Akt- and Foxo-dependent inhibition of the ubiquitin ligase atrogin-1 expression.
Am J Physiol Heart Circ Physiol. 2010;
298:H1565
-70

→ Aller vers SYNTHESE
 ), la cachexie est définie comme « un syndrome métabolique complexe associé à une pathologie sous-jacente, et caractérisé par une perte de masse musculaire sévère associée ou non à une perte de tissu adipeux. La caractéristique majeure de la cachexie est la perte de poids chez l’adulte ». Le critère diagnostique principal pour la cachexie est une perte de poids corporel supérieure à 5 % sur les 12 derniers mois ou moins (Evans et coll., 2008
), la cachexie est définie comme « un syndrome métabolique complexe associé à une pathologie sous-jacente, et caractérisé par une perte de masse musculaire sévère associée ou non à une perte de tissu adipeux. La caractéristique majeure de la cachexie est la perte de poids chez l’adulte ». Le critère diagnostique principal pour la cachexie est une perte de poids corporel supérieure à 5 % sur les 12 derniers mois ou moins (Evans et coll., 2008 ). Le délai dépendra de la pathologie, plus court pour le cancer (6 mois) et plus long pour l’insuffisance cardiaque, rénale ou respiratoire (12 mois). Un indice de masse corporelle < 20 kg.m-2 est également considéré suffisant pour établir le diagnostic de la cachexie (Evans et coll., 2008
). Le délai dépendra de la pathologie, plus court pour le cancer (6 mois) et plus long pour l’insuffisance cardiaque, rénale ou respiratoire (12 mois). Un indice de masse corporelle < 20 kg.m-2 est également considéré suffisant pour établir le diagnostic de la cachexie (Evans et coll., 2008  ; Rolland et coll., 2011
; Rolland et coll., 2011 ). Associée à ce critère principal, la présence d’au moins 3 des critères suivants doit également être retrouvée :
). Associée à ce critère principal, la présence d’au moins 3 des critères suivants doit également être retrouvée : ) ;
) ; ) ;
) ; ).
). ). La sarcopénie est donc caractérisée par une perte progressive et généralisée de la masse et de la force musculaire squelettique avec un risque d’effets indésirables comme le handicap physique, la mauvaise qualité de la vie et de façon ultime, la mort (Delmonico et coll., 2007
). La sarcopénie est donc caractérisée par une perte progressive et généralisée de la masse et de la force musculaire squelettique avec un risque d’effets indésirables comme le handicap physique, la mauvaise qualité de la vie et de façon ultime, la mort (Delmonico et coll., 2007 ). La perte de masse musculaire se produit approximativement à partir de l’âge de 30-40 ans. Cette perte qui est estimée à 1 % par an jusqu’à l’âge de 70 ans, s’accélère par la suite pour atteindre 25-40 % par décennie (Goodpaster et coll., 2006
). La perte de masse musculaire se produit approximativement à partir de l’âge de 30-40 ans. Cette perte qui est estimée à 1 % par an jusqu’à l’âge de 70 ans, s’accélère par la suite pour atteindre 25-40 % par décennie (Goodpaster et coll., 2006 ; Grimby et Saltin, 1983
; Grimby et Saltin, 1983 ; Hughes et coll., 2001
; Hughes et coll., 2001 ). La caractéristique majeure de la sarcopénie est d’être un syndrome gériatrique : prévalence élevée chez les sujets âgés, origine multifactorielle, et coexistence fréquente avec d’autres syndromes gériatriques comme les chutes, la fragilité ou l’anorexie (Cruz-Jentoft et coll., 2010
). La caractéristique majeure de la sarcopénie est d’être un syndrome gériatrique : prévalence élevée chez les sujets âgés, origine multifactorielle, et coexistence fréquente avec d’autres syndromes gériatriques comme les chutes, la fragilité ou l’anorexie (Cruz-Jentoft et coll., 2010 ). La prévalence de la sarcopénie est d’environ 25 % chez la population des plus de 65 ans et même supérieure à 40 % chez la population des plus de 80 ans (Iannuzzi-Sucich et coll., 2002
). La prévalence de la sarcopénie est d’environ 25 % chez la population des plus de 65 ans et même supérieure à 40 % chez la population des plus de 80 ans (Iannuzzi-Sucich et coll., 2002 ). L’European Working Group in Older People recommande l’utilisation de la présence simultanée d’une perte de masse musculaire et d’une perte de fonction musculaire (force, performance) pour diagnostiquer la sarcopénie (Cruz-Jentoft et coll., 2010
). L’European Working Group in Older People recommande l’utilisation de la présence simultanée d’une perte de masse musculaire et d’une perte de fonction musculaire (force, performance) pour diagnostiquer la sarcopénie (Cruz-Jentoft et coll., 2010 ). En effet, la force musculaire ne dépend pas uniquement de la masse musculaire, et la relation entre masse et force musculaire n’est pas linéaire, la perte de force musculaire étant plus rapide que la perte de masse musculaire avec l’avancée en âge (Goodpaster et coll., 2006
). En effet, la force musculaire ne dépend pas uniquement de la masse musculaire, et la relation entre masse et force musculaire n’est pas linéaire, la perte de force musculaire étant plus rapide que la perte de masse musculaire avec l’avancée en âge (Goodpaster et coll., 2006 ; Janssen et coll., 2004
; Janssen et coll., 2004 ). Le diagnostic de la sarcopénie repose sur la présence combinée des 2 critères suivants (Kim et Choi, 2013
). Le diagnostic de la sarcopénie repose sur la présence combinée des 2 critères suivants (Kim et Choi, 2013 ; Muscaritoli et coll., 2010
; Muscaritoli et coll., 2010 ; Muscaritoli et coll., 2013
; Muscaritoli et coll., 2013 ) :
) : ) ;
) ; ).
). ).
). ). Pour un même volume expiratoire maximal par seconde (VEMS < 50 % des valeurs prédites), ces auteurs montraient que les patients ayant une surface de section transversale de la cuisse supérieure à 70 cm2 avaient une mortalité considérablement inférieure à celle de patients pour lesquels la surface de section transversale de la cuisse était inférieure à 70 cm2. Dans une étude plus récente, Jones et coll. montraient que la prévalence du déconditionnement musculaire chez les patients BPCO était de 14,5 %, la prévalence augmentant avec l’âge et le stade de la pathologie, mais ne différait pas en fonction du sexe ou en fonction de la présence d’une diminution de force musculaire (Jones et coll., 2015
). Pour un même volume expiratoire maximal par seconde (VEMS < 50 % des valeurs prédites), ces auteurs montraient que les patients ayant une surface de section transversale de la cuisse supérieure à 70 cm2 avaient une mortalité considérablement inférieure à celle de patients pour lesquels la surface de section transversale de la cuisse était inférieure à 70 cm2. Dans une étude plus récente, Jones et coll. montraient que la prévalence du déconditionnement musculaire chez les patients BPCO était de 14,5 %, la prévalence augmentant avec l’âge et le stade de la pathologie, mais ne différait pas en fonction du sexe ou en fonction de la présence d’une diminution de force musculaire (Jones et coll., 2015 ). Cette atteinte musculaire affecte principalement les muscles locomoteurs antigravitaires, notamment le quadriceps (Antoun et coll., 2010
). Cette atteinte musculaire affecte principalement les muscles locomoteurs antigravitaires, notamment le quadriceps (Antoun et coll., 2010 ), avec une atrophie préférentielle des fibres musculaires de type IIa/IIx et IIx (Gosker et coll., 2002
), avec une atrophie préférentielle des fibres musculaires de type IIa/IIx et IIx (Gosker et coll., 2002 ). Comparativement à des sujets de même âge et de même sexe, la force isométrique du quadriceps est également réduite d’environ 20 % à 30 % chez des patients BPCO, une réduction expliquée par une baisse de la surface de section transversale du quadriceps (Bernard et coll., 1998
). Comparativement à des sujets de même âge et de même sexe, la force isométrique du quadriceps est également réduite d’environ 20 % à 30 % chez des patients BPCO, une réduction expliquée par une baisse de la surface de section transversale du quadriceps (Bernard et coll., 1998 ; Donaldson et coll., 2012
; Donaldson et coll., 2012 ). Enfin, le risque de mortalité augmente avec la réduction de la force maximale volontaire de contraction du quadriceps (Swallow et coll., 2007
). Enfin, le risque de mortalité augmente avec la réduction de la force maximale volontaire de contraction du quadriceps (Swallow et coll., 2007 ).
). ; Tisdale, 2009
; Tisdale, 2009 et 2010
et 2010 ). Cela concerne notamment les patients atteints de cancers pancréatique, gastrique, de la sphère ORL ou bronchopulmonaire (Porporato, 2016
). Cela concerne notamment les patients atteints de cancers pancréatique, gastrique, de la sphère ORL ou bronchopulmonaire (Porporato, 2016 ). Les patients cancéreux en surpoids ou obèses peuvent aussi être touchés par la perte de masse musculaire. Toutefois, la cachexie chez ces patients est souvent masquée par leur indice de masse corporelle élevé. Une publication récente a étudié la prévalence et les conséquences cliniques de l’obésité cachectique à partir de données issues de 14 études. Il ressort de cette analyse que la prévalence de la cachexie est comprise entre 15 % et 36 % chez les patients cancéreux obèses (Carneiro et coll., 2016
). Les patients cancéreux en surpoids ou obèses peuvent aussi être touchés par la perte de masse musculaire. Toutefois, la cachexie chez ces patients est souvent masquée par leur indice de masse corporelle élevé. Une publication récente a étudié la prévalence et les conséquences cliniques de l’obésité cachectique à partir de données issues de 14 études. Il ressort de cette analyse que la prévalence de la cachexie est comprise entre 15 % et 36 % chez les patients cancéreux obèses (Carneiro et coll., 2016 ). Ce syndrome cachectique a des répercussions extrêmement importantes pour le patient. Un certain nombre d’études ont montré, de façon consistante, une augmentation de la cytotoxicité des traitements anti-tumoraux chez des patients cancéreux cachectiques (Antoun et coll., 2010
). Ce syndrome cachectique a des répercussions extrêmement importantes pour le patient. Un certain nombre d’études ont montré, de façon consistante, une augmentation de la cytotoxicité des traitements anti-tumoraux chez des patients cancéreux cachectiques (Antoun et coll., 2010 ; Prado et coll., 2009
; Prado et coll., 2009 ; Sjoblom et coll., 2015
; Sjoblom et coll., 2015 ) ou un arrêt plus précoce du traitement (Antoun et coll., 2010
) ou un arrêt plus précoce du traitement (Antoun et coll., 2010 ). Les patients cancéreux obèses présentent un risque plus important de toxicité induite par le traitement (Antoun et coll., 2013
). Les patients cancéreux obèses présentent un risque plus important de toxicité induite par le traitement (Antoun et coll., 2013 ). La cachexie associée au cancer est également associée à une augmentation du risque chirurgical (Lieffers et coll., 2012
). La cachexie associée au cancer est également associée à une augmentation du risque chirurgical (Lieffers et coll., 2012 ). Enfin, il est maintenant bien établi que le risque de mortalité augmente chez les patients cachectiques (Friedrichsen et coll., 2013
). Enfin, il est maintenant bien établi que le risque de mortalité augmente chez les patients cachectiques (Friedrichsen et coll., 2013 ; Imai et coll., 2015
; Imai et coll., 2015 ; Iritani et coll., 2015
; Iritani et coll., 2015 ; Martin et coll., 2013
; Martin et coll., 2013 ). Par exemple, dans une étude récente, il a été montré que des patients cancéreux cumulant 3 indicateurs de cachexie (perte de poids, atrophie musculaire et index d’atténuation musculaire1
bas) survivaient 8,4 mois alors que les patients ne présentant aucun de ces indicateurs survivaient 29,9 mois, et ceci indépendamment de la valeur de l’indice de masse corporelle (Martin et coll., 2013
). Par exemple, dans une étude récente, il a été montré que des patients cancéreux cumulant 3 indicateurs de cachexie (perte de poids, atrophie musculaire et index d’atténuation musculaire1
bas) survivaient 8,4 mois alors que les patients ne présentant aucun de ces indicateurs survivaient 29,9 mois, et ceci indépendamment de la valeur de l’indice de masse corporelle (Martin et coll., 2013 ). De façon similaire, la perte de masse musculaire lors d’un traitement chimiothérapique chez des patients atteints d’un cancer colorectal métastatique était prédictive d’une faible survie (Blauwhoff-Buskermolen et coll., 2016
). De façon similaire, la perte de masse musculaire lors d’un traitement chimiothérapique chez des patients atteints d’un cancer colorectal métastatique était prédictive d’une faible survie (Blauwhoff-Buskermolen et coll., 2016 ). Enfin, on notera que la mortalité est globalement supérieure chez les patients obèses cachectiques comparativement aux patients de corpulence normale ou en insuffisance pondérale (Antoun et coll., 2013
). Enfin, on notera que la mortalité est globalement supérieure chez les patients obèses cachectiques comparativement aux patients de corpulence normale ou en insuffisance pondérale (Antoun et coll., 2013 ). Globalement, on considère que la cachexie associée au cancer serait responsable du décès d’environ 20 % des patients (Argiles et coll., 2014
). Globalement, on considère que la cachexie associée au cancer serait responsable du décès d’environ 20 % des patients (Argiles et coll., 2014  ; Tisdale, 2010
; Tisdale, 2010 ). L’atrophie musculaire est également associée à une réduction de force musculaire (Chen et coll., 2011
). L’atrophie musculaire est également associée à une réduction de force musculaire (Chen et coll., 2011 ; Kilgour et coll., 2013
; Kilgour et coll., 2013 ). Dans la dernière étude, les patients pour lesquels la force musculaire, appréciée à l’aide d’un dynamomètre de main, était inférieure au 10e percentile avaient une durée de vie plus courte, une prévalence de l’atrophie musculaire plus importante et un niveau de fatigue supérieur (Kilgour et coll., 2013
). Dans la dernière étude, les patients pour lesquels la force musculaire, appréciée à l’aide d’un dynamomètre de main, était inférieure au 10e percentile avaient une durée de vie plus courte, une prévalence de l’atrophie musculaire plus importante et un niveau de fatigue supérieur (Kilgour et coll., 2013 ). On notera toutefois qu’une méta-analyse récente ne permettait pas de montrer qu’une force musculaire basse était un facteur prédictif de la mortalité associée au cancer (Volaklis et coll., 2015
). On notera toutefois qu’une méta-analyse récente ne permettait pas de montrer qu’une force musculaire basse était un facteur prédictif de la mortalité associée au cancer (Volaklis et coll., 2015 ).
). ). Il n’existe à notre connaissance aucune étude clinique pour des temps post-AVC plus précoces, qui permettrait d’évaluer si l’ampleur de cette atrophie pourrait être encore supérieure dans les jours ou les premières semaines qui suivent l’AVC. En raison de la décussation pyramidale, l’atteinte est plus prononcée pour les muscles de l’hémicorps opposé à la lésion cérébrale (Dowlati et coll., 2010
). Il n’existe à notre connaissance aucune étude clinique pour des temps post-AVC plus précoces, qui permettrait d’évaluer si l’ampleur de cette atrophie pourrait être encore supérieure dans les jours ou les premières semaines qui suivent l’AVC. En raison de la décussation pyramidale, l’atteinte est plus prononcée pour les muscles de l’hémicorps opposé à la lésion cérébrale (Dowlati et coll., 2010 ; English et coll., 2010
; English et coll., 2010 ; Ryan et coll., 2011
; Ryan et coll., 2011 ; Ryan et coll., 2000
; Ryan et coll., 2000 ; Ryan et coll., 2002
; Ryan et coll., 2002 ), c’est-à-dire du côté parétique. D’un point de vue histologique, l’atrophie musculaire se traduit par une baisse de la surface de section transversale des fibres entre le membre parétique et le membre non parétique, mais également entre le membre parétique et celui d’un sujet sain apparié en âge (Hachisuka et coll., 1997
), c’est-à-dire du côté parétique. D’un point de vue histologique, l’atrophie musculaire se traduit par une baisse de la surface de section transversale des fibres entre le membre parétique et le membre non parétique, mais également entre le membre parétique et celui d’un sujet sain apparié en âge (Hachisuka et coll., 1997 ; Landin et coll., 1977
; Landin et coll., 1977 ). L’atrophie musculaire affecterait préférentiellement les fibres de type IIb (Hachisuka et coll., 1997
). L’atrophie musculaire affecterait préférentiellement les fibres de type IIb (Hachisuka et coll., 1997 ; Toffola et coll., 2001
; Toffola et coll., 2001 ) même si ce résultat n’est pas systématiquement retrouvé (Jakobsson et coll., 1991
) même si ce résultat n’est pas systématiquement retrouvé (Jakobsson et coll., 1991 ). On notera cependant que les patients ayant subi un AVC avec des déficiences motrices relativement peu importantes et qui poursuivent une activité physique quotidienne conséquente ne présentent aucune modification de la surface de section transversale des fibres musculaires (Sunnerhagen et coll., 1999
). On notera cependant que les patients ayant subi un AVC avec des déficiences motrices relativement peu importantes et qui poursuivent une activité physique quotidienne conséquente ne présentent aucune modification de la surface de section transversale des fibres musculaires (Sunnerhagen et coll., 1999 ). Des déficits marqués de force musculaire allant jusqu’à 60 % comparativement à des sujets sains (Teixeira-Salmela et coll., 1999
). Des déficits marqués de force musculaire allant jusqu’à 60 % comparativement à des sujets sains (Teixeira-Salmela et coll., 1999 ) ont été rapportés, mais ceux-ci doivent être pour l’essentiel attribués à l’altération de la commande motrice consécutive à l’AVC. Ceci explique aussi pourquoi l’ampleur de la perte de force musculaire excède largement l’atrophie musculaire chez les patients ayant eu un AVC.
) ont été rapportés, mais ceux-ci doivent être pour l’essentiel attribués à l’altération de la commande motrice consécutive à l’AVC. Ceci explique aussi pourquoi l’ampleur de la perte de force musculaire excède largement l’atrophie musculaire chez les patients ayant eu un AVC. rapportaient une réduction du volume musculaire du mollet chez des patients insuffisants cardiaques (Mancini et coll., 1992
rapportaient une réduction du volume musculaire du mollet chez des patients insuffisants cardiaques (Mancini et coll., 1992 ). Plus tard, Harrington et coll. montraient également une réduction de la surface de section transversale de la cuisse supérieure à 10 % chez des patients insuffisants cardiaques comparativement à des sujets contrôles appariés en âge (Harrington et coll., 1997
). Plus tard, Harrington et coll. montraient également une réduction de la surface de section transversale de la cuisse supérieure à 10 % chez des patients insuffisants cardiaques comparativement à des sujets contrôles appariés en âge (Harrington et coll., 1997 ). D’un point de vue histologique, l’atrophie musculaire chez le patient insuffisant cardiaque est associée à une réduction de la taille des fibres musculaires et à une augmentation du pourcentage de fibres de type II, notamment de type IIb (Mancini et coll., 1989
). D’un point de vue histologique, l’atrophie musculaire chez le patient insuffisant cardiaque est associée à une réduction de la taille des fibres musculaires et à une augmentation du pourcentage de fibres de type II, notamment de type IIb (Mancini et coll., 1989 ). Il a également été rapporté une réduction de la force de contraction maximale isométrique du quadriceps de plus de 20 % comparativement à celle de sujets témoins sains (Anker et coll., 1997b
). Il a également été rapporté une réduction de la force de contraction maximale isométrique du quadriceps de plus de 20 % comparativement à celle de sujets témoins sains (Anker et coll., 1997b ). De façon intéressante, la force musculaire spécifique (ramenée à la surface de section du muscle) était elle aussi abaissée (Anker et coll., 1997b
). De façon intéressante, la force musculaire spécifique (ramenée à la surface de section du muscle) était elle aussi abaissée (Anker et coll., 1997b ) suggérant que la perte de force musculaire n’était pas uniquement due à une perte de masse musculaire mais pouvait également impliquer une altération des propriétés contractiles du tissu musculaire. Des études plus récentes ont établi, chez des patients insuffisants cardiaques, une prévalence du déconditionnement musculaire de 10-20 % (Christensen et coll., 2013
) suggérant que la perte de force musculaire n’était pas uniquement due à une perte de masse musculaire mais pouvait également impliquer une altération des propriétés contractiles du tissu musculaire. Des études plus récentes ont établi, chez des patients insuffisants cardiaques, une prévalence du déconditionnement musculaire de 10-20 % (Christensen et coll., 2013 ; Fulster et coll., 2013
; Fulster et coll., 2013 ), et que ce déconditionnement musculaire était associé à une réduction de la force du quadriceps et du pic de consommation d’oxygène (Fulster et coll., 2013
), et que ce déconditionnement musculaire était associé à une réduction de la force du quadriceps et du pic de consommation d’oxygène (Fulster et coll., 2013 ). La présence du syndrome cachectique a des conséquences particulièrement importantes pour les patients : il a ainsi été montré que la cachexie était directement associée à une augmentation de la mortalité des patients insuffisants cardiaques (Anker et coll., 1997a
). La présence du syndrome cachectique a des conséquences particulièrement importantes pour les patients : il a ainsi été montré que la cachexie était directement associée à une augmentation de la mortalité des patients insuffisants cardiaques (Anker et coll., 1997a ; Narumi et coll., 2015
; Narumi et coll., 2015 ), et ce d’autant plus que le niveau de consommation d’oxygène des patients était faible (Anker et coll., 1997a
), et ce d’autant plus que le niveau de consommation d’oxygène des patients était faible (Anker et coll., 1997a ).
). ; Kim et coll., 2010
; Kim et coll., 2010 ). Le concept d’obésité sarcopénique a ainsi été proposé pour définir un syndrome présent chez des sujets âgés, chez qui l’état d’obésité est accompagné d’une sarcopénie et d’une résistance à l’insuline (Baumgartner, 2000
). Le concept d’obésité sarcopénique a ainsi été proposé pour définir un syndrome présent chez des sujets âgés, chez qui l’état d’obésité est accompagné d’une sarcopénie et d’une résistance à l’insuline (Baumgartner, 2000 ). Dans une étude états-unienne, il a été estimé que la prévalence de l’obésité sarcopénique chez des personnes d’environ 70 ans était de 18 % dans la population féminine et supérieure à 40 % dans la population masculine. Le déconditionnement musculaire du patient diabétique de type 2 a été généralement attribué au vieillissement, à l’immobilité ou à l’existence de pathologies chroniques associées (Muscaritoli et coll., 2010
). Dans une étude états-unienne, il a été estimé que la prévalence de l’obésité sarcopénique chez des personnes d’environ 70 ans était de 18 % dans la population féminine et supérieure à 40 % dans la population masculine. Le déconditionnement musculaire du patient diabétique de type 2 a été généralement attribué au vieillissement, à l’immobilité ou à l’existence de pathologies chroniques associées (Muscaritoli et coll., 2010  ; Sayer et coll., 2005
; Sayer et coll., 2005 ). Ce déconditionnement n’était donc pas, jusqu’à très récemment, considéré comme une complication spécifique du diabète. Toutefois, des données récentes semblent remettre en cause cette affirmation. Guerrero et coll. montrent ainsi une détérioration de la masse et de la force musculaires directement associée à la condition diabétique, indépendamment de la durée de la maladie, du contrôle métabolique des patients ou de l’existence de complications microvasculaires (Guerrero et coll., 2016
). Ce déconditionnement n’était donc pas, jusqu’à très récemment, considéré comme une complication spécifique du diabète. Toutefois, des données récentes semblent remettre en cause cette affirmation. Guerrero et coll. montrent ainsi une détérioration de la masse et de la force musculaires directement associée à la condition diabétique, indépendamment de la durée de la maladie, du contrôle métabolique des patients ou de l’existence de complications microvasculaires (Guerrero et coll., 2016 ). Le processus sarcopénique semble également plus rapide chez le patient diabétique. Park et coll. ont ainsi montré dans le cadre d’un suivi longitudinal de 3 ans que la perte de masse et de force musculaires des membres inférieurs était plus importante chez des patients diabétiques de type 2 comparativement à des sujets non diabétiques appariés en âge (Park et coll., 2007
). Le processus sarcopénique semble également plus rapide chez le patient diabétique. Park et coll. ont ainsi montré dans le cadre d’un suivi longitudinal de 3 ans que la perte de masse et de force musculaires des membres inférieurs était plus importante chez des patients diabétiques de type 2 comparativement à des sujets non diabétiques appariés en âge (Park et coll., 2007 ). De façon importante, cette accélération du processus sarcopénique chez le patient diabétique de type 2 était toujours retrouvée après correction pour un certain nombre de covariables, notamment la présence de pathologies chroniques associées (Park et coll., 2007
). De façon importante, cette accélération du processus sarcopénique chez le patient diabétique de type 2 était toujours retrouvée après correction pour un certain nombre de covariables, notamment la présence de pathologies chroniques associées (Park et coll., 2007 ). L’accélération de la perte de masse et force musculaires chez les patients diabétiques âgés a également été rapportée par d’autres auteurs (Leenders et coll., 2013
). L’accélération de la perte de masse et force musculaires chez les patients diabétiques âgés a également été rapportée par d’autres auteurs (Leenders et coll., 2013 ).
). ). Dans une autre étude impliquant des patients âgés hospitalisés, les patients sarcopéniques présentaient un taux plus élevé de symptômes dépressifs que des patients non sarcopéniques (Gariballa et Alessa, 2013
). Dans une autre étude impliquant des patients âgés hospitalisés, les patients sarcopéniques présentaient un taux plus élevé de symptômes dépressifs que des patients non sarcopéniques (Gariballa et Alessa, 2013 ). Il est probable dans cette dernière étude que la sarcopénie, responsable d’une réduction de la mobilité et d’une augmentation de la fragilité des sujets, alimente le syndrome dépressif par cette spirale de déconditionnement.
). Il est probable dans cette dernière étude que la sarcopénie, responsable d’une réduction de la mobilité et d’une augmentation de la fragilité des sujets, alimente le syndrome dépressif par cette spirale de déconditionnement. ; Saarni et coll., 2009
; Saarni et coll., 2009 ; Sugawara et coll., 2012
; Sugawara et coll., 2012 ). Par exemple, une étude réalisée au Japon mettait en évidence une augmentation du pourcentage de masse grasse et une réduction de la masse et de la force musculaires chez des patients schizophrènes après ajustement pour l’âge, le sexe et l’indice de masse corporelle (Sugawara et coll., 2012
). Par exemple, une étude réalisée au Japon mettait en évidence une augmentation du pourcentage de masse grasse et une réduction de la masse et de la force musculaires chez des patients schizophrènes après ajustement pour l’âge, le sexe et l’indice de masse corporelle (Sugawara et coll., 2012 ). De façon intéressante, le traitement pharmacologique de la schizophrénie augmente le pourcentage de masse maigre, cette augmentation étant également associée à une augmentation de la masse grasse et de façon générale à une augmentation de l’indice de masse corporelle (Kivircik et coll., 2003
). De façon intéressante, le traitement pharmacologique de la schizophrénie augmente le pourcentage de masse maigre, cette augmentation étant également associée à une augmentation de la masse grasse et de façon générale à une augmentation de l’indice de masse corporelle (Kivircik et coll., 2003 ). D’un point de vue histologique, il a été rapporté la présence de fibres musculaires atrophiées dans le muscle de patients schizophrènes (Borg et coll., 1987
). D’un point de vue histologique, il a été rapporté la présence de fibres musculaires atrophiées dans le muscle de patients schizophrènes (Borg et coll., 1987 ; Flyckt et coll., 2000
; Flyckt et coll., 2000 ).
). ). Toutefois, le déficit de force n’était plus observé lorsque la force musculaire était ajustée à la surface musculaire (Baker et coll., 2015
). Toutefois, le déficit de force n’était plus observé lorsque la force musculaire était ajustée à la surface musculaire (Baker et coll., 2015 ), indiquant ici que le déficit fonctionnel était essentiellement dû à la perte de masse musculaire. Ce déconditionnement musculaire était le plus prononcé pour les patients ayant le pourcentage de masse grasse le plus faible (Baker et coll., 2015
), indiquant ici que le déficit fonctionnel était essentiellement dû à la perte de masse musculaire. Ce déconditionnement musculaire était le plus prononcé pour les patients ayant le pourcentage de masse grasse le plus faible (Baker et coll., 2015 ). Il a aussi été montré que le déficit en masse maigre était plus important chez les hommes que chez les femmes atteints de polyarthrite rhumatoïde (Baker et coll., 2015
). Il a aussi été montré que le déficit en masse maigre était plus important chez les hommes que chez les femmes atteints de polyarthrite rhumatoïde (Baker et coll., 2015 ). Dans une autre étude, Kramer et coll. ont montré que la densité musculaire chez des patients atteints de polyarthrite rhumatoïde était associée à l’état d’incapacité, et de façon moins surprenante, au niveau de performance physique des patients (Kramer et coll., 2012
). Dans une autre étude, Kramer et coll. ont montré que la densité musculaire chez des patients atteints de polyarthrite rhumatoïde était associée à l’état d’incapacité, et de façon moins surprenante, au niveau de performance physique des patients (Kramer et coll., 2012 ). De façon intéressante, une étude expérimentale chez le singe indiquait que le déconditionnement musculaire exacerbait l’inflammation de l’articulation dans un modèle de polyarthrite rhumatoïde induite (Horai et coll., 2013
). De façon intéressante, une étude expérimentale chez le singe indiquait que le déconditionnement musculaire exacerbait l’inflammation de l’articulation dans un modèle de polyarthrite rhumatoïde induite (Horai et coll., 2013 ), suggérant l’existence d’une interaction moléculaire réciproque entre le tissu musculaire et l’articulation.
), suggérant l’existence d’une interaction moléculaire réciproque entre le tissu musculaire et l’articulation. ). Même si le rôle de nombreux facteurs reste encore à préciser dans un contexte clinique, nous pouvons aujourd’hui, sur la base de ces données, présenter un schéma global cohérent des acteurs moléculaires du déconditionnement musculaire pour de nombreuses pathologies chroniques.
). Même si le rôle de nombreux facteurs reste encore à préciser dans un contexte clinique, nous pouvons aujourd’hui, sur la base de ces données, présenter un schéma global cohérent des acteurs moléculaires du déconditionnement musculaire pour de nombreuses pathologies chroniques. ; Lemire et coll., 2012
; Lemire et coll., 2012 ; Puig-Vilanova et coll., 2015
; Puig-Vilanova et coll., 2015 ). Dans l’étude de Doucet et coll.
). Dans l’étude de Doucet et coll. , l’expression de MuRF-1 et de MAFbx était plus élevée chez les patients BPCO ayant une faible masse musculaire comparativement aux patients présentant une masse musculaire normale (Doucet et coll., 2007
, l’expression de MuRF-1 et de MAFbx était plus élevée chez les patients BPCO ayant une faible masse musculaire comparativement aux patients présentant une masse musculaire normale (Doucet et coll., 2007 ). Paradoxalement, il a été rapporté à plusieurs reprises une activation de la voie de signalisation Akt-mTOR (mammalian target of rapamycin) (Doucet et coll., 2007
). Paradoxalement, il a été rapporté à plusieurs reprises une activation de la voie de signalisation Akt-mTOR (mammalian target of rapamycin) (Doucet et coll., 2007 ; Vogiatzis et coll., 2010
; Vogiatzis et coll., 2010 ), voie qui contrôle positivement l’initiation de la traduction des protéines, suggérant ici une activation de la synthèse des protéines chez les patients BPCO. Ces données ont été interprétées comme étant une tentative vaine de l’organisme pour restaurer la masse musculaire ou pour au moins limiter la perte de masse musculaire liée à l’évolution de la pathologie (Remels et coll., 2013
), voie qui contrôle positivement l’initiation de la traduction des protéines, suggérant ici une activation de la synthèse des protéines chez les patients BPCO. Ces données ont été interprétées comme étant une tentative vaine de l’organisme pour restaurer la masse musculaire ou pour au moins limiter la perte de masse musculaire liée à l’évolution de la pathologie (Remels et coll., 2013 ). Les mécanismes en amont à l’origine de ces régulations ne sont pas encore clairement identifiés, mais le stress oxydant, l’inflammation et la myostatine (un régulateur négatif de la masse musculaire) sont des candidats particulièrement intéressants. Il a été montré que des marqueurs de stress oxydant sont négativement corrélés avec la masse maigre et la force musculaire chez le patient BPCO (Barreiro et coll., 2008
). Les mécanismes en amont à l’origine de ces régulations ne sont pas encore clairement identifiés, mais le stress oxydant, l’inflammation et la myostatine (un régulateur négatif de la masse musculaire) sont des candidats particulièrement intéressants. Il a été montré que des marqueurs de stress oxydant sont négativement corrélés avec la masse maigre et la force musculaire chez le patient BPCO (Barreiro et coll., 2008 ). De plus, la production d’espèces réactives de l’oxygène est supérieure chez des patients BPCO cachectiques comparativement à des patients non cachectiques ou des sujets témoins (Fermoselle et coll., 2012
). De plus, la production d’espèces réactives de l’oxygène est supérieure chez des patients BPCO cachectiques comparativement à des patients non cachectiques ou des sujets témoins (Fermoselle et coll., 2012 ), ce qui pourrait contribuer au processus atrophique via la régulation de l’équilibre entre synthèse et dégradation des protéines. La BPCO est souvent associée à un état inflammatoire à bas bruit, notamment à une augmentation du taux circulant de TNF-α (Tumor necrosis factor-α) (Nussbaumer-Ochsner et Rabe, 2011
), ce qui pourrait contribuer au processus atrophique via la régulation de l’équilibre entre synthèse et dégradation des protéines. La BPCO est souvent associée à un état inflammatoire à bas bruit, notamment à une augmentation du taux circulant de TNF-α (Tumor necrosis factor-α) (Nussbaumer-Ochsner et Rabe, 2011 ) qui pourrait contribuer à activer la protéolyse musculaire. Même si l’expression musculaire du TNF-α dans le muscle squelettique de patients BPCO est controversée (Remels et coll., 2013
) qui pourrait contribuer à activer la protéolyse musculaire. Même si l’expression musculaire du TNF-α dans le muscle squelettique de patients BPCO est controversée (Remels et coll., 2013 ), l’activation du facteur de transcription NF-κB (nuclear factor-kappa B) dans le muscle des patients BPCO (Fermoselle et coll., 2012
), l’activation du facteur de transcription NF-κB (nuclear factor-kappa B) dans le muscle des patients BPCO (Fermoselle et coll., 2012 ) suggère fortement l’implication d’un axe TNF-α-NF-κB dans le syndrome cachectique chez le patient BPCO. L’expression de la myostatine est également supérieure dans le muscle de patients BPCO comparativement à celui de sujets témoins (Hayot et coll., 2011
) suggère fortement l’implication d’un axe TNF-α-NF-κB dans le syndrome cachectique chez le patient BPCO. L’expression de la myostatine est également supérieure dans le muscle de patients BPCO comparativement à celui de sujets témoins (Hayot et coll., 2011 ; Plant et coll., 2010
; Plant et coll., 2010 ). De plus, l’expression de la myostatine est inversement corrélée à la force du muscle quadriceps et l’endurance de patients BPCO (Allen et coll., 2010
). De plus, l’expression de la myostatine est inversement corrélée à la force du muscle quadriceps et l’endurance de patients BPCO (Allen et coll., 2010 ).
).
 ). Les mécanismes moléculaires mis en jeu dans le déconditionnement musculaire associés au cancer ont particulièrement bien été décrits dans différents modèles murins. En support à ces études fondamentales, des études cliniques ont permis pour l’essentiel de valider les données obtenues chez l’animal. De nombreuses études ont ainsi mis en évidence l’implication du système ubiquitine-protéasome dans la perte de masse musculaire associée au cancer chez l’animal (Acharyya et coll., 2004
). Les mécanismes moléculaires mis en jeu dans le déconditionnement musculaire associés au cancer ont particulièrement bien été décrits dans différents modèles murins. En support à ces études fondamentales, des études cliniques ont permis pour l’essentiel de valider les données obtenues chez l’animal. De nombreuses études ont ainsi mis en évidence l’implication du système ubiquitine-protéasome dans la perte de masse musculaire associée au cancer chez l’animal (Acharyya et coll., 2004 ; Busquets et coll., 2004
; Busquets et coll., 2004 ; Gallot et coll., 2014
; Gallot et coll., 2014 ; Khal et coll., 2005
; Khal et coll., 2005 ; Lecker et coll., 2004
; Lecker et coll., 2004 ; Llovera et coll., 1994
; Llovera et coll., 1994 ), mais également dans le cadre d’études cliniques (Bossola et coll., 2003
), mais également dans le cadre d’études cliniques (Bossola et coll., 2003 ; DeJong et coll., 2005
; DeJong et coll., 2005 ; Khal et coll., 2005
; Khal et coll., 2005 ). Le second système protéolytique majeur du tissu musculaire, le système autophagie-lysosome, est lui aussi activé dans des modèles murins de cachexie associée au cancer (Lecker et coll., 2004
). Le second système protéolytique majeur du tissu musculaire, le système autophagie-lysosome, est lui aussi activé dans des modèles murins de cachexie associée au cancer (Lecker et coll., 2004 ; Penna et coll., 2013
; Penna et coll., 2013 ; White et coll., 2011
; White et coll., 2011 ), mais également chez l’humain (Op den Kamp et coll., 2013
), mais également chez l’humain (Op den Kamp et coll., 2013 ). En accord avec ces données, il a été montré que la dégradation des protéines musculaires est également activée chez le patient cancéreux (Bonetto et coll., 2011
). En accord avec ces données, il a été montré que la dégradation des protéines musculaires est également activée chez le patient cancéreux (Bonetto et coll., 2011 ; Williams et coll., 2012
; Williams et coll., 2012 ). Les facteurs de transcription NF-κB et FoxO (forkhead box) seraient mis en jeu dans la régulation transcriptionnelle en amont de ces deux systèmes protéolytiques, aussi bien dans les modèles animaux (Cai et coll., 2004
). Les facteurs de transcription NF-κB et FoxO (forkhead box) seraient mis en jeu dans la régulation transcriptionnelle en amont de ces deux systèmes protéolytiques, aussi bien dans les modèles animaux (Cai et coll., 2004 ; Eley et Tisdale, 2007
; Eley et Tisdale, 2007 ; Gallot et coll., 2014
; Gallot et coll., 2014 ; Lecker et coll., 2004
; Lecker et coll., 2004 ; Liu et coll., 2007
; Liu et coll., 2007 ; Tisdale, 2010
; Tisdale, 2010 ) que chez le patient cancéreux (Puig-Vilanova et coll., 2015
) que chez le patient cancéreux (Puig-Vilanova et coll., 2015 ; Rhoads et coll., 2010
; Rhoads et coll., 2010 ; Schmitt et coll., 2007
; Schmitt et coll., 2007 ). La voie de signalisation Akt-mTOR, voie qui contrôle positivement l’initiation de la traduction des protéines, est également inhibée chez l’animal (Gallot et coll., 2014
). La voie de signalisation Akt-mTOR, voie qui contrôle positivement l’initiation de la traduction des protéines, est également inhibée chez l’animal (Gallot et coll., 2014 ; MacDonald et coll., 2015
; MacDonald et coll., 2015 ) et l’humain (Schmitt et coll., 2007
) et l’humain (Schmitt et coll., 2007 ), même si la mise en évidence d’une réduction de la synthèse des protéines chez l’humain est plus controversée. Ces données suggèrent que l’activation de la protéolyse serait un des mécanismes majeurs mis en jeu dans la perte de masse musculaire associée au cancer. Les concentrations circulantes ainsi que l’expression musculaire de nombreuses cytokines pro-inflammatoires sont augmentées comme les interleukines 1β et 6 (IL1β et IL-6) et le TNF-α. Ces observations expérimentales (Baltgalvis et coll., 2008
), même si la mise en évidence d’une réduction de la synthèse des protéines chez l’humain est plus controversée. Ces données suggèrent que l’activation de la protéolyse serait un des mécanismes majeurs mis en jeu dans la perte de masse musculaire associée au cancer. Les concentrations circulantes ainsi que l’expression musculaire de nombreuses cytokines pro-inflammatoires sont augmentées comme les interleukines 1β et 6 (IL1β et IL-6) et le TNF-α. Ces observations expérimentales (Baltgalvis et coll., 2008 ; Tisdale, 2010
; Tisdale, 2010 ) et cliniques (Batista et coll., 2013
) et cliniques (Batista et coll., 2013 ; Puig-Vilanova et coll., 2015
; Puig-Vilanova et coll., 2015 ) laissent suggérer un rôle important de ces cytokines dans la régulation en amont de l’équilibre entre synthèse et dégradation des protéines. De plus, la myostatine serait également impliquée dans cette régulation, comme en témoignent expérimentalement l’augmentation de sa production musculaire (Costelli et coll., 2008
) laissent suggérer un rôle important de ces cytokines dans la régulation en amont de l’équilibre entre synthèse et dégradation des protéines. De plus, la myostatine serait également impliquée dans cette régulation, comme en témoignent expérimentalement l’augmentation de sa production musculaire (Costelli et coll., 2008 ; Liu et coll., 2008
; Liu et coll., 2008 ; Tisdale, 2010
; Tisdale, 2010 ) et le rôle majeur de son inhibition dans la prévention expérimentale de la cachexie associée au cancer (Gallot et coll., 2014
) et le rôle majeur de son inhibition dans la prévention expérimentale de la cachexie associée au cancer (Gallot et coll., 2014 ; Liu et coll., 2008
; Liu et coll., 2008 ; Tisdale, 2010
; Tisdale, 2010 ). L’importance fonctionnelle de la myostatine en clinique mérite toutefois d’être explorée plus avant. En effet, Loumaye et coll. ont récemment montré que la concentration circulante de myostatine était similaire chez des patients cancéreux cachectiques et non-cachectiques, contrairement à la concentration circulante d’activine, qui était supérieure chez les patients cachectiques (Loumaye et coll., 2015
). L’importance fonctionnelle de la myostatine en clinique mérite toutefois d’être explorée plus avant. En effet, Loumaye et coll. ont récemment montré que la concentration circulante de myostatine était similaire chez des patients cancéreux cachectiques et non-cachectiques, contrairement à la concentration circulante d’activine, qui était supérieure chez les patients cachectiques (Loumaye et coll., 2015 ). Enfin, le stress oxydatif pourrait aussi contribuer à l’étiologie du déconditionnement associée au cancer. Une étude récente a ainsi montré que l’oxydation des protéines musculaires était supérieure chez des patients cancéreux comparativement à des sujets témoins, et que cette augmentation était positivement corrélée à l’activation de voies de signalisation (NF-κB et FoxO) sensibles à l’état oxydatif, et connues pour être impliquées dans le contrôle de la synthèse et de la dégradation des protéines (Puig-Vilanova et coll., 2015
). Enfin, le stress oxydatif pourrait aussi contribuer à l’étiologie du déconditionnement associée au cancer. Une étude récente a ainsi montré que l’oxydation des protéines musculaires était supérieure chez des patients cancéreux comparativement à des sujets témoins, et que cette augmentation était positivement corrélée à l’activation de voies de signalisation (NF-κB et FoxO) sensibles à l’état oxydatif, et connues pour être impliquées dans le contrôle de la synthèse et de la dégradation des protéines (Puig-Vilanova et coll., 2015 ).
). ; Springer et coll., 2014
; Springer et coll., 2014 ). La voie de signalisation Akt-mTOR, qui contrôle positivement l’initiation de la traduction des protéines, est également inhibée (Desgeorges et coll., 2015
). La voie de signalisation Akt-mTOR, qui contrôle positivement l’initiation de la traduction des protéines, est également inhibée (Desgeorges et coll., 2015 ), suggérant l’existence d’une réduction de la synthèse des protéines dans ce modèle. L’ischémie cérébrale est également à l’origine d’une augmentation de l’expression de la myostatine (Desgeorges et coll., 2015
), suggérant l’existence d’une réduction de la synthèse des protéines dans ce modèle. L’ischémie cérébrale est également à l’origine d’une augmentation de l’expression de la myostatine (Desgeorges et coll., 2015 ; Springer et coll., 2014
; Springer et coll., 2014 ), un régulateur négatif de la masse musculaire. En accord avec ces données expérimentales obtenues chez l’animal, Ryan et coll. ont rapporté une augmentation de l’expression de la myostatine dans le muscle vastus lateralis chez les patients ayant eu un AVC (délai post-AVC > 6 mois) (Ryan et coll., 2011
), un régulateur négatif de la masse musculaire. En accord avec ces données expérimentales obtenues chez l’animal, Ryan et coll. ont rapporté une augmentation de l’expression de la myostatine dans le muscle vastus lateralis chez les patients ayant eu un AVC (délai post-AVC > 6 mois) (Ryan et coll., 2011 ), mais qui n’était pas retrouvée lorsque l’analyse était réalisée plus de 9 mois après l’AVC (von Walden et coll., 2012
), mais qui n’était pas retrouvée lorsque l’analyse était réalisée plus de 9 mois après l’AVC (von Walden et coll., 2012 ). D’autres études ont également décrit, dans le même modèle de muscle vastus lateralis de patients ayant eu un AVC (délai post-AVC > 6 mois), une augmentation cette fois du niveau en ARNm de TNF-α (Hafer-Macko et coll., 2005
). D’autres études ont également décrit, dans le même modèle de muscle vastus lateralis de patients ayant eu un AVC (délai post-AVC > 6 mois), une augmentation cette fois du niveau en ARNm de TNF-α (Hafer-Macko et coll., 2005 ), qui de la même façon n’était pas retrouvée lorsque l’analyse était réalisée plus de 9 mois après l’AVC (von Walden et coll., 2012
), qui de la même façon n’était pas retrouvée lorsque l’analyse était réalisée plus de 9 mois après l’AVC (von Walden et coll., 2012 ). Ces données suggèrent un rôle important pour les cytokines d’origine musculaire (myokines) dans le déconditionnement musculaire du patient ayant eu un AVC, plusieurs mois après la survenue de l’AVC. Associée à la réponse inflammatoire systémique (Lambertsen et coll., 2012
). Ces données suggèrent un rôle important pour les cytokines d’origine musculaire (myokines) dans le déconditionnement musculaire du patient ayant eu un AVC, plusieurs mois après la survenue de l’AVC. Associée à la réponse inflammatoire systémique (Lambertsen et coll., 2012 ), l’augmentation de la production de ces facteurs circulants (myokines et cytokines) pourrait contribuer largement au déconditionnement musculaire du patient ayant eu un AVC.
), l’augmentation de la production de ces facteurs circulants (myokines et cytokines) pourrait contribuer largement au déconditionnement musculaire du patient ayant eu un AVC. ), suggérant l’activation du système protéolytique ubiquitine-protéasome dans ce contexte. L’expression de la myostatine (ARNm et protéine) était supérieure chez les patients insuffisants cardiaques comparativement à des sujets témoins (Gielen et coll., 2012
), suggérant l’activation du système protéolytique ubiquitine-protéasome dans ce contexte. L’expression de la myostatine (ARNm et protéine) était supérieure chez les patients insuffisants cardiaques comparativement à des sujets témoins (Gielen et coll., 2012 ). De façon intéressante, il a été montré, dans un modèle murin d’insuffisance cardiaque, que la production de myostatine par le myocarde pouvait contribuer directement à la cachexie musculaire (Heineke et coll., 2010
). De façon intéressante, il a été montré, dans un modèle murin d’insuffisance cardiaque, que la production de myostatine par le myocarde pouvait contribuer directement à la cachexie musculaire (Heineke et coll., 2010 ), suggérant un rôle important de la myostatine dans la cachexie associée à l’insuffisance cardiaque. À l’inverse, le niveau en ARNm d’IGF-1 (insulin-like growth factor-1), un régulateur positif de la voie de signalisation Akt-mTOR, était inférieur chez des patients insuffisants cardiaques comparativement à des sujets témoins (Gielen et coll., 2012
), suggérant un rôle important de la myostatine dans la cachexie associée à l’insuffisance cardiaque. À l’inverse, le niveau en ARNm d’IGF-1 (insulin-like growth factor-1), un régulateur positif de la voie de signalisation Akt-mTOR, était inférieur chez des patients insuffisants cardiaques comparativement à des sujets témoins (Gielen et coll., 2012 ; Hambrecht et coll., 2002
; Hambrecht et coll., 2002 ). Ces observations suggèrent que l’initiation de la traduction des protéines musculaires était réduite chez ces patients. L’expression musculaire d’IL-1β, IL-6, TNF-α est supérieure chez des patients insuffisants respiratoires par rapport à celle observée chez des sujets témoins (Gielen et coll., 2003
). Ces observations suggèrent que l’initiation de la traduction des protéines musculaires était réduite chez ces patients. L’expression musculaire d’IL-1β, IL-6, TNF-α est supérieure chez des patients insuffisants respiratoires par rapport à celle observée chez des sujets témoins (Gielen et coll., 2003 ), suggérant encore une fois, dans ce contexte pathologique, l’intervention de ces myokines dans le contrôle de la cachexie. On soulignera également le rôle plus particulier joué ici par l’angiotensine II. En effet, les patients cachectiques à des stades avancés d’insuffisance cardiaque ont fréquemment un niveau élevé d’angiotensine II (Roig et coll., 2000
), suggérant encore une fois, dans ce contexte pathologique, l’intervention de ces myokines dans le contrôle de la cachexie. On soulignera également le rôle plus particulier joué ici par l’angiotensine II. En effet, les patients cachectiques à des stades avancés d’insuffisance cardiaque ont fréquemment un niveau élevé d’angiotensine II (Roig et coll., 2000 ). De plus, le traitement par des inhibiteurs de l’enzyme de conversion de l’angiotensine diminue le risque de perte de poids chez ces patients (Anker et coll., 2003
). De plus, le traitement par des inhibiteurs de l’enzyme de conversion de l’angiotensine diminue le risque de perte de poids chez ces patients (Anker et coll., 2003 ). Chez l’animal, un traitement par l’angiotensine II augmente la dégradation musculaire des protéines (Brink et coll., 2001
). Chez l’animal, un traitement par l’angiotensine II augmente la dégradation musculaire des protéines (Brink et coll., 2001 ). Ceci met notamment en jeu une réduction de l’expression musculaire d’IGF-1 (Brink et coll., 2001
). Ceci met notamment en jeu une réduction de l’expression musculaire d’IGF-1 (Brink et coll., 2001 ; Song et coll., 2005
; Song et coll., 2005 ) et la régulation de l’expression des E3-ubiquitines ligases MuRF-1 et MAFbx, via la régulation de l’axe Akt-FoxO (Yoshida et coll., 2010
) et la régulation de l’expression des E3-ubiquitines ligases MuRF-1 et MAFbx, via la régulation de l’axe Akt-FoxO (Yoshida et coll., 2010 ). L’activation du stress oxydant chez les patients insuffisants cardiaques (Radovanovic et coll., 2012
). L’activation du stress oxydant chez les patients insuffisants cardiaques (Radovanovic et coll., 2012 ) doit également être considérée comme un facteur potentiel du contrôle de l’équilibre entre synthèse et dégradation des protéines musculaires (Powers et coll., 2012
) doit également être considérée comme un facteur potentiel du contrôle de l’équilibre entre synthèse et dégradation des protéines musculaires (Powers et coll., 2012 ). Enfin, on notera également qu’il a été rapporté l’existence d’une mort nucléaire2
dans les fibres musculaires de patients insuffisants cardiaques (Adams et coll., 1999
). Enfin, on notera également qu’il a été rapporté l’existence d’une mort nucléaire2
dans les fibres musculaires de patients insuffisants cardiaques (Adams et coll., 1999 ), mécanisme pouvant également contribuer à la cachexie chez ces patients.
), mécanisme pouvant également contribuer à la cachexie chez ces patients. ) et la dégradation des protéines (axe Akt-FoxO) (Sandri et coll., 2004
) et la dégradation des protéines (axe Akt-FoxO) (Sandri et coll., 2004 ). Akt est donc au carrefour du contrôle du métabolisme du glucose et du métabolisme anabolique. Pereira et coll. ont montré que des patients diabétiques de type 2 de sexe masculin présentaient un état de résistance à l’action anabolique de l’insuline (Pereira et coll., 2008
). Akt est donc au carrefour du contrôle du métabolisme du glucose et du métabolisme anabolique. Pereira et coll. ont montré que des patients diabétiques de type 2 de sexe masculin présentaient un état de résistance à l’action anabolique de l’insuline (Pereira et coll., 2008 ), suggérant que le métabolisme protéique, comme celui du glucose, serait insulino-résistant chez les patients diabétiques de type 2. Ce mécanisme pourrait contribuer à l’obésité sarcopénique chez ces patients. Concernant la protéolyse, si les modèles expérimentaux du diabète chez l’animal mettent clairement en évidence une activation du système ubiquitine-protéasome (Rom et Reznick, 2016
), suggérant que le métabolisme protéique, comme celui du glucose, serait insulino-résistant chez les patients diabétiques de type 2. Ce mécanisme pourrait contribuer à l’obésité sarcopénique chez ces patients. Concernant la protéolyse, si les modèles expérimentaux du diabète chez l’animal mettent clairement en évidence une activation du système ubiquitine-protéasome (Rom et Reznick, 2016 ), il n’existe à notre connaissance aucune étude qui a exploré ce mécanisme chez le patient diabétique de type 2. Les mécanismes sous-jacents à l’insulino-résistance sont en partie associés au développement d’une réponse inflammatoire, qui pourrait aussi contribuer à l’évolution du processus sarcopénique chez les patients diabétiques de type 2, notamment par la modulation de l’activité transcriptionnelle du facteur de transcription NF-κB (Tantiwong et coll., 2010
), il n’existe à notre connaissance aucune étude qui a exploré ce mécanisme chez le patient diabétique de type 2. Les mécanismes sous-jacents à l’insulino-résistance sont en partie associés au développement d’une réponse inflammatoire, qui pourrait aussi contribuer à l’évolution du processus sarcopénique chez les patients diabétiques de type 2, notamment par la modulation de l’activité transcriptionnelle du facteur de transcription NF-κB (Tantiwong et coll., 2010 ). Par ailleurs, il a été montré d’une part que l’expression musculaire de la myostatine (Hittel et coll., 2009
). Par ailleurs, il a été montré d’une part que l’expression musculaire de la myostatine (Hittel et coll., 2009 ; Palsgaard et coll., 2009
; Palsgaard et coll., 2009 ) ainsi que sa concentration circulante étaient augmentées chez des patients diabétiques de type 2 (Hittel et coll., 2009
) ainsi que sa concentration circulante étaient augmentées chez des patients diabétiques de type 2 (Hittel et coll., 2009 ), et d’autre part que le niveau de myostatine était corrélé avec la sévérité de l’insulino-résistance (Hittel et coll., 2009
), et d’autre part que le niveau de myostatine était corrélé avec la sévérité de l’insulino-résistance (Hittel et coll., 2009 ). Ces données suggèrent un rôle de la myostatine dans l’étiologie de l’insulino-résistance, et de façon plus classique, une contribution à l’obésité sarcopénique. Des marqueurs de stress oxydant (peroxydation lipidique) sont également augmentés dans le muscle squelettique de patients diabétiques de type 2 (Ingram et coll., 2012
). Ces données suggèrent un rôle de la myostatine dans l’étiologie de l’insulino-résistance, et de façon plus classique, une contribution à l’obésité sarcopénique. Des marqueurs de stress oxydant (peroxydation lipidique) sont également augmentés dans le muscle squelettique de patients diabétiques de type 2 (Ingram et coll., 2012 ), pouvant ainsi contribuer au processus atrophique via la régulation de l’équilibre entre synthèse et dégradation des protéines. On notera également que le stress oxydant était associé à la sévérité de l’état d’insulino-résistance chez ces patients (Ingram et coll., 2012). D’une façon générale, l’ensemble de ces données souligne la nature commune de certains mécanismes moléculaires impliqués à la fois dans le contrôle de la sensibilité à l’insuline et dans l’homéostasie musculaire chez le patient diabétique.
), pouvant ainsi contribuer au processus atrophique via la régulation de l’équilibre entre synthèse et dégradation des protéines. On notera également que le stress oxydant était associé à la sévérité de l’état d’insulino-résistance chez ces patients (Ingram et coll., 2012). D’une façon générale, l’ensemble de ces données souligne la nature commune de certains mécanismes moléculaires impliqués à la fois dans le contrôle de la sensibilité à l’insuline et dans l’homéostasie musculaire chez le patient diabétique. ). Chez l’animal, il a été montré expérimentalement que l’application d’un stress psychologique était à l’origine d’une augmentation de l’expression des E3-ubiquitines ligases MuRF-1 et MAFbx, d’une sous-unité du facteur de transcription NF-κB et de la myostatine (Allen et coll., 2010
). Chez l’animal, il a été montré expérimentalement que l’application d’un stress psychologique était à l’origine d’une augmentation de l’expression des E3-ubiquitines ligases MuRF-1 et MAFbx, d’une sous-unité du facteur de transcription NF-κB et de la myostatine (Allen et coll., 2010 ). Bien que ce modèle expérimental n’induise pas à proprement parler d’état dépressif chez l’animal, ces données soulignent l’importance du stress psychologique sur le contrôle de l’homéostasie musculaire.
). Bien que ce modèle expérimental n’induise pas à proprement parler d’état dépressif chez l’animal, ces données soulignent l’importance du stress psychologique sur le contrôle de l’homéostasie musculaire. ), qui pourrait éventuellement contribuer à réguler en amont le déconditionnement musculaire chez ces patients.
), qui pourrait éventuellement contribuer à réguler en amont le déconditionnement musculaire chez ces patients. ). Même si l’action de ces cytokines pro-inflammatoires sur le tissu musculaire reste à déterminer, ces données laissent suggérer que dans cette situation pathologique également, l’état inflammatoire pourrait contribuer au déconditionnement musculaire des patients.
). Même si l’action de ces cytokines pro-inflammatoires sur le tissu musculaire reste à déterminer, ces données laissent suggérer que dans cette situation pathologique également, l’état inflammatoire pourrait contribuer au déconditionnement musculaire des patients. ). Même si certaines données méritent indiscutablement d’être consolidées, la régulation de l’état inflammatoire systémique et local, au niveau musculaire, apparaît comme étant un des facteurs clés de régulation en amont de ces mécanismes. Le stress oxydatif pourrait également jouer un rôle important.
). Même si certaines données méritent indiscutablement d’être consolidées, la régulation de l’état inflammatoire systémique et local, au niveau musculaire, apparaît comme étant un des facteurs clés de régulation en amont de ces mécanismes. Le stress oxydatif pourrait également jouer un rôle important. ). L’activité physique induit un certain nombre d’adaptations physiologiques et moléculaires dans le muscle squelettique et le tissu adipeux que nous allons décrire ci-dessous, qui directement et indirectement relayent les bénéfices de l’activité physique sur les autres organes. En effet, des données récentes des dix dernières années suggèrent que les muscles produisent des signaux de communication à distance avec d’autres organes appelés myokines (Pedersen et Febbraio, 2012
). L’activité physique induit un certain nombre d’adaptations physiologiques et moléculaires dans le muscle squelettique et le tissu adipeux que nous allons décrire ci-dessous, qui directement et indirectement relayent les bénéfices de l’activité physique sur les autres organes. En effet, des données récentes des dix dernières années suggèrent que les muscles produisent des signaux de communication à distance avec d’autres organes appelés myokines (Pedersen et Febbraio, 2012 ) (figure 6.2
) (figure 6.2 ).
). ). Au niveau moléculaire, ces adaptations physiologiques sont relayées par différents effecteurs notamment la p38 MAPK (mitogen-activated protein kinase), l’AMPK (5’-AMP-activated protein kinase), les sirtuines-1/3 et la CaMK-II (calmoduline kinase-II). Ces effecteurs intracellulaires réagissent respectivement à l’état d’oxydo-réduction, aux ratios AMP/ATP, NAD+/NADH, et aux variations calciques de la fibre musculaire (Egan et Zierath, 2013
). Au niveau moléculaire, ces adaptations physiologiques sont relayées par différents effecteurs notamment la p38 MAPK (mitogen-activated protein kinase), l’AMPK (5’-AMP-activated protein kinase), les sirtuines-1/3 et la CaMK-II (calmoduline kinase-II). Ces effecteurs intracellulaires réagissent respectivement à l’état d’oxydo-réduction, aux ratios AMP/ATP, NAD+/NADH, et aux variations calciques de la fibre musculaire (Egan et Zierath, 2013 ). Ces protéines modulent ensuite l’expression et l’activité d’un coactivateur transcriptionnel clé du métabolisme oxydatif appelé PGC1α (peroxisome proliferator activated receptor coactivator-1α) (Lin et coll., 2002
). Ces protéines modulent ensuite l’expression et l’activité d’un coactivateur transcriptionnel clé du métabolisme oxydatif appelé PGC1α (peroxisome proliferator activated receptor coactivator-1α) (Lin et coll., 2002 ). PGC1α stimule par ailleurs l’expression de myokines comme l’irisine (Bostrom et coll., 2012
). PGC1α stimule par ailleurs l’expression de myokines comme l’irisine (Bostrom et coll., 2012 ). La contraction musculaire induit également la sécrétion de myokines ayant des effets pléiotropes, à la fois sur le muscle lui-même et sur des organes à distance. Parmi ces myokines, certaines ont des propriétés anti-inflammatoires comme l’interleukine-6 (IL-6) (Carey et coll., 2006
). La contraction musculaire induit également la sécrétion de myokines ayant des effets pléiotropes, à la fois sur le muscle lui-même et sur des organes à distance. Parmi ces myokines, certaines ont des propriétés anti-inflammatoires comme l’interleukine-6 (IL-6) (Carey et coll., 2006 ), d’autres des propriétés trophiques comme l’IL-15, le LIF (leukemia inhibitory factor), et l’IGF-1 (Benatti et Pedersen, 2015
), d’autres des propriétés trophiques comme l’IL-15, le LIF (leukemia inhibitory factor), et l’IGF-1 (Benatti et Pedersen, 2015 ), ou encore des propriétés anti-hypertrophiques sur le muscle comme la célèbre myostatine (McPherron et coll., 1997
), ou encore des propriétés anti-hypertrophiques sur le muscle comme la célèbre myostatine (McPherron et coll., 1997 ) (figure 6.2
) (figure 6.2 ).
). ). Ces effets sont médiés par des hormones anaboliques produites pendant l’activité physique comme l’IGF-1 et l’hormone de croissance, et par le stress mécanique généré sur les fibres musculaires pendant la contraction. Ces systèmes activent une voie de signalisation Akt/mTOR qui stimule l’initiation de la traduction des protéines via la protéine p70-S6K1 (Ribosomal protein S6 kinase beta-1) et le facteur de transcription eIF4E (eukaryotic translation initiation factor 4E) (Goodman, 2014
). Ces effets sont médiés par des hormones anaboliques produites pendant l’activité physique comme l’IGF-1 et l’hormone de croissance, et par le stress mécanique généré sur les fibres musculaires pendant la contraction. Ces systèmes activent une voie de signalisation Akt/mTOR qui stimule l’initiation de la traduction des protéines via la protéine p70-S6K1 (Ribosomal protein S6 kinase beta-1) et le facteur de transcription eIF4E (eukaryotic translation initiation factor 4E) (Goodman, 2014 ). L’activation de la voie Akt inhibe également la protéine FOXO3 qui régule la dégradation des protéines par les E3 ubiquitines ligases MuRF1 et atrogin-1/MAFbx. Il est à noter que l’AMPK, activée par les exercices d’endurance, bloque l’activation du complexe mTOR, ce qui explique l’interférence entre les exercices aérobies et de résistance décrite précédemment (Hawley et coll., 2014
). L’activation de la voie Akt inhibe également la protéine FOXO3 qui régule la dégradation des protéines par les E3 ubiquitines ligases MuRF1 et atrogin-1/MAFbx. Il est à noter que l’AMPK, activée par les exercices d’endurance, bloque l’activation du complexe mTOR, ce qui explique l’interférence entre les exercices aérobies et de résistance décrite précédemment (Hawley et coll., 2014 ).
). ; Riviere et coll., 1989
; Riviere et coll., 1989 ). Des données similaires ont été obtenues au cours d’études longitudinales d’entraînement aérobie montrant une amélioration de la réponse lipolytique β-adrénergique sur adipocytes isolés de sujets obèses, indépendamment de la taille adipocytaire (De Glisezinski et coll., 1998
). Des données similaires ont été obtenues au cours d’études longitudinales d’entraînement aérobie montrant une amélioration de la réponse lipolytique β-adrénergique sur adipocytes isolés de sujets obèses, indépendamment de la taille adipocytaire (De Glisezinski et coll., 1998 ). Des améliorations fonctionnelles au niveau récepteur et post-récepteur ont été rapportées (De Glisezinski et coll., 1998
). Des améliorations fonctionnelles au niveau récepteur et post-récepteur ont été rapportées (De Glisezinski et coll., 1998 ; Moro et coll., 2009
; Moro et coll., 2009 ). Il a été montré par microdialyse in situ dans le tissu adipeux que 4 mois d’entraînement aérobie améliore la lipolyse β-adrénergique et ANP (atrial natriuretic peptide)-dépendante chez des hommes jeunes en surpoids (Moro et coll., 2005
). Il a été montré par microdialyse in situ dans le tissu adipeux que 4 mois d’entraînement aérobie améliore la lipolyse β-adrénergique et ANP (atrial natriuretic peptide)-dépendante chez des hommes jeunes en surpoids (Moro et coll., 2005 ). Des résultats similaires ont été obtenus chez des femmes obèses atteintes d’un syndrome des ovaires polykystiques (Moro et coll., 2009
). Des résultats similaires ont été obtenus chez des femmes obèses atteintes d’un syndrome des ovaires polykystiques (Moro et coll., 2009 ). Ces effets pourraient impliquer une meilleure efficacité des protéines dépendantes de l’AMPc et du GMPc. On observe également une amélioration de la lipolyse induite par un exercice aigu après 4 mois d’entraînement aérobie chez des hommes en surpoids (De Glisezinski et coll., 2003
). Ces effets pourraient impliquer une meilleure efficacité des protéines dépendantes de l’AMPc et du GMPc. On observe également une amélioration de la lipolyse induite par un exercice aigu après 4 mois d’entraînement aérobie chez des hommes en surpoids (De Glisezinski et coll., 2003 ). Ce résultat pourrait s’expliquer en partie par une réduction de l’effet anti-lipolytique α2-adrénergique dans le tissu adipeux, suite à la diminution des niveaux circulant d’adrénaline, le ligand physiologique principal des récepteurs α2-adrénergiques. Ainsi il a été montré que l’activité anti-lipolytique α2-adrénergique était réduite après 3 mois d’entraînement en endurance (Richterova et coll., 2004
). Ce résultat pourrait s’expliquer en partie par une réduction de l’effet anti-lipolytique α2-adrénergique dans le tissu adipeux, suite à la diminution des niveaux circulant d’adrénaline, le ligand physiologique principal des récepteurs α2-adrénergiques. Ainsi il a été montré que l’activité anti-lipolytique α2-adrénergique était réduite après 3 mois d’entraînement en endurance (Richterova et coll., 2004 ). Des adaptations similaires de lipolyse du tissu adipeux ont été observées en réponse à un entraînement en résistance chez des sujets obèses (Polak et coll., 2005
). Des adaptations similaires de lipolyse du tissu adipeux ont été observées en réponse à un entraînement en résistance chez des sujets obèses (Polak et coll., 2005 ).
). ), la météorine (Rao et coll., 2014
), la météorine (Rao et coll., 2014 ), le β-aminoisobutyric acid (BAIBA) (Roberts et coll., 2014
), le β-aminoisobutyric acid (BAIBA) (Roberts et coll., 2014 ) et FGF-21 (fibroblast growth factor-21) (Kharitonenkov et coll., 2005
) et FGF-21 (fibroblast growth factor-21) (Kharitonenkov et coll., 2005 ), en partie via l’induction de PGC1α. Ces myokines activent la conversion du tissu adipeux blanc en tissu adipeux beige, qui possède un potentiel oxydatif et une respiration cellulaire accentués en raison de l’induction de la protéine découplante-1 (UCP1) (Bostrom et coll., 2012
), en partie via l’induction de PGC1α. Ces myokines activent la conversion du tissu adipeux blanc en tissu adipeux beige, qui possède un potentiel oxydatif et une respiration cellulaire accentués en raison de l’induction de la protéine découplante-1 (UCP1) (Bostrom et coll., 2012 ; Fisher et coll., 2012
; Fisher et coll., 2012 ; Rao et coll., 2014
; Rao et coll., 2014 ; Roberts et coll., 2014
; Roberts et coll., 2014 ). Une des conséquences de ce phénotype est une plus grande consommation d’acides gras issus de la lipolyse et de glucose par ces adipocytes beiges (figure 6.2
). Une des conséquences de ce phénotype est une plus grande consommation d’acides gras issus de la lipolyse et de glucose par ces adipocytes beiges (figure 6.2 ). Ces adaptations du tissu adipeux permettent de lutter contre la prise de poids et corrigent le déséquilibre glycémique chez les souris rendues obèses par un régime riche en graisses (Bostrom et coll., 2012
). Ces adaptations du tissu adipeux permettent de lutter contre la prise de poids et corrigent le déséquilibre glycémique chez les souris rendues obèses par un régime riche en graisses (Bostrom et coll., 2012 ; Kharitonenkov et coll., 2005
; Kharitonenkov et coll., 2005 ).
). ). Comme déjà évoqué dans les différents chapitres de cette expertise, l’activité physique devrait être prescrite dans la prise en charge d’un certain nombre d’affections chroniques d’origine métabolique (obésité, diabète de type 1 et 2, insulino-résistance, dyslipidémies), cardiovasculaire (hypertension, maladie coronarienne, insuffisance cardiaque, claudication intermittente), pulmonaire (broncho-pneumopathie chronique obstructive, asthme), ostéo-articulaire (arthrose, polyarthrite rhumatoïde, ostéoporose, fibromyalgie, syndrome de fatigue chronique), neurologique (dépression, schizophrénie), et des cancers (Pedersen et Saltin, 2015
). Comme déjà évoqué dans les différents chapitres de cette expertise, l’activité physique devrait être prescrite dans la prise en charge d’un certain nombre d’affections chroniques d’origine métabolique (obésité, diabète de type 1 et 2, insulino-résistance, dyslipidémies), cardiovasculaire (hypertension, maladie coronarienne, insuffisance cardiaque, claudication intermittente), pulmonaire (broncho-pneumopathie chronique obstructive, asthme), ostéo-articulaire (arthrose, polyarthrite rhumatoïde, ostéoporose, fibromyalgie, syndrome de fatigue chronique), neurologique (dépression, schizophrénie), et des cancers (Pedersen et Saltin, 2015 ). Les effets bénéfiques de l’activité physique sont donc très largement multifactoriels. Nous allons traiter les mécanismes physiologiques et moléculaires potentiellement impliqués dans les effets bénéfiques de l’activité physique pour chaque pathologie chronique.
). Les effets bénéfiques de l’activité physique sont donc très largement multifactoriels. Nous allons traiter les mécanismes physiologiques et moléculaires potentiellement impliqués dans les effets bénéfiques de l’activité physique pour chaque pathologie chronique. ). L’activité physique augmente aussi la production de facteurs vasodilatateurs comme le peptide atrial natriurétique ayant une activité antagoniste du système rénine-angiotensine-aldostérone (Coats et coll., 1992
). L’activité physique augmente aussi la production de facteurs vasodilatateurs comme le peptide atrial natriurétique ayant une activité antagoniste du système rénine-angiotensine-aldostérone (Coats et coll., 1992 ). L’activité physique exerce par ailleurs un effet anti-athéromateux en prévenant la formation des thrombus et en inhibant l’inflammation (Pedersen et Febbraio, 2012
). L’activité physique exerce par ailleurs un effet anti-athéromateux en prévenant la formation des thrombus et en inhibant l’inflammation (Pedersen et Febbraio, 2012 ). La prévention des thrombus s’explique par une augmentation de la fibrinolyse et une diminution de l’agrégation plaquettaire. Au niveau cardiaque, l’activité physique augmente le volume d’éjection systolique et la force de contraction du myocarde, tout en limitant l’hypertrophie induite par une surcharge de pression (Demopoulos et coll., 1997
). La prévention des thrombus s’explique par une augmentation de la fibrinolyse et une diminution de l’agrégation plaquettaire. Au niveau cardiaque, l’activité physique augmente le volume d’éjection systolique et la force de contraction du myocarde, tout en limitant l’hypertrophie induite par une surcharge de pression (Demopoulos et coll., 1997 ). En augmentant le potentiel oxydatif des muscles locomoteurs, l’activité physique repousse le seuil anaérobie et améliore la tolérance à l’exercice des patients insuffisants cardiaques (Meyer et coll., 1996
). En augmentant le potentiel oxydatif des muscles locomoteurs, l’activité physique repousse le seuil anaérobie et améliore la tolérance à l’exercice des patients insuffisants cardiaques (Meyer et coll., 1996 ).
). ). Une diminution locale de l’inflammation et du stress oxydant serait également observée. L’activité physique active aussi la production de facteurs neurotrophiques dans l’hippocampe et dans les muscles comme le BDNF, le GDNF (glial cell-derived neurotrophic factor) et l’IGF-1 (Aguiar et coll., 2014
). Une diminution locale de l’inflammation et du stress oxydant serait également observée. L’activité physique active aussi la production de facteurs neurotrophiques dans l’hippocampe et dans les muscles comme le BDNF, le GDNF (glial cell-derived neurotrophic factor) et l’IGF-1 (Aguiar et coll., 2014 ; Wrann et coll., 2013
; Wrann et coll., 2013 ). Ces facteurs stimulent la prolifération et la survie des neurones, la plasticité neuronale, et l’expression de protéines synaptiques (synaptophysin, postsynaptic density protein 95) et de β-endorphine dans l’hippocampe (Knaepen et coll., 2010
). Ces facteurs stimulent la prolifération et la survie des neurones, la plasticité neuronale, et l’expression de protéines synaptiques (synaptophysin, postsynaptic density protein 95) et de β-endorphine dans l’hippocampe (Knaepen et coll., 2010 ). L’activité physique induit également la libération de VEGF, qui augmente la vascularisation et le flux sanguin cérébral (Arany et coll., 2008
). L’activité physique induit également la libération de VEGF, qui augmente la vascularisation et le flux sanguin cérébral (Arany et coll., 2008 ). Enfin, l’activité physique augmente les concentrations cérébrales de sérotonine en induisant la tryptophane hydroxylase dans le noyau du Raphé et en augmentant la biodisponibilité en tryptophane libre, acide aminé précurseur de la sérotonine. Les activités physiques de type aérobie augmentent également l’expression de la kynurénine aminotransférase via le coactivateur transcriptionnel PGC1α dans les muscles (Agudelo et coll., 2014
). Enfin, l’activité physique augmente les concentrations cérébrales de sérotonine en induisant la tryptophane hydroxylase dans le noyau du Raphé et en augmentant la biodisponibilité en tryptophane libre, acide aminé précurseur de la sérotonine. Les activités physiques de type aérobie augmentent également l’expression de la kynurénine aminotransférase via le coactivateur transcriptionnel PGC1α dans les muscles (Agudelo et coll., 2014 ), ce qui diminue les concentrations circulantes de kynurénine, un métabolite du tryptophane induisant des troubles dépressifs. Il semble aussi que les activités physiques de type Qi gong s’opposent à l’hyperactivité de l’axe corticotrope en diminuant les influences cognitives et affectives au niveau du système limbique (Tsang et Fung, 2008
), ce qui diminue les concentrations circulantes de kynurénine, un métabolite du tryptophane induisant des troubles dépressifs. Il semble aussi que les activités physiques de type Qi gong s’opposent à l’hyperactivité de l’axe corticotrope en diminuant les influences cognitives et affectives au niveau du système limbique (Tsang et Fung, 2008 ). Les exercices de type résistance ne semblent pas quant à eux modifier les concentrations hippocampiques de BDNF.
). Les exercices de type résistance ne semblent pas quant à eux modifier les concentrations hippocampiques de BDNF. ). Comme dans la dépression, ces effets sont corrélés à une augmentation de la neurogenèse et des concentrations de BDNF dans l’hippocampe.
). Comme dans la dépression, ces effets sont corrélés à une augmentation de la neurogenèse et des concentrations de BDNF dans l’hippocampe. ). Les stades avancés de cancer évoluent vers une cachexie, c’est-à-dire une perte de masse musculaire (Gould et coll., 2013
). Les stades avancés de cancer évoluent vers une cachexie, c’est-à-dire une perte de masse musculaire (Gould et coll., 2013 ). Via l’induction de systèmes anti-oxydants et anti-inflammatoires au niveau systémique et hypothalamique, l’activité physique atténue l’anorexie associée à l’état cachectique (Lira et coll., 2011
). Via l’induction de systèmes anti-oxydants et anti-inflammatoires au niveau systémique et hypothalamique, l’activité physique atténue l’anorexie associée à l’état cachectique (Lira et coll., 2011 ). Elle contribue également au maintien de la masse musculaire en stimulant la synthèse des protéines et la production d’hormones anaboliques comme l’hormone de croissance et l’IGF-1. Ces bénéfices restent à confirmer sur le plan clinique (Grande et coll., 2014
). Elle contribue également au maintien de la masse musculaire en stimulant la synthèse des protéines et la production d’hormones anaboliques comme l’hormone de croissance et l’IGF-1. Ces bénéfices restent à confirmer sur le plan clinique (Grande et coll., 2014 ; Stene et coll., 2013
; Stene et coll., 2013 ) (voir chapitre « Cancers »).
) (voir chapitre « Cancers »). ). L’activité physique augmente les concentrations circulantes de cytokines anti-inflammatoires (IL-10, IL-1Ra) et diminue l’inflammation locale dans le parenchyme pulmonaire (Silva et coll., 2010
). L’activité physique augmente les concentrations circulantes de cytokines anti-inflammatoires (IL-10, IL-1Ra) et diminue l’inflammation locale dans le parenchyme pulmonaire (Silva et coll., 2010 ). Les muscles actifs produisent également de l’interleukine-6 qui s’oppose aux effets délétères du TNFα sur les voies aériennes et sur la fonte musculaire (cachexie) (Petersen et coll., 2008
). Les muscles actifs produisent également de l’interleukine-6 qui s’oppose aux effets délétères du TNFα sur les voies aériennes et sur la fonte musculaire (cachexie) (Petersen et coll., 2008 ).
). ; LaMonte et coll., 2005
; LaMonte et coll., 2005 ; Tuomilehto et coll., 2001
; Tuomilehto et coll., 2001 ). Les mécanismes par lesquels un programme adapté d’activité physique corrige en partie le déséquilibre glycémique et l’hémoglobine glyquée (HbA1c) sont multiples. Un des effets majeurs de l’activité physique est l’amélioration de la sensibilité à l’insuline des tissus périphériques, notamment du muscle squelettique (Bruce et coll., 2006
). Les mécanismes par lesquels un programme adapté d’activité physique corrige en partie le déséquilibre glycémique et l’hémoglobine glyquée (HbA1c) sont multiples. Un des effets majeurs de l’activité physique est l’amélioration de la sensibilité à l’insuline des tissus périphériques, notamment du muscle squelettique (Bruce et coll., 2006 ; Polak et coll., 2005
; Polak et coll., 2005 ). Ceci implique une augmentation de la translocation du transporteur de glucose GLUT4 à la membrane chez des patients diabétiques ayant suivi un programme d’entraînement (Hussey et coll., 2012
). Ceci implique une augmentation de la translocation du transporteur de glucose GLUT4 à la membrane chez des patients diabétiques ayant suivi un programme d’entraînement (Hussey et coll., 2012 ). On observe également une potentialisation de la signalisation insulinique dans le muscle, reflétée en partie par une augmentation de la phosphorylation d’Akt et d’AS160 (Akt substrate of 160 kDa) ou TBC1D4 (TBC1 domain family member 4) (Sylow et coll., 2014
). On observe également une potentialisation de la signalisation insulinique dans le muscle, reflétée en partie par une augmentation de la phosphorylation d’Akt et d’AS160 (Akt substrate of 160 kDa) ou TBC1D4 (TBC1 domain family member 4) (Sylow et coll., 2014 ), une Rab GTPase impliquée dans le transport vésiculaire de GLUT4 (Pehmoller et coll., 2012
), une Rab GTPase impliquée dans le transport vésiculaire de GLUT4 (Pehmoller et coll., 2012 ). Ceci pourrait s’expliquer par une diminution des concentrations intramyocellulaires de diacylglycérols et céramides (Dube et coll., 2011
). Ceci pourrait s’expliquer par une diminution des concentrations intramyocellulaires de diacylglycérols et céramides (Dube et coll., 2011 ), des lipides toxiques capables d’inhiber la signalisation de l’insuline au niveau d’IRS1 (insulin receptor substrate-1) et d’Akt respectivement (Samuel et Shulman, 2012
), des lipides toxiques capables d’inhiber la signalisation de l’insuline au niveau d’IRS1 (insulin receptor substrate-1) et d’Akt respectivement (Samuel et Shulman, 2012 ). Cette baisse des diacylglycérols et céramides ferait suite à une augmentation de la capacité oxydative musculaire et de l’oxydation des lipides. Ceci implique une augmentation de la densité mitochondriale et des enzymes de la β-oxydation médiée par le coactivateur transcriptionnel PGC1α (Sparks et coll., 2013
). Cette baisse des diacylglycérols et céramides ferait suite à une augmentation de la capacité oxydative musculaire et de l’oxydation des lipides. Ceci implique une augmentation de la densité mitochondriale et des enzymes de la β-oxydation médiée par le coactivateur transcriptionnel PGC1α (Sparks et coll., 2013 ). Il est aussi largement admis aujourd’hui que la contraction musculaire augmente le transport de glucose et la translocation de GLUT4 via l’AMPK (Friedrichsen et coll., 2013
). Il est aussi largement admis aujourd’hui que la contraction musculaire augmente le transport de glucose et la translocation de GLUT4 via l’AMPK (Friedrichsen et coll., 2013 ). Par ailleurs, une augmentation de la densité capillaire par fibre musculaire facilite la diffusion et le captage de glucose par les muscles en réponse à l’activité physique (Akerstrom et coll., 2014
). Par ailleurs, une augmentation de la densité capillaire par fibre musculaire facilite la diffusion et le captage de glucose par les muscles en réponse à l’activité physique (Akerstrom et coll., 2014 ). Ces effets se retrouvent à la fois dans des exercices d’endurance, de résistance ou une combinaison des deux. Il semblerait, pour finir, que l’activité physique facilite la sécrétion de myokines capables de stimuler le transport de glucose au niveau des muscles et potentiellement du tissu adipeux, comme l’IL-6, l’apeline et le FGF-21 (Besse-Patin et coll., 2014
). Ces effets se retrouvent à la fois dans des exercices d’endurance, de résistance ou une combinaison des deux. Il semblerait, pour finir, que l’activité physique facilite la sécrétion de myokines capables de stimuler le transport de glucose au niveau des muscles et potentiellement du tissu adipeux, comme l’IL-6, l’apeline et le FGF-21 (Besse-Patin et coll., 2014 ). Ces adaptations métaboliques à l’activité physique sont également observées dans le diabète de type 1. Les exercices par intervalles de haute intensité et de sprint semblent également efficaces pour améliorer la sensibilité à l’insuline via PGC1α et une augmentation de la protéine GLUT4 musculaire, malgré un faible volume hebdomadaire (< 75 min/semaine) (Gillen et coll., 2016
). Ces adaptations métaboliques à l’activité physique sont également observées dans le diabète de type 1. Les exercices par intervalles de haute intensité et de sprint semblent également efficaces pour améliorer la sensibilité à l’insuline via PGC1α et une augmentation de la protéine GLUT4 musculaire, malgré un faible volume hebdomadaire (< 75 min/semaine) (Gillen et coll., 2016 ; Little et coll., 2011
; Little et coll., 2011 ).
). ). Plusieurs études épidémiologiques ont mis en évidence qu’une diminution de la dépense énergétique liée aux activités physiques quotidiennes est très fortement corrélée à l’augmentation du poids moyen des populations aux États-Unis (Church et coll., 2011
). Plusieurs études épidémiologiques ont mis en évidence qu’une diminution de la dépense énergétique liée aux activités physiques quotidiennes est très fortement corrélée à l’augmentation du poids moyen des populations aux États-Unis (Church et coll., 2011 ). L’activité physique prescrite seule ne semble pas suffisante pour induire une perte de poids significative en raison d’une compensation par la prise alimentaire. Cependant, en association avec une restriction calorique, l’activité physique potentialise la perte de poids et facilite le maintien à long terme de la perte de poids (Church et coll., 2009
). L’activité physique prescrite seule ne semble pas suffisante pour induire une perte de poids significative en raison d’une compensation par la prise alimentaire. Cependant, en association avec une restriction calorique, l’activité physique potentialise la perte de poids et facilite le maintien à long terme de la perte de poids (Church et coll., 2009 ). Au-delà de l’aspect strictement calorique, l’activité physique induit également des adaptations facilitant la mobilisation des graisses par le tissu adipeux et leur oxydation par les muscles locomoteurs (Horowitz, 2003
). Au-delà de l’aspect strictement calorique, l’activité physique induit également des adaptations facilitant la mobilisation des graisses par le tissu adipeux et leur oxydation par les muscles locomoteurs (Horowitz, 2003 ). L’entraînement en endurance améliore la sensibilité lipolytique du tissu adipeux aux principales hormones lipolytiques (adrénaline et peptide atrial natriurétique) et restaure en partie les défauts de lipolyse constatés chez des sujets en surpoids ou obèses (Moro et Lafontan, 2013
). L’entraînement en endurance améliore la sensibilité lipolytique du tissu adipeux aux principales hormones lipolytiques (adrénaline et peptide atrial natriurétique) et restaure en partie les défauts de lipolyse constatés chez des sujets en surpoids ou obèses (Moro et Lafontan, 2013 ). Pour ce qui est de l’oxydation des lipides, ces effets semblent largement relayés au niveau moléculaire par l’induction de PGC1α et l’activation des sirtuines 1 et 3 dans le muscle squelettique (Hawley et coll., 2014
). Pour ce qui est de l’oxydation des lipides, ces effets semblent largement relayés au niveau moléculaire par l’induction de PGC1α et l’activation des sirtuines 1 et 3 dans le muscle squelettique (Hawley et coll., 2014 ). L’activité physique stimule aussi la production de LPL (lipase des lipoprotéines) par les muscles, ce qui facilite la clairance et l’extraction des triglycérides circulants contenus dans les VLDL (Seip et coll., 1995
). L’activité physique stimule aussi la production de LPL (lipase des lipoprotéines) par les muscles, ce qui facilite la clairance et l’extraction des triglycérides circulants contenus dans les VLDL (Seip et coll., 1995 ). En diminuant la lipolyse basale des adipocytes, notamment au niveau viscéral, l’activité physique diminue le flux d’acides gras vers le foie et la stéatose hépatique (Bacchi et coll., 2013
). En diminuant la lipolyse basale des adipocytes, notamment au niveau viscéral, l’activité physique diminue le flux d’acides gras vers le foie et la stéatose hépatique (Bacchi et coll., 2013 ). Ces adaptations fonctionnelles concourent à diminuer les taux de triglycérides circulants et corriger en partie la dyslipidémie accompagnant les diabètes, l’obésité et le syndrome métabolique dans un certain nombre d’affections chroniques (Earnest et coll., 2013
). Ces adaptations fonctionnelles concourent à diminuer les taux de triglycérides circulants et corriger en partie la dyslipidémie accompagnant les diabètes, l’obésité et le syndrome métabolique dans un certain nombre d’affections chroniques (Earnest et coll., 2013 ).
). ).
). ). En stimulant la force musculaire et l’équilibre, l’activité physique augmente les contraintes mécaniques sur l’os et la densité osseuse en facilitant la production de l’ostéocalcine par les ostéoblastes et la fixation du calcium (Coiro et coll., 2012
). En stimulant la force musculaire et l’équilibre, l’activité physique augmente les contraintes mécaniques sur l’os et la densité osseuse en facilitant la production de l’ostéocalcine par les ostéoblastes et la fixation du calcium (Coiro et coll., 2012 ; Iwamoto et coll., 2004
; Iwamoto et coll., 2004 ).
).