| |
| Med Sci (Paris). 33(12): 1035–1038. doi: 10.1051/medsci/20173312006.Un modèle mathématique pour l’étude des interactions bactériennes en biofilm Bénédicte Martin1a and Fabrice Mahé2 1Inserm U1241 Nutrition, métabolismes et cancer (NuMeCan) – Équipe Contrôle du métabolisme du fer et maladies associées au fer (CIMIAD), Université de Rennes 1-2, avenue du professeur Léon Bernard, 35043Rennes, France 2Institut de recherche mathématique de Rennes CNRS, Université de Rennes 1, 263, avenue du général Leclerc, 35042Rennes, France MeSH keywords: |
La compréhension de l’étiologie des maladies inflammatoires d’origine infectieuse, en particulier les maladies affectant les muqueuses du système oro-digestif, a beaucoup évolué ces dernières années : plutôt qu’une seule espèce, différentes études ont démontré l’implication de consortiums de plusieurs espèces bactériennes dans l’origine de ces pathologies. La communauté bactérienne non pathologique, très diverse, assure un certain nombre de fonctions essentielles à l’hôte qui l’héberge. Cependant, sous l’effet de variations environnementales, l’émergence et la dominance de certaines espèces est à l’origine d’un déséquilibre de la composition du microbiote, appelé dysbiose, mais aussi d’une modification des fonctions qu’il assure, aboutissant à une stimulation incontrôlée du système immunitaire [1]. Le traitement de ces maladies inflammatoires doit donc viser à reconstituer un microbiote sain et fonctionnel. Dans ce but, il est primordial de comprendre les processus initiant la dysbiose, et notamment les interactions inter-espèces. Parmi les maladies inflammatoires chroniques touchant l’homme, les parodontites, infections des tissus de soutien de la dent, figurent parmi les mieux caractérisées. Dans cette pathologie, les bactéries adhèrent aux tissus minéralisés et aux tissus non minéralisés de soutien des dents (le parodonte), tout en étant enrobées d’une matrice polymérique composée d’exopolysaccharides, de protéines et d’acides nucléiques, constituant les biofilms. Cette organisation leur confère non seulement une résistance plus importante aux traitements, mais elle permet également des interactions intra et inter-espèces, qui peuvent être physiques, génétiques ou encore métaboliques. Le microbiote buccal étant constitué de plus de 800 espèces bactériennes identifiées à ce jour, il est difficile de reproduire in vitro un modèle de biofilm buccal complet. Des études récentes de méta-génomique ont néanmoins pu associer la présence de certaines espèces de bactéries soit à un état sain, soit à un état pathologique : ainsi, Streptococcus gordonii est plutôt considérée comme une bactérie commensale, non pathogène, alors que Porphyromonas gingivalis serait une espèce non seulement à l’origine de la dysbiose, mais également pathogène [2]. |
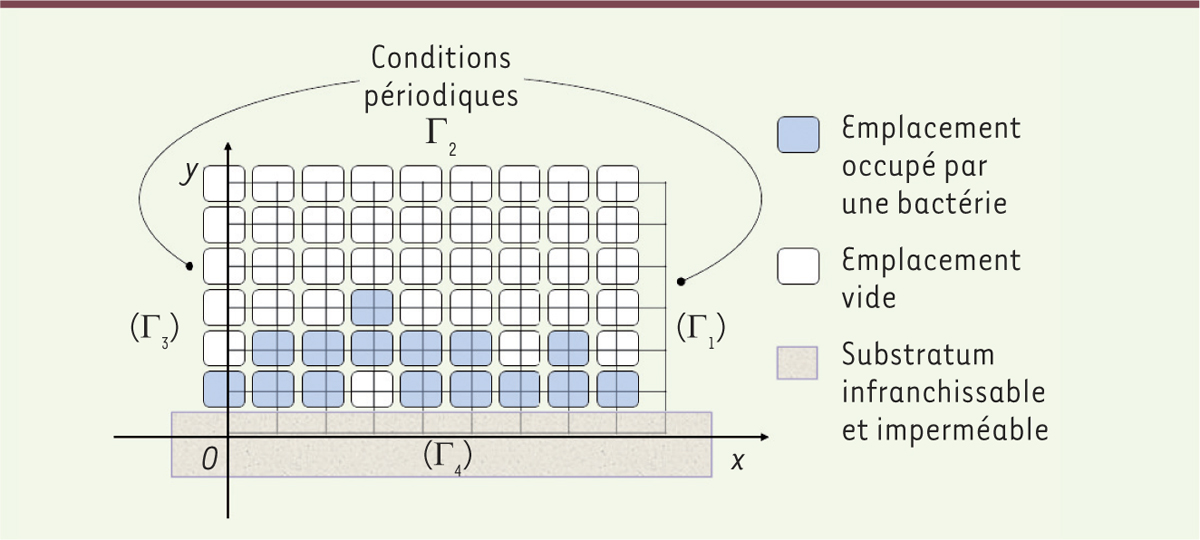
Modélisation mathématique et biofilm Les biofilms multi-bactériens sont des structures microbiologiques complexes rendant l’analyse des interactions entre bactéries difficile. L’intérêt des modèles mathématiques est de faciliter l’étude de ces mécanismes fondamentaux, en formulant des hypothèses qui peuvent être testées par des équations simplifiées [3]. Ces modèles sont flexibles et permettent d’intégrer des quantités importantes de données. Ils permettent, en outre, d’isoler un processus biologique d’un autre, ce qui n’est souvent pas possible expérimentalement. Ainsi, les contributions relatives de chacun des processus peuvent être évaluées. Pour comprendre les interactions entre espèces bactériennes, dans un contexte le plus proche possible de la situation physiopathologique, c’est-à-dire sous la forme de biofilm, un modèle expérimental a été utilisé et caractérisé d’un point de vue biologique [4]. Ce modèle de biofilm est composé de deux espèces de bactéries : d’une part S. gordonii, espèce commensale, et, d’autre part, P. gingivalis, espèce pathogène et délétère, ces deux espèces étant respectivement bénéfique et délétère pour les tissus parodontaux. Des simulations mathématiques du développement spatio-temporel des deux espèces bactériennes dans le biofilm ont été réalisées en parallèle. Contrairement à la plupart des modèles publiés, le modèle mathématique développé ici a été alimenté par les données expérimentales obtenues biologiquement et pas uniquement par des données théoriques [5]. La croissance des bactéries en biofilm est modélisée au moyen d’un automate cellulaire à 2 dimensions (largeur x hauteur) dans lequel chaque bactérie est considérée comme un individu caractérisé par un comportement qui lui est propre (Figure 1) [6]. À chaque division cellulaire, les bactéries se répartissent dans les emplacements les plus proches disponibles dans la matrice de l’automate. Plusieurs paramètres régissent la croissance des bactéries dans le biofilm en fonction du temps :
-
la disponibilité en substrat (cs) : elle dépend non seulement de la concentration initiale de substrat (cs0) mais aussi de ses propriétés biochimiques qui influent sur sa diffusion dans le biofilm ;
-
les caractéristiques de croissance et de métabolisme de la bactérie : elles sont définies par les taux de croissance (µm), les coefficients de rendement (Yxs) et de maintenance (ms), et le taux de consommation du substrat (rs) par chaque bactérie ;
-
les dommages produits par la bactérie qui limitent sa croissance, définis par les paramètres ω, δ et γ [7].
 | Figure 1.
Automate cellulaire à 2 dimensions utilisé pour la simulation mathématique des biofilms. Γ1, Γ2, Γ3 et Γ4 représentent les limites du domaine de simulation. Pour éviter des effets de bord, des conditions périodiques sont appliquées aux extrémités latérales Γ1 et Γ3. x et y correspondent respectivement à la largeur et à l’épaisseur du biofilm. |
La biomasse (cx
) générée par chaque bactérie (i) au sein du biofilm en fonction du temps, est donnée par l’équation présentée dans la
Figure 2
.  | Figure 2.
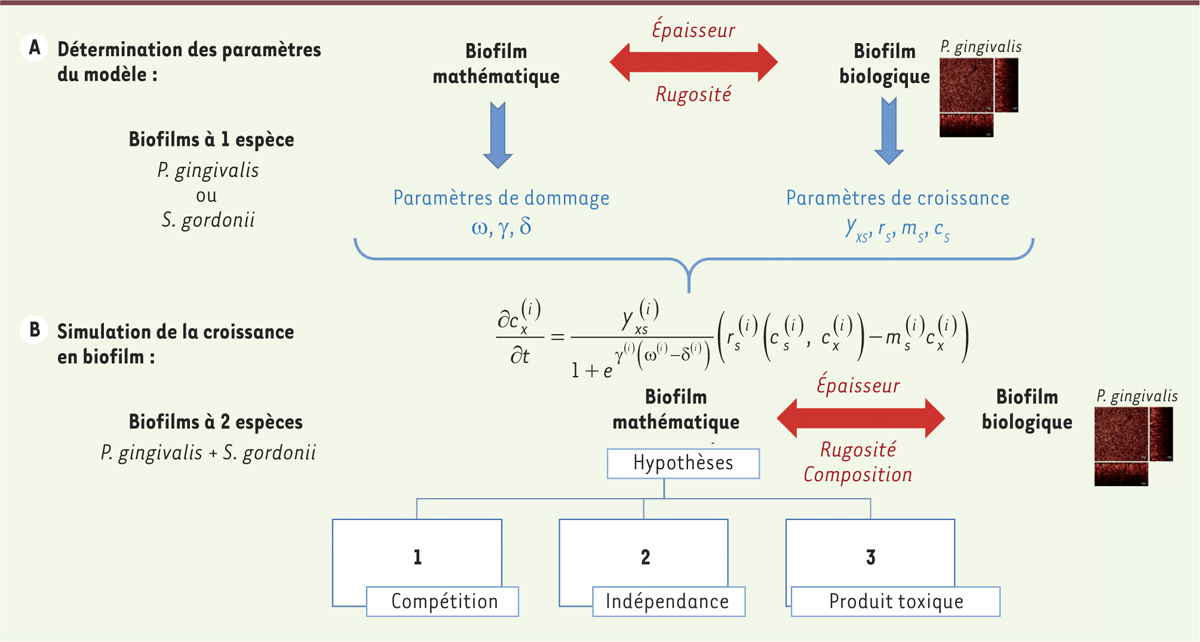
Diagramme représentant le plan expérimental de modélisation des biofilms. En bleu sont représentés les paramètres, expérimentaux ou numériques, utilisés pour alimenter le modèle de croissance du biofilm. En rouge sont indiqués les critères retenus pour la validation du modèle mathématique par les données biologiques. La biomasse cx
générée par chaque bactérie (i) au sein du biofilm en fonction du temps, est donnée par l’équation, avec cx : biomasse de la bactérie (i), t : temps, Yxs : coefficient de rendement ; ms : coefficient de maintenance, rs : taux de consommation du substrat par la bactérie (i) (qui dépend du taux de croissance µm) ; ω : concentration de dommages qui dépend des coefficients δ et γ. |
|
Simulation mathématique des interactions bactériennes inter-espèces en biofilm La procédure adoptée pour l’étude des interactions entre S. gordonii et P. gingivalis a consisté en 2 grandes étapes (Figure 2A et B) : Étape A : dans un premier temps, les paramètres de croissance, de concentration de substrat et de dommages ont été calibrés à partir de modèles expérimentaux de biofilms mono-espèces, soit par mesure directe, quand cela était possible, soit par résolution d’un problème inverse. Étape B : différentes hypothèses d’interaction entre les deux espèces ont été énoncées et testées par le modèle mathématique. Les simulations sont alors comparées aux données expérimentales obtenues avec les biofilms bi-bactériens pour valider les hypothèses d’interaction énoncées :
-
compétition entre les 2 espèces pour un même substrat,
-
indépendance de substrat entre les 2 espèces,
-
production d’une molécule toxique avec indépendance de substrat. Dans ce dernier cas, la molécule produite par une espèce (S. gordoni) est toxique pour l’autre espèce (P. gingivalis).
Différents critères ont été utilisés afin de comparer les biofilms construits par modèles mathématique et biologique. Il s’agit de l’épaisseur des biofilms, leur rugosité, leur composition (c’est-à-dire les proportions relatives des deux espèces les constituant). Les résultats biologiques expérimentaux montrent que les biofilms mono-bactériens de P. gingivalis présentent une répartition en surface et en épaisseur qui s’avère plus hétérogène que celle des biofilms mono-bactériens de S. gordonii. S. gordonii colonise toute la surface du substratum, ce qui est cohérent avec son rôle connu de colonisateur primaire de la cavité buccale [8]. La croissance en épaisseur des biofilms de P. gingivalis, qui est significativement plus élevée (55 µm) que celle des biofilms de S. gordonii (34 µm), est plus lente et n’atteint sa valeur maximale qu’après 48 h (contre 24 h pour S. gordonii). En présence des deux espèces de bactéries, les biofilms formés ont un profil de croissance et une architecture très superposables à ceux des biofilms mono-bactériens produits par S. gordonii : ces biofilms bi-bactériens sont en effet dominés par l’espèce commensale, avec plus de 90 % de la population bactérienne constituée de S. gordonii. Les simulations mathématiques d’épaisseur et de rugosité de biofilm bi-bactérien se sont révélées en adéquation avec les données effectivement observées expérimentalement, uniquement avec l’hypothèse de production par S. gordonii d’une substance toxique pour P. gingivalis (hypothèse 3). Les proportions de bactéries, obtenues avec ce modèle mathématique, s’ajustent également avec les quantités mesurées expérimentalement. Ces données sont cohérentes avec les connaissances des métabolismes des deux espèces. En effet, celles-ci utilisent des substrats différents : substrats protéiques pour P. gingivalis [9] et substrats glucidiques pour S. gordonii [10]. Ceci élimine donc l’hypothèse de compétition de substrat (hypothèse 2). Néanmoins, l’hypothèse d’indépendance de substrat (hypothèse 1) ne suffit pas, en elle-même, pour décrire l’interaction négative entre les 2 espèces au sein du biofilm. Il est nécessaire d’introduire le paramètre de production d’une molécule toxique par S. gordonii responsable de la diminution de croissance de P. gingivalis. Des données de la littérature corroborent cette hypothèse. S. gordonii est en effet capable de produire du peroxyde d’hydrogène [11] qui est toxique pour P. gingivalis [12]. L’interaction entre les deux bactéries a également été étudiée en présence de différentes concentrations de substrat : la comparaison des modèles mono et bi-bactériens permet d’isoler et de mettre en évidence les processus majoritairement mis en œuvre selon ces différentes concentrations. Il est ainsi apparu que seules les fortes concentrations de substrat permettaient de différencier l’hypothèse de production de substance toxique (hypothèse 3) des deux autres. En effet, à faible concentration, les dommages causés pas S. gordonii deviennent minoritaires, en raison de la faible disponibilité en substrat et de la faible croissance de cette espèce. Dans ce cas, les compositions bactériennes des biofilms sont comparables entre les 3 hypothèses. |
Le modèle que nous avons développé peut être adapté à d’autres espèces bactériennes et d’autres substrats, dans la mesure où les paramètres de croissance et le métabolisme des espèces sont connus. En association avec d’autres techniques expérimentales, comme l’analyse transcriptomique, ce modèle mathématique devient un outil de choix pour la compréhension des interactions entre espèces bactériennes. Il peut alors être envisagé de manipuler expérimentalement ou mathématiquement les conditions environnementales pour comprendre les variations d’équilibre entre les différentes espèces au sein d’un biofilm et imaginer des stratégies pour contrecarrer la dysbiose, à l’origine des maladies inflammatoires chroniques. Ce modèle peut être aussi transposé en recherche appliquée, pour tester de nouveaux traitements anti-biofilm. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Lamont J, Hajishengallis G. Polymicrobial synergy and dysbiosis in inflammatory disease . Trends Mol Med. 2015; ; 21 : :172.–183. 2.
Meuric V, Le Gall-David S, Boyer E, et al. Signature of microbial dysbiosis in periodontitis . Appl Environ Microbiol. 2017; ; 83 : :e00462.–e00417. 3.
Cogan NG, Gunn JS, Wozniak DJ. Biofilms and infectious diseases: biology to mathematics and back again . FEMS Microbiol Lett. 2011; ; 322 : :1.–7. 4.
Meuric V, Martin B, Guyodo H, et al. Treponema denticola improves adhesive capacities of Porphyromonas gingivalis . Mol Oral Microbiol. 2013; ; 28 : :40.–53. 5.
Martin B, Tamanai-Shacoori Z, Bronsard J, et al. A new mathematical model of bacterial interactions in two-species oral biofilms . PLoS One. 2017; ; 12 : :e0173153.. 6.
Kreft JU, Picioreanu C, Wimpenny JW, et al. Individual-based modelling of biofilms . Microbiology. 2001; ; 147 : :2897.–2912. 7.
Fagerlind MG, Webb JS, Barraud N, et al. Dynamic modelling of cell death during biofilm development . J Theor Biol. 2012; ; 295 : :23.–36. 8.
Slots J, Gibbons RJ. Attachment of Bacteroides melaninogenicus subsp. asaccharolyticus to oral surfaces and its possible role in colonization of the mouth and of periodontal pockets . Infect Immun. 1978; ; 19 : :254.–264. 9.
Shah HN, Gharbia SE. Studies on the physiology and ecology of black-pigmented gram-negative anaerobes which may be important in disease development . FEMS Immunol Med Microbiol. 1993; ; 6 : :165.–172. 10.
Marsh PD, McDermid AS, Keevil CW, et al. Environmental regulation of carbohydrate metabolism by Streptococcus sanguis NCTC 7865 grown in a chemostat . J Gen Microbiol. 1985; ; 131 : :2505.–2514. 11.
Barnard JP, Stinson MW. Influence of environmental conditions on hydrogen peroxide formation by Streptococcus gordonii . Infect Immun. 1999; ; 67 : :6558.–6564. 12.
Leclerc J, Rosenfeld E, Trainini M, et al. The cytochrome bd oxidase of Porphyromonas gingivalis contributes to oxidative stress resistance and dioxygen tolerance . PLoS One. 2015; ; 10 : :e0143808.. |