| |
| Med Sci (Paris). 33(12): 1023–1025. doi: 10.1051/medsci/20173312002.Régulation des invadopodes : un nouveau rôle dans l’invasion cellulaire pour p27 Pauline Jeannot1 and Arnaud Besson1a 1Centre de recherches en cancérologie de Toulouse (CRCT), Inserm UMR1037, université Toulouse III Paul Sabatier, CNRS ERL5294, 31000Toulouse, France MeSH keywords: |
p27, une protéine aux multiples facettes L’invasion cellulaire correspond au déplacement d’une cellule dans un milieu tridimensionnel souvent constitué de matrice extracellulaire (MEC). L’invasion est nécessaire à de nombreux processus physiologiques comme la gastrulation, durant l’embryogenèse, la réponse immunitaire, ou la cicatrisation des blessures. L’invasion cellulaire est également utilisée par les cellules tumorales pour envahir localement le tissu environnant, ou à distance, pour former des tumeurs secondaires appelées métastases. Le processus d’invasion se réalise ainsi : les cellules se lient à la MEC, la dégradent, et se déplacent ensuite dans l’espace ainsi nouvellement libéré. La protéine p27 a d’abord été décrite comme un inhibiteur du cycle cellulaire : elle lie et inhibe différents complexes cycline/CDK (cyclin-dependent kinase), réprimant ainsi l’avancée dans les différentes étapes du cycle cellulaire [1]. Il a toutefois été montré, à différentes reprises, que p27 était également impliquée dans le contrôle d’autres fonctions cellulaires. Elle régule, par exemple, l’apoptose, la cytocinèse (la dernière étape de la mitose, permettant la séparation des deux cellules filles), la différenciation cellulaire, ou encore la transcription [1–4] (→).
(→) Voir la Nouvelle de B. Leclercq et A. Besson, m/s n° 6-7, juin-juillet 2012, page 570
Parmi ces fonctions, certaines dépendent de l’interaction de la protéine avec les CDK, et donc de l’inhibition de leur fonction kinase. D’autres reposent sur des mécanismes moléculaires différents, indépendamment des CDK. Un modèle de souris knock-in a été généré dans lequel le gène de p27 a été muté de manière à ce que la protéine ne puisse plus lier, ni inhiber les complexes cyclines/CDK. Ces souris, ainsi que les cellules qui en sont dérivées, présentent, vis-à-vis de certaines fonctions, un phénotype différent de celui de souris knock-out (n’exprimant plus p27), démontrant ainsi que p27 peut avoir une action indépendante des cyclines et des CDK [5]. L’une de ces fonctions est la régulation de la migration cellulaire. La protéine p27 peut en effet inhiber l’activation de la GTPase RhoA, et ainsi moduler la formation des adhérences focales et des fibres de stress d’actine-F, des structures importantes pour la migration cellulaire [6]. Ces différentes fonctions de p27 contribuent à des effets de la protéine qui se révèlent être parfois opposés au cours de l’oncogenèse. La protéine p27 agit en effet comme un suppresseur de tumeur, lorsqu’elle est localisée dans le noyau des cellules, en inhibant le cycle cellulaire et la transcription de gènes impliqués dans l’oncogenèse [2]. Lorsqu’elle est localisée dans le cytoplasme, p27 présente, à l’inverse, des fonctions oncogéniques, notamment en régulant la migration cellulaire [1, 5, 6]. |
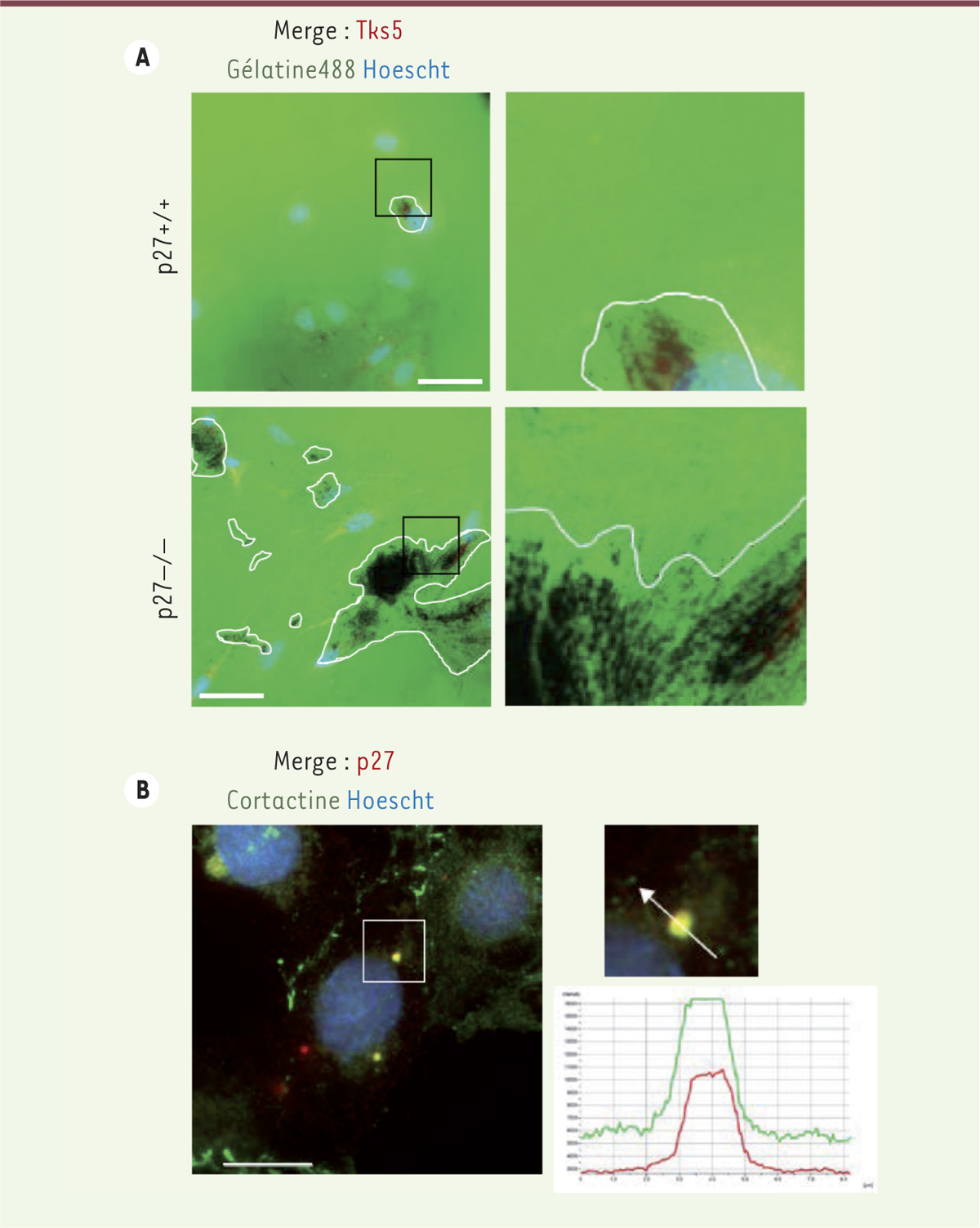
p27 et la régulation des invadopodes Notre laboratoire a découvert que la protéine p27 interagissait avec la cortactine, une protéine adaptatrice régulatrice du cytosquelette d’actine. La cortactine a différentes fonctions, dont un rôle majeur dans la régulation des invadopodes [6]. Les invadopodes sont des structures de la membrane cellulaire qui se forment en réponse à différents stimulus : de l’actine branchée est générée localement et provoque la formation de cette protrusion cellulaire. Ces structures permettent, à maturation, la sécrétion de différentes protéases à l’origine de la dégradation de la MEC environnante. Elles sont donc naturellement impliquées dans l’invasion cellulaire. Les invadopodes ont un temps de vie assez court (généralement de quelques dizaines de minutes). On peut donc observer une succession de cycles de formation, de maturation (dégradation de la MEC) et de désassemblage de ces structures [8]. Afin d’étudier le rôle de p27 dans la formation des invadopodes, nous avons cultivé, sur de la gélatine fluorescente, des fibroblastes d’embryons de souris (MEF pour mouse embryonic fibroblast) invalidés ou non pour le gène codant la protéine p27. La dégradation de la gélatine, reflet de la capacité de dégradation de la MEC par les cellules, laisse apparaître des zones non-fluorescentes (noires) sur le support. Un marquage de l’adaptateur Tks51 a été réalisé simultanément afin de visualiser les invadopodes (Figure 1A) [9]. L’absence de p27 conduit à une hausse importante du nombre d’invadopodes par cellule et à une dégradation de la gélatine accrue, un résultat plutôt surprenant, la p27 ayant été décrite comme un facteur favorisant l’invasion cellulaire. Des expériences similaires avec des cellules MEF exprimant p27CK- (dans lesquelles la p27 est incapable de lier et d’inhiber les complexes cyclines/CDK) présentent en revanche le même phénotype que les cellules sauvages, démontrant ainsi que la régulation des invadopodes par p27 est indépendante de ces complexes. Pour tenter d’expliquer ces données (accroissement du nombre d’invadopodes et augmentation de la dégradation de la MEC, en l’absence de p27), nous avons recherché s’il existait une interaction entre la p27 et la cortactine. En utilisant différentes approches, nous avons montré qu’après stimulation par du sérum (qui s’accompagne d’une relocalisation d’une partie de la p27 dans le cytoplasme), la protéine p27 se liait à la cortactine et que les deux protéines se localisaient au même niveau des invadopodes (Figure 1B). Pourtant, malgré leur capacité exacerbée à dégrader la MEC, les MEF qui n’expriment pas la p27 (MEF p27
-/-) présentent un défaut d’invasion cellulaire. Les invadopodes produits par ces cellules ont en fait une durée de vie très supérieure à celle des invadopodes des cellules sauvages. Ceci explique leur accumulation dans ces cellules et l’augmentation de la capacité de dégradation de la MEC que l’on observe.
 | Figure 1.
La protéine p27 est localisée au niveau des invadopodes. A. Des cellules MEF p27
+/+ ou p27
-/- (exprimant ou non p27) sont ensemencées sur de la gélatine fluorescente (en vert) pour observer la dégradation de la matrice (zones entourées en blanc) et un marquage par immunofluorescence de Tks5, un marqueur des invadopodes, est réalisé (en rouge). B. Immunofluorescence avec un double marquage p27/cortactine (en rouge et vert, respectivement) mettant en évidence la co-localisation de ces deux protéines au niveau de l’invadopode (figure adaptée de [ 9]). |
Le défaut d’invasion des cellules MEF p27
-/- repose donc sur le défaut de renouvellement des invadopodes (un renouvellement observé dans les cellules contrôles), ce qui rend le processus d’invasion inefficace. La p27 régule en fait la durée de vie des invadopodes en influant sur la voie Rac1/PAK1/cortactine (Ras-related C3 butulinum toxin sunstrate1/p21-activated kinase), une voie identifiée par Moshfegh et al. [10]. En effet, p27 permet l’interaction de PAK1 avec la cortactine et, par conséquent, la phosphorylation sur plusieurs sérines de celle-ci, ce qui favorise le désassemblage des invadopodes. Un mutant de la cortactine, présentant des résidus phosphomimétiques aux positions des sérines 113, 150 et 282, annule totalement le phénotype d’hyper-stabilité des invadopodes des cellules MEF p27-/-
. Comment la phosphorylation de la cortactine sur des sérines localisées dans son domaine d’interaction avec l’actine-F induit le désassemblage des invadopodes reste pour le moment inconnu : cette phosphorylation pourrait diminuer l’affinité de la cortactine pour l’actine-F, et provoquer la déstabilisation du réseau d’actine branchée et le désassemblage des invadopodes [9]. |
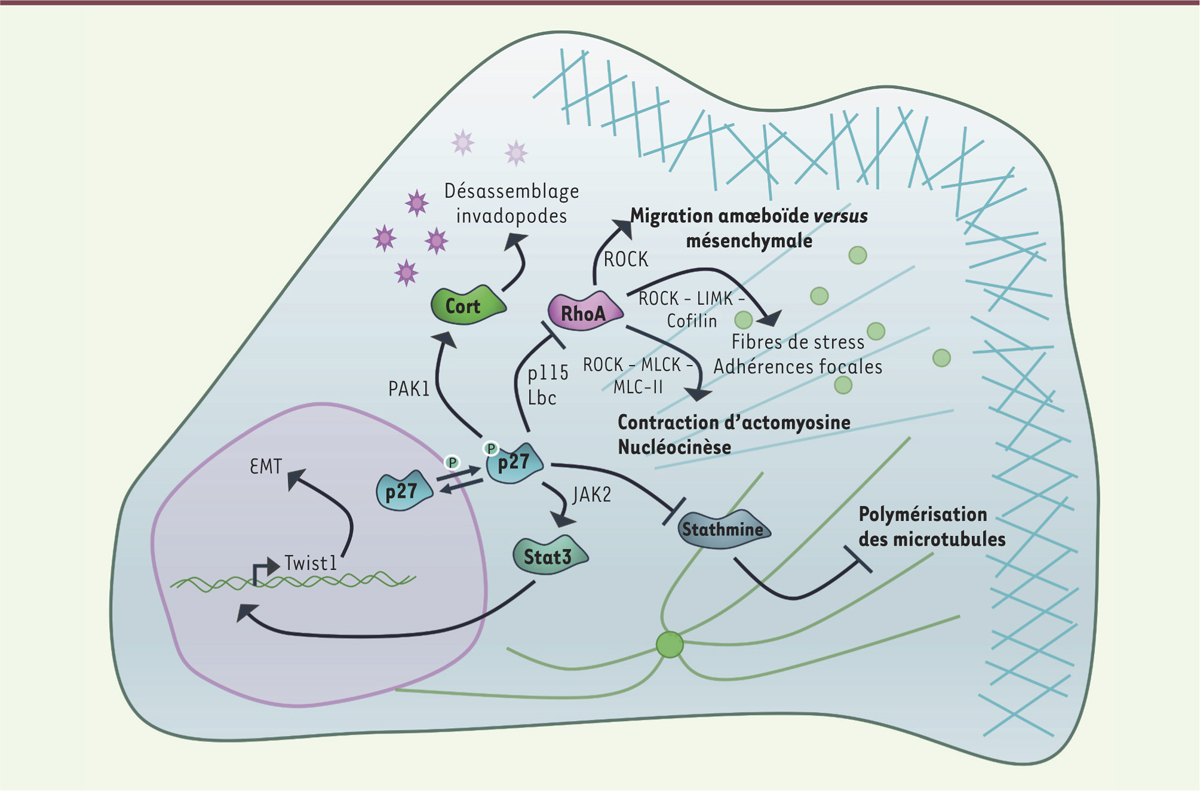
p27, un coordinateur cellulaire ? La protéine p27 contrôle la migration cellulaire selon différents mécanismes (Figure 2). Par la voie STAT3 (signal transducer and activator of transcription 3), elle régule la transition épithélio-mésenchymateuse (EMT) qui permet aux cellules épithéliales d’adopter un phénotype propice à la migration. Mais elle participe également à la régulation de la polymérisation des microtubules et de la migration cellulaire, via la stathmine, une protéine provoquant la déstabilisation des microtubules [3]. Nos travaux sont les premiers qui montrent une fonction directe de la p27 dans l’invasion et la dégradation de la MEC. L’ensemble de ces données suggère donc que la p27 pourrait synchroniser différents aspects de la migration et de l’invasion cellulaires afin de les rendre plus efficaces.
 | Figure 2.
Régulation de la migration et l’invasion cellulaires par p27. La protéine p27 contrôle la migration par l’inhibition de la GTPase RhoA, lui permettant de moduler le remodelage de l’actine et des adhérences focales ; par l’inhibition de la stathmine, promouvant ainsi la polymérisation des microtubules ; par l’activation de Stat3 (signal transducer and activator of transcription 3) permettant l’activation de la transition épithélio-mésenchymateuse (EMT) ; et enfin, par le contrôle de cortactine (Cort) et des invadopodes. JAK2 : Janus kinase 2; p115 Lbc ou p115-RhoGEF : GDP exchange factor ; LIMK : kinase activée par ROCK qui présente des domaines riches en cystéine contenant deux doigts de zinc appelés domaines LIM ; MLCK : myosin light chain kinase ; MLCII : myosin light chain II ; PAK1 : p21-activated kinase ; ROCK : Rho-associated protein kinase ; Twist : class A basic helix-loop-helix protein 38.
|
Plus généralement, il semble que la p27 puisse agir comme un coordinateur entre cycle cellulaire et autres fonctions, comme la migration et l’invasion, la différenciation ou encore la transcription. Cette hypothèse est appuyée par les fonctions pléiotropiques de la p27, mais elle reste néanmoins à confirmer. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Besson A, Dowdy SF, Roberts JM. CDK inhibitors: cell cycle regulators and beyond . Dev Cell. 2008; ; 14 : :159.. 2.
Jeannot P, Callot C, Baer R, et al. Loss of p27Kip1 promotes metaplasia in the pancreas via the regulation of Sox9 expression . Oncotarget. 2015; ; 34 : :358880.–358892. 3.
Sharma SS, Pledger WJ. The non-canonical functions of p27(Kip1) in normal and tumor biology . Cell Cycle. 2016; ; 15 : :1189.–1201. 4.
Leclercq B, Besson A. Un nouveau rôle de p27KIP1 dans la mitose ? . Med Sci (Paris). 2012; ; 28 : :570.–572. 5.
Besson A, Hwang HC, Cicero S, et al. Discovery of an oncogenic activity in p27Kip1 that causes stem cell expansion and a multiple tumor phenotype . Genes Dev. 2007; ; 21 : :1731.–1746. 6.
Besson A, Gurian-West M, Schmidt A, et al. p27Kip1 modulates cell migration through the regulation of RhoA activation . Genes Dev. 2004; ; 18 : :862.–876. 7.
Macgrath SM, Koleske AJ. Cortactin in cell migration and cancer at a glance . J Cell Sci. 2012; ; 125 : :1621.–1626. 8.
Beaty BT, Condeelis J. Digging a little deeper: the stages of invadopodium formation and maturation . Eur J Cell Biol. 2014; ; 93 : :438.–444. 9.
Jeannot P, Nowosad A, Perchey RT, et al. p27Kip1 promotes invadopodia turnover and invasion through the regulation of the PAK1/Cortactin pathway . eLife. 2017;; 6 : :e22207.. 10.
Moshfegh Y, Bravo-Cordero JJ, Miskolci V, et al. A Trio-Rac1-Pak1 signalling axis drives invadopodia disassembly . Nat Cell Biol. 2014; ; 16 : :574.–586. |