| |
| Med Sci (Paris). 33(11): 947–949. doi: 10.1051/medsci/20173311010.La galectine-9 favorise la persistance du virus de l’hépatite C dans le foie Amina Zahaf,1a Aurore Badia,1c Jessica Morel,1b and Olivier Dellis2d 1M1 Biologie-Santé, Université Paris-Saclay, 91405Orsay, France 2Inserm UMR-S 1174, équipe signalisation calcique, bâtiment 443, rue des Adèles, 91405Orsay, France |

Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Olivier Guittet (maître de conférences, université Paris-Sud)
Boris Julien (maître de conférences, université Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
Philippe Robin (maître de conférences, université Paris-Sud)
karim.benihoud@u-psud.fr Série coordonnée par Laure Coulombel. L’infection par le virus de l’hépatite C (VHC) touche 180 millions de personnes dans le monde, et cause 700 000 décès par an. Elle entraîne des hépatites chroniques ou aiguës. La forme aiguë est la plupart du temps asymptomatique, alors que la forme chronique s’accompagne de symptômes dus à de graves lésions du foie. Ces lésions augmentent les risques de cancer et de fibrose du foie. Il est donc primordial de pouvoir les traiter pour retarder ou éviter l’apparition d’un cancer. Ces lésions hépatiques sont causées par les cellules natural killer (NK), composantes du système immunitaire inné, première ligne de défense de l’organisme. Les cellules NK ont la capacité de tuer des cellules infectées. Elles le font en libérant des granules contenant les enzymes granzyme (sérine protéase) et perforine (molécule de perméabilisation membranaire) lorsqu’elles détectent l’absence de molécules du complexe majeur d’histocompatibilité de classe I (CMHI) sur une cellule. Granzyme et perforine forment alors des pores dans la membrane de la cellule cible, ce qui provoque sa mort. L’activation des cellules NK par le VHC augmente leur cytotoxicité, provoquant ainsi des lésions hépatiques menant à une infection virale chronique. Si le rôle prépondérant de ces cellules dans la pathogenèse de l’hépatite C chronique est reconnu, en revanche le mécanisme précis de leur activation par le virus n’a pas encore été entièrement élucidé. S’appuyant sur des données antérieures de Mengshol et al. [1], qui avaient montré un taux sérique de galectine-9 (Gal-9) supérieur à la normale chez les patients atteints d’hépatite C chronique, Nishio et al. se sont intéressés au rôle de Gal-9 dans l’activation des cellules NK chez les patients atteints d’hépatite C chronique [2].
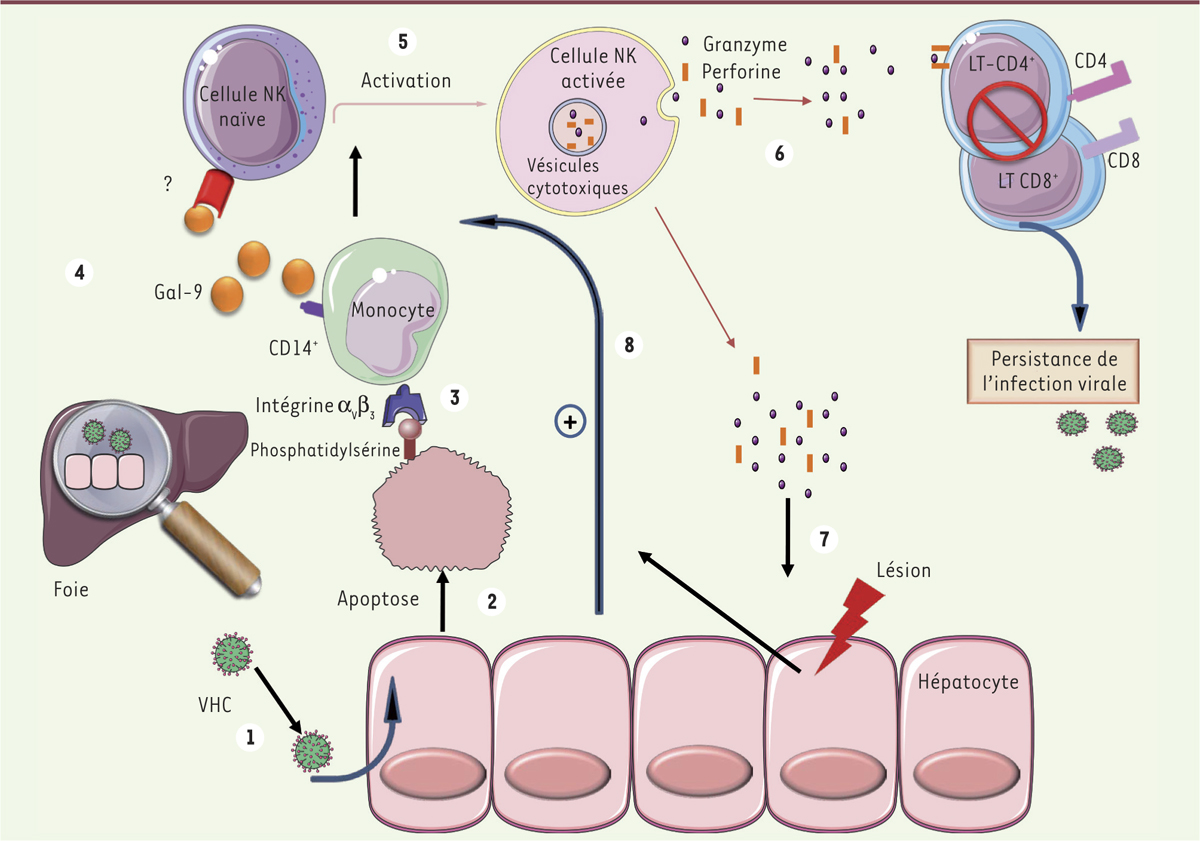
 | Figure 1.
Rôle central de la galectine-9 dans la persistance du virus de l’hépatite C (VHC). Le VHC infecte l'hépatocyte (1) et induit sa mort par apoptose (2). La cellule expose donc ses molécules de phosphatidylsérine sur la face externe de sa membrane. Ces molécules sont ensuite reconnues par les intégrines αVβ3 exprimées par les cellules de Kupffer qui sont des macrophages CD14+ résidents du foie (3). Ces cellules libèrent alors la galectine-9 (4) qui active les cellules NK naïves via un récepteur qui reste à ce jour inconnu (5). Les cellules NK lysent, d'une part, les LT CD4+ et CD8+, contribuant ainsi à la persistance de l'infection virale (6), et, d'autre part, les hépatocytes (7), amplifiant ainsi l'apoptose, l'activation des cellules de Kupffer et la production de galectine-9 (8). |
|
Gal-9 active les cellules NK naïves et leur cytotoxicité Dans une série d’expériences dans lesquelles cellules NK et cellules K562 (une lignée tumorale de cellules érythroleucémiques sensibles à l’action cytotoxique des cellules NK) ont été cocultivées en présence, ou non, de Gal-9, les auteurs constatent que la présence de Gal-9 augmente l’expression du marqueur CD107a (cluster of differentiation 107a) à la surface des cellules NK, et leur production d’IFN (interféron)-γ. Or, la glycoprotéine transmembranaire CD107a, contenue à l’intérieur de granules lytiques dans les cellules au repos, est transloquée à la surface membranaire des cellules NK après le processus de dégranulation [3]. Son expression à la membrane est donc un marqueur de l’activité cytotoxique des cellules NK qui correspond à l’exocytose de granules lytiques présents dans le cytoplasme et qui contiennent la perforine, les granzymes et la granulysine (molécule lytique antimicrobienne). L’addition d’un anticorps neutralisant deux récepteurs connus de Gal-9, Tim-3 et 4-1BB (CD137), n’empêche ni l’expression de CD107a à la membrane, ni la production d’IFN-γ par les cellules NK activées par Gal-9 ; elle ne diminue pas non plus leur cytotoxicité vis-à-vis des cellules K562, excluant un lien entre l’activation des cellules NK et l’interaction Gal-9-Tim-3 ou Gal-9-4-1BB. Ces résultats confirment l’indépendance de la signalisation de Gal-9 de Tim-3, déjà montrée par d’autres [4, 5], et suggèrent que l’activation des NK met en jeu d’autres récepteurs. Toutefois, dans un autre modèle, utilisant non pas des cellules NK naïves, mais des cellules NK stimulées par l’interleukine(IL)-12 ou l’IL-15 [4], Golden-Mason montre au contraire que Gal-9 diminue la cytotoxicité des NK. Une explication possible de cette différence pourrait être liée à la différence des contextes cellulaires dans lesquels ces expériences ont été réalisées. De plus, Nishio et al. ont montré que les cellules NK activées par Gal-9 étaient capables de lyser les lymphocytes T CD4+ et CD8+ [2]. Or, des publications récentes ont montré que les cellules NK activées régulent les activités des lymphocytes T, et que cette régulation contribue à la persistance de l’infection virale [6, 7]. |
Les monocytes CD14 + sont impliqués dans la production de Gal-9 Par des expériences effectuées in vitro, les auteurs ont cherché à déterminer lesquelles, parmi les cellules mononucléées du sang périphérique, activaient la cytotoxicité des cellules NK via la production de Gal-9. Pour cela, les cellules mononucléées du sang ont été fractionnées en différents sous-types, mises en culture avec les cellules JFH/Huh-71, et la synthèse de Gal-9 mesurée. L’absence de lymphocytes B CD19+, de lymphocytes T CD3
+
ou de cellules NK CD56+ ne modifie pas la sécrétion de Gal-9 dans le milieu de culture. En revanche, l’absence des monocytes CD14+ la diminue significativement, désignant ces cellules comme responsables de la production de Gal-9. Pour confirmer cette hypothèse, les auteurs ont réduit dans des monocytes primaires l’expression de Gal-9 par des ARN interférents (siARN). Ces monocytes ont ensuite été remis en contact avec les autres cellules mononucléées du sang périphérique et cultivés avec les cellules hépatiques JFH/Huh-7. L’inhibition de l’expression de Gal-9 dans les monocytes CD14+ entraîne une diminution significative de l’expression de CD107a par les cellules NK, et donc de la cytotoxicité exercée par ces dernières. L’activation des cellules NK est donc bien dépendante de Gal-9 produite par les monocytes, production elle-même induite par des hépatocytes infectés par le VHC. |
Le contact entre monocytes et hépatocytes apoptotiques induit la production de Gal-9 L’infection des hépatocytes par le VHC se fait via des récepteurs tels que la lipoprotéine LDL (low-density lipoprotein), la claudine-1 ou l’occludine. La mort cellulaire par apoptose qui en résulte est à l’origine de pathologies hépatiques telles que la cirrhose et le carcinome hépatocellulaire. Lorsqu’une cellule est en apoptose, elle exprime la phosphatidylsérine sur sa membrane cellulaire externe, qui est utilisée comme un ligand par les cellules phagocytaires (monocytes/macrophages) via par exemple l’intégrine αvβ3 [8–10]. En cocultivant les cellules JFH/Huh-7 et les cellules mononucléées du sang périphérique en présence d’un anticorps anti-intégrine αvβ3, les chercheurs ont réduit la synthèse de Gal-9, ce qui démontre que cette synthèse dépend de l’interaction entre les monocytes et les hépatocytes apoptotiques. De plus, l’augmentation du taux de Gal-9 sérique se reflète indirectement dans l’augmentation des taux plasmatiques d’une enzyme, l’alanine aminotransférase (ALT), caractéristique d’une cytolyse hépatique. De fait, chez les personnes infectées par le VHC, les taux de Gal-9 sont beaucoup plus élevés chez celles qui ont un taux élevé d’ALT, ce qui suggère que Gal-9 est impliquée dans les lésions du foie. |
Les auteurs ont montré que, en réponse à une infection par le virus de l’hépatite C, Gal-9 est produite par des monocytes CD14+, qui, dans le foie, sont représentés par les cellules de Kupffer. Gal-9 peut alors activer les cellules NK qui lysent les cellules T CD4+ et CD8+, permettant la persistance de l’infection par le VHC. Malgré les nouveaux traitements antiviraux qui agissent directement contre le VHC, comme le Sovaldi, et permettent l’élimination du virus chez 95 % des patients [11] (→), de nouvelles stratégies thérapeutiques qui cibleraient Gal-9 permettraient de traiter les patients qui ne répondent pas à ces molécules et d’empêcher l’évolution de la pathologie vers une cirrhose et/ou un hépatocarcinome. Gal-9 pourrait aussi jouer un rôle dans d’autres pathologies hépatiques. Dans des résultats non publiés, les auteurs de cet article ont en effet montré que Gal-9 est colocalisée avec des cellules CD14+ dans le foie de patients infectés chroniquement par le virus de l’hépatite B, ou atteints de stéato-hépatite non alcoolique. (→) Voir la Synthèse de S. Pol, m/s n° 11, novembre 2013, page 998
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Mengshol JA, Golden-Mason L, Arikawa T, et al. A crucial role for Kupffer cell-derived galectin-9 in regulation of T cell immunity in hepatitis C infection . PLoS One. 2010; ; 5 : :e9504.. 2.
Nishio A, Tatsumi T, Nawa T, et al. CD14+ monocyte-derived galectin-9 induces natural killer cell cytotoxicity in chronic hepatitis C . Hepatology. 2017; ; 65 : :18.–31. 3.
Alter G, Malenfant JM, Altfeld M CD107a as a functional marker for the identification of natural killer cell activity . J Immunol Methods. 2004; ; 294 : :15.–22. 4.
Golden-Mason L, McMahan RH, Strong M, et al. Galectin-9 functionally impairs natural killer cells in humans and mice . J Virol. 2013; ; 87 : :4835.–4845. 5.
Su EW, Bi S, Kane LP Galectin-9 regulates T helper cell function independently of Tim-3 . Glycobiology. 2011; ; 21 : :1258.–1265. 6.
Waggoner SN, Taniguchi RT, Mathew PA, et al. Absence of mouse 2B4 promotes NK cell-mediated killingof activated CD81 T cells, leading to prolonged viral persistenceand altered pathogenesis . J Clin Invest. 2010; ; 120 : :1925.–1938. 7.
Lang PA, Lang KS, Xu HC, et al. Natural killer cell activation enhances immune pathology and promotes chronic infection by limiting CD8 T-cell immunity . Proc Natl Acad Sci USA. 2012; ; 109 : :1210.–1215. 8.
Elmore S. Apoptosis: a review of programmed cell death . Toxicol Pathol. 2007; ; 35 : :495.–516. 9.
Kofahi HM, Taylor NG, Hirasawa K, et al. Hepatitis C virus infection of cultured human hepatoma cells causes apoptosis and pyroptosis in both infected and bystander cells . Sci Rep. 2016; ; 6 : :37433.. 10.
Lim EJ, El Khobar K, Chin R, et al. Hepatitis C virus-induced hepatocyte cell death and protection by inhibition of apoptosis . J Gen Virol. 2014; ; 95 : :2204.–2215. 11.
Pol S. Virus de l’hépatite C : 25 ans, la fin de l’histoire ? Med Sci (Paris). 2013; ; 29 : :998.–1003. |