| |
| Med Sci (Paris). 33(10): 852–856. doi: 10.1051/medsci/20173310013.Le vaccin ARN, une approche prometteuse pour la réactivation du système immunitaire dans la lutte contre le cancer Mathieu Richaud1* and Nathalie Bendriss-Vermare2** 1Master de cancérologie, module d’immunologie - virologie, université de Lyon, université Claude Bernard Lyon 1, Lyon, France 2Université de Lyon, Université Claude Bernard Lyon 1, Inserm U1052, CNRS 5286, centre Léon Bérard, centre de recherche en cancérologie de Lyon, Lyon, 69008, France |

Master cancer, ISPB Lyon
Responsable du module
Julien Marie (julien.marie@inserm.fr)
Département immunologie, virologie et inflammation, centre de recherche en cancérologie de Lyon, bâtiment Cheney A, 5e étage, 69373 Lyon Cedex 08, France. Le cancer est devenu récemment la première cause de mortalité en France. Depuis peu, de nouvelles stratégies d’immunothérapie ont fait leur apparition dans la lutte contre le cancer. La nouveauté de ces approches est qu’elles ne ciblent plus la cellule cancéreuse, mais stimulent les défenses de l’organisme exercées par le système immunitaire vis-à-vis des cellules tumorales. Cependant, dans un grand nombre de cancers, le système immunitaire est dérégulé par la tumeur afin qu’il ne puisse plus protéger l’organisme du développement tumoral (
Figure 1
). L’immunothérapie vise à contrer cet endormissement ou cette perversion du système immunitaire et réveiller les défenses naturelles de l’hôte pour l’aider à se défendre contre sa tumeur. L’objectif principal est d’induire une réponse immunitaire, spécifique et durable, vis-à-vis des cellules tumorales. Ceci peut être réalisé grâce à des approches de vaccination antitumorale basée sur des marqueurs tumoraux qui constituent les antigènes (Ag) cibles. Récemment, des résultats très prometteurs ont été obtenus en utilisant un vaccin à ARN, qui présenterait l’avantage d’être universel, donc applicable à tous les cancers.
 | Figure 1.
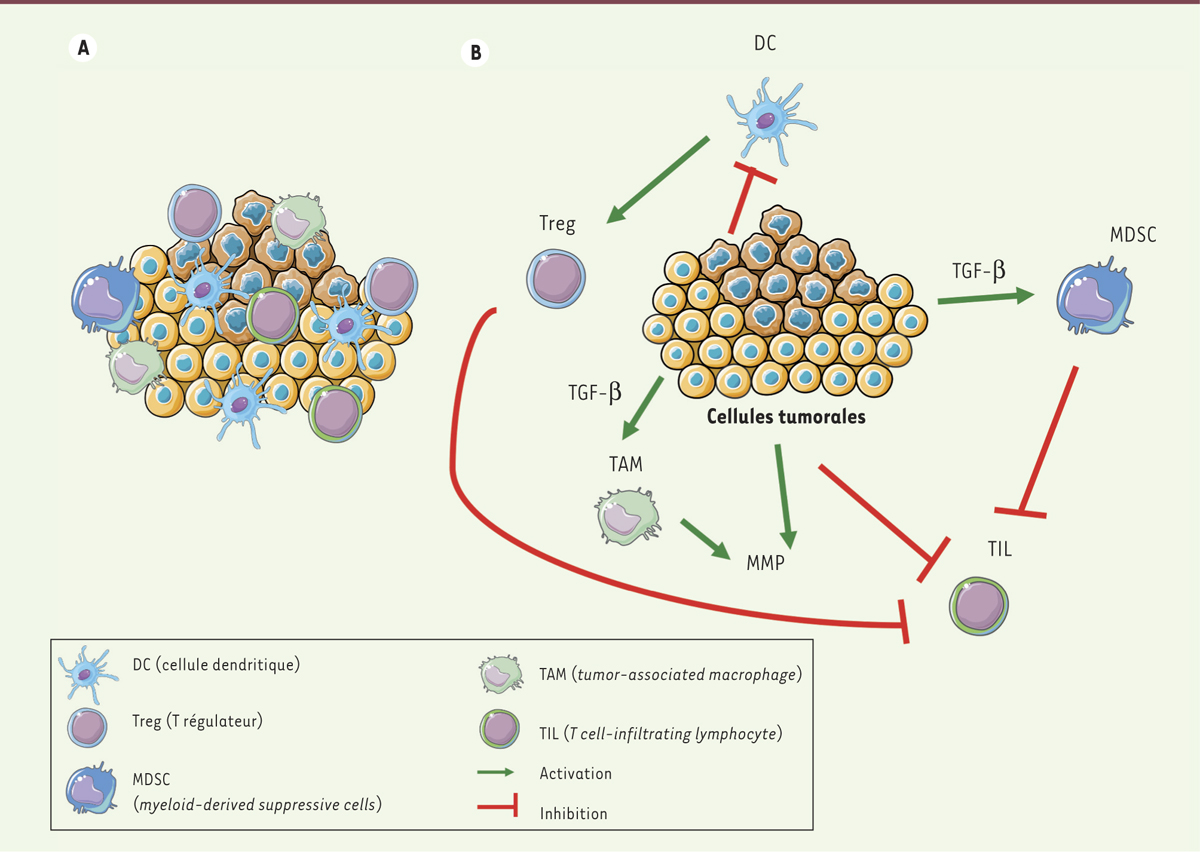
Microenvironnement immunitaire tumoral et cibles potentielles intervenant dans la réponse immune antitumorale. A. Infiltration de la tumeur par les cellules immunitaires. B. Interactions entre les cellules tumorales et le microenvironnement immunitaire. La tumeur module le système immunitaire en inhibant certaines cellules comme les cellules dendritiques ou en en activant d’autres comme les Treg, les TAM ou les MDSC. Ainsi, la tumeur échappe au contrôle du système immunitaire et continue à proliférer. Aujourd’hui, de nombreux chercheurs veulent combattre cet échappement tumoral en modulant les acteurs du système immunitaire avec notamment l’activation des DC ou la suppression des Treg, afin qu’ils réagissent contre les cellules tumorales. DC : dendritic cells ; TAM : tumor-associated macrophages ; MDSC : myeloid-derived suppressive cells ; Treg : lymphocytes T régulateurs ; TIL : tumor-infiltrated lymphocytes. MMP : matrix metalloproteases.
|
|
Réveiller le système immunitaire pour lutter contre le cancer en ciblant les acteurs de l’échappement tumoral Des dérégulations majeures concernent les lymphocytes T (LT) qui sont des acteurs essentiels de la réponse immunitaire. Ainsi, on observe, d’une part, un défaut d’activation des LT par les cellules dendritiques (DC) dans les ganglions, cellules dendritiques qui sont elles-mêmes inhibées par le contexte tumoral [1] ; d’autre part, une « paralysie » des LT activés ayant infiltré les tumeurs (ou tumor-infiltrating lymphocyte - TIL), ce qui les empêche d’éliminer les cellules tumorales [1] (
Figure 1
). Les points de contrôles immunitaires sont des récepteurs de régulation négative présents à la surface des LT, tels que CTLA-4 (cytotoxic T-lymphocyte–associated antigen 4) et PD-1 (programmed death 1), dont l’engagement par leurs ligands exprimés par les cellules tumorales ou des cellules immunosuppressives du microenvironnement1 bloque la fonction des LT [2]. Il est donc apparu logique de tenter de lutter contre le cancer en réactivant le système immunitaire, et les LT en particulier, d’une part, en bloquant l’interaction des points de contrôles immunitaires avec leurs ligands, et, d’autre part, en optimisant l’activation des LT par les cellules dendritiques. La première approche repose sur l’utilisation d’anticorps (Ac) bloquants anti-CTLA-4, anti-PD-1 et anti-PD-L1 (ligand de PD-1), qui permettent aux LT de retrouver leur fonctionnalité et ainsi leur capacité à éliminer les cellules tumorales [2], ou sur la suppression des LT régulateurs immunosuppresseurs [1]. La seconde approche repose sur des stratégies visant à stimuler les propriétés des cellules dendritiques. |
Les cellules dendritiques, chef d’orchestre de la réponse immunitaire Les cellules dendritiques focalisent l’attention car elles ont un rôle crucial d’intermédiaire entre la détection de la tumeur et la mise en place de l’immunité dirigée spécifiquement contre celle-ci. En effet, lors de leur mort, les cellules tumorales libèrent des molécules - ou antigènes (Ag) tumoraux - dans l’environnement. Ces Ag tumoraux sont détectés et captés par les cellules dendritiques présentes dans le tissu tumoral, déclenchant leur activation et leur migration vers le ganglion lymphatique le plus proche. L’Ag tumoral capturé est alors fragmenté en peptides qui sont apprêtés dans les molécules du complexe majeur d’histocompatibilité de classes I et II (CMHI et CMHII), puis exportés à la surface des cellules dendritiques pour être présentés aux LT. La présentation croisée est le processus qui permet de présenter des peptides exogènes sur le CMHI aux LT CD8+ (LT8), alors que les voies conventionnelles de présentation antigénique consistent en une présentation des peptides endogènes sur le CMHI aux LT8 et des peptides exogènes sur le CMHII aux LT CD4+ (LT4). La présentation croisée est donc cruciale dans le contexte de la réponse immunitaire antitumorale car elle permet l’activation de LT8 « tueurs » spécifiques des cellules tumorales exprimant l’Ag tumoral capté. Au cours de leur migration vers le ganglion lymphatique, les cellules dendritiques acquièrent les propriétés nécessaires à l’activation des LT ; elles exercent alors leur rôle de cellules présentatrices d’antigènes dans le ganglion. Un dialogue élaboré s’installe entre la cellule dendritique et le LT naïf à travers une synapse immunologique, conduisant à l’activation optimale de ce dernier et à sa différenciation en un LT effecteur. Les LT8 et LT4 effecteurs vont à leur tour migrer vers le tissu tumoral pour y éliminer la cible. |
La vaccination fondée sur les cellules dendritiques pour réveiller et booster la réponse immunitaire Les caractéristiques et les fonctions des cellules dendritiques permettent d’envisager leur utilisation en clinique. En effet, leurs propriétés d’induction d’une réponse immunitaire spécifique sont actuellement exploitées dans des stratégies de vaccination pour lutter contre certains cancers. Les premiers vaccins élaborés à partir de cellules dendritiques ont été produits in vitro. Pour cela, des précurseurs de cellules dendritiques sont isolés du sang du patient, transformés en cellules dendritiques matures et exposés à l’Ag tumoral d’intérêt in vitro. Ces cellules ainsi « chargées » avec l’Ag tumoral sont réinjectées au patient dans le but d’activer les LT8 spécifiques de l’Ag tumoral d’intérêt. C’est ce que l’on appelle un vaccin par cellules dendritiques [3]. La plupart des patients traités par ce type de vaccin le sont dans le contexte d’essais cliniques, car pour la majorité des cancers (à l’exception du cancer de la prostate), cette approche vaccinale est encore dans une phase expérimentale. Cependant, cette thérapie est très complexe à mettre en œuvre techniquement, également très coûteuse, et, qui plus est, elle n’aboutit pas à de bons résultats. En effet, les cellules dendritiques réinjectées ont un faible taux de survie et elles migrent difficilement vers les ganglions pour activer les LT8. Toutefois, l’espoir d’un vaccin universel contre le cancer renaît grâce aux travaux de l’équipe d’Ugur Sahin [4]. |
Le vaccin à ARN, un ciblage in situ à façon des cellules dendritiques Les chercheurs de cette équipe ont mis au point récemment [4] une nouvelle technique permettant de cibler et d’activer les cellules dendritiques directement in vivo suite à l’injection intraveineuse de nanoparticules lipidiques - appelées ARN-LPX - contenant l’ARN codant l’Ag tumoral exprimé à la surface des cellules cancéreuses. La première étape a consisté à construire le meilleur ARN-LPX, celui qui permettra une incorporation et une activation maximales par les cellules dendritiques. Le choix des auteurs s’est porté sur une formulation de l’ARN-LPX dans laquelle le ratio lipide:ARN est de 1,3:2. Cette nanoparticule cible facilement la rate et d’autres organes lymphoïdes secondaires, forme des particules stables et résiste à la dégradation par le sérum. La suite de ce travail a porté sur l’identification du type cellulaire ciblé par les nanoparticules ARN-LPX in vivo. Les auteurs ont montré que ces nanoparticules permettent de délivrer l’ARN tumoral sélectivement et efficacement aux cellules dendritiques in vivo (
Figure 2
). Celles-ci vont alors produire l’Ag tumoral codé par l’ARN et l’exprimer sur leurs molécules de CMHI de façon à activer les LT8 spécifiques. Par ailleurs, lorsqu’elles sont activées par les nanoparticules, les cellules dendritiques réagissent comme s’il s’agissait d’une attaque virale, confondant les nanoparticules extrêmement petites avec des virus. On parle de vaccination ARN in situ.
 | Figure 2.
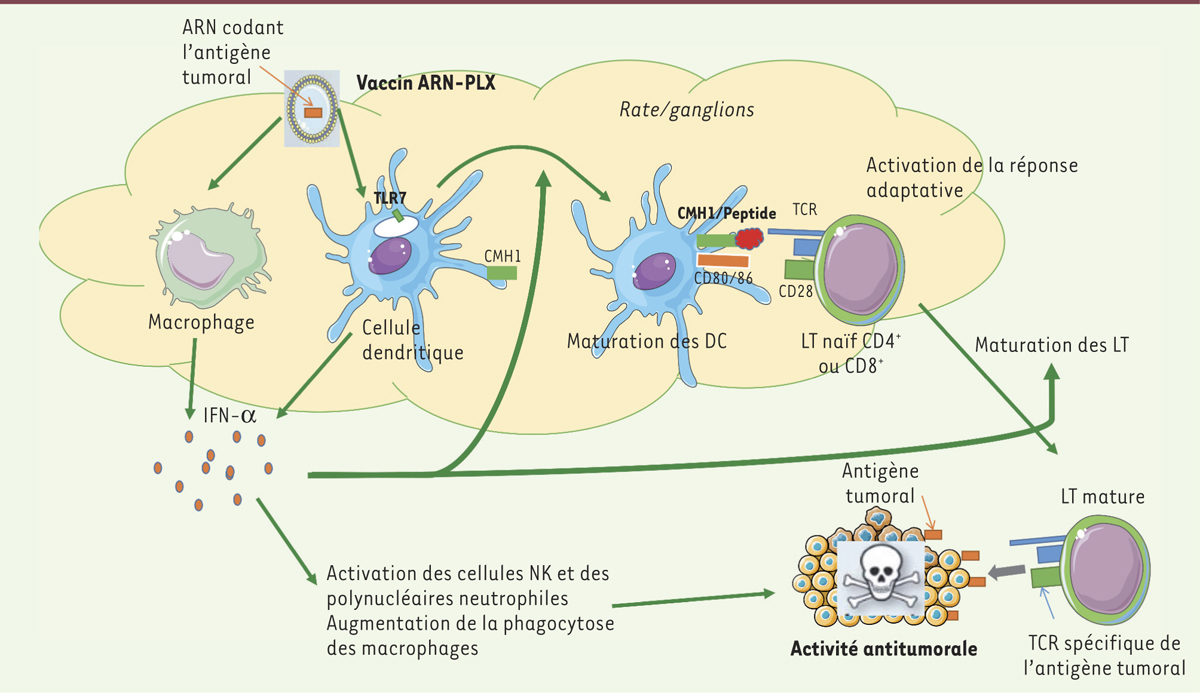
Activation de la réponse immunitaire contre les cellules tumorales en réponse à une vaccination ARN codant un antigène tumoral. La nanoparticule ARN-LPX injectée va cibler les cellules dendritiques (DC) principalement, mais aussi les macrophages au niveau de la rate et des organes lymphoïdes secondaires. S’ensuivent deux conséquences biologiques majeures : (1) la sécrétion d’IFN-α (interféron) par les cellules dendritiques et les TAM (tumor-associated macrophages) et (2) la maturation des cellules dendritiques, qui vont exprimer à leur surface le complexe CMHI/peptide correspondant à l’antigène codé par l’ARN de la nanoparticule ainsi que les molécules de costimulation CD80/86, requis pour l’activation des LT. La cellule dendritique mature active les LT naïfs, induisant leur différenciation en LT matures dirigés contre les cellules tumorales présentant l’antigène codé par l’ARN contenu dans la nanoparticule. De plus, l’IFN-α sécrété exerce également un rôle majeur dans la maturation des cellules dendritiques et des LT. DC : dendritic cells ; TAM : tumor-associated macrophages ; Treg : lymphocytes T régulateurs ; TCR : T cell receptor ; TLR7 : Toll-like receptor 7.
|
|
La nanoparticule ARN-LPX déclenche une réponse immunitaire spécifique Les auteurs ont par la suite montré que leur construction provoquait une réponse immunitaire innée et une réponse adaptative spécifique de l’Ag tumoral. En effet, la production d’interféron-α (IFN-α), protéine normalement fabriquée en réponse à une infection virale, est rapidement observée dans les macrophages et les cellules dendritiques, six heures seulement après l’injection de l’ARN-LPX. L’IFN-α a un rôle majeur dans la réponse innée via l’activation des polynucléaires neutrophiles et des cellules natural killer (NK). Par ailleurs, il est également essentiel à la mise en place de l’immunité adaptative parce qu’il facilite (1) l’interaction entre les cellules dendritiques et les LT, (2) la reconnaissance des cellules tumorales par les cellules tueuses de l’immunité, et (3) la maturation, la survie et les fonctions effectrices des lymphocytes T et B (
Figure 2
). Par ailleurs, en réponse à l’injection d’ARN-LPX, apparaissent des LT8 et LT4 activés par les cellules dendritiques. Les LT8 ont pour rôle de tuer les cellules présentant l’Ag, alors que les LT4 participent à l’activation des lymphocytes B et des LT8. L’ensemble des cellules immunitaires activées reconnaîtront spécifiquement l’Ag codé par l’ARN tumoral inséré dans la nanoparticule (
Figure 2
). Ainsi, l’action lytique des LT8 est spécifique des cellules tumorales présentant le peptide à leur surface. Ce vaccin ARN est d’autant plus remarquable qu’il exerce une action antitumorale dans des approches prophylactique aussi bien que thérapeutique. En effet, si la vaccination est réalisée avant la greffe des cellules tumorales chez la souris, la tumeur ne se développe pas. Si le vaccin est administré après la greffe des cellules tumorales, alors une diminution, voire une disparition, de la tumeur est observée chez la souris. |
De la paillasse à la clinique Ce traitement a montré de tels résultats in vitro et in vivo qu’il fait aujourd’hui l’objet d’essais cliniques de phase 1, c’est-à-dire testant sa toxicité. Il ne semble pas provoquer d’effets indésirables importants. Par ailleurs, des réponses cliniques prometteuses ont été observées, notamment des régressions tumorales ou l’absence de progression tumorale, chez des patients atteints de mélanome [1]. |
Ces travaux montrent donc qu’un vaccin thérapeutique anticancer, à base de nanoparticules composées d’ARN tumoral et de lipides, peut induire une réponse immunitaire efficace, semblable à celle que déclenche normalement une infection virale. Cette réponse s’appuie sur les cellules dendritiques, véritables chefs d’orchestre du système immunitaire. On peut parler d’éducation du système immunitaire. En effet, cette nanoparticule signale précisément aux cellules dendritiques quels sont les Ag de surface des cellules dangereuses contre lesquelles elles doivent enclencher une réponse immunitaire. Les résultats impressionnants publiés dans cet article relancent ainsi l’espoir d’un vaccin anticancer. Ce traitement innovant présente de nombreux avantages. En effet, sa production serait facile et moins coûteuse que les traitements d’immunothérapie actuellement sur le marché. Toutefois, il reste à en vérifier l’innocuité et l’efficacité à long terme dans des essais cliniques randomisés (tirage au sort des patients traités versus non traités) incluant de plus grands effectifs de patients. Il faudra aussi élaborer des nanoparticules chargées d’ARN codant des Ag différents selon le type de cancer, voire, si possible, développer un vaccin « universel » susceptible de combattre tout type de cancer. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dewitte H, Verbeke R, Breckpot K, et al. Nanoparticle design to induce tumor immunity and challenge the suppressive tumor microenvironment . Nano Today. 2014; ; 9 : :743.–758. 2.
Postow MA, Callahan MK, Wolchok JD. Immune checkpoint blockade in cancer therapy . J Clin Oncol. 2015; ; 33 : :1974.–1982. 3.
Sabado RL, Balan S, Bhardwaj N. Dendritic cell-based immunotherapy . Cell Res. 2017; ; 27 : :74.–95. 4.
Kranz LM, Diken M, Haas H, et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy . Nature. 2016; ; 534 : :396.–401. |