Dormir est une activité biologique commune au règne animal. Avec l’apparition des mammifères, est survenue une évolution majeure prenant la forme d’un second état de sommeil dit paradoxal (SP ou rapid eye movement [REM], sleep en anglais). Décrit seulement à la fin des années 1950, le sommeil paradoxal demeure aujourd’hui fascinant, en particulier pour sa concomitance avec l’activité onirique1. Le sommeil paradoxal se caractérise par une activité cérébrale maximale, supérieure à celle de la veille, paradoxalement associée à une immobilité corporelle qui résulte d’une atonie de la musculature posturale empêchant tous mouvements intempestifs, potentiellement dangereux pour le rêveur coupé du monde extérieur. En 1986, une pathologie (la parasomnie) consécutive à la perte totale ou intermittente de l’atonie musculaire pendant le sommeil paradoxal, a été décrite [1]. Le patient présentant cette pathologie, bien qu’endormi et inconscient, montre d’impressionnants mouvements complexes, involontaires, souvent violents et agressifs, qui s’accompagnent de vocalisations et de cris : le dormeur extérioriserait ses rêves [2, 3] (→).
(→) Voir la Nouvelle de J.F. Gagnon et al., m/s n° 10, octobre 2009, page 782
Outre son impact délétère sur la qualité de vie des patients, des études longitudinales récentes ont établi que ces troubles comportementaux en sommeil paradoxal (TCSP, ou REM sleep behavior disorder [RBD]) constituent un marqueur diagnostique précoce (supérieur à 10 ans) de maladies neurodégénératives de type synucléinopathique2 (comme la maladie de Parkinson, la démence à corps de Lewy, l’atrophie multi-systématisée) [4, 5]. Selon l’hypothèse étiologique actuelle, le RBD reflèterait une atteinte synucléinopathique des neurones à l’origine de l’atonie musculaire pendant le sommeil paradoxal. En effet chez ces patients, la zone pontique cérébrolésée inclut le noyau sublatérodorsal (SLD) qui est constitué de neurones excitateurs glutamate actifs uniquement durant le sommeil paradoxal. Ils sont considérés comme générateurs de cet état de sommeil paradoxal en synchronisant l’ensemble de ses signes pathognomoniques (comme l’activation corticale, l’atonie musculaire, des mouvements oculaires rapides, érection pénienne, etc.) [6].
Notre étude réalisée chez le rat, publiée dans la revue Brain [7], avait pour objectifs (1) de déterminer si les connexions intracérébrales des neurones glutamate du noyau sublatérodorsal sous-tendaient ce rôle de générateur du sommeil paradoxal, (2) de démontrer fonctionnellement leur implication dans l’expression du SP, et (3) de déterminer si leur dysfonctionnement pouvait rendre compte de la parasomnie RBD.
Nous avons combiné le traçage rétrograde multiple des voies nerveuses (une méthode permettant de suivre le devenir de molécules marquées selon les trajets neuronaux) à une approche de neuroanatomie fonctionnelle, chez le rat traité pour être en hypersomnie de sommeil paradoxal. Au sein du noyau sublatérodorsal, deux populations neuronales se distinguent par leurs projections : ascendantes, vers les noyaux intralaminaires thalamiques corticopètes, et descendantes, vers le bulbe rachidien ventral. Pendant le sommeil paradoxal, seule la voie descendante, de nature glutamatergique, est activée. Cette organisation anatomique du noyau sublatérodorsal suggère que ses neurones glutamate ne peuvent être les seuls générateurs du sommeil paradoxal. Ils seraient positionnés afin d’exercer un contrôle des réseaux moteurs bulbo-spinaux qui sont mis en jeu lors de la paralysie du sommeil paradoxal.
Nous avons testé ces hypothèses chez des rats préparés pour la polysomnographie3. Nous avons profité de la spécificité moléculaire de vecteurs adéno-viraux véhiculant un shARN (short-hairpin ARN) dirigé contre le transporteur vésiculaire de type 2 du glutamate (vGluT2) afin de supprimer génétiquement la transmission glutamate provenant du noyau sublatérodorsal. Dans ce modèle, les vecteurs (AAV-shARN-vGluT2 couplés au gène rapporteur fluorescent rouge mcherry) injectés se disséminent dans tous les neurones de la zone de diffusion. Ils ne sont cependant efficaces que dans les neurones exprimant des ARN messagers codant vGluT2 auxquels ils s’hybrident. Il en résulte une cascade d’évènements intracellulaires qui conduisent à l’élimination irréversible des ARN messagers ciblés, et donc, à l’arrêt de la traduction de la protéine native. Le transporteur vGluT2 étant nécessaire à la neurotransmission glutamate centrale, les neurones, bien qu’encore présents et fonctionnels, ne peuvent plus communiquer avec leurs cibles post-synaptiques, en particulier bulbo-spinales. Ils sont donc comme déconnectés des réseaux neuronaux auxquels ils appartiennent (Figure 1). Les animaux traités par des AAV-shARN-vGluT2 ou AAV-shARN-contrôles ont donc été observés, et leur sommeil et leur activité motrice ont été analysés et comparés pendant 30 jours.
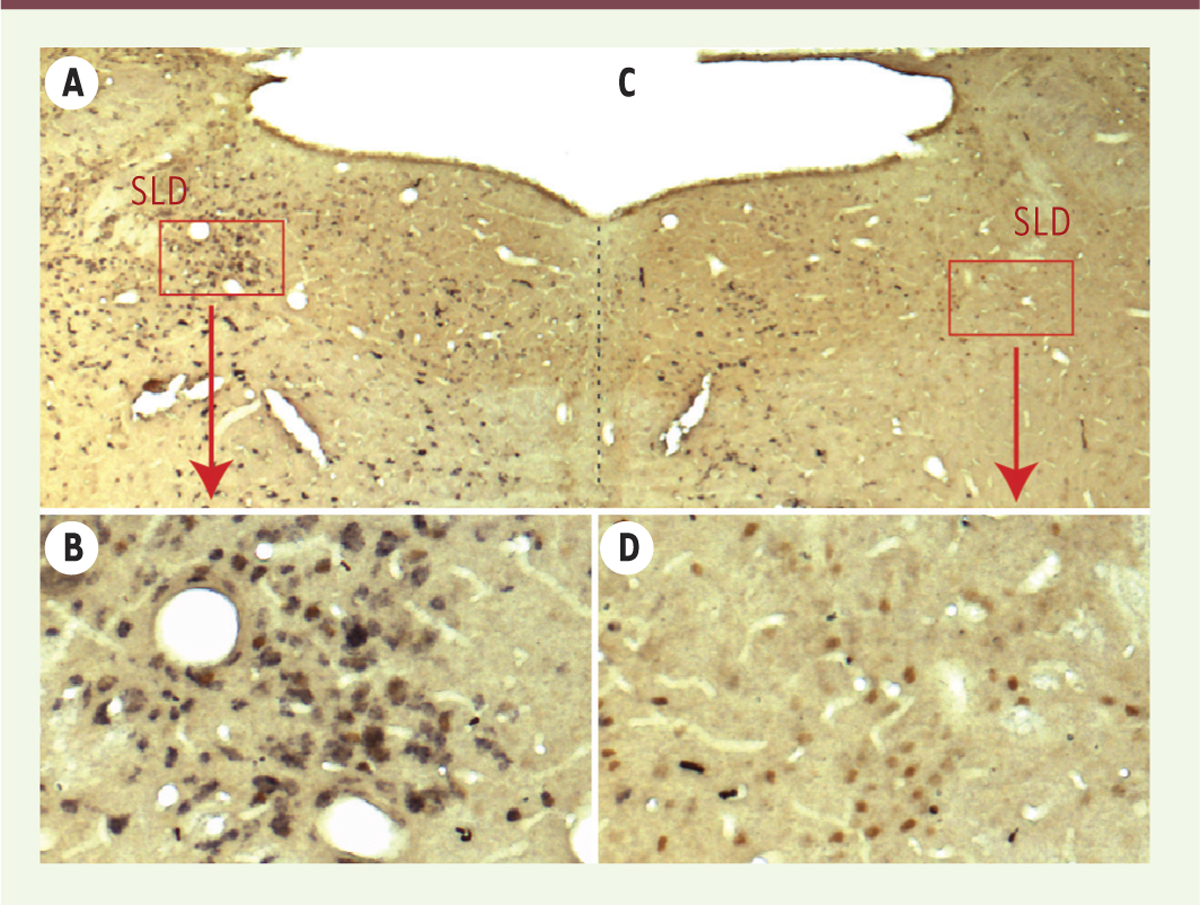
| Figure 1.
Photomontage illustrant l’efficacité et la spécificité de l’action moléculaire des vecteurs AAV-shRNA dirigés contre les ARN messagers du vGluT2 dans les neurones du noyau sublatérodorsal (SLD). Chez un rat traité par les vecteurs adéno-associés contrôles (en A et B), les neurones présents dans le noyau sublatérodorsal (SLD) et actifs pendant le sommeil paradoxal (noyaux colorés en marron par la protéine cFos, un marqueur d’activité neuronale) sont de nature glutamate (grains noirs présents dans le cytoplasme suite à l’hybridation in situ des ARN messagers [ARNm] du transporteur vésiculaire de type 2 du glutamate, vGluT2). Chez un rat traité par les AAV-shARN-vGluT2 (C et D), les neurones sont toujours présents (noyaux marrons) mais ne sont plus capables d’exprimer les ARNm du vGluT2 (absence de coloration noire) et donc de libérer le neurotransmetteur excitateur dans leurs cibles post-synaptiques. |
L’inactivation génétique des neurones glutamate du noyau sublatérodorsal ne modifie que marginalement l’expression du sommeil paradoxal : celui-ci est toujours généré naturellement sans qu’apparaissent de modifications des rythmes électroencéphalographiques (EEG) corticaux caractéristiques (thêta et gamma). Cette observation a constitué notre première surprise ! Contrairement à l’hypothèse princeps formulée il y a 60 ans, et en accord avec la cytoarchitectonie du noyau sublatérodorsal, ces données physiologiques remettent en effet en question la responsabilité unique du noyau sublatérodorsal dans la genèse du sommeil paradoxal. Un deuxième résultat marquant que nous avons obtenu, montre l’apparition d’une activité comportementale importante et variée durant le sommeil paradoxal chez les rats ayant reçu les injections de AAV-shARN-vGluT2, leur locomotion, pendant la veille, demeurant cependant normale. Alors qu’ils sont profondément endormis avec les paupières fermées, ces rats ne sont en effet plus paralysés, comme le confirme les analyses par électromyogramme, un maintien d’un tonus musculaire « pathologique » étant soutenu, bien qu’irrégulier, pendant tous les épisodes de sommeil paradoxal. L’électromyographie multiple est assez aisée en pratique clinique pour une analyse quantitative, par le placement d’électrodes sur la peau de tous les territoires musculaires d’intérêt. Chez l’animal préparé pour permettre les enregistrements polysomnographiques en continu sur plusieurs semaines, les électrodes nécessitent d’être placées dans les muscles et les fils de raccordement sous la peau, ce qui est inconfortable pour l’animal sur la durée des expérimentations. Afin d’éviter ce désagrément, nous avons développé une méthode d’analyse actimétrique4,, seconde par seconde, à partir d’enregistrements vidéo synchronisés à la polysomnographie. L’actimétrie montre que les animaux qui ont reçu les AAV-shARN-vGluT2 produisent, pendant le sommeil paradoxal, des mouvements plus nombreux, plus longs et plus intenses que leurs congénères traités par les AAV-shARN-contrôles (Figure 2). L’activité motrice est très variée, prenant la forme de petits mouvements des pattes avant et/ou arrière, de secousses du tronc, jusqu’à des mouvements plus élaborés et coordonnés, mimant la recherche de nourriture dans la litière, une course, parfois une activité saltatoire ou reptatoire5,. Ces comportements, pendant le sommeil paradoxal, rappellent clairement le tableau clinique des patients souffrant de RBD : mouvements très variés, irréguliers, plus ou moins élaborés et coordonnés, en position couchée, les yeux étant toujours fermés (voir les vidéos enregistrées chez le rat [7] et chez les patients [2]).
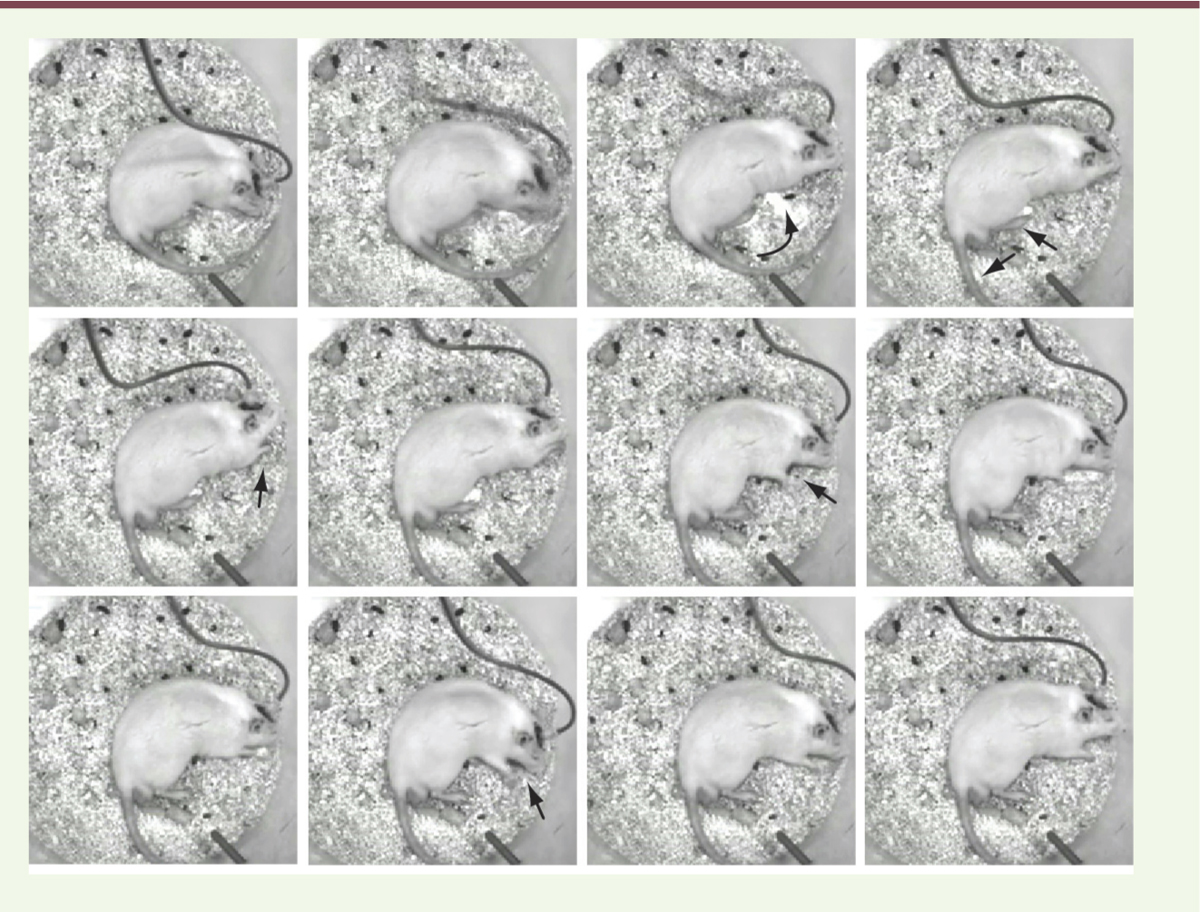
| Figure 2.
Séquence de photos successives illustrant chez un rat traité des mouvements oniriques pendant le sommeil paradoxal mimant les troubles comportementaux humains. Captures vidéo successives prises toutes les secondes (de gauche à droite, haut en bas) pendant lesquelles l’animal perd l’atonie musculaire caractéristique du sommeil paradoxal, exécutant alors des mouvements, les yeux fermés, en position allongée et coupé des stimuli extérieurs. Notez le changement de position du corps avec des mouvements des pattes arrière et de la queue (flèches, première ligne), se poursuivant par ceux des pattes avant et de la tête, mimant la recherche d’une croquette avec le museau dans la litière puis son ingestion (flèches, seconde ligne). |
Cette étude a permis de générer des résultats complémentaires grâce aux données obtenues par l’analyse post-mortem des sites d’injection, la spécificité/efficacité de l’action moléculaire du vecteur ARN interférant et la disparition effective de la protéine vGluT2 ciblée. Les voies axonales, issues des neurones infectés, ont en effet pu être déterminées grâce à l’expression de la protéine rapporteure fluorescente mcherry : les neurones du noyau sublatérodorsal projettent densément sur le bulbe rachidien ventral ; cette voie est sélectivement recrutée pendant le sommeil paradoxal, comme le montre l’étude neuroanatomique décrite précédemment. Ces contacts s’orientent vers des neurones libérant le neurotransmetteur glycine. Ces neurones inhibiteurs, activés pendant le sommeil paradoxal et placés sous le contrôle du noyau sublatérodorsal, apparaissent dès lors comme les meilleurs candidats de l’hyperpolarisation des motoneurones somatiques dont résulte la paralysie pendant le sommeil paradoxal [8].
Notre étude apporte donc, pour la première fois, des arguments fonctionnels et génétiques sur le rôle des neurones glutamate du noyau sublatérodorsal dans le contrôle de l’atonie musculaire pendant le sommeil paradoxal, sans qu’ils n’aient d’incidence sur le sommeil paradoxal per se. Leur dysfonctionnement, induit expérimentalement, est suffisant pour reproduire des comportements « oniriques » très similaires à ceux observés chez des patients souffrant de RBD. Ces données valident donc un modèle pré-clinique simple et reproductible de cette pathologie permettant d’identifier des pistes de recherche pour sa compréhension et son traitement. Nos résultats suggèrent également que chez les patients, ces neurones glutamate pourraient être la cible privilégiée de l’atteinte synucléinopathique [5]. Il conviendrait de tester cette hypothèse sur des biopsies. Les troubles RBD surviennent à l’étape 26 (sur 6) du processus dégénératif progressif de la maladie de Parkinson, selon le modèle de Braak [9] ; les symptômes moteurs cardinaux apparaissent quant à eux, au stade 47, avec l’atteinte des neurones dopamine mésencéphaliques. Ce délai entre le diagnostic du RBD et celui d’une maladie de Parkinson pourrait refléter le temps de propagation dans l’axe caudo-rostral de la synucléinopathie provenant du noyau sublatérodorsal, selon un motif stéréotypique, par transmission de cellule à cellule, et une propagation via les faisceaux d’interconnexions cérébrales. Quelques arguments expérimentaux en faveur d’un tel scénario physiopathologique ont été récemment rapportés [6, 10]. Cette dernière hypothèse passionnante quant à l’étiologie des troubles comportementaux en sommeil paradoxal et sa conversion en maladie de Parkinson, devra faire l’objet de recherches approfondies afin de la valider. Notre étude démontre également l’intérêt translationnel en santé publique que représentent les mécanismes de régulation du sommeil paradoxal et leur dysfonctionnement dans la pathologie RBD.