| |
| Med Sci (Paris). 33(10): 820–822. doi: 10.1051/medsci/20173310003.De la diversité des cellules dendritiques humaines Gaëlle Breton1* 1Laboratoire d’immunologie moléculaire, The Rockefeller University, 1230 York Avenue, Box 220, New York, NY10065, États-Unis MeSH keywords: Cellules de la moelle osseuse, Différenciation cellulaire, Cellules dendritiques, Humains, physiologie |
Les cellules dendritiques sont spécialisées dans l’initiation et le contrôle des réponses immunitaires. Situées à l’interface avec le milieu extérieur, elles assurent la surveillance immunitaire dans les tissus. En cas d’intrusion d’un pathogène, les cellules dendritiques vont phagocyter l’intrus, apprêter les antigènes et migrer vers les ganglions lymphatiques où elles initient la réponse immunitaire adaptative spécifique vis-à-vis de ces antigènes [1]. |
Les cellules dendritiques humaines : une population hétérogène de leucocytes aux fonctions diverses Les cellules dendritiques constituent une population hétérogène de cellules qui présentent différentes fonctions permettant d’activer une réponse immunitaire spécifique vis-à-vis d’un pathogène. Trois sous-populations principales de cellules dendritiques ont été décrites chez l’homme : les cellules dendritiques plasmacytoïdes qui expriment CD303 (ou BDCA-2, blood dendritic cell antigen 2) et ont l’unique capacité de produire de grande quantité d’interféron de type I en réponse à une infection virale [2] ; les deux autres sous-populations de cellules dendritiques sont dites myéloïdes, ou conventionnelles. Elles peuvent être distinguées par l’expression soit de CD1c (BDCA-1), soit de CD141 (BDCA-3). Les cellules dendritiques BDCA-1+ excellent dans la stimulation des lymphocytes T CD4+ naïfs. Elles orientent les réponses lymphocytaires T CD4+ contre les pathogènes extracellulaires, vers le type Th-17 ou le type Th-2 [3]. Les cellules dendritiques BDCA-3+ induisent, quant à elles, des réponses lymphocytaires T CD4+ de type Th-1 ; elles ont aussi la capacité de capturer des cellules infectées (et apoptotiques) par l’intermédiaire de la lectine de type C Clec9A (C-type lectin domain family 9 member A), et de présenter aux lymphocytes T CD8+ les pathogènes présents dans ces cellules et qui n’infectent pas directement les cellules dendritiques [4]. Les mécanismes à l’origine des réponses immunitaires des différentes sous-populations de cellules dendritiques sont de mieux en mieux connus. Néanmoins, l’origine de la diversité fonctionnelle de ces cellules reste à élucider. |
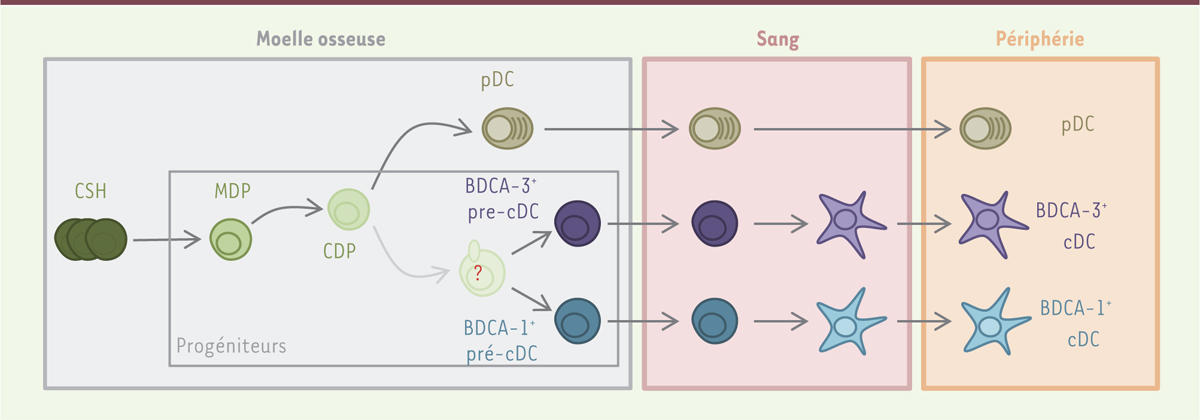
Origine des cellules dendritiques humaines Les trois sous-populations de cellules dendritiques partagent avec les monocytes, un progéniteur commun dans la moelle osseuse. Appelé MDP (monocyte and dendritic cell progenitor) [5, 7], ce progéniteur se différencie en monocyte mais également en une cellule progénitrice qui est commune à toutes les cellules dendritiques, le CDP (common dendritic cell progenitor). Le CDP a perdu la capacité de différenciation en monocytes. Il n’est à l’origine que des trois sous-populations de cellules dendritiques. Dans la moelle osseuse, le CDP se différencie en cellules dendritiques plasmacytoïdes et en un précurseur immédiat des cellules dendritiques conventionnelles, le pré-cDC (conventional dendritic cell precursor) [6, 7] (→). (→) Voir la Nouvelle de G. Breton et al., m/s n° 6-7, août-septembre 2015, page 725 Le pré-cDC a été identifié dans la moelle osseuse, mais il a également été isolé dans le sang et dans les amygdales. Il peut donc migrer de la moelle osseuse vers les organes lymphoïdes secondaires par la circulation sanguine. |
Une même origine pour toutes les cellules dendritiques conventionnelles ? L’origine de la diversité fonctionnelle des cellules dendritiques n’est actuellement pas identifiée. Les cellules dendritiques BDCA-1+ et BDCA-3+ se développent-elles indépendamment ou ont-elles une origine commune, avant d’acquérir des fonctions spécifiques selon le milieu dans lequel elles se trouvent ? Les pré-cDC sont à l’origine des deux sous-types de cellules dendritiques conventionnelles. Nous avons cependant observé in vitro qu’une cellule pré-cDC unique pouvait n’être à l’origine que de cellules dendritiques BDCA-1+ ou de cellules BDCA-3+, mais très rarement des deux sous-types de cellules [6]. Chez la souris, les cellules pré-cDC contiennent en fait deux précurseurs qui sont déjà engagés dans la différenciation de l’une ou l’autre des sous-populations de cellules dendritiques [8,9]. Chez l’homme, les pré-cDC pourraient donc être également hétérogènes. Des marqueurs spécifiques des différentes populations cellulaires semblent donc nécessaires afin d’isoler le précurseur à l’origine de chacune des sous-populations de cellules dendritiques conventionnelles. |
Deux précurseurs à l’origine des cellules dendritiques BDCA-1 + et BDCA-3 +Afin d’étudier l’hétérogénéité des progéniteurs pré-cDC chez l’homme et ainsi d’identifier les précurseurs des cellules dendritiques BDCA-1+ et BDCA-3+, nous avons examiné le transcriptome au niveau de la cellule, d’environ 450 cellules pré-cDC isolées de sang de cordon ou de sang périphérique humains [10]. Cette méthode permet une analyse détaillée de l’expression génique au niveau de la cellule individuelle. Elle donne également des indications quant à la nature et à l’étendue de l’hétérogénéité d’une population cellulaire. Par cette analyse, nous avons montré que les pré-cDC constituent en réalité un groupe de cellules hétérogène regroupant des cellules qui expriment les marqueurs caractéristiques des cellules dendritiques BDCA-1+ (Clec10A [C-type lectin domain family 10], ETS2 [erythroblastosis virus E26 oncogene homolog-2], ZEB2 [zinc finger E-box binding bomeobox 2]) ou les marqueurs des cellules dendritiques BDCA-3+ (Clec9A, IDO2 [indoleamine 2,3-dioxygenase 2], BATF3 [basic leucine zipper ATF-like transcription factor 3]). Afin de distinguer ces deux sous-types de précurseurs au sein de la population pré-cDC étudiée, nous avons recherché des marqueurs spécifiquement exprimés par l’une ou l’autre des sous-populations de cellules dendritiques différenciées. Nous avons montré que les deux types de précurseurs peuvent en fait être différenciés selon leur expression de CD172a (ou SIRPa [signal protein regulatory α]), les pré-cDC exprimant ce marqueur étant les précurseurs des cellules BDCA-1+, les pré-cDC CD172a- étant à l’origine des cellules BDCA-3+ (
Figure 1
). Chaque sous-population de pré-cDC est présente dans la moelle osseuse mais également dans le sang périphérique et dans le sang de cordon. Elles prolifèrent et présentent un phénotype plus immature que les cellules dendritiques différenciées. L’analyse transcriptomique réalisée sur les précurseurs exprimant CD172a (les BDCA-1+ pré-cDC) et ceux ne l’exprimant pas (les BDCA-3+ pré-cDC) a montré qu’ils représentaient deux populations distinctes qui expriment des facteurs de transcription spécifiques des lignées BDCA-1+ ou BDCA-3+. L’injection de Flt3l (FMS-like tyrosine kinase 3 ligand), hématopoïétine nécessaire pour le développement des cellules dendritiques, permet d’augmenter le nombre de cellules des deux sous-types de précurseurs dans le sang de volontaires et cela de façon similaire à l’augmentation observée pour les trois populations de cellules dendritiques matures. Notre étude ne nous a cependant pas permis d’identifier un précurseur commun pour les cellules dendritiques BDCA-1+ et les cellules BDCA-3+. Son existence reste néanmoins possible.
 | Figure 1.
Développement des cellules dendritiques humaines. Trois sous-populations de cellules dendritiques ont été décrites chez l’homme : les cellules dendritiques plasmacytoïdes (pDC), et deux populations de cellules dendritiques conventionnelles (cDC) que l’on différencie par l’expression de BDCA-1 (blood dendritic cell antigen-1) ou de BDCA-3. Leur développement débute dans la moelle osseuse. Le progéniteur MDP (monocyte and dendritic cell progenitor), commun aux monocytes et aux cellules dendritiques, est à l’origine du précurseur commun aux trois sous-populations de cellules dendritiques, le CDP (common DC progenitor). Le CDP mature en pDC et est à l’origine de deux précurseurs immédiats des cellules dendritiques conventionnelles appelé BDCA-1+ pré-cDC (conventional dendritic cell precursor) et BDCA-3+ pré-cDC. Ces précurseurs migrent de la moelle osseuse vers les organes lymphoïdes secondaires via la circulation sanguine et sont à l’origine des deux sous-populations principales de cellules dendritiques conventionnelles, nommées BDCA-1+ cDC et BDCA-3+ cDC. L’existence d’un précurseur commun aux cellules dendritiques BDCA-1+ et BDCA-3+ n’est pas connu. CSH : cellules souches hématopoïétiques. |
|
Conclusion et perspectives L’identification de deux précurseurs qui se différencient spécifiquement en cellules dendritiques BDCA-1+ ou en cellules dendritiques BDCA-3+ constitue une étape importante dans notre compréhension des cellules dendritiques. Cependant, le contrôle du développement de ces deux populations dans un contexte non-pathologique reste incompris. Savoir si différentes conditions d’inflammation ou d’infection favorisent le développement d’une population au détriment de l’autre reste également à définir. Comprendre comment ces populations sont régulées est primordial afin de déterminer le rôle de ces cellules dans les différentes pathologies dans lesquelles elles interviennent, mais également pour le développement de nouvelles approches thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Collin M, McGovern N, Haniffa M. Human dendritic cell subsets. Immunology. 2013; ; 140 : :22.–30. 2.
Swiecki Melissa, Colonna Marco. The multifaceted biology of plasmacytoid dendritic cells . Nat Rev Immunol. 2015; ; 15 : :471.–485. 3.
Schlitzer A, McGovern N, Teo P, et al. IRF4 transcription factor-dependent CD11b+ dendritic cells in human and mouse control mucosal IL-17 cytokine responses . Immunity. 2013; ; 38 : :970.–983. 4.
Villadangos JA, Shortman K. Found in translation: the human equivalent of mouse CD8+ dendritic cells . J Exp Med. 2010; ; 207 : :1131.–1134. 5.
Lee J, Breton G, Oliveira TY, et al. Restricted dendritic cell and monocyte progenitors in human cord blood and bone marrow . J Exp Med. 2015; ; 212 : :385.–399. 6.
Breton G, Lee J, Zhou YJ, et al. Circulating precursors of human CD1c+ and CD141+ dendritic cells . J Exp Med. 2015; ; 212 : :401.–413. 7.
Breton G. Origine et développement des cellules dendritiques humaines . Med Sci (Paris). 2015; ; 31 : :725.–727. 8.
Schlitzer A, Sivakamasundari V, Chen J, et al. Identification of cDC1- and cDC2-committed DC progenitors reveals early lineage priming at the common DC progenitor stage in the bone marrow . Nat Immunol. 2015; ; 16 : :718.–728. 9.
Grajales-Reyes GE, Iwata A, Albring J, et al. Batf3 maintains autoactivation of Irf8 for commitment of a CD8α+ conventional DC clonogenic progenitor . Nat Immunol. 2015; ; 16 : :708.–717. 10.
Breton G, Zheng S, Valieris R. Tojal da Silva I, Satija R, Nussenzweig MC. Human dendritic cells (DCs) are derived from distinct circulating precursors that are precommitted to become CD1c+ or CD141+ DCs . J Exp Med. 2016; ; 213 : :2861.–2870. |