| |
| Med Sci (Paris). 33(8-9): 771–778. doi: 10.1051/medsci/20173308023.Les lymphocytes B thymiques : plus que de simples spectateurs de la lymphopoïèse T Vincent Gies,1* Aurélien Guffroy,1 and Anne-Sophie Korganow1 1CNRS UPR 3572, Immunopathologie et chimie thérapeutique, Laboratoire d’Excellence Médalis, Institut de biologie moléculaire et cellulaire (IBMC), 67000Strasbourg, France.Service d’immunologie clinique et de médecine interne, Centre national de référence des maladies auto-immunes rares, Hôpitaux universitaires de Strasbourg, 67091Strasbourg, France |

La structure et la fonction du thymus sont intensément étudiées depuis l’identification de son rôle central dans la réponse immunitaire [46] (→).
(→) Voir le Forum de V. Geenen, m/s n° 6-7, juin-juillet 2017, page 653
Le thymus est très actif durant la période fœtale et post-natale, permettant la génération de lymphocytes T (LT) matures CD4+ et CD8+ dépourvus d’autoréactivité. Par la suite, le tissu lymphoïde thymique s’atrophie avec l’âge, laissant place à du tissu adipeux, tout en gardant un caractère fonctionnel, même si diminué, capable de générer des LT tolérants au soi. Cependant, il est également connu depuis plus de 30 ans que le thymus abrite aussi des lymphocytes B (LB) : ils ont été décrits pour la première fois en histologie par Isaacson et al. comme des cellules rares (moins de 1 % des lymphocytes thymiques) correspondant à un groupe morphologiquement hétérogène de cellules rondes ou « astéroïdes » [1]. Jusqu’à ces 10 dernières années, leur présence a souvent été considérée comme « due au hasard », issue d’un homing
1, de LB périphériques, et peu de choses étaient connues sur leur devenir et leur fonction avec, principalement, des données d’immunohistochimie [1–3]. Toutefois, ces premières descriptions ont montré leur présence précoce au cours du développement thymique, ainsi qu’une localisation histologique précise et l’expression de marqueurs d’activation. Dans cette revue, nous nous attacherons à synthétiser les connaissances actuelles montrant l’importance de cette population lymphocytaire encore méconnue. |
Développement des lymphocytes B thymiques Bien que la majorité des LT se développent dans l’organe lymphoïde thymique, ils dérivent de cellules souches hématopoïétiques qui résident dans la moelle osseuse. Ces précurseurs T pénètrent dans le thymus au niveau de la jonction cortico-médullaire et migrent dans le cortex. La maturation des LT est par la suite orchestrée par l’environnement thymique constitué en particulier des cellules épithéliales thymiques corticales (cTEC, cortical thymic epithelial cell) et médullaires (mTEC, medullary thymic epithelial cell), de cellules dendritiques, de macrophages et de LB. La production continue de LT dépend d’une migration constante de précurseurs dérivant de la moelle osseuse dans le thymus, où ils prolifèrent et subissent les processus de sélection, afin de permettre la sortie de LT CD4+ et CD8+ naïfs et tolérants au soi [4]. Dans le thymus, moins de 1 % des thymocytes sont des LB. Ils sont présents dans les espaces périvasculaires et dispersés dans le cortex, mais une majorité d’entre eux s’accumulent dans la médulla, particulièrement autour des corpuscules de Hassal2, et à la jonction cortico-médullaire, où ils constituent près de 30 % des cellules [1–3]. Les LB IgM+ (immunoglobuline M)3, et plus généralement les LB ayant réarrangé les gènes d’immunoglobulines [5], sont confinés dans la médulla, alors que des cellules CD19+
4 peuvent être visualisées dans le cortex (Figure 1) [6, 7]. Chez la souris, ce sont principalement les cellules stromales thymiques corticales qui participent au développement des LB [8], suggérant que les progéniteurs des LB sont localisés dans le cortex, alors que les lymphocytes B plus matures sont présents dans la médulla. La répartition phénotypique des LB thymiques diffère de celle de la moelle et du sang périphérique [6, 9], et bien qu’un homing de LB périphériques existe, il ne semble jouer qu’un rôle mineur dans le maintien de la population de LB thymiques [6, 10]. Ces informations ne nous indiquent cependant pas si les LB thymiques sont originaires du thymus ou s’ils y migrent.
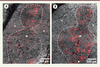 | Figure 1.
Immunofluorescence sur une section de thymus humain (6 µm) avec un anticorps anti-CD19 humain (A) ou anti-IgM humain (B). Anti-CD19 ou anti-IgM (rouge) ; DAPI (gris) ; jonction cortico-médullaire (lignes pointillées) ; médulla (m) ; cortex (c). IgM : immunoglobuline M. |
Les premières observations suggérant un développement indépendant des LB au sein du thymus ont été effectuées chez la souris, où des LB thymiques matures sont détectables au stade embryonnaire dès le 14e jour de gestation, c’est-à-dire avant l’apparition d’une lymphopoïèse B dans la moelle osseuse [11]. L’ontogénie exacte des LB thymiques reste difficile à établir. Les progéniteurs lymphoïdes communs, qui ont un potentiel T et B [12], ou des progéniteurs B très précoces, pourraient migrer de la périphérie vers le thymus et participer à la lymphopoïèse B. Comme la moelle osseuse, le thymus présente tous les stades de maturation des précurseurs B [6, 9] qui sont capables de maturer et de proliférer in situ [6, 7, 10, 13]. La fréquence plus élevée de cellules pro-B5, et pré-B dans le thymus, par rapport au sang périphérique [6], suggère que le microenvironnement thymique, murin et humain, supporte aussi bien la maturation complète des LT que celle des LB (Figure 2).
 | Figure 2.
Proposition de modèles pour l’ontogénie des lymphocytes B (LB) thymiques. Des progéniteurs lymphoïdes circulants (progéniteurs lymphoïdes communs ?) possédant une restriction pour se différencier vers la lignée T ou B entrent dans le thymus. En fonction du type d’interactions avec le microenvironnement thymique, ces progéniteurs peuvent s’engager vers la lignée B. La lymphopoïèse B thymique est par la suite soutenue par des précurseurs B corticaux qui vont maturer en LB matures naïfs, capables de commuter, situés dans la médulla. LT : lymphocytes T. |
Cependant, dans le thymus, la lymphopoïèse B reste minimale, impliquant l’existence de mécanismes qui limitent la maturation B intrathymique. Il a été proposé que l’activation via des ligands, présentés par les cellules stromales thymiques, de la voie de Notch1 dans les progéniteurs thymiques précoces, favorise une restriction du potentiel de maturation cellulaire vers la lignée T, limitant ainsi l’émergence de LB. Malgré ce scénario d’émergence de LB par « défaut » d’engagement dans la lignée T, il reste surprenant que les LB thymiques ne représentent que moins de 1 % des thymocytes. En effet, les précurseurs B thymiques sont, en partie, exposés aux même stimulus que les LB de la moelle osseuse, comme les cytokines produites de façon paracrine par les cTEC [14] (→).
(→) Voir la Nouvelle de V.M. Lopez et S. Ezine, m/s n° 6-7, juin-juillet 2015, page 591
Ils devraient, en particulier, répondre à l’interleukine-7 (IL-7) qui stimule la prolifération des pro-B et potentialise le réarrangement de la chaîne lourde (chaîne µ) dans ces précurseurs. L’IL-7 ne stimule cependant pas efficacement les précurseurs B thymiques et, en présence de stroma thymique, des précurseurs B dérivant de la moelle osseuse ne répondent pas de façon optimale à cette interleukine [15]. Le microenvironnement thymique semble donc limiter la lymphopoïèse B, empêchant l’émergence d’une compétition développementale entre les LB et les LT, qui pourrait interférer avec la lymphopoïèse T. Les LB thymiques étant impliqués dans la sélection des LT (voir plus loin), leur croissance excessive et non contrôlée pourrait également être délétère pour les processus d’éducation thymique [7, 15]. |
Un phénotype de cellules présentatrices d’antigènes Les LB sont présents dans le thymus aux stades fœtaux, postnatals et adultes. Ils expriment des marqueurs typiques de la lignée B, comme les molécules CD19 et CD20, et des immunoglobulines de surface [1–3, 6]. On y retrouve des LB matures naïfs, mais également des LB ayant subi une commutation de classe dont la fréquence augmente avec l’âge, une conséquence probable de l’accumulation dans les espaces périvasculaires thymiques de LB mémoires et de plasmocytes, dont certains ont des propriétés antivirales (voir plus loin) [16]. Ces LB, dont la commutation de classe s’effectue in situ [17], expriment des IgG et des IgA, mais pas d’IgE. Le répertoire des LB thymiques se développe indépendamment de celui des LB sanguins ou des ganglions mésentériques. La diversification du répertoire de ces cellules peut se réaliser avant la naissance [5, 18, 19]. Les LB thymiques ont un phénotype de cellules activées. Ils présentent des niveaux élevés de molécules d’adhésion et de costimulation, comme CD69, CD40, CD80 et CD86, et de molécules du complexe majeur d’histocompatibilité de classe II (CMH-II), suggérant une fonction de cellules présentatrices d’antigènes (APC, antigen presenting cell) [6, 10, 20, 21]. Chez un même individu, 20 % des LB thymiques matures surexpriment CD86. Cette surexpression n’est pas retrouvée dans les LB périphériques ou ceux de la moelle osseuse, ce qui révèle la restriction de ce caractère de cellules hyperactivées aux LB thymiques [6]. Chez la souris, malgré ce phénotype de cellules activées, des stimulus comme le lipopolysaccharide bactérien (LPS) ou un traitement avec un anticorps anti-IgM et de l’IL-4, n’induisent qu’une faible réponse proliférative des LB thymiques, en comparaison aux LB spléniques [22]. À l’inverse, la stimulation de CD40 (récepteur de costimulation du LB) provoque une forte réponse proliférative et une production d’anticorps [23]. Les souris déficientes en CD40 présentent des LB thymiques en nombre réduit qui expriment un niveau plus faible de CD69 et de CD86 [20], sans qu’il y ait d’altération des compartiments B de la rate ou des ganglions [10]. La déficience en CD40 ligand (CD40L, le ligand de CD40) se traduit également par une réduction (de 10 fois) du nombre de LB thymiques [24] et des souris dépourvues de LT simple positifs (LT SP), seule population de thymocytes à exprimer le CD40L, ont un moindre nombre de LB thymiques en comparaison avec des souris contrôles [21]. Ces données soutiennent donc le rôle primordial de CD40 dans l’homéostasie des LB thymiques. Le dialogue entre LB thymique et LT SP via l’interaction entre CD40 et son ligand, CD40L, apparaît donc essentiel pour l’activation des LB intrathymiques et pour leur participation à la sélection négative (voir plus loin) [21, 25]. Certains LB thymiques expriment faiblement la molécule CD5 [6, 22], qui, entre autre, régule négativement l’intensité du signal résultant de l’activation du BCR (B cell receptor) [26]. Initialement, les LB thymiques CD5+ étaient considérés, chez la souris, comme appartenant à la population LB B1a (CD11b+CD5+), une population de LB T-indépendante et productrice d’autoanticorps naturels de classe IgM [27]. Cependant, les LB thymiques n’expriment pas CD11b. Les LB B16,, générés par le foie fœtal, et les LB thymiques semblent en fait de deux origines différentes. Que ce soient les progéniteurs de la moelle osseuse ou ceux du foie fœtal, ils sont capables de restaurer en partie le pool de LB thymiques d’une souris Rag-1
-/- (sans LT ou LB matures) irradiée. Les LB thymiques se développent donc aussi bien à partir du foie fœtal que de la moelle osseuse, soulignant un lignage différent avec celui des LB B1, originaire exclusivement du foie fœtal [10]. La stimulation in vitro des LB B2, via CD40 et avec un anticorps anti-IgM, permet une faible induction de CD5 à leur surface [28]. L’importance de l’interaction CD40-CD40L dans l’activation des LB thymiques pourrait donc expliquer la présence de LB thymiques CD5+. Le CD5 favorise également la survie des LB en stimulant la production d’IL-10 et en régulant négativement l’activation par le BCR [26]. Xing et al. ont ainsi identifié une population de LB thymiques murins CD5+ productrice d’IL-10 aux propriétés régulatrices [29], et l’expression du CD5 pourrait également expliquer la survie des LB thymiques possédant un BCR autoréactif qui participent à la sélection négative (voir plus loin). La pertinence biologique de l’expression de CD5 reste toutefois débattue. En effet Ferrero et al., bien que détectant des LB thymiques CD5+ en cytométrie de flux, n’ont pas retrouvé d’ARNm codant CD5, suggérant que la présence de CD5 à leur surface pourrait, en réalité, être la simple conséquence d’un transfert passif à partir des LT environnants [20]. Les LB thymiques possèdent donc des caractéristiques d’APC. Localisés, pour leur grande majorité, dans la médulla et à la jonction cortico-médullaire, site de la sélection négative et de l’expression ectopique d’auto-antigènes tissus-spécifiques (TRA, tissu restricted antigens) par les mTEC [4], ils pourraient donc être impliqués dans la sélection des thymocytes. |
Rôle dans la tolérance centrale Le développement et le devenir des thymocytes sont déterminés par des interactions cellulaires avec l’environnement thymique. Les thymocytes vont passer par différents stades de maturation reposant sur des interactions avec les APC, ce qui permet l’export en périphérie de LT tolérants. Les cTEC interviennent dans la sélection positive, via la présentation de peptides du soi par le CMH-I ou le CMH-II. Ils sont à l’origine de la déplétion de LT double positifs autoréactifs de forte affinité. Les LT SP résultants seront soumis à une sélection négative impliquant les mTEC présentant des TRA sous l’influence du facteur de transcription AIRE. Les mTEC jouent ainsi le rôle de réservoir d’autoantigènes ectopiques et d’APC [4]. Dès 1992, Spencer et al. décrivent certains LB thymiques de la médulla entourés d’une couronne de thymocytes [2]. Cependant, malgré une localisation histologique précise, le rôle des LB thymiques dans la tolérance est longtemps resté obscur. À ce jour, de nombreuses données montrent leur implication dans le processus de tolérance, par l’intermédiaire de mécanismes d’action complexes et variés, et soulignent l’importance des LB thymiques dans la création du répertoire T. Expression de BCR autoréactifs En coopération avec les LT, les LB thymiques peuvent réaliser une commutation de classe. L’inhibition de cette commutation est à l’origine de l’émergence d’un nombre plus important de LT autoréactifs, ce qui suggère un rôle important des LB thymiques commutés dans la sélection [ 17]. Le répertoire de ces LB thymiques présente un biais d’utilisation en faveur du VH4 ( variable heavy chain region 4), une famille de gènes impliqués dans la recombinaison V(D)J, fréquemment rencontrés dans un contexte auto-immun [ 5, 19]. Comparés aux LB périphériques, une fréquence plus élevée de mutations est retrouvée dans les CDR ( complementarity determining regions) des LB thymiques, et leurs séquences suggèrent un biais de reconnaissance vers des autoantigènes (avec une forte homologie avec des anticorps poly-réactifs ou anti-gangliosides) [ 19]. En 2016, la génération d’anticorps à partir de LB naïfs thymiques, par Rother et al., a confirmé le caractère autoréactif plus important envers des antigènes protéiques, des LB thymiques par rapport à leurs équivalents de la moelle osseuse [ 30]. Ces LB autoréactifs peuvent capter efficacement différents autoantigènes au moyen de leur BCR et présenter des peptides dérivés de ces autoantigènes, par l’intermédiaire du CMH-II, aux thymocytes en développement [10, 17, 21]. L’interaction des LB autoréactifs avec les LT SP autoréactifs pourrait conduire à l’activation des LB thymiques, via l’interaction CD40-CD40L, et faciliter la commutation de classe. Ce changement d’isotype permet la survie du LB activé [31] et améliore ses capacités d’internalisation et de traitement de l’antigène dont il est spécifique [32]. En retour, ces LB thymiques commutés participeraient à la délétion des LT autoréactifs de même spécificité. La proportion plus élevée de LT autoréactifs en l’absence de commutation de classe plaide en faveur de ce processus [17]. L’activation d’un LB autoréactif permettrait donc l’élimination du LT SP autoréactif qui est à l’origine de sa maturation, afin d’éviter toute rupture de tolérance, un événement d’apparence paradoxale. Ce modèle permet néanmoins de relier l’autoréactivité des LB à un mécanisme d’élimination des LT ayant une spécificité partagée dans le thymus (Figure 3).
 | Figure 3.
Proposition de modèles pour la sélection négative des lymphocytes T (LT) par les lymphocytes B (LB) thymiques. Les LT simple positifs thymiques (LT SP), contrairement aux LT périphériques, ne sont pas débarrassés de leurs éléments autoréactifs. A. Des LB autoréactifs vont exprimer, via le CMH-II (complexe majeur d’histocompatibilité de classe II), des autoantigènes reconnus par leur BCR (B cell receptor). Des LT SP autoréactifs, exprimant constitutivement CD40L (CD40 ligand), vont reconnaître ces autoantigènes, permettant ainsi une interaction avec les LB. Ce dialogue permet l’activation des LB et l’expression de niveaux élevés de CMH-II, CD80, CD86, ainsi que l’induction de la commutation de classe des LB thymiques autoréactifs. Ces LB thymiques commutés autoréactifs vont pouvoir participer à la sélection négative des LT. B. Des LT SP autoréactifs vont reconnaître les autoantigènes, probablement endogènes aux LB, présentés par les LB thymiques via le CMH-II. Les LT SP expriment constitutivement CD40L, permettant ainsi une interaction avec les LB. Ce dialogue permet l’activation des lymphocytes B et l’expression de niveaux élevés de CMH-II, CD80, CD86, ainsi que l’expression d’AIRE. Ces LB thymiques activés vont pouvoir participer à la sélection négative via l’expression d’autoantigènes tissus spécifiques (TRA) dépendant, pour une partie, de l’expression d’AIRE. |
Expression d’AIRE Le caractère le plus inhabituel des LB thymiques est sans doute l’expression de la protéine AIRE ( autoimmune regulator), élément clé de la sélection négative [ 6, 21]. La protéine AIRE est associée à l’expression intrathymique de TRA par les mTEC de l’épithélium thymique, à l’origine de la délétion des LT autoréactifs [ 33] ( →).
(→) Voir la Synthèse de N. Lopes et al., m/s n° 8-9, août-septembre 2015, page 742
Yamano et al. ont montré que 2 à 3 % des LB thymiques murins étaient positifs pour AIRE [21]. Nous avons confirmé la présence d’AIRE dans le noyau d’environ 5 % des LB thymiques chez l’homme, à un niveau toutefois plus faible que dans les mTEC [6]. Il n’existe qu’une faible concordance dans les gènes induits par AIRE entre les mTEC et les LB thymiques chez la souris [21], suggérant que les LB thymiques humains expriment un ensemble unique de TRA. Nous avons montré, par une analyse transcriptomique par ARNseq, que les LB naïfs humains thymiques expriment un plus grand nombre de TRA que leurs homologues périphériques, certains de ces TRA étant connus pour leur lien avec des maladies auto-immunes (voir plus loin). Une induction de CD80 et du CMH-II, avec une expression post-mitotique d’AIRE, est caractéristique des mTEC [33] ; il est donc concevable que l’expression d’AIRE soit corrélée à la surexpression de marqueurs d’activation, comme CD80 et le CMH-II. Chez la souris, l’activation via CD40 et une présentation d’autoantigènes par le CMH-II permettent la maturation des LB thymiques et l’expression d’AIRE. Le traitement de LB spléniques par un agoniste de CD40 permet également l’induction d’AIRE. Au contraire, une stimulation simultanée du BCR et de CD40, mécanisme clé de la formation des centres germinatifs, inhibe cette expression. Bien que la nature exacte des autoantigènes permettant ce mécanisme ne soit pas connue, l’induction d’AIRE semble centrée sur une expression BCR-indépendante d’autoantigènes via le CMH-II. Ces données permettent d’expliquer la raison pour laquelle les LB des centres germinatifs ne sont pas capables d’exprimer AIRE et restreignent ainsi ce caractère unique aux LB thymiques [21]. L’analyse d’AIRE et de l’expression de TRA dans les LB thymiques confirme l’implication des LB thymiques dans la sélection négative, via l’existence d’interactions complexes entre des LB thymiques possédant un caractère tolérogène et les thymocytes SP autoréactifs. Ce qui rend d’avantage complexe le processus de tolérance centrale (Figure 3). Régulation de la genèse des lymphocytes T régulateurs La genèse des lymphocytes T régulateurs (Treg), indispensables au maintien de l’homéostasie lymphocytaire, trouve son origine dans la médulla thymique où le dialogue avec les APC, via l’interaction TCR-CMH, joue un rôle crucial dans le façonnage de leur répertoire. Contrairement à la sélection des autres LT, la déviation clonale, permettant le développement de Treg, nécessite une interaction d’affinité intermédiaire entre TCR et CMH, une affinité trop élevée aboutissant à leur délétion. La présentation par les mTEC d’autoantigènes tissulaires, régulée par AIRE, est cruciale dans le processus de sélection des Treg [ 4]. Chez la souris, le nombre de Treg est corrélé au nombre de LB thymiques. Il est diminué chez les souris qui n’expriment pas CD19 (CD19KO) ; il augmente dans les modèles de souris transgéniques exprimant BAFF (B-cell activating factor) et chez les souris CD19KO après un transfert de LB thymiques [29, 34]. En l’absence de CMH-II sur les LB thymiques, ou d’un répertoire de BCR intact, une réduction du nombre de lymphocytes Treg thymiques est observée dans des modèles murins. Les LB thymiques peuvent donc induire une prolifération de Treg dépendante du CMH-II (via une présentation antigénique), et participer au processus de tolérance lymphocytaire T en régulant la genèse de ces lymphocytes régulateurs (Figure 3) [34, 35]. |
Protection de l’intégrité du thymus Le thymus a longtemps été considéré comme un site « immuno-privilégié », mais il peut être la cible de divers agents pathogènes susceptibles de perturber la lymphopoïèse T. Des infections fongiques, bactériennes ou virales peuvent entraîner une atrophie thymique, avec une déplétion lymphocytaire intense. La sélection négative des LT étant liée aux antigènes présentés dans le thymus, l’infection de cet organe pourrait, en théorie, conduire à une tolérance envers les pathogènes qui l’infectent. Ainsi, dans plusieurs modèles animaux, des infections virales et bactériennes influencent la sélection positive et négative. Chez l’homme, le virus de la rougeole peut être potentiellement délétère pour le thymus en infectant les cTEC et en perturbant leur fonction dans la tolérance [36, 37]. Les LB thymiques incluent une population plasmocytaire jusqu’à présent non caractérisée. Nuñez et al. ont en effet montré que des plasmocytes capables de produire de façon constitutive des IgG reconnaissant des particules virales étaient présents dans les espaces périvasculaires dès la première année de vie. Ces plasmocytes qui ne sécrétent que des IgG1 et des IgG3, pourraient offrir une protection thymique contre les infections. Par leur localisation, à l’interface entre circulation et épithélium thymique, ces LB pourraient protéger le thymus contre les pathogènes, tout au long de la vie [16]. |
Implication des lymphocytes B thymiques en pathologie Bien qu’à l’heure actuelle aucun lien direct n’ait pu être établi, certains éléments suggèrent un rôle des LB thymiques en pathologie. L’absence ou l’augmentation des LB thymiques pourrait en effet avoir des conséquences cliniques. Ainsi, un déficit de LB thymiques, sans lymphopénie B périphérique, est observé dans un modèle animal de diabète de type I [38]. Contrairement à la situation physiologique où le thymus ne comporte qu’une discrète population de LB, une expansion des LB thymiques a été notée, chez l’homme, dans certaines pathologies auto-immunes comme le lupus érythémateux disséminé [39] et la myasthénie [40, 41]. En effet, de nombreux centres germinatifs, sites d’activation B intense, et une augmentation très importante du nombre des LB thymiques et de plasmocytes sécrétant, entre autres, des autoanticorps anti-récepteur de l’acétylcholine, sont observés dans le thymus des patients myasthéniques [40, 41]. Ces données indiquent que la rupture de tolérance chez ces patients pourrait trouver, en partie, son origine dans les LB thymiques [42]. En oncologie médicale, les LB thymiques mémoires sont considérés comme étant à l’origine du lymphome médiastinal primitif à grandes cellules B. Initialement décrit en 1980, il constitue jusqu’à 10 % des lymphomes diffus à grandes cellules B [43]. Des manifestations auto-immunes sont observées dans 15 à 20 % des déficits immunitaires primitifs humoraux. Au vu du rôle des LB thymiques dans le maintien de la tolérance T, il est ainsi possible d’envisager que, dans certains cas, la tolérance centrale T reposant sur les LB thymiques puisse être atteinte. La polyendocrinopathie auto-immune de type 1 (APS-1), ou syndrome APECED7, est liée à une expression anormale de TRA, conséquence d’une mutation du gène codant la protéine AIRE [44] (→).
(→) Voir la Synthèse de N. Dragin et al., m/s n° 2, février 2017, page 169
Ce syndrome se traduit par une candidose cutanéo-muqueuse chronique, une hypoparathyroïdie et une insuffisance surrénale d’origine auto-immune, avec parfois un diabète de type I. Étant donnée l’existence d’une population de LB thymiques exprimant AIRE, il est possible que l’absence d’expression de la protéine dans ces LB intrathymiques participe à la pathogénie des APECED. L’analyse transcriptomique que nous avons effectuée révèle une transcription plus élevée d’AIRE et de TRA par les LB naïfs thymiques que par les LB naïfs périphériques [6]. Certains de ces TRA sont en particulier associés à des pathologies auto-immunes, comme ICA1 (islet cell autoantigen 1, dans le diabète de type I), LAD1 (leukocyte adhesion deficiency-1, dans la dermatose à IgA linéaire), ACHE et AKAP12 (anticholinesterase, A-kinase anchoring protein 12, dans la myasténie), SCG2 (secretogranin 2, dans l’hypophysite autoimmune), ou encore FBN1 (fibrillin 1, dans la sclérodermie systémique) [6]. |
Les LB thymiques ne sont donc pas de simples spectateurs de la lymphopoïèse T, mais des cellules activées avec un phénotype d’APC qui sont capables de façonner le répertoire T. Leurs propriétés uniques soulèvent de nombreuses questions, aussi bien biologiques que cliniques. Mais leurs caractérisations s’avèrent complexes au regard du faible nombre de cellules concernées et de la difficulté d’accessibilité du thymus, chez l’homme. Même si l’impact biologique sur le compartiment T est avéré, les rares études publiées ne montrent pas de conséquences cliniques évidentes de la thymectomie, qui reste couramment effectuée dans le cadre d’interventions pour des malformations cardiaques congénitales par exemple [45] (→).
(→) Voir la Nouvelle de D. Sauce et V. Appay, m/s n° 4, avril 2010, page 347
Cette absence d’effet ainsi que l’involution naturelle de l’organe avec l’âge, suggèrent un rôle prépondérant du thymus dans la mise en place d’un système immunitaire tolérant durant la période prénatale/embryonnaire. L’étude des conséquences d’une perturbation des LB thymiques dans les stades prénataux présente des problèmes techniques significatifs. Elle nécessitera une approche combinée entre analyse chez l’homme et modèles animaux afin de pouvoir intégrer définitivement les LB thymiques dans des processus physiologiques et pathologiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Isaacson PG, Norton AJ, Addis BJ. The human thymus contains a novel population of B lymphocytes . Lancet. 1987; ; 2 : :1488.–1491. 2.
Spencer J, Choy M, Hussell T, et al. Properties of human thymic B cells . Immunology. 1992; ; 75 : :596.–600. 3.
Fend F, Nachbaur D, Oberwasserlechner F, et al. Phenotype and topography of human thymic B cells. An immunohistologic study . Virchows Arch B Cell Pathol Incl Mol Pathol. 1991; ; 60 : :381.–388. 4.
Klein L, Kyewski B, Allen PM, et al. Positive and negative selection of the T cell repertoire: what thymocytes see (and don’t see) . Nat Rev Immunol. 2014; ; 14 : :377.–391. 5.
Dunn-Walters DK, Howe CJ, Isaacson PG, et al. Location and sequence of rearranged immunoglobulin genes in human thymus . Eur J Immunol. 1995; ; 25 : :513.–519. 6.
Gies V, Guffroy A, Danion F, et al. B cells differentiate in human thymus and express AIRE . J Allergy Clin Immunol. 2017; ; 139 : :1049.–52.e12. 7.
Akashi K, Richie LI, Miyamoto T, et al. B lymphopoiesis in the thymus . J Immunol. 2000; ; 164 : :5221.–5226. 8.
Sugihara A, Inaba M, Mori SI, et al. Differentiation from thymic B cell progenitors to mature B cells in vitro . Immunobiology. 2000; ; 201 : :515.–526. 9.
Weerkamp F, de Haas EFE, Naber BAE, et al. Age-related changes in the cellular composition of the thymus in children . J Allergy Clin Immunol. 2005; ; 115 : :834.–840. 10.
Perera J, Meng L, Meng F, et al. Autoreactive thymic B cells are efficient antigen-presenting cells of cognate self-antigens for T cell negative selection . Proc Natl Acad Sci USA. 2013; ; 110 : :17011.–17016. 11.
Nango K-I, Inaba M, Inaba K, et al. Ontogeny of thymic B cells in normal mice . Cell Immunol. 1991; ; 133 : :109.–115. 12.
Luc S, Luis TC, Boukarabila H, et al. The earliest thymic T cell progenitors sustain B cell and myeloid lineage potential . Nat Immunol. 2012; ; 13 : :412.–419. 13.
Mori S, Inaba M, Sugihara A, et al. Presence of B cell progenitors in the thymus . J Immunol. 1997; ; 158 : :4193.–4199. 14.
Lopez VM, Ezine S. L’épithélium thymique, un passé dans la dualité et un présent unifié . Med Sci (Paris). 2015; ; 31 : :591.–593. 15.
Hashimoto Y, Montecino-Rodriguez E, Leathers H, et al. B-cell development in the thymus is limited by inhibitory signals from the thymic microenvironment . Blood. 2002; ; 100 : :3504.–3511. 16.
Nuñez S, Moore C, Gao B, et al. The human thymus perivascular space is a functional niche for viral-specific plasma cells . Sci Immunol. 2016;; 1 : :eaah4447.. 17.
Perera J, Zheng Z, Li S, et al. Self-antigen-driven thymic B cell class switching promotes T cell central tolerance . Cell Rep. 2016; ; 17 : :387.–398. 18.
McAleer J, Weber P, Sun J, et al. Antibody repertoire development in fetal and neonatal piglets. XI. The thymic B-cell repertoire develops independently from that in blood and mesenteric lymph nodes . Immunology. 2005;; 114 : :171.–183. 19.
Tonnelle C, D’Ercole C, Depraetere V, et al. Human thymic B cells largely overexpress the VH4 Ig gene family. A possible role in the control of tolerance in situ? . Int Immunol. 1997; ; 9 : :407.–414. 20.
Ferrero I, Anjuère F, Martín P, et al. Functional and phenotypic analysis of thymic B cells: role in the induction of T cell negative selection . Eur J Immunol. 1999; ; 29 : :1598.–1609. 21.
Yamano T, Nedjic J, Hinterberger M, et al. Thymic B cells are licensed to present self antigens for central t cell tolerance induction . Immunity. 2015; ; 42 : :1048.–1061. 22.
Inaba M, Inaba K, Adachi Y, et al. Functional analyses of thymic CD5+ B cells: responsiveness to major histocompatibility complex class II−restricted T blasts but not to lipopolysaccharide or anti-IgM plus interleukin 4 . J Exp Med. 1990; ; 171 : :321.–326. 23.
Inaba M, Inaba K, Fukuba Y, et al. Activation of thymic B cells by signals of CD40 molecules plus interleukin-10 . Eur J Immunol. 1995; ; 25 : :1244.–1248. 24.
Akirav EM, Xu Y, Ruddle NH. Resident B cells regulate thymic expression of myelin oligodendrocyte glycoprotein . J Neuroimmunol. 2011; ; 235 : :33.–39. 25.
Fujihara C, Williams JA, Watanabe M, et al. T cell-B cell thymic cross-talk: maintenance and function of thymic B cells requires cognate CD40-CD40 ligand interaction . J Immunol. 2014; ; 193 : :5534.–5544. 26.
Gary-Gouy H, Harriague J, Bismuth G, et al. Human CD5 promotes B-cell survival through stimulation of autocrine IL-10 production . Blood. 2002; ; 100 : :4537.–4543. 27.
Hardy RR. B-1 B cell development . J Immunol. 2006; ; 177 : :2749.–2754. 28.
Wortis HH, Teutsch M, Higer M, et al. B-cell activation by crosslinking of surface IgM or ligation of CD40 involves alternative signal pathways and results in different B-cell phenotypes . Proc Natl Acad Sci USA. 1995; ; 92 : :3348.–3352. 29.
Xing C, Ma N, Xiao H, et al. Critical role for thymic CD19+CD5+CD1dhiIL-10+ regulatory B cells in immune homeostasis . J Leukoc Biol. 2015; ; 97 : :547.–556. 30.
Rother MB, Schreurs MWJ, Kroek R, et al. The human thymus is enriched for autoreactive B cells . J Immunol. 2016; ; 1501992 : 31.
Martin SW, Goodnow CC. Burst-enhancing role of the IgG membrane tail as a molecular determinant of memory . Nat Immunol. 2002; ; 3 : :182.–188. 32.
Nussenzweig MC. Immune responses: Tails to teach a B cell . Curr Biol. 1997; ; 7 : :R355.–R357. 33.
Lopes N, Ferrier P, Irla M. Induction de la tolérance centrale dans le thymus par le facteur de transcription Aire . Med Sci (Paris). 2015; ; 31 : :742.–747. 34.
Walters SN, Webster KE, Daley S, et al. A role for intrathymic B cells in the generation of natural regulatory T cells . J Immunol. 2014; ; 193 : :170.–176. 35.
Lu FT, Yang W, Wang YH, et al. Thymic B cells promote thymus-derived regulatory T cell development and proliferation . J Autoimmun. 2015; ; 61 : :62.–72. 36.
Savino W. The thymus is a common target organ in infectious diseases . PLoS Pathog. 2006; ; 2 : :e62.. 37.
Nunes-Alves C, Nobrega C, Behar SM, et al. Tolerance has its limits: how the thymus copes with infection . Trends Immunol. 2013; ; 34 : :502.–510. 38.
Tullin S, Farris P, Petersen JS, et al. A pronounced thymic B cell deficiency in the spontaneously diabetic BB rat . J Immunol. 1997; ; 158 : :5554.–5559. 39.
Mackay IR, Masel M, Burnet FM. Thymic abnormality in systemic lupus erythematosus . Australas Ann Med. 1964; ; 13 : :5.–14. 40.
Leprince C, Cohen-Kaminsky S, Berrih-Aknin S, et al. Thymic B cells from myasthenia gravis patients are activated B cells . Phenotypic and functional analysis. J Immunol. 1990; ; 145 : :2115.–2122. 41.
Christensson B, Biberfeld P, Matell G. B-cell compartment in the thymus of patients with myasthenia gravis and control subjects . Ann NY Acad Sci. 1988; ; 540 : :293.–297. 42.
Vrolix K, Fraussen J, Losen M, et al. Clonal heterogeneity of thymic B cells from early-onset myasthenia gravis patients with antibodies against the acetylcholine receptor . J Autoimmun. 2014; ; 52 : :101.–112. 43.
Bergkvist KS, Nørgaard MA, Bøgsted M, et al. Characterization of memory B cells from thymus and its impact for DLBCL classification . Exp Hematol. 2016; ; 44 : :982.–90.e11. 44.
Dragin N, Panse RL, Berrih-Aknin S. Prédisposition aux pathologies auto-immmunes : les hommes ne manquent pas « d’Aire » . Med Sci (Paris). 2017; ; 33 : :169.–175. 45.
Sauce D, Appay V. Thymectomie et infection virale chez l’homme : arguments pour un rôle du thymus à l’âge adulte . Med Sci (Paris). 2010; ; 26 : :347.–349. 46.
Geenen V. Histoire du thymus : d’un organe vestigial à la programmation de la tolérance immunitaire . Med Sci (Paris). 2017; ; 33 : :653.–663. |