Une forme d’infection virale, tout à fait originale chez les herpesvirus humains, a été mise en évidence pour le HHV-6 [1]. Elle avait initialement été découverte, dans les années 1990, par Luppi et al., chez des sujets atteints de syndromes lymphoprolifératifs ou de sclérose en plaque. L’ensemble du génome viral est alors intégré dans le génome humain, plus précisément dans la région subtélomérique de l’un des chromosomes, dans toutes les cellules de l’organisme, y compris les gamètes (Figure 1) [3, 4]. Le mécanisme d’intégration fait intervenir une recombinaison homologue entre les séquences répétées terminales génomiques virales et celles des télomères humains qui leur sont homologues : la séquence (GGGTTA)n, n allant de 5 à 83 sur le génome viral, et de 1167 à 1667 sur le génome humain [7]. Wallaschek et al. [5] ont montré que ces répétitions télomériques virales étaient nécessaires pour une intégration efficace du génome viral dans l’ADN chromosomique. La protéine codée par le gène U94 du virus constituerait une intégrase potentielle : elle est en effet homologue de la protéine Rep78/68 de l’adeno-associated parvovirus (AAV) qui est essentielle à l’intégration du matériel génétique de l’AAV dans l’ADN chromosomique [6] (→).
(→) Voir la Synthèse de A. Rossi et A. Salvetti, m/s n° 2, février 2016, page 167
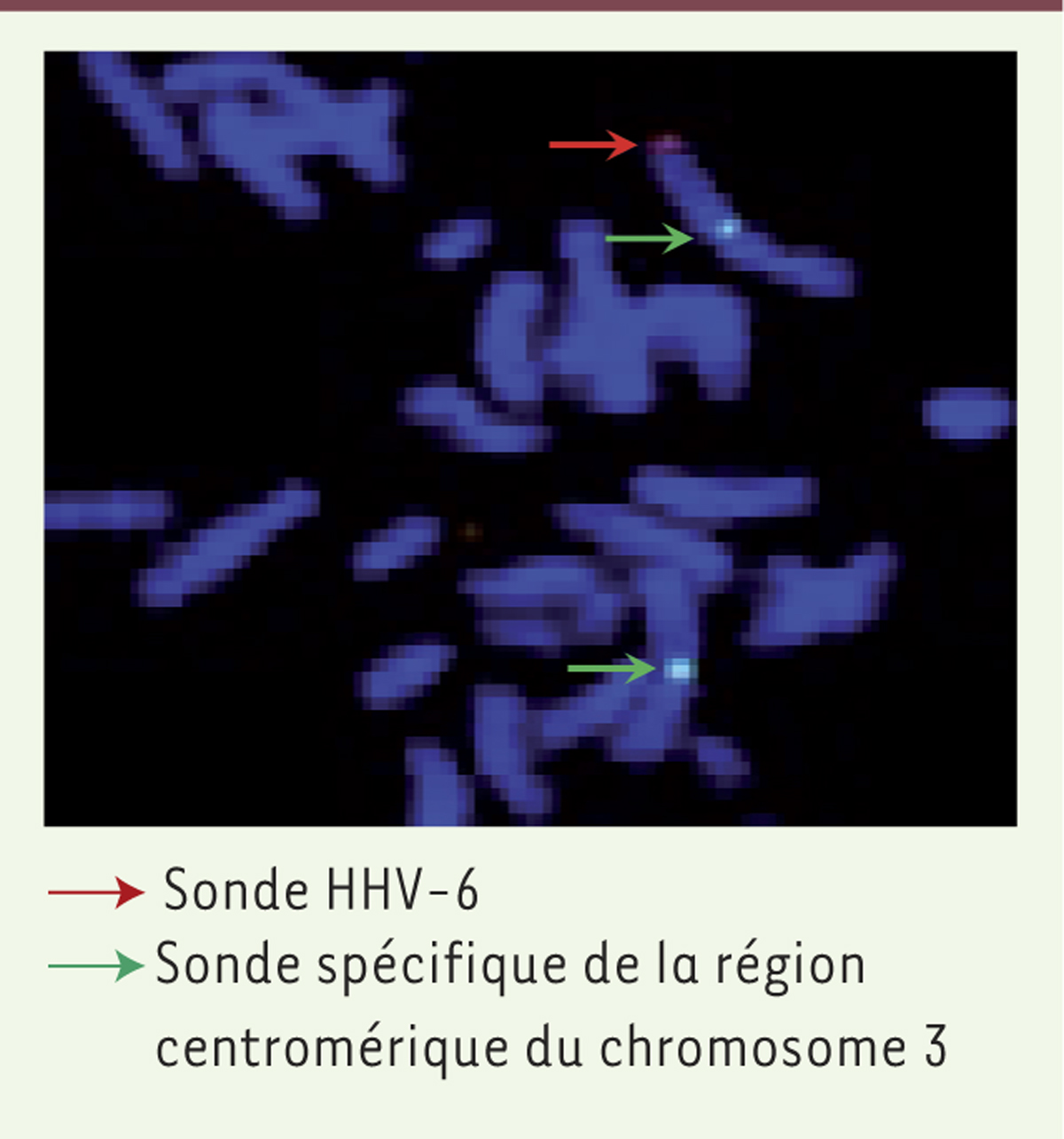
 | Figure 1.
Détection du génome du HHV-6 intégré au génome humain par hybridation in situ en fluorescence. Flèche rouge : sonde HHV-6 ; flèche verte : sonde spécifique de la région centromérique du chromosome 3. |
La protéine U94 contient d’une part, des domaines liant l’ADN et, d’autre part, des domaines à activités endonucléase, hélicase et ATPase, pouvant intervenir dans l’intégration du HHV-6 [7]. Cependant, pour l’AAV, l’intégration se réalise sur un site précis, alors que pour le HHV-6, elle se fait par recombinaison homologue au niveau des séquences télomériques humaines [6].
L’iciHHV-6, qui concerne les deux espèces HHV-6A et HHV-6B, est observé chez 0,2 à 1 % de la population générale des pays développés [1,3]. Il se transmet du parent qui en est porteur, à l’enfant, sur un mode mendélien. D’où le nom actuellement proposé pour cette forme : inherited chromosomally integrated HHV-6, iciHHV-6 [7]. Selon les sujets, les études et les pays, plusieurs chromosomes sont la cible d’une intégration, dont les chromosomes 1, 3, 9, 10, 11, 17, 18, 19 et 22 [3] (et données personnelles). Pour un même sujet, l’intégration s’effectue dans un seul chromosome. La présence de formes intégrées sur deux chromosomes différents chez un même sujet n’a en effet été décrite qu’une seule fois et, compte tenu de la prévalence de l’iciHHV-6, devrait survenir avec une fréquence d’1/10 000 [1].
En dehors de la transmission verticale, l’iciHHV-6 peut également être transmis lors d’une greffe de cellules souches hématopoïétiques lorsque le donneur en est porteur. Après reconstitution de la moelle osseuse, l’ensemble des cellules hématopoïétiques du receveur présentent l’iciHHV-6, ce qui entraîne une charge virale très élevée, supérieure à 1 copie de génome viral par cellule [1].
L’iciHHV-6 soulève de nombreuses questions en termes de lien avec des pathologies, de possibilité de reprise de l’infection active, et pose des problèmes lors du diagnostic et du suivi de l’infection, en particulier chez les patients immunodéprimés [1]. À ce jour, l’iciHHV-6 ne semble pas avoir d’impact majeur sur le développement des enfants qui en sont porteurs et une grande étude canadienne a mis en évidence que la seule pathologie associée à cette forme intégrée est l’angor (angine de poitrine) [8, 9]. Par ailleurs, Hill et al. ont récemment mis en évidence le fait que les patients greffés de cellules souches hématopoïétiques porteurs d’iciHHV-6 avaient deux fois plus de risque de développer une maladie du greffon contre l’hôte aiguë (acute GvHd), et trois fois plus de risque de réactiver le CMV avec une forte virémie [10].
A priori, aucune pathologie marquée par une prolifération cellulaire n’y serait associée. La possibilité d’une réactivation de l’iciHHV-6, avec production de particules virales infectieuses, a cependant été décrite par deux équipes [11, 12]. Gravel et al. ont observé que des femmes enceintes porteuses d’iciHHV-6 pouvaient transmettre à leur fœtus des particules virales dont la séquence génomique était identique à celle de leur forme intégrée [9]. Après réactivation de la multiplication virale, des particules peuvent donc traverser la barrière placentaire et infecter le fœtus. Cette réactivation in vivo a également été démontrée par Endo et al., chez un nourrisson de 2 mois atteint d’un syndrome de déficit immunitaire combiné sévère [12]. Cet enfant, porteur d’un virus iciHHV-6 provenant de son père, présentait de la fièvre, une toux, une diarrhée et un syndrome hémophagocytaire. Du virus réplicatif, dont la séquence génomique était identique à celle de la forme parentale intégrée (analyses réalisées chez l’enfant et son père), était présent dans le sang. La réactivation d’iciHHV-6 chez l’enfant était à l’origine de sa symptomatologie.
Le diagnostic formel de présence d’iciHHV-6 est réalisé par la détection ou la quantification du génome du HHV-6 dans les follicules pileux ou les ongles. Une charge sanguine très élevée supérieure à 106 copies de génome viral par million de cellules ou par millilitre de sang sur plusieurs prélèvements séquentiels est également un argument fort [1]. À ce jour, il n’existe aucune recommandation de traitement pour prévenir la réactivation de l’iciHHV-6 chez des patients sous traitement immunosuppresseur.
En conclusion, la forme intégrée iciHHV-6 est un phénomène tout à fait original chez les herpesvirus qui est observé chez 1 % de la population générale, sans retentissement majeur sur le développement chez l’enfant, mais qui est associée à l’angine de poitrine. Les questions que HHV-6 soulève ici vont nécessiter de nombreuses années d’études avant d’être résolues.