| |
| Med Sci (Paris). 33(8-9): 714–716. doi: 10.1051/medsci/20173308009.Nouvelles fonctions d’une protéine liant l’ADN méthylé dans le cancer Ikrame Naciri,1 Audrey Roussel-Gervais,1,2 Pierre-Antoine Defossez,1 and Olivier Kirsh1* 1Équipe « Dynamique de la méthylation de l’ADN des génomes eucaryotes », Centre épigénétique et destin cellulaire, UMR7216 CNRS, université Paris Diderot, université Sorbonne Paris Cité (USPC), 35, rue Hélène Brion, 75205Paris Cedex 13, France 2Département de pathologie et immunologie, centre médical universitaire, université de Genève, Genève, Suisse |
La perte de la protéine ZBTB4 est un marqueur de stade avancé de cancer ZBTB4 (Zinc finger and BTB domain containing 4) est un membre de la famille des protéines MBP (methyl binding protein) qui interagissent de manière préférentielle avec l’ADN méthylé [1]. Ces protéines sont considérées comme des effecteurs biologiques potentiels de la méthylation de l’ADN [2, 3]. Des analyses du transcriptome des cancers du sein, de la prostate, du poumon et de neuroblastomes, montrent que la protéine ZBTB4 est sous-exprimée dans les tumeurs, en comparaison des tissus sains. Cliniquement, une relation inverse nette a été observée entre le niveau d’expression de ZBTB4 et le grade (ou gravité) de la tumeur d’une part, et le taux de survie des patients, d’autre part [4, 5]. On observe également un fort taux d’aneuploïdie dans les tumeurs qui expriment peu ou pas la protéine ZBTB4 [6]. La perte d’expression de ZBTB4 constitue-t-elle un évènement déterminant de la transformation tumorale ? Ou est-elle la simple conséquence d’un processus adaptatif des cellules tumorales ? Afin de répondre à ces questions, nous avons généré des cellules humaines et murines dont le gène codant la protéine ZBTB4 a été invalidé. |
Les souris Zbtb4 -/- sont plus sensibles à la transformation tumorale Les souris mutantes homozygotes pour le gène Zbtb4 (Zbtb4-/-) sont viables, fertiles, et ne présentent pas de tumeurs spontanées. La perte d’expression de ZBTB4 n’est donc pas promotrice de la cancérogénèse mais peut-être confère-t-elle une plus grande susceptibilité à la transformation et à la progression tumorale ? Pour tester cette hypothèse, nous avons réalisé un protocole de carcinogenèse cutanée en deux étapes. Le traitement des souris au TPA/DMBA1 provoque deux fois plus de tumeurs chez les souris Zbtb4-/-
que chez les souris sauvages et le temps de latence d’apparition des tumeurs est réduit chez les premières. Cette sensibilité accrue à l’apparition de papillomes confirme donc que, au moins dans la peau, la perte de la protéine ZBTB4 est un évènement important du processus de tumorigénèse. |
L’inactivation de Zbtb4 provoque des anomalies chromosomiques Nous avons parallèlement réalisé des analyses cytogénétiques sur des fibroblastes embryonnaires (MEF) isolés à partir de souris sauvages ou de souris Zbtb4 -/-
, ainsi que sur des cellules de lignées cancéreuses humaines dans lesquelles l’expression de ZBTB4 a été inhibée par ARN interférence (RNAi). Ces cellules, qui n’expriment plus la protéine ZBTB4, présentent une fréquence accrue de cellules binucléées, de micronoyaux et de ponts chromosomiques. Ces phénotypes trahissent une plus grande instabilité génomique des cellules dépourvues de la protéine ZBTB4. L’utilisation de sondes ADN dirigées contre les chromosomes 12 et X, dans des cellules MEF immortalisées (appelées iMEF) femelles, montre également une aneuploïdie plus importante dans les cellules iMEF provenant de souris Zbtb4-/-. Ces résultats sont cohérents avec l’aneuploïdie que l’on observe dans les tumeurs humaines, mais également in vivo chez les souris Zbtb4-/-
. L’instabilité génomique provoquée par la perte de ZBTB4 pourrait donc être à l’origine de l’aneuploïdie et favoriser la tumorigénèse [7]. |
Les cellules invalidées pour Zbtb4 ont un point de contrôle mitotique altéré Nous avons exploré le transcriptome des cellules sauvages ou n’exprimant plus Zbtb4, afin d’identifier le programme transcriptionnel qui serait sous le contrôle de ce facteur de transcription. La signature moléculaire et les gènes exprimés différemment entre les deux types de cellules, comme ceux codant la kinase BUBR1 (mitotic checkpoint serine/threonine-protein kinase) et la phosphatase CDC25c (cell division cycle 25C), nous ont alors mis sur la piste de facteurs impliqués dans le point de contrôle de l’assemblage du fuseau mitotique, ou SAC (spindle assembly checkpoint). Une anomalie de ce point de contrôle peut entraîner l’apparition de cellules binucléées et de micro-noyaux comme nous l’observons dans les cellules dépourvues de ZBTB4. L’analyse du cycle cellulaire des cellules, par cytométrie de flux, indique une réduction du nombre de cellules en phase G2/M quand l’expression de ZBTB4 est réduite par ARN interférence ; la diminution de la durée de la métaphase est confirmée par vidéomicroscopie. Le point de contrôle du SAC est précisément activé pendant la métaphase. Il retarde normalement le déclenchement de l’anaphase tant que tous les chromosomes ne sont pas correctement alignés sur la plaque métaphasique. Sa robustesse peut être évaluée par l’abondance des protéines des kinétochores2 comme la kinase BUBR1 et la protéine MAD2L1 (mitotic arrest deficient 2 like 1) [8]. Les cellules dépourvues de ZBTB4 présentent moins de protéines BUBR1 et MAD2L1, quelques heures après l’arrêt du traitement par une drogue permettant d’activer le point de contrôle, telle que le nocodazole3, ainsi qu’une diminution rapide de cycline B1. La cycline B1 est une marque de l’inactivation du point du contrôle du fuseau et de la progression du cycle cellulaire ; sa diminution dans les cellules dépourvues de ZBTB4 indique donc l’extinction de ce signal. |
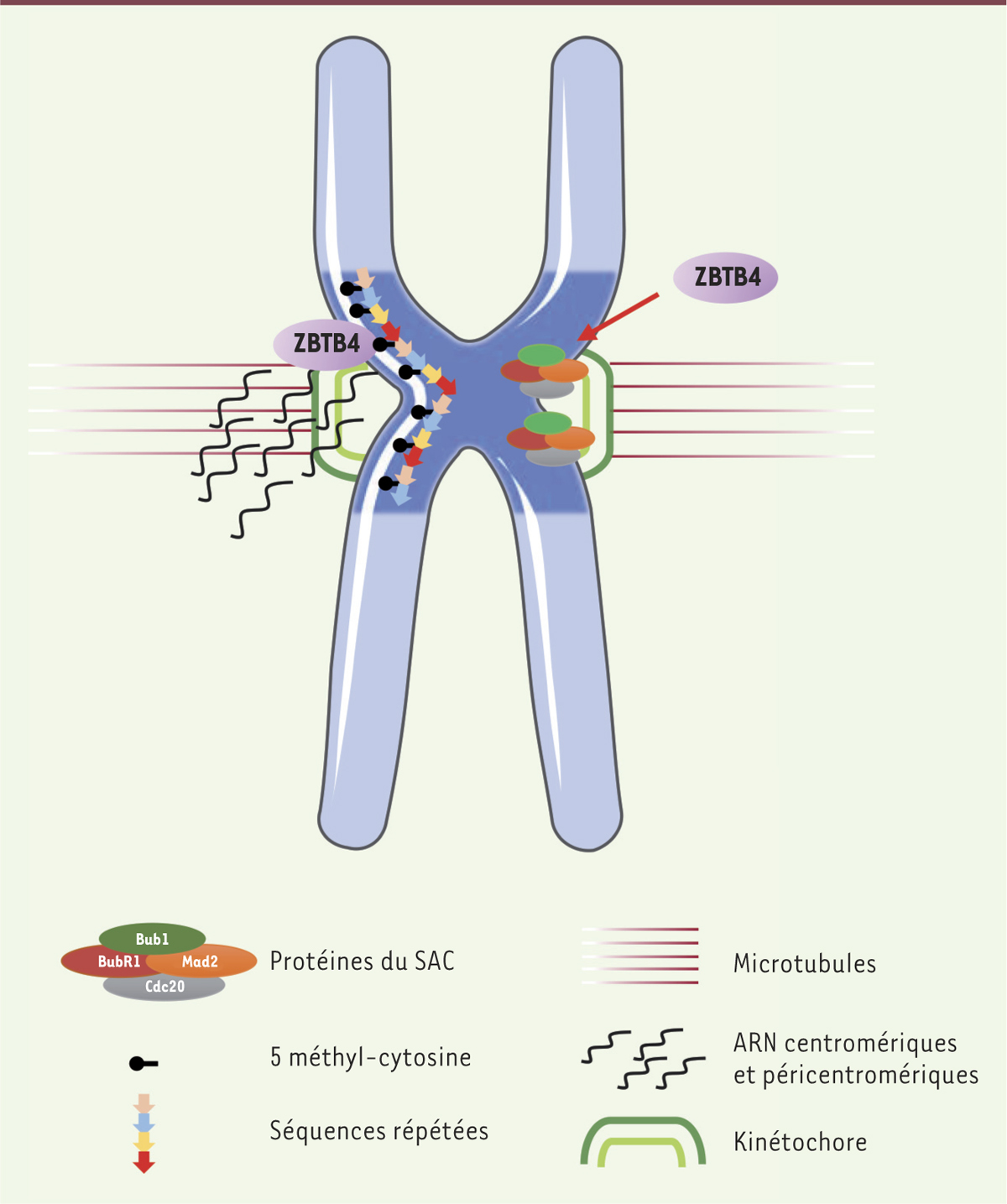
Conclusion : ZBTB4 un « maître régulateur » de la mitose et de l’aneuploïdie ? L’ensemble de nos résultats montre que ZBTB4 joue un rôle important dans le maintien de la stabilité génomique chez l’homme et la souris. Mais s’agit-il de la seule protéine de la famille des MBP impliquée dans ce processus ? L’exploration des bases de données génomiques indique que les tumeurs qui expriment faiblement ZBTB4 présentent des altérations chromosomiques. La même analyse, effectuée pour d’autres membres de la famille des MBP, par exemple le gène Kaiso, ne confirme pas cette caractéristique. Lors de la mitose, ZBTB4 pourrait avoir un double rôle de gardien du génome, en contrôlant directement l’expression des gènes clef du point de contrôle du fuseau, tout en régulant la transcription des régions centromériques et péricentromériques (Figure 1). Les expériences de ChIP-seq4 n’ont cependant pas permis de vérifier la première hypothèse. Dans des tests d’immunofluorescence, la protéine ZBTB4 est détectée sur les centromères, et sa disparition entraîne une diminution de la transcription de ces régions lors de la mitose. L’altération des profils de méthylation est une des caractéristiques des cellules cancéreuses [9] (→).
(→) Voir la Nouvelle de M. Weber, m/s n° 8-9, août-septembre 2008, page 731
 | Figure 1.
Modèle des fonctions centromériques de ZBTB4. 1. ZBTB4 interagit avec l’ADN méthylé des régions péricentromériques et centromériques et contrôle l’expression des séquences répétées. 2. ZBTB4 contrôle également l’expression et/ou la stabilité des protéines du point de contrôle du fuseau (spindle assembly checkpoint, SAC). |
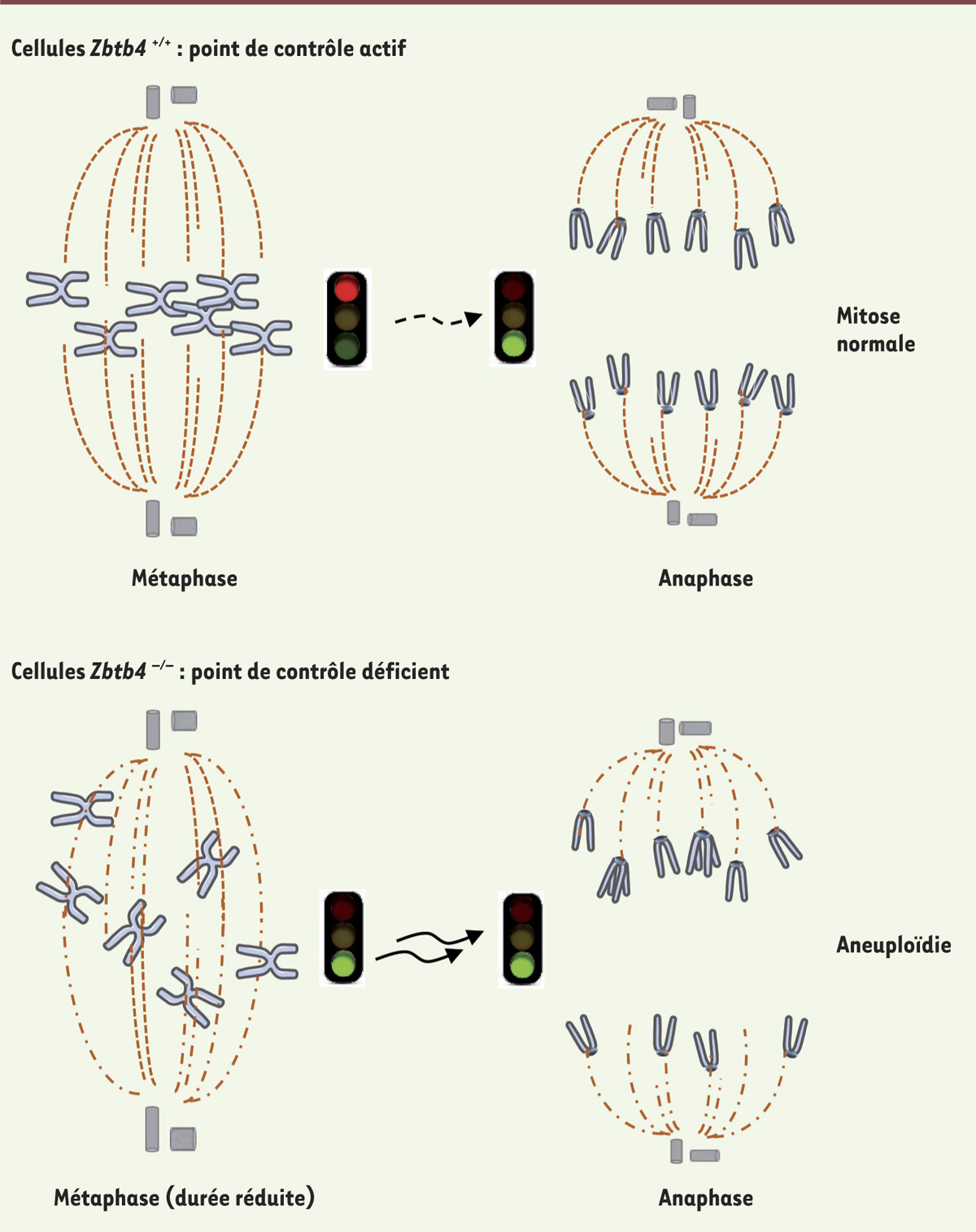
La transcription des régions centromériques lors de la mitose est également importante pour la stabilité génomique [10]. Toutefois, le lien entre l’activité de ZBTB4 lors de la mitose et son affinité pour l’ADN méthylé n’a pas été démontré. La perte de ZBTB4 pourrait jouer un rôle important dans les étapes précoces de la transformation tumorale en favorisant l’instabilité génomique, l’aneuploïdie (Figure 2), et en conférant aux cellules, une plasticité phénotypique propice à l’émergence de cellules cancéreuses.
 | Figure 2.
Conséquence de la perte de ZBTB4 lors de la mitose. Les cellules Zbtb4-/-
ont un point de contrôle d’assemblage du fuseau mitotique (SAC) moins efficace que les cellules contrôles. La ségrégation des chromosomes est alors inégale, entraîne une aneuploïdie et favorise la tumorigenèse. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Filion GJP, Zhenilo S, Salozhin S, et al. A family of human zinc finger proteins that bind methylated DNA and repress transcription . Mol Cell Biol. 2006; ; 26 : :169.. 2.
Sasai N, Defossez PA. Many paths to one goal? The proteins that recognize methylated DNA in eukaryotes . Int J Dev Biol. 2009; ; 53 : :323.–334. 3.
Fournier A, Sasai N, Nakao M, et al. The role of methyl-binding proteins in chromatin organization and epigenome maintenance . Brief Funct Genomics. 2012; ; 11 : :251.–264. 4.
Weber A, Marquardt J, Elzi D, et al. Zbtb4 represses transcription of P21CIP1 and controls the cellular response to p53 activation . EMBO J. 2008; ; 27 : :1563.–1574. 5.
Kim K, Chadalapaka G, Lee SO, et al. Identification of oncogenic microRNA-17-92/ZBTB4/ specificity protein axis in breast cancer . Oncogene. 2012; ; 31 : :1034.–1044. 6.
Roussel-Gervais A, Naciri I, Kirsh O, et al. Loss of the methyl-CpG–binding protein ZBTB4 alters mitotic checkpoint, increases aneuploidy, and promotes tumorigenesis . Cancer Res. 2017; ; 77 : :62.–73. 7.
Holland AJ, Cleveland DW. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis . Nat Rev Mol Cell Biol. 2009; ; 10 : :478.–487. 8.
Gascoigne KE, Taylor SS. How do anti-mitotic drugs kill cancer cells? . J Cell Sci. 2009; ; 122 : :2579.–2585. 9.
Weber M. Profils de méthylation de l’ADN dans les cellules normales et cancéreuses . Med Sci (Paris). 2008; ; 24 : :731.–734. 10.
Hall LE, Mitchell SE, O’Neill RJ. Pericentric and centromeric transcription: a perfect balance required . Chromosome Res. 2012; ; 20 : :535.–546. |