| |
| Med Sci (Paris). 33: 16–26. doi: 10.1051/medsci/201733s104.Pathologies musculaires liées à la titine Un domaine en émergence Ana Ferreiro1,2* and J. Andoni Urtizberea3 1Pathophysiology of Striated Muscles laboratory, Unit of Functional and Adaptive Biology, BFA, University Paris Diderot/CNRS, Sorbonne Paris Cité, Paris, France 2AP-HP, Centre de Référence Maladies Neuromusculaires Paris-Est, Groupe Hospitalier Pitié-Salpêtrière, 75013, Paris, France 3Centre de compétence neuromusculaire Filnemus/Hôpital Marin, Hendaye, France |
Vignette (Titin-crystallographic structure, © Wikimedia). Les titinopathies sont des maladies rares, d’origine génétique, qui se transmettent selon un mode autosomique dominant ou autosomique récessif. Elles sont dues à la présence d’une ou plusieurs anomalies (mutations) du gène TTN codant une protéine musculaire de très grande taille, la titine. De description récente dans la littérature médicale, ce groupe de maladies concerne un nombre grandissant de patients. Les nouvelles techniques de séquençage à haut débit permettent de parvenir à un diagnostic de certitude plus aisément. Ceci concerne aussi bien les adultes que les enfants. Les mécanismes intimes de ces maladies sont cenpendant encore mal connus. Une titinopathie se traduit par une faiblesse musculaire d’expression très variable et plus rarement par une atteinte, concomitante ou non, du cœur. Elle peut aussi donner lieu à une atteinte cardiaque isolée (ce qui sort un peu du cadre de cette mise au point). Les complications respiratoires y sont fréquemment rencontrées alors que d’autres organes que le muscle ne sont pas concernés. |
Si leur prévalence est encore très difficile à estimer, les authentiques titinopathies touchant les muscles squelettiques sont considérées comme des maladies globalement très rares. Cette notion est en train d’évoluer avec la généralisation du séquençage à haut débit (NGS) à visée diagnostique. Celui-ci permet de séquencer rapidement et à moindre coût la quasi-totalité du gène TTN. Le NGS a conduit à une augmentation exponentielle du nombre de variants TTN identifiés et donc du nombre des maladies ou phénotypes en rapport. En 2007, 30 variants TTN seulement avaient été associés de manière formelle à quatre phénotypes (soit des myopathies squelettiques pures, soit des cardiomyopathies). Sept ans plus tard, 127 mutations de TTN étaient associées à au moins dix phénotypes touchant les muscles squelettiques, le myocarde ou bien les deux [1, 2]. Le très grand nombre de variants TTN identifiés à présent, aussi bien dans la population générale que parmi les patients atteints de myopathie, suggère qu’un nombre important de phénotypes et de patients non encore caractérisés relèvent de ce groupe de pathologies. Il n’existe pas encore de registre spécifique de patients atteints de titinopathie, que ce soit au niveau national ou international. Un projet de base de données à l’échelle internationale a été lancé. À ce jour, seules les quelques séries de cas rapportés dans la littérature scientifique servent de base pour une épidémiologie sommaire des titinopathies. En matière de titinopathie, on note quelques particularités ethno-géographiques. En Finlande, par exemple, une mutation fondatrice est à l’origine d’une titinopathie singulière : la dystrophie musculaire tibiale de type Udd (TMD) représente la maladie musculaire la plus fréquente dans cette population, avec une prévalence de 1/5 000 [3]. 500 à 1 000 personnes seraient ainsi concernées. Avec une moindre fréquence, la TMD est aussi présente dans d’autres populations [4, 5]. La myopathie dite d’Edström (à qui l’on préfère désormais l’acronyme HMERF pour désigner la myopathie héréditaire avec insuffisance respiratoire précoce) a été décrite pour la première fois en Suède. Originellement considérée comme très rare et restreinte aux pays scandinaves, cette titinopathie est en fait relativement fréquente et surtout universelle. Des études récentes ont identifié des mutations de TTN à l’origine de HMERF dans au moins 30 familles d’origines différentes [6–12]. Certaines mutations retrouvées dans des cas d’HMERF paraissent plus fréquentes en Espagne ou en Grande-Bretagne. En France, l’inventaire des titinopathies reste à faire. Toutes les régions semblent concernées de manière identique, sans particularité géographique ni pic particulier de fréquence. On notera, pour l’anecdote, que le premier diagnostic de titinopathie a été fait dans une famille originaire du Nord de la France. |
Les mutations du gène TTN sont désormais légion et en rapport avec un groupe important de maladies musculaires squelettiques dont le spectre phénotypique est en pleine expansion. Les titinopathies se situent aux confins de plusieurs groupes de pathologies musculaires comme en témoignent l’extrême variété des présentations cliniques et des lésions histopathologiques observées. On les trouve ainsi impliquées aussi bien dans les myopathies congénitales (myopathies à cores ou myopathies centronucléaires), que dans les myopathies distales, les myopathies des ceintures, les myopathies myofibrillaires, et dans les cardiomyopathies isolées. Dans ce dernier groupe, TTN est actuellement reconnu comme le premier gène responsable de cardiomyopathie dilatée héréditaire [13]. Nous ne traiterons pas ici les titinopathies cardiaques pures, mais uniquement les phénotypes marqués par une atteinte du muscle squelettique avec ou sans cardiomyopathie associée. Cette longue liste n’est pas close tant le gène TTN nous réserve des surprises. À ce jour, au moins onze phénotypes comportant une atteinte musculaire squelettique ont été inclus sous le terme générique de titinopathie (
Tableau I
). La plupart de ces entités sont de description récente. Par conséquent, la classification des titinopathies et de leur spectre phénotypique est encore en évolution. En fonction de l’âge de début des premiers symptômes, on peut les classer en deux grands groupes : (a) les titinopathies débutant après la première décennie de la vie, ou plus tardivement à l’âge adulte ; (b) celles à début congénital ou infantile.
Tableau I.
| Présentation clinique |
Acronyme |
Transmission |
Age de début |
Commentaires |
| Dystrophie musculaire tibiale |
TDM |
AD |
Adulte |
Effet fondateur en Finlande |
|
| Dystrophie musculaire tibiale |
TDM |
AR |
Juvénile |
|
|
| Myopathie des ceintures 2J |
LGMD 2J |
AR |
Enfance ou adolescence |
Association de deux mutations qui, à l’état hétérozygote, provoquent un phénotype AD de type TMD |
|
| Dystrophie musculaire proximale |
|
AR |
Adulte |
Deux familles décrites |
|
| Myopathie héréditaire avec atteinte respiratoire précoce |
HMERF |
AD |
Adulte |
Atteinte respiratoire prédominante associée à une myopathie à début distale. Corps cytoplasmiques fréquents. L’une des mutations serait « semi-dominante » |
|
| Myopathie précoce avec cardiomyopathie létale |
EOMFC |
AR |
Congénital |
Désormais incluse dans les myopathies MmD avec atteinte cardiaque |
|
| Myopathie multi-minicore |
MmD |
AR |
Congénital |
Avec cardiomyopathie infantile ou adulte, ou sans atteinte cardiaque |
|
| Arthrogryposis multiplex congenita |
AMC |
AR |
Anténatal |
Avec ou sans cardiomyopathie |
|
| Myopathie « centronucléaire » |
CNM |
AR |
Congénital |
Les noyaux internalisés coexistent avec d’autres lésions histologiques (minicores) |
|
| Myopathie Emery-Dreifuss like
|
EMD-like |
AR |
Congénital ou infantile (< 10 ans) |
Tableau rétractile. Peut être associé à une atteinte cardiaque |
Phénotypes comportant une atteinte musculaire squelettique inclus sous le terme générique de titinopathie. AD : autosomique dominant ; AR : autosomique récessif. |
Titinopathies à début juvénile ou tardif Pour la plupart, il s’agit de myopathies autosomiques dominantes associées à des mutations hétérozygotes de TTN (TMD, HMERF), mais des phénotypes récessifs (titinopathie distale juvénile [ 14], titinopathie de type Emery-Dreifuss [ 15], deux familles avec titinopathie proximale à début adulte [ 16] ont été rapportés récemment. Les patients décrits jusqu’à présent ne présentent pas d’atteinte cardiaque, et, seulement dans le cas de HMERF, on observe une insuffisance respiratoire importante. Ces titinopathies sont souvent associées à des lésions histologiques de type dystrophique ou myofibrillaire. Dans la dystrophie musculaire tibiale (TMD), ou myopathie dite de Udd, la distribution du déficit moteur est très sélective avec une atteinte quasi-exclusive de la loge antérieure des muscles de jambe. Les membres supérieurs ne sont quasiment jamais atteints. Il s’agit exclusivement de patients adultes et avec une prévalence très élevée en Finlande du fait d’un effet fondateur (mutation FINmaj). L’atteinte des muscles releveurs des pieds est source de gêne à la marche et à la montée des escaliers. La pointe du pied tombe lors de la marche et oblige à lever haut le genou pour éviter que le pied n’accroche le sol (steppage). L’évolution est lente et bénigne, évoluant dans certains cas vers une faiblesse modérée et tardive des muscles proximaux des membres inférieurs. Plus rarement, la présence de deux mutations de TTN à l’état hétérozygote composite est associée à une forme autosomique récessive de TMD à début plus précoce (vers l’âge de 20 ans), appelée TMD juvénile [16, 14]. Dans la myopathie des ceintures de type 2J (ou LGMD 2J), le début est précoce, dans l’enfance ou à l’adolescence. Cette forme est observée lorsque la mutation FINmaj se retrouve à l’état homozygote chez un enfant de parents atteints de TMD, ou plus rarement lorsque deux autres mutations de TTN sont associées en homozygotie ou en hétérozygotie composite. L’atteinte est proximale, surtout au niveau pelvien et dans une moindre mesure au niveau scapulaire (décollement des omoplates plus ou moins marqué). L’évolution est en règle assez rapide et un nombre important d’individus atteints perdent la marche. La myopathie héréditaire avec insuffisance respiratoire précoce dite aussi myopathie d’Edström ou HMERF (pour Hereditary Myopathy with Early Respiratory Failure), s’avère être une pathologie non exceptionnelle. Le diagnostic doit être évoqué devant une myopathie, d’expression initialement distale puis proximo-distale, débutant à l’adolescence ou au début de l’âge adulte, lentement progressive, et s’accompagnant d’un syndrome respiratoire restrictif souvent au premier plan [17]. Le taux de CPK reste proche de la normale. La progression conduit à une perte de la marche, une tétraparésie grave et une ventilation permanente, en moyenne 10 à 15 ans après le début de la maladie. La transmission est autosomique dominante ce qui permet, dans les formes familiales, de la distinguer de la maladie de Pompe, notamment. Dans trois familles publiées récemment [15] un phénotype autosomique récessif a été décrit sous le terme de titinopathie Emery-Dreifuss-like à début infantile/juvénile. Il est caractérisé par une faiblesse des muscles de la ceinture pelvienne associée à des rétractions tendineuses des membres et, dans certains cas, du rachis, débutant avant l’âge de dix ans et rapidement évolutives, conduisant à la perte de la marche. Ils présentaient aussi une atteinte respiratoire modérée mais pas d’atteinte cardiaque. Le taux de CPK atteignait dans certains cas vingt fois la normale. Titinopathies congénitales Il s’agit de pathologies autosomiques récessives à début anténatal (immobilité fœtale, arthrogrypose) ou dans la première année de la vie. La plupart des tableaux donnent lieu à un retard moteur et une faiblesse musculaire non sélective, avec une atteinte relativement diffuse, en général à prédominance proximale et axiale (muscles paravertébraux, diaphragme), et souvent avec une composante rétractile (rétractions des tendons d’Achille, Rigid Spine). La musculature du visage peut être concernée (pauvreté de la mimique, inexpressivité). De rares cas avec chute bilatérale des paupières (ptosis) ont été rapportés, mais les mouvements des muscles extraoculaires étaient normaux chez tous les patients identifiés jusqu’à présent. Le taux de CPK est en général normal ou modérément élevé, typiquement à moins de cinq fois la normale. La majorité des patients développent une scoliose qui souvent nécessite d’une correction chirurgicale (arthrodèse vertébrale) autour de l’adolescence. Une insuffisance respiratoire restrictive est aussi presque systématique, de gravité variable mais qui nécessite le plus souvent une ventilation nocturne dans la première décennie de la vie. L’atteinte myocardique primaire, en général une cardiomyopathie dilatée, n’est pas présente dans tous les cas, mais est fréquente et doit faire évoquer une titinopathie lorsqu’elle est associée à une maladie musculaire congénitale. La première titinopathie congénitale a été identifiée en 2007 chez deux familles consanguines [18], dont l’une, d’origine soudanaise, avait été rapportée phénotypiquement préalablement par M. Salih. Histologiquement, il était noté des lésions de type myopathie congénitale (notamment multi-minicores et centralisations nucléaires) associées dans quelques cas à des lésions évoquant une dystrophie musculaire congénitale. Les cinq enfants atteints avaient une forme modérée d’atteinte musculaire congénitale, avec retard moteur et une faiblesse musculaire compatible avec la marche. Tous ont malheureusement développé une cardiomyopathie dilatée progressive qui a provoqué leur décès entre 5 et 19 ans. Les patients portaient des mutations tronquantes de TTN à l’état homozygote ; les parents hétérozygotes étaient sains. Ce phénotype a été nommé EOMFC (Early-onset Myopathy with Fatal Cardiomyopathy). Par la suite, d’autres familles avec myopathie congénitale à cores et atteinte cardiaque ont été associées par la même équipe à des mutations homozygotes ou hétérozygotes composites de TTN, élargissant le spectre clinique [1]. Dans certains cas, la cardiomyopathie dilatée peut apparaître tardivement, au début de l’âge adulte ; au contraire, le début peut être anténatal, avec arthrogryposis multiplex congenita et non-compaction du ventricule gauche. D’autres patients présentent un phénotype tout à fait superposable à une myopathie d’Emery-Dreifuss avec atteinte cardiaque. Pour englober tout ce spectre phénotypique, y compris l’EOMFC, le terme plus large de myopathie multi-minicore autosomique récessive avec atteinte cardiaque (MmD with heart disease, AR MmD-HD) a été proposé. Cinq autres familles avec un phénotype très similaire et deux mutations TTN mais sans atteinte cardiaque ont été décrites comme myopathies centronucléaires en raison de la présence d’un nombre important de noyaux internalisés sur les biopsies, bien qu’ils soient associés à des minicores. Le pronostic des titinopathies est par définition éminemment variable d’un sujet à l’autre, allant d’une simple gêne musculaire peu ou pas évolutive jusqu’à des tableaux dramatiques chez l’enfant avec risque de décès prématuré (notamment d’origine cardiaque). De manière générale, plus le début des symptômes est précoce et plus le risque de complications au long cours est élevé. Le pronostic ultérieur dépend de la présence ou non de complications cardiaques et/ou respiratoires. Une atteinte du muscle cardiaque, sous la forme d’une cardiomyopathie possiblement évolutive, n’est jamais de bon pronostic, a fortiori chez un enfant. Dans les formes dites purement distales de titinopathie (type TMD), le risque évolutif est celui d’une perte de l’autonomie de déplacement du fait de difficultés locomotrices croissantes. |
L’apport de la biopsie musculaire est réel dans les titinopathies même si la pratique de ce geste invasif est en nette diminution ces temps-ci. Plusieurs types de lésions histologiques ont été rapportés dans les titinopathies. Leur éventail est exceptionnellement étendu et pourrait encore s’élargir avec la validation en cours de la pathogénicité de nouveaux variants du gène TTN. Prises individuellement, la plupart de ces lésions histologiques sont peu ou non spécifiques. Pour autant, le profil histologique permet souvent d’étayer le diagnostic d’une titinopathie devant la coexistence de plusieurs d’entre elles chez un patient présentant un phénotype clinique compatible. Le choix du lieu de la biopsie importe. C’est le cas notamment dans les atteintes musculaires très focales, comme dans la TMD où le muscle tibial antérieur peut être le siège de lésions dystrophiques significatives alors même que les autres groupes musculaires sont indemnes. Les anomalies décrites dans les titinopathies comprennent :
-
des lésions dystrophiques
Nécrose, régénération et fibrose endomysiale sont rarement très marquées dans les titinopathies sauf dans les muscles cliniquement très touchés (formes évoluées de TMD et LGMD 2J). Il en va de même pour les titinopathies congénitales qui peuvent dans certains cas faire penser à une dystrophie musculaire congénitale.
-
des perturbations du réseau inter-myofibrillaire
Ces lésions (bavures de la strie Z, désorganisation des myofibrilles, accumulation de matériel protéique granulo-filamentaire) peuvent faire évoquer en première analyse une myopathie de type myofibrillaire. Dans ce contexte, les études complémentaires en microscope électronique peuvent se révéler d’une grande aide.
-
des vacuoles bordées
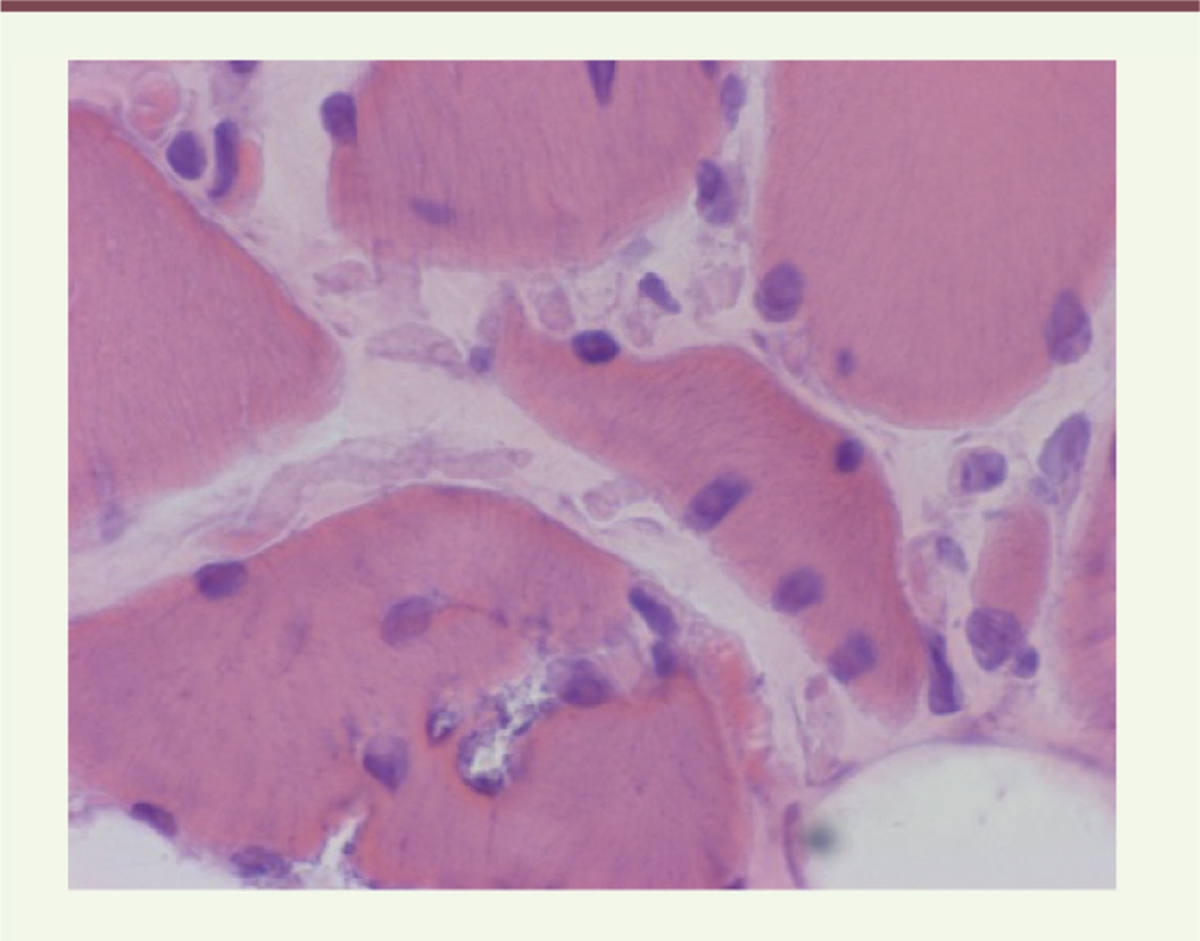
Situées dans le sarcoplasme, elles n’ont rien de spécifique mais se voient volontiers en grand nombre dans l’HMERF (Figure 1) et peuvent être observées aussi dans les muscles atteints dans la TMD.
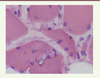 | Figure 1.
Vacuoles bordées et centralisations nucléaires chez un patient diagnostiqué HMERF (coloration hématoxyline-éosine). |
-
des lésions de type core
Les cores sont des lésions habituellement caractéristiques des myopathies congénitales (central core, multi-minicore, etc.). Des multiples minicores sont presque systématiquement observés, isolément ou en association avec d’autres lésions, dans les titinopathies congénitales.
-
des centralisations nucléaires
Au lieu d’être situés en périphérie, comme dans toute fibre normale, les noyaux de la fibre musculaire sont souvent internalisés en grand nombre. Cet aspect histologique peut faire penser initialement à une myopathie centronucléaire, bien que, contrairement à celle-ci, dans les titinopathies les internalisations nucléaires soient presque toujours associés à d’autres anomalies de structure des fibres musculaires.
-
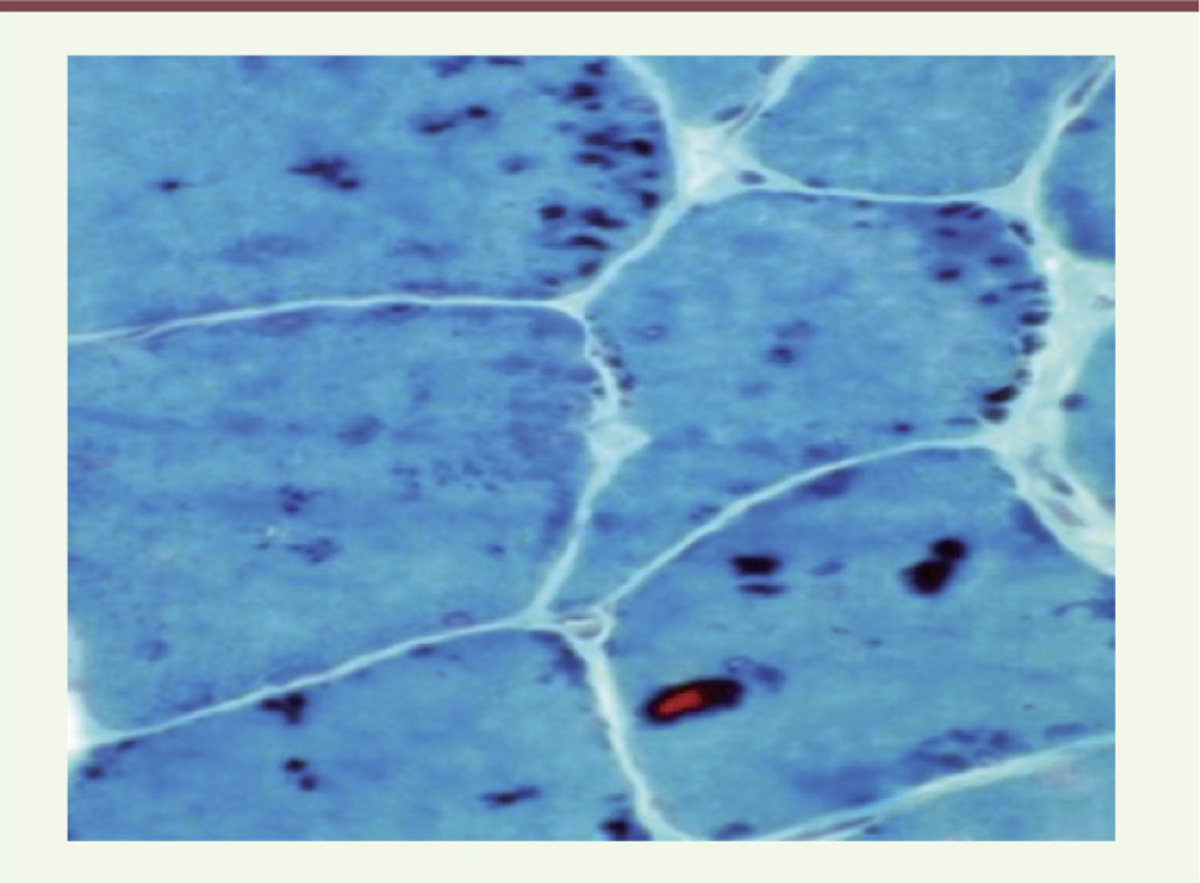
des inclusions dites éosinophiles
Elles sont, par leur couleur, facilement reconnaissables en microscopie optique. Elles peuvent converger et donner des aspects de véritables inclusions appelées corps cytoplasmiques (à ne pas confondre avec les « cores »). Ces inclusions, lorsqu’elles sont en périphérie de la fibre musculaire, peuvent prendre l’aspect d’un collier ( necklace en anglais). Ceci a été notamment décrit dans l‘HMERF (Figure 2).
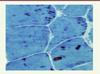 | Figure 2.
Corps cytoplasmiques visibles chez un patient diagnostiqué HMERF (coloration trichrome Gomori modifiée). |
-
des lésions non spécifiques
Les lésions sont parfois si discrètes ou si peu spécifiques qu’on parle alors d’un simple aspect myopathique, sans plus de précision. L’errance diagnostique est, dans ce cas de figure, particulièrement fréquente. Les différentes combinaisons de ces lésions orientent vers les différentes titinopathies. Par exemple, l’association de multiples noyaux internalisés par fibre et de multi-minicores, avec ou sans augmentation du tissu conjonctif endomysial, doit faire penser à une titinopathie congénitale. Dans les formes à début plus tardif, une combinaison de lésions myofibrillaires et dystrophiques est souvent observée. Les études en microscopie électronique sont indiquées lorsque sont mises en évidence des lésions de type myofibrillaire ou lorsque les centralisations nucléaires questionnent l’anatomo-pathologiste. Quant à l’immunocytochimie, elle est d’une utilité limitée (sauf pour éliminer des diagnostics alternatifs). Les protéines membranaires (dystrophine, sarcoglycanes, dysferline, pour ne citer que les plus fréquemment étudiées) sont constamment normales dans les titinopathies. Les anticorps dirigés contre la titine elle-même ne sont utilisés que dans les laboratoires de recherche et n’ont pas d’applications diagnostiques à ce jour. Le Western Blot (technique semi-quantitative fréquemment utilisée dans l’exploration des causes de dystrophie musculaire) peut parfois être à l’origine d’erreurs de diagnostic. On observe assez souvent une diminution du signal de la calpaïne-3, une protéine intimement liée à la titine et interagissant avec elle via un site de liaison localisé dans l’extremité C-terminale de la titine. Il s’agit dans ce cas d’un déficit secondaire en calpaïne-3 dû non pas à une anomalie du gène CAPN3 proprement dit (calpaïnopathie primitive) mais bien à la présence de deux mutations du gène TTN qui entraînent une perte de ce site. Cette déplétion secondaire de calpaïne a été décrite chez les patients homozygotes pour FINmaj, chez les cas EDMD-like sans atteinte cardiaque et chez les patients avec EOMFC. |
Seule l’étude du gène TTN permet de confirmer le diagnostic de titinopathie de manière formelle. Des examens complémentaires (dosages des enzymes musculaires, EMG, imagerie, biopsie musculaire) ont parfois une valeur d’orientation. Aucun n’est véritablement spécifique. Le taux de CPK est très variable, allant de valeurs normales jusqu’à des chiffres significativement plus élevés (jusqu’à 15 fois). Dans la plupart des patients toutefois, les valeurs restent modérément élevées, aux alentours de 3-4 fois la normale. L’électromyogramme (EMG) n’apporte pas d’éléments décisifs. Il est typiquement myopathique, et son intérêt principal réside dans le diagnostic différentiel avec d’autres pathologies neuromusculaires, notamment les troubles de la jonction neuromusculaire et les neuropathies dans les cas avec atteinte distale prédominante. L’imagerie musculaire (IRM, tomodensitométrie ou échographie) joue pour l’instant un rôle modeste, la distribution des lésions observées étant aussi variable que les différents phénotypes cliniques rapportés. Elle permet une cartographie des muscles atteints et servira à définir plus précisément les spécificités de chacun des phénotypes. Pour établir des profils IRM types, par exemple, elle se heurte encore au relatif petit nombre de malades étudiés. Les explorations cardiaques et respiratoires sont indispensables lors du diagnostic et tout au long du suivi d’une titinopathie. L’objectivation d’une composante cardiaque et/ou respiratoire dans le tableau clinique initial peut, dans certains cas, aider au diagnostic. Certaines titinopathies peuvent aussi avoir une expression purement cardiaque. Dans d’autres cas, il peut s’agir d’une atteinte mixte, squelettique et cardiaque. Une atteinte respiratoire significative et d’apparition précoce chez un adulte doit faire évoquer plus spécifiquement une myopathie de type HMERF. |
Aspects génétiques et physiopathologie Les titinopathies sont par définition des maladies génétiques. Elles touchent indistinctement les hommes et les femmes. Parmi les nombreuses formes de titinopathie, deux modes de transmission ont été documentés : le mode autosomique dominant et le mode autosomique récessif. Le gène TTN codant la titine, localisé dans le chromosome 2, est de taille très imposante (364 exons). Il est, de ce fait, difficile à explorer dans son intégralité. Le produit protéique qui découle de la traduction de ce gène, la titine, représente, avec ses 33 000 acides aminés, la plus grosse protéine de tout l’organisme. Le gène TTN est aussi de nature complexe, codant notamment un domaine kinase et une grande série de répétitions de motifs immunoglobulines (Ig) ou fibronectine 3 (Fn3). On distingue quatre parties dans la protéine. L’extrémité amino-terminale est ancrée dans le disque Z du sarcomère. L’autre extrémité (C-terminale) est intégrée dans la ligne M (M-line) au milieu du sarcomère, et est codée par les six derniers exons (358 à 363, nommés aussi Mex1 à Mex6). Entre les deux, se situent deux autres régions, intégrées respectivement dans les bandes A et I. Avant l’arrivée du séquençage à haut débit, la plupart des études de séquençage de TTN était focalisée sur la partie C-terminale. Ceci peut contribuer à expliquer le fait que, à ce jour, la majorité des mutations du gène TTN décrites dans des manifestations musculaires se trouve dans les six derniers exons. Les anomalies du gène TTN sont nombreuses (plus de 150 recensées à ce jour) et de nature variable : mutation faux-sens, petites ou grandes délétions, insertions, mutations stop. Beaucoup aboutissent à ce que la titine soit tronquée. Dans ce cas précis, le domaine de liaison à la calpaïne 3 est souvent absent et explique la diminution, secondaire, du signal de la calpaïne musculaire en Western-Blot. La complexité, et surtout la taille, du gène TTN complique singulièrement la mise en évidence de ces anomalies et donc la détermination du mode précis de transmission (dominant ou récessif). Il n’est pas rare d’avoir à reclasser certains cas familiaux de titinopathie de récessif à dominant et vice-versa. L’identification de la plupart des mutations du gène TTN se fait désormais dans le cadre du séquençage à haut débit (NGS pour Next Generation Sequencing). Le plus souvent, il s’agit d’un séquençage ciblé. On s’intéresse à une pathologie ou un groupe de pathologies en particulier. On dispose ainsi de puces ADN de séquençage permettant dans une même étude l’exploration de plusieurs dizaines de gènes correspondant à des présentations cliniques ou histologiques particulières de myopathie. Il existe ainsi des puces spécialisées, ou panel de gènes, pour les myopathies congénitales, d’autres pour les myopathies des ceintures, d’autres pour les myopathies rétractiles, d’autres encore pour les cardiomyopathies familiales. Le gène TTN fait désormais partie des gènes testés dans la plupart de ces panels tant la présentation clinique des titinopathies est variable. Pour autant, l’exploration du gène TTN n’est pas complètement exhaustive. Certaines zones du gène (des exons) ne sont pas ou pas bien analysées en général du fait d’artefacts techniques. D’autre part, le NGS passe souvent, avec le standard actuel, à côté de changements plus subtils à détecter comme des grandes délétions ou des duplications du gène TTN. Si le ou les panels de gènes s’avèrent non concluants, on peut être amené à étudier l’exome (partie codante du génome) dans son intégralité. Plus rarement, enfin, une ou des mutations du gène TTN peuvent être identifiées à la suite d’une étude dite du génome entier (WGS pour whole genome study). Cette technique balaye l’ensemble du génome de l’individu (exons et introns compris) mais avec une forte probabilité de trouver des variations de séquence (ou polymorphismes) sans signification pathologique particulière. Une fois la mutation identifiée en NGS, le laboratoire devra aussitôt confirmer son existence par des techniques classiques de séquençage (type Sanger), et si possible, étudier sa distribution à l’intérieur de la famille (étude dite de ségrégation). La preuve de la pathogénicité d’un variant du gène TTN reste encore délicate malgré la sophistication des algorithmes et l’alimentation des bases de données moléculaires. La découverte d’une variation de séquence dans le gène TTN n’est pas obligatoirement synonyme de titinopathie. Il y a sans doute, de ce point de vue, quelques variations/variants qui ont été, à tort, qualifiés de pathogènes ces dernières années. Ce travail d’inventaire des variations de séquence de TTN et de façon générale, l’interprétation des résultats du NGS, nécessitent une vraie expertise. Ces variants doivent toujours être replacés dans le contexte de la présentation clinique de la personne considérée. D’où la nécessité d’échanges réguliers entre cliniciens et biologistes pour valider les diagnostics de titinopathie. |
Les titinopathies autosomiques dominantes Chacun d’entre nous possède deux exemplaires du gène TTN, l’un et l’autre étant hérités de nos deux parents. Dans le mode de transmission autosomique dominant, il suffit qu’un seul exemplaire du gène TTN présente une anomalie (dite pathogène) pour qu’une titinopathie survienne. Comme dans la plupart des maladies génétiques autosomiques dominantes, le degré d’expressivité de la maladie reste très variable d’un individu atteint à l’autre, y compris dans la même famille. Il peut arriver que les symptômes soient très discrets au point de penser que la personne pourtant porteuse de l’anomalie génétique n’est pas atteinte. Il arrive aussi, surtout dans les formes distales de titinopathie que cette expressivité se manifeste très tardivement, passée la cinquantaine par exemple. Typiquement, ce mode de transmission se rencontre dans la myopathie de Udd (TMD) et dans la myopathie d’Edström (HMERF), mais aussi dans certaines cardiomyopathies familiales. Ces phénotypes sont associés à des mutations dans des régions très localisées du gène TTN (hot-spots) : les derniers exons (Mex5 et Mex6) pour la TMD et LGMD2J et l’exon 343 qui contient toutes les mutations HMERF confirmées. |
Les titinopathies autosomiques récessives Les formes autosomiques récessives de titinopathie sont, à ce jour et sous réserve de la publication des nouvelles mutations identifiées récemment, plus rares que celles transmises selon un mode autosomique dominant. Elles concernent essentiellement la myopathie des ceintures de type 2J (qui correspond en général à des patients homozygotes pour la mutation TMD) et les titinopathies congénitales. En cas de forme autosomique récessive, on met en évidence en général une mutation en double exemplaire (homozygote) ou deux mutations distinctes du gène TTN (hétérozygote composite). On notera qu’il est parfois difficile d’affirmer, même au niveau moléculaire le caractère dominant ou récessif de la transmission. Des travaux récents illustrent ces difficultés. Il faut parfois plusieurs mois aux biologistes pour identifier la deuxième mutation d’une titinopathie répertoriée comme autosomique récessif. Néanmoins, il convient de noter que, en ce qui concerne les phénotypes musculaires, et contrairement à ce qui a été décrit pour les cardiomyopathies isolées, toutes les mutations tronquantes de TTN rapportées sont récessives, les porteurs hétérozygotes n’ayant pas de déficit musculaire. L’expression clinique de la maladie peut varier selon le mode de transmission. Par exemple, dans la myopathie de Udd, le déficit musculaire a une topographie distale dans la forme dominante (TMD) et une distribution de type plutôt myopathie des ceintures, donc proximale (mais aussi distale), dans la forme récessive (LGMD de type 2J). |
Quand les manifestations de la maladie sont atypiques et/ou discrètes, ou quand il n’y pas de concordance parfaite entre les données cliniques, histologiques et moléculaires, le diagnostic de titinopathie peut être difficile à établir avec certitude. Cette situation est plutôt la norme que l’exception. Elle peut engendrer un doute diagnostique pendant plusieurs mois ou années, expliquant la longue errance diagnostique rapportée par les patients et leurs familles. Dans chacune des situations cliniques évoquées plus haut, et a fortiori, s’il n’y a pas d’antécédents familiaux, d’autres diagnostics que celui de titinopathie vont être évoqués. Ainsi, les myopathies distales qui bien que rares, posent de nombreux problèmes diagnostiques. Non pas tant avec la myopathie de Miyoshi (qui s’accompagne constamment, au moins au début, d’une élévation franche des enzymes musculaires) et la myopathie GNE (les deux étant transmises sur un mode autosomique récessif) qu’avec toutes les autres (y compris certaines myopathies myofibrillaires). Quand la présentation clinique est celle d’une myopathie dite des ceintures autosomique récessive (LGMD2), une titinopathie est rarement évoquée d’emblée tant elle reste exceptionnelle sauf dans un contexte ethno-géographique particulier (mutation fondatrice finlandaise par exemple). Le déficit musculaire a une topographie proximale. Les LGMD récessives (LGMD 2) sont caractérisées par une très grande hétérogénéité clinique et génétique (26 gènes ont été mis en cause à ce jour). L’imagerie musculaire peut donner quelques éléments d’orientation mais c’est souvent l’étude génétique, sur panels ciblés ou en exome entier, qui permet de redresser/préciser le diagnostic. L’association d’une myopathie et d’une atteinte cardiaque ouvre d’autres alternatives diagnostiques. C’est surtout chez l’enfant que le problème se pose. Dans ce cas précis, une titinopathie pourra être discutée pas tant avec une dystrophinopathie ou un déficit en FKRP (où les enzymes musculaires sont généralement très élevées) qu’avec une laminopathie, ou, plus rarement, une mitochondriopathie. Dans les présentations myopathiques de type rétractile, une titinopathie peut également être discutée devant les formes évoquant une Emery-Dreifuss ou une myopathie à FHL1, l’atteinte cardiaque pouvant être absente ou présente dans les titinopathies. L’association de signes respiratoires et d’une myopathie à l’âge adulte doit faire penser à un déficit en maltase acide (maladie de Pompe). Le mode de transmission est différent mais la distinction avec une myopathie HMERF peut se poser dans les cas sporadiques où le caractère familial manque. |
La prise en charge des titinopathies est, pour l’instant, purement symptomatique. Elle vise essentiellement à prévenir les complications, notamment cardiaques et respiratoires, et à améliorer le confort de vie des personnes atteintes de titinopathie. Le conseil génétique, bien que délicat dans ce groupe de maladies au pronostic très variable, fait partie de la prise en charge de la personne malade et de sa famille. De manière générale, les déficiences motrices doivent faire l’objet d’appareillages (attelles releveurs, par exemple, dans les déficits du tibial antérieur ; autres orthèses) ou d’aides techniques. L’atteinte respiratoire notée dans l’HMERF conduit pratiquement constamment à proposer une ventilation non invasive aux patients concernés. Le suivi cardiologique est également important et peut aboutir à une prescription de médicaments cardiotropes destinés à pallier le risque d’insuffisance cardiaque. Le risque d’atteinte cardiaque primitive est toutefois limité à une partie des titinopathies. Dans les formes congénitales, une ventilation non invasive et une arthrodèse pour stabiliser ou corriger la scoliose sont en général nécessaires avant l’adolescence. La prise en charge cardiaque La prise en charge des troubles cardiaques conditionne le pronostic vital à long terme. Un suivi cardiologique régulier est indispensable afin qu’un traitement adapté soit mis en route dès les premiers signes ou perturbations des bilans. Dans les titinopathies, et parce qu’elles sont encore mal connues, l’appréciation du risque cardiaque théorique reste difficile. Le risque est extrême dans les quelques cas rapportés de EOMFC et inexistant dans la TMD ou l’HMERF. Le bilan cardiaque annuel et systématique Il comporte au minimum des examens de type électrocardiogramme (ECG) et électrocardiogramme ambulatoire des 24 heures (enregistrement Holter) pour détecter d’éventuels troubles de la conduction et/ou des troubles du rythme. L’échocardiographie renseigne sur les capacités du cœur à se contracter et sert à détecter une cardiomyopathie. Dans certains centres, l’IRM cardiaque (cardio-IRM) renseigne de manière encore plus précise sur les altérations cardiaque. En cas de doute sur l’existence de symptômes (malaises, syncopes, palpitations…) ou si l’électrocardiogramme met en évidence des anomalies (permanentes ou survenant lors de crises soudaines et transitoires), les médecins ont recours à des examens plus poussés du fonctionnement rythmique du cœur. L’exploration du faisceau de His (la région du cœur spécialisée dans la propagation de l’influx nerveux) permet d’affiner l’évaluation du risque de déclenchement de troubles de la conduction ou de troubles du rythme. Cet examen se fait en milieu spécialisé (à l’hôpital ou dans le secteur privé) et sous surveillance étroite.
-
En cas de troubles du rythme cardiaque, le traitement consiste à prendre des médicaments (anti-arythmiques, anti-coagulants…) en cas de troubles du rythme auriculaires, ou à la mise en place d’un défibrillateur automatique implantable en cas de troubles du rythme ventriculaires.
-
L’insuffisance cardiaque dans les titinopathies relève habituellement des traitements cardiologiques classiques, essentiellement médicamenteux (inhibiteurs de l’enzyme de conversion, bêtabloquants, diurétiques…) associés à des règles hygiéno-diététiques (régime sans sel). En cas d’échappement au traitement médical bien conduit, une transplantation cardiaque doit être discutée même si, dans le contexte spécifique des titinopathies, le recours à cette technique n’a jamais été rapporté. En attente de greffe, des dispositifs de circulation extra-corporelle, comme dans les dystrophinopathies sévères, peuvent être évoqués, au moins en théorie.
La prise en charge respiratoire L’atteinte respiratoire est essentiellement rencontrée, comme indiqué dans le nom de la maladie, dans la myopathie héréditaire avec insuffisance respiratoire précoce (HMERF) et dans les titinopathies congénitales. Elle est exceptionnelle dans les autres formes de titinopathie mais il convient de toujours penser à la rechercher. La surveillance régulière de la fonction respiratoire permet de mettre en route une prise en charge adaptée. L’atteinte des muscles respiratoires La faiblesse des muscles respiratoires rencontrée dans certaines titinopathies peut expliquer l’apparition d’un syndrome respiratoire restrictif : la personne dispose d’une moindre force pour inspirer et expirer, elle fait facilement des infections bronchiques et/ou peut avoir le souffle court. Il ne semble pas y avoir de tropisme pour un muscle respiratoire en particulier (diaphragme ou muscles intercostaux). La prise en charge respiratoire Dans les formes très précoces de titinopathie Les enfants atteints ont besoin d’une ventilation assistée, rarement pendant les premiers jours de leur vie mais en général avant l’âge de 10 ans. Les études de fonction respiratoire doivent être systématiques.
-
Le suivi médical annuel permet de surveiller l’apparition éventuelle de signes d’une atteinte respiratoire : difficultés passagères pour respirer, toux peu efficace, infections pulmonaires à répétition, maux de tête ou sueurs, surtout au réveil, difficulté à prendre du poids ou à ne pas en perdre, fatigue…
-
Des examens complémentaires (mesure de la capacité vitale, gazométrie, enregistrement pendant le sommeil…) visent à détecter une baisse possible de la capacité vitale (diminution du volume d’air mobilisé lors d’une inspiration maximale suivie d’une expiration forcée), un syndrome d’hypoventilation alvéolaire (les muscles respiratoires n’arrivent plus à faire évacuer le gaz carbonique CO2 produit par l’organisme) et/ou un nombre trop important de pauses respiratoires pendant le sommeil (apnées du sommeil).
Les infections pulmonaires, lorsqu’elles surviennent, sont traitées précocement par des antibiotiques, de la kinésithérapie respiratoire (toux assistée, techniques manuelles de désencombrement) et l’utilisation d’appareillages adaptés (type Cough Assist® ou Percussionnaire®). La toux assistée peut être complétée, au besoin, par des techniques de drainage bronchique réalisées par le kinésithérapeute. Le drainage bronchique facilite la remontée des sécrétions présentes dans les voies respiratoires et est nécessaire en cas d’infection pulmonaire.
-
Les vaccinations contre la grippe et le pneumocoque sont très largement recommandées en prévention, a fortiori en cas d’atteinte respiratoire avérée.
-
Dans le cas où les paramètres respiratoires sont très perturbés, le médecin propose une ventilation non invasive (généralement la nuit, à l’aide d’un masque nasal, avec un ventilateur portatif type C-PaP® ou, mieux, Bi-PaP®). Ces appareils insufflent de l’air dans les voies aériennes au rythme physiologique de la respiration et sont particulièrement utiles pendant le sommeil. Les muscles respiratoires ainsi mis au repos récupèrent de la force pendant la nuit.
Le recours à la trachéotomie est en revanche exceptionnel et doit être discuté au cas par cas en fonction des choix de l’individu et de sa famille. La ventilation non invasive peut entraîner certains inconvénients à prendre en compte avec l’équipe de soins : irritation cutanée au niveau de certaines zones de contact du masque, aérophagie due au passage de l’air dans l’estomac, gêne liée au bruit de la machine… Améliorer les surfaces de contact, diminuer la pression d’application du masque, faire un masque sur mesure à partir d’un moulage facial, porter une gaine en coutil pour limiter l’expansion abdominale sont autant de solutions pour rendre confortable la ventilation assistée. Les appareils de ventilation et leurs accessoires (masques, tubulures…) sont fournis par des associations réunies au sein de l’ANTADIR (ou des prestataires privés (type Vitalaire®) en lien avec le médecin prescripteur. Il en de même pour les réglages et la maintenance de la machine.
-
Les consultations de conseil génétique peuvent être accompagnées d’une ou de plusieurs rencontre(s) avec un psychologue pour être aidé et soutenu face aux décisions importantes à prendre.
|
Comment sont organisés la recherche et les essais thérapeutiques dans les titinopathies ? Les équipes de recherche directement impliquées dans les titinopathies étaient relativement peu nombreuses jusqu’à présent. Pour des raisons historiques, la Finlande (laboratoire de B. Udd) mais aussi la France (laboratoire de Généthon, I. Richard, laboratoire d’A. Ferreiro à Paris), l’Allemagne (pour des études plus fondamentales), l’Angleterre et les Etats-Unis ont fait office de pionniers dans le domaine. Beaucoup de laboratoires dits de diagnostic ont pris le relais pour la recherche de mutations ce qui pourrait nuire, paradoxalement, à une meilleure connaissance du gène TTN tant le risque de perte d’information sur les variants est grand. Le nombre croissant de patients diagnostiqués grâce au NGS devrait logiquement relancer l’intérêt des chercheurs pour la titine et les pathologies qui en découlent. à ce jour, il n’y a pas, à proprement parler, d’essais ou de protocoles à visée thérapeutique dans les titinopathies. Le site clinicaltrials.gov est d’ailleurs muet à ce sujet. Ceci n’est pas très étonnant si l’on considère que ce groupe de maladies est de découverte relativement récente. Par ailleurs, et même si des progrès ont été réalisés, les options thérapeutiques paraissent à ce stade hors de portée, en dehors des approches génériques, et pour l’instant purement théoriques, de type CRISPR-Cas-9. Un workshop consacré, sous les auspices, de l’ENMC, aux titinopathies a eu lieu en avril 2016 aux Pays-Bas. Il a permis de réunir pendant trois jours une vingtaine de chercheurs et scientifiques du monde entier impliqués dans le gène codant la titine et les maladies afférentes [19]. L’une des initiatives issues de ce workshop est la mise en place d’une base de données internationale anonyme mettant en relation tous les variants TTN identifiés par les différents laboratoires (qu’ils soient pathogènes ou de signification inconnue) avec le phénotype des patients qui les portent, avec l’objectif de mieux comprendre les corrélations phénotype-génotype et, par conséquent, de faciliter l’interprétation des nombreux variants TTN dont on ne peut pas affirmer à présent s’ils sont responsables de la maladie ou des simples polymorphismes. Au niveau français, un groupe de travail interdisciplinaire s’est mis en place à l’initiative conjointe de la Société Française de Myologie (SFM) et de la filière nationale neuromusculaire FILNEMUS. |
Un peu d’histoire et quelques explications L’histoire des titinopathies est intimement liée à celle de la titine, cette protéine qui s’est longtemps appelée connectine. L’existence d’une protéine élastique de grande taille a été évoquée pour la première fois en 1954 par un chercheur japonais, Reiji Natori. Celui-ci disséquait l’appareil contractile de la fibre musculaire à la recherche des partenaires de protéines contractiles connues (comme la myosine et l’actine). D’après B. Udd, un autre japonais, Marayama, aurait aussi joué un rôle clé dans ces travaux exploratoires. Ce n’est que vingt ans plus tard que cette protéine sera finalement purifiée par d’autres chercheurs et baptisée titine en référence à Titan, une divinité issue de la mythologie grecque (Figure 3).
 | Figure 3.
Sculpture représentant Titan soutenant la voûte céleste pour l’éternité.
|
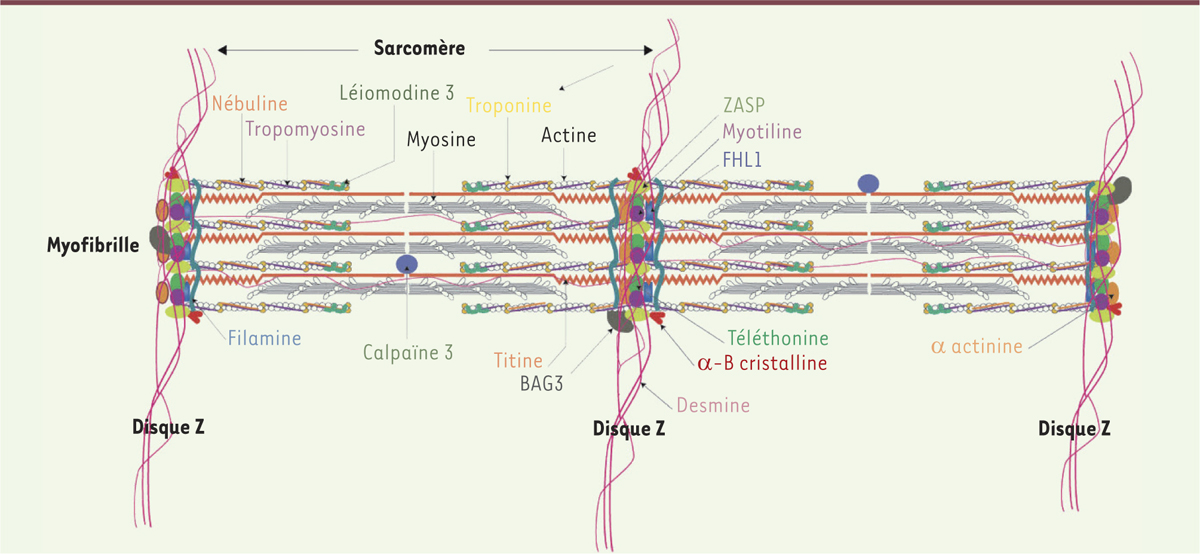
Dès lors, il a été possible d’isoler la titine, de déterminer précisément sa structure protéique, sa composition en acides aminés et d’étudier ses multiples fonctions cellulaires. La titine s’avère être la protéine la plus grosse connue dans la nature, bien plus grande encore que la dystrophine. Elle dispose de dimensions hors du commun, l’isoforme la plus longue ayant un poids moléculaire de 4 200 kilodaltons, une suite de 38 138 acides aminés, et une longueur de 1,2 micron (soit un peu plus d’un millième de millimètre, ce qui à l’échelle d’une cellule est gigantesque). Autrement dit, elle s’étend sur la moitié de la longueur d’un sarcomère (l’unité élémentaire de l’appareil contractile) ce qui est là aussi très impressionnant. Des auteurs facétieux ont même fait remarquer qu’en mettant bout à bout les lettres désignant les acides aminés de la titine, on aboutissait au mot le plus long de la langue anglaise ! La titine est le principal constituant des filaments longitudinaux qui assurent le maintien de l’architecture myofibrillaire. C’est la coordination de l’action de la titine et de la téléthonine qui permet la stabilité (équilibre dynamique) des muscles. La titine contrôle l’intégrité et assure la stabilité mécanique du sarcomère grâce à sa fixation et à ses interactions avec plusieurs protéines musculaires, dont l’actine, la myosine, l’alpha-actine, la calpaine, l’obscurcine et bien d’autres encore. On la retrouve exclusivement bien évidemment dans le muscle squelettique et dans le muscle cardiaque (myocarde) mais avec des isoformes différentes. Le gène de la titine a été cloné en 1995 par des chercheurs allemands (Labeit). Impressionnant aussi par sa taille (pas moins de 364 exons, dont 363 codants) et par le nombre d’isoformes en découlant, le gène TTN (c’est son nom officiel d’après la nomenclature internationale) est particulièrement complexe. On distingue au sein de la protéine quatre zones principales dont une correspond à l’ancrage avec la bande Z et l’autre avec la ligne M. La dernière zone/partie contient un domaine kinase très important pour la fonction de modelage du sarcomère (Figure 4).
 | Figure 4.
La titine assure la stabilité mécanique du sarcomère grâce à sa fixation et aux interactions avec plusieurs protéines musculaires.
|
Rechercher une anomalie au sein du gène TTN revenait à chercher une aiguille dans une meule de foin, ce qui est un peu moins vrai maintenant avec l’arrivée du NGS. Peu après son clonage, et du fait du tropisme musculaire et cardiaque de cette dernière, le gène de la titine a très vite constitué un bon candidat pour expliquer certaines pathologies dont des myopathies. Le frein majeur pour établir ce lien résidait dans la grande difficulté à explorer ce gène « titanesque » en biologie moléculaire. Ce sont les cardiologues qui, les premiers, ont pu faire le lien avec une génopathie humaine et qui se sont intéressés à la titine comme cause potentielle d’insuffisance cardiaque à caractère familial. En 2002, et à la suite de plusieurs études de cartographie et de clonage positionnel, les premières mutations du gène codant la titine ont été formellement impliquées dans la genèse de certaines cardiomyopathies dites dilatées (par opposition aux cardiomyopathies hypertrophiques). Les mutations responsables siégeaient, dans ce cas, préférentiellement dans les exons codant le domaine de la bande A. L’avenir prouvera que des mutations du même gène peuvent donner lieu aussi à des cardiomyopathies hypertrophiques et même à des dysplasies arythmogènes du ventricule droit. En pathologie musculaire, on retiendra deux dates importantes. En 2002, la myopathie distale que Udd avait décrite en Finlande au début des années 1990 (TMD, répertoriée 188840 dans le catalogue OMIM) est formellement élucidée au niveau moléculaire. La TMD est une des myopathies les plus fréquentes dans ce pays de 5 millions d’habitants. Les travaux de Udd, en collaboration avec une chercheuse du Généthon, Isabelle Richard, aboutiront à l’identification d’un effet fondateur dans cette population. L’anomalie retrouvée dans le gène TTN porte le nom de FINmaj et correspond à une insertion-délétion du 11 paires de bases dans l’exon 363 (Mex6) aboutissant à un changement de quatre acides aminés au niveau protéique. Les homozygotes pour cette myopathie présentent un tableau plus sévère qui s’apparente plus à celui d’une myopathie des ceintures (LGMD2J). La collaboration entre Udd et Richard vient du fait que bon nombre des patients avec TMD avaient un déficit en calpaïne. Il a été rapidement démontré par I. Richard (grande spécialiste de la calpaïne musculaire de type 3) que les déficits observés en Western Blot étaient en fait secondaires et qu’un autre gène devait être en cause. La titine a été considérée comme un bon gène candidat ce d’autant qu’une étude préalable de cartographie pointait vers la région q31 du chromosome 2. Pour l’anecdote, on signalera que l’identification de cette mutation fondatrice finlandaise a été laborieuse, la clé du problème se trouvant dans le 363e et dernier exon du gène de TTN ! L’autre grande date dans l’histoire des titinopathies remonte à 2005 quand une équipe londonienne identifie une mutation autosomique domaine kinase de TTN dans une grande famille chez qui une myopathie d’un type particulier avait été décrite par un médecin suédois, Lars Edström, près de trente ans auparavant (1980). Cette même myopathie sera ensuite rebaptisée en HMERF et d’autres mutations seront identifiées dans ce même exon 343 de TTN.
La première titinopathie autosomique récessive, qui a représenté également la première à associer une atteinte des muscles squelettiques et cardiaques et à avoir un début congénital, est la EOMFC. Le phénotype a été initialement décrit par un médecin soudanais installé en Arabie Saoudite, Mustafa Salih, et le tableau mis en rapport avec des mutations de la titine par Ana Ferreiro, médecin et chercheuse Inserm, en 2007. D’autres formes congénitales ont été par la suite décrites par son laboratoire. L’élargissement des titinopathies à d’autres champs de la pathologie musculaire s’est fait petit à petit et se poursuit encore. Quant à la physiopathologie des titinopathies, de nombreux travaux de recherche restent à conduire tant elle apparaît complexe et protéiforme. En conclusion, nous ne sommes qu’au tout début des connaissances concernant les titinopathies. Le gène TTN et son produit protéique, la titine, sont loin d’avoir livré tous leurs secrets. Remarques
-
Des anticorps dirigés contre la titine existent dans la sclérodermie mais selon un mécanisme totalement différent (en l’occurrence auto-immun).
-
Pour l’anecdote : en France, la famille décrite par F. Chapon (Caen) dans les années 1990 associant myopathie à corps cytoplasmiques et atteinte respiratoire était une bonne candidate pour des mutations du gène TTN. Une première analyse avait éliminé ce gène avant qu’une deuxième vienne confirmer que la titine était bien mutée, le tout rentrant dans le cadre d’une authentique HMERF.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Chauveau C, Bonnemann CG, Julien C, et al. Recessive TTN truncating mutations define novel forms of core myopathy with heart disease . Hum Mol Genet. 2014; ; 23 : :980.–991. 2.
Savarese M, Sarparanta J, Vihola A, et al. Increasing role of Titin mutations in neuromuscular disorders . J Neuromuscul Dis. 2016; ; 3 : :293.–308. 3.
Hackman P, Marchand S, Sarparanta J, et al. Truncating mutations in C-terminal titin may cause more severe tibial muscular dystrophy (TMD) . Neuromuscul Disord. 2008; ; 18 : :922.–928. 4.
Van den Bergh PY, Bouquiaux O, Verellen C, et al. Tibial muscular dystrophy in a Belgian family . Ann Neurol. 2003; ; 54 : :248.–251. 5.
Pollazzon M, Suominen T, Penttilä S, et al. The first Italian family with tibial muscular dystrophy caused by a novel titin mutation . J Neurol. 2010; ; 257 : :575.–579. 6.
Ohlsson M, Hedberg C, Brådvik B, et al. Hereditary myopathy with early respiratory failure associated with a mutation in A-band titin . Brain. 2012; ; 135 : :1682.–1694. 7.
Pfeffer G, Elliott HR, Griffin H, et al. Titin mutation segregates with hereditary myopathy with early respiratory failure . Brain. 2012; ; 135 : :1695.–1713. 8.
Palmio J, Evilä A, Chapon F, et al. Hereditary myopathy with early respiratory failure: occurrence in various populations . J Neurol Neurosurg Psychiatry. 2014; ; 85 : :345.–353. 9.
Toro C, Olivé M, Dalakas MC, et al. Exome sequencing identifies titin mutations causing hereditary myopathy with early respiratory failure (HMERF) in families of diverse ethnic origins . BMC Neurol. 2013; ; 13 : :29.. 10.
Yue D, Gao M, Zhu W, et al. New disease allele and de novo mutation indicate mutational vulnerability of titin exon 343 in hereditary myopathy with early respiratory failure . Neuromuscul Disord. 2015; ; 25 : :172.–176. 11.
Izumi R, Niihori T, Aoki Y, et al. Exome sequencing identifies a novel TTN mutation in a family with hereditary myopathy with early respiratory failure . J Hum Genet. 2013; ; 58 : :259.–266. 12.
Pfeffer G, Joseph JT, Innes AM, et al. Titinopathy in a Canadian family sharing the British founder haplotype . Can J Neurol Sci. 2014; ; 41 : :90.–94. 13.
Herman DS, Lam L, Taylor MR, et al. Truncations of titin causing dilated cardiomyopathy . N Engl J Med. 2012; ; 366 : :619.–628. 14.
Evilä A, Palmio J, Vihola A, et al. Targeted next-generation sequencing reveals novel TTN mutations causing recessive distal titinopathy . Mol Neurobiol. 2016 Oct 29; . doi: doi: 10.1007/s12035-016-0242-3.. 15.
De Cid R, Ben Yaou R, Roudaut C, et al. A new titinopathy: childhood-juvenile onset Emery-Dreifuss-like phenotype without cardiomyopathy . Neurology. 2015; ; 85 : :2126.–2135. 16.
Evilä A, Vihola A, Sarparanta J, et al. Atypical phenotypes in titinopathies explained by second titin mutations . Ann Neurol. 2014; ; 75 : :230.–240. 17.
Lange S, Xiang F, Yakovenko A, et al. The kinase domain of titin controls muscle gene expression and protein turnover . Science. 2005; ; 308 : :1599.–1603. 18.
Carmignac V, Salih MA, Quijano-Roy S, et al. C-terminal titin deletions cause a novel early-onset myopathy with fatal cardiomyopathy . Ann Neurol. 2007;; 61: :340.–351. Erratum in: Ann Neurol 2012 ; 71 : 728. 19.
Hackman P, Udd B, Bönnemann CG, Ferreiro A, Titinopathy Database Consortium. 219th ENMC international workshop. Titinopathies international database of titin mutations and phenotypes, Heemskerk, The Netherlands, 29 April-1 May 2016 . Neuromuscul Disord. 2017; ; 27 : :396.–407. |