Vignette (Photo © Inserm/U257).
Les mitochondries jouent un rôle central dans le métabolisme énergétique cellulaire. Elles possèdent leur propre génome (l’ADN mitochondrial ou ADNmt), dont la transmission est exclusivement maternelle. Tous les gènes portés par l’ADNmt sont dédiés à la production de sous-unités des complexes de la chaîne respiratoire. Les mutations de l’ADNmt, fréquentes en pathologie humaine, sont responsables de maladies sévères (les cytopathies mitochondriales) sans traitement curatif à ce jour. Elles ont la particularité d’être portées le plus souvent à l’état hétéroplasmique, c’est-à-dire que coexistent dans les différents tissus/cellules de l’individu, à la fois des molécules d’ADNmt mutées et sauvages, dont les quantités respectives définissent un taux d’hétéroplasmie. Seuls les taux d’hétéroplasmie élevés, dépassant un seuil, sont associés à une expression clinique. Ce taux seuil est cependant variable d’un tissu à l’autre, et d’une mutation à l’autre, voire d’un individu à un autre, expliquant, du moins en partie, l’hétérogénéité clinique intra et interfamiliale pour une mutation donnée, et compliquant considérablement le conseil génétique de ces affections [23] (→). 1
(→) Voir la Synthèse de Y. Tonin et N. Entelis, m/s n° 12, décembre 2014, page 1101
Les femmes porteuses d’une mutation de l’ADNmt ont un risque élevé de transmettre une maladie grave à leur descendance, et beaucoup font la demande d’une prise en charge en diagnostic prénatal (DPN) et/ou préimplantatoire (DPI). Ces procédures diagnostiques consistent à mesurer le taux d’hétéroplasmie fœtal ou embryonnaire, et à considérer que les embryons et les fœtus porteurs d’un taux d’hétéroplasmie inférieur au taux seuil de la mutation ont un risque faible de développer une cytopathie mitochondriale [1-4]. Cependant, la majorité des enfants nés après ce type de diagnostic sont porteurs de la mutation de l’ADNmt ce qui les expose à un risque résiduel de développer la maladie. De plus, certaines patientes ont très peu de chances de donner naissance à un enfant porteur d’un faible taux d’hétéroplasmie, dans la mesure où elles-mêmes portent un taux élevé de mutation, d’où un risque important d’interruption de grossesse en cas de DPN (50 % dans notre population) ou de non-transfert embryonnaire en cas de DPI. Les nouvelles techniques d’édition du génome comme les enzymes TALEN (transcription activator-like effector nuclease) [5], le système CRISPR(clustered regularly interspaced short palindromic repeat)/Cas 9 [6], voire les ARN anti-réplicatif [7], pourraient être appliquées aux embryons in vitro, dans le but de diminuer leur taux d’hétéroplasmie. Cependant, pour les patientes homoplasmiques (qui sont porteuses uniquement de molécules d’ADNmt mutées), ces options ne sont pas applicables. La plupart d’entre elles se tournent alors vers le don d’ovocytes. C’est dans ce contexte que des équipes ont développé une procédure alternative : le don de cytoplasme. Le don de cytoplasme offre à ces femmes la possibilité de transmettre les caractères héréditaires portés par leur génome nucléaire à un enfant sans lui transmettre leur mutation de l’ADNmt. Cette procédure aboutit ainsi à la mise en présence des génomes nucléaires parentaux avec le génome mitochondrial d’une donneuse, d’où le malheureux nom donné à cette technique de « fécondation in vitro (FIV) à 3 parents ». Très débattue au niveau international, cette procédure reste particulièrement controversée en France.
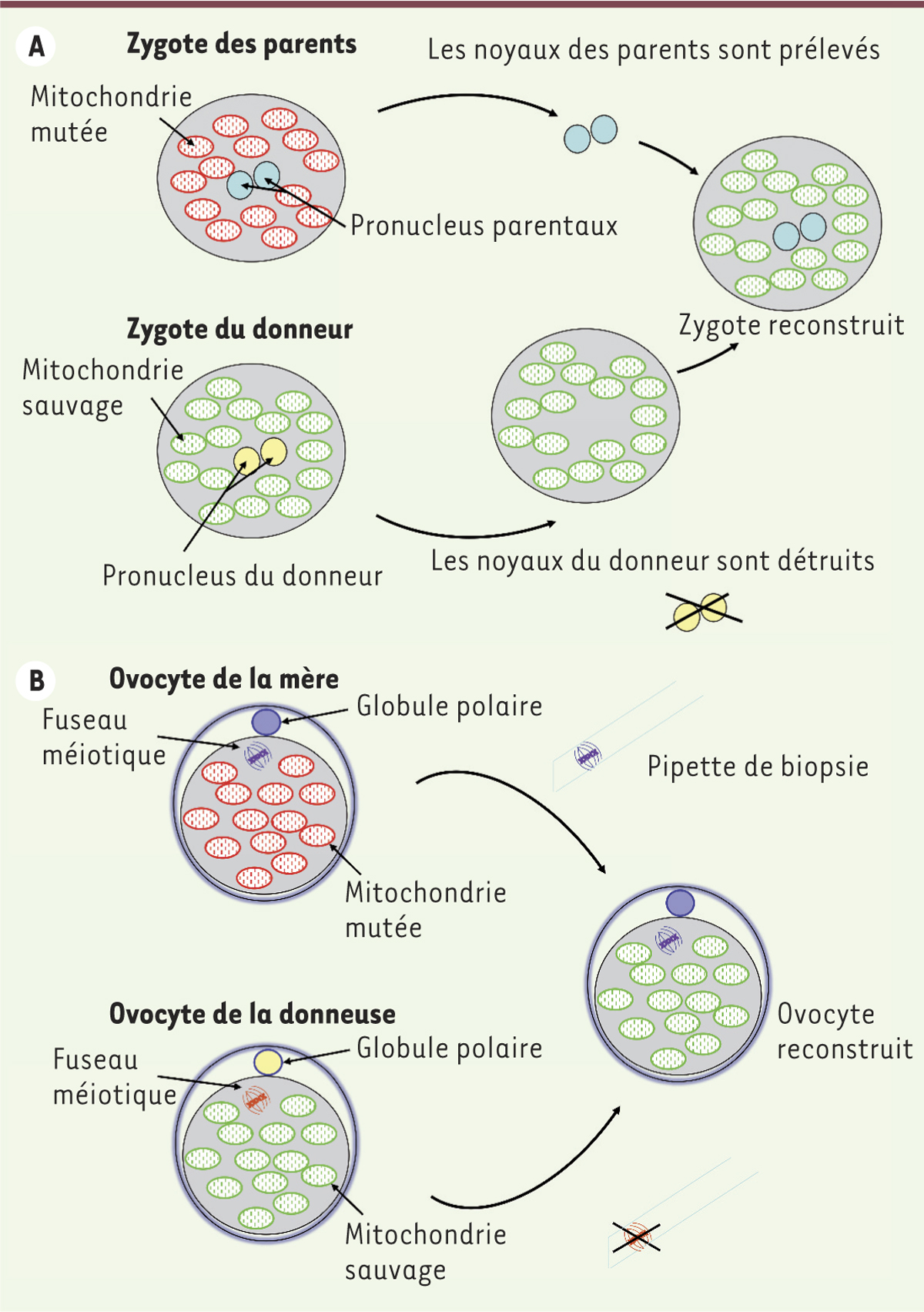
La première application de transfert nucléaire sur des embryons humains a été rapportée en 2010 par l’équipe de Craven et al à Newcastle, avec le transfert de pronoyaux entre des zygotes anormaux (mono et/ou trinucléés) [8]. La procédure a consisté à prélever un karyoplaste2 contenant les pronoyaux d’un zygote A, et à le transférer sous la zone pellucide d’un zygote B préalablement énucléé, donneur de cytoplasme, puis à fusionner les membranes grâce à la protéine virale inactivée du virus Sendaï (ou HVJ pour hemagglutinating virus of Japan) (Figure 1A). Le développement in vitro des zygotes ainsi reconstruits a été suivi jusqu’au stade de blastocyste. Le taux d’hétéroplasmie mesuré sur les embryons issus de cette reconstruction a montré une très faible contamination par l’ADNmt du zygote A (moins de 2 %), transféré de façon artéfactuelle avec le karyoplaste. Récemment, la même équipe a appliqué cette procédure à des zygotes humains normaux (diploïdes) et a montré i) que le taux d’ADNmt contaminant restait faible, ii) que les embryons dérivés ne présentaient pas un excès d’anomalies chromosomiques, et iii) qu’ils avaient un profil d’expression génique comparable aux témoins [9]. Cependant, la culture de cellules souches embryonnaires dérivées à partir de cinq embryons ainsi reconstitués, était associée dans un cas à une réversion génétique aboutissant à une colonisation de la lignée par l’ADNmt issu du karyoplaste, ADN qui devenait alors très rapidement majoritaire. Bien que le modèle de cellules souches embryonnaires ne reste qu’un modèle d’étude in vitro, ce résultat suggère qu’au cours de l’embryogenèse, une réversion génétique est possible.
| Figure 1.
Stratégie de prévention des maladies par mutation de l’ADN mitochondrial par transfert nucléaire. Le prélèvement précautionneux du matériel génétique nucléaire des parents peut être réalisé à partir d’un zygote (A. prélèvement des pro-noyaux 6 heures après la fécondation) ou d’un ovocyte (B. prélèvement du fuseau méiotique avant la fécondation). Le karyoplaste ainsi obtenu est porteur d’un faible nombre de mitochondries qui vont « contaminer » le cytoplasme du donneur et générer un état hétéroplasmique. |
Le transfert nucléaire entre ovocytes en métaphase de deuxième division méiotique semble une alternative efficace (Figure 1B), une équipe ayant obtenu la naissance de deux singes rhésus porteurs de moins de 3 % d’ADNmt du karyoplaste [10]. Très récemment, cette procédure a été appliquée à des ovocytes humains porteurs de mutations de l’ADNmt [11]. Les embryons résultant de ce transfert au stade préimplantatoire portaient des taux d’ADNmt contaminant très faibles (moins de 1 %). Cependant, la culture de cellules souches embryonnaires issues de ces embryons a confirmé la possibilité de réversions génétiques (dans 3 lignées sur 18). Ces observations soulèvent la question de possibles reversions génétiques in vivo, et donc du devenir des embryons/fœtus issus d’une telle procédure. Elles ne font que renforcer les incertitudes qui avaient été émises autour du don de cytoplasme.
Les premières incertitudes sont effectivement nées de l’observation de modèles de souris congéniques, c’est-à-dire porteuses d’un même ADN nucléaire et d’ADNmt qui diffèrent par une vingtaine de bases (polymorphismes). Des lignées de souris A et B ont été croisées successivement jusqu’à aboutir à la naissance de souriceaux porteurs dans leur génome nucléaire des gènes de la lignée B, et dans leur génome mitochondrial, des gènes de la lignée A, et réciproquement. Le phénotypage de ces nouvelles lignées de souris montre que des ADNmt différents, en interaction avec un même génome nucléaire, sont capables de modifier les apprentissages, les capacités exploratrices, le développement sensoriel, et l’anatomie cérébrale de ces animaux [12]. Une étude très récente a montré par ailleurs que l’échange des ADNmt entre 2 lignées de souris peut s’accompagner d’une amélioration de leur état de santé au fil du temps (en particulier, diminution des cas d’obésité, de diabète, et médiane de durée de vie allongée) [13]. Ces études montrent que des ADNmt différents, en interaction avec un même génome nucléaire, sont capables de modifier des fonctions cognitives essentielles. Elles soulignent l’importance de l’existence d’un dialogue nucléo-mitochondrial qui reste encore très mal connu. Pourtant ce dialogue a déjà été mis en cause dans l’expression phénotypique d’une mutation localisée dans un gène nucléaire. Le phénotype « surdité » de souris mutées dans le gène Ahl (age-related hearing loss gene), ne s’exprime en effet qu’en cas de co-mutation touchant un gène mitochondrial codant l’ARNt-Arg [14]. Chez l’humain, la pénétrance3, incomplète des mutations de l’ADNmt responsables de la neuropathie optique de Leber4, serait liée à l’existence d’un ou plusieurs gènes nucléaires modificateurs localisés sur le chromosome X [15]. En conclusion, le transfert nucléaire qui aboutit à l’introduction d’un génome « étranger » dans la cellule, pourrait modifier brutalement le dialogue mitochondries-noyau et être source de dysfonctionnements cellulaires.
Indépendamment de l’implication du génome nucléaire, il est possible que l’état « hétéroplasmique » soit délétère par lui-même. En effet, chez les mammifères, deux phénomènes se conjuguent pour maintenir un état homoplasmique. D’une part, la transmission monoparentale de l’ADNmt assure, en dehors du cas particulier des mutations touchant cet ADN, un état homoplasmique chez les enfants d’un couple. D’autre part, le phénomène de bottleneck5, observé à de multiples reprises chez différents mammifères, et qui correspond à une restriction importante du nombre de mitochondries fondatrices d’un individu à un moment donné de l’ovogenèse chez la femme/femelle, induit une perte de variance génétique à la génération suivante [16-18]. Or le transfert nucléaire induit de facto un état hétéroplasmique, car le transfert de karyoplaste s’accompagne toujours d’un transfert artéfactuel de mitochondries. Des études menées sur des modèles murins suggèrent que l’hétéroplasmie par elle-même serait source de dysfonctionnements cellulaires [19-20]. Les souris nées après transfert cytoplasmique entre 2 espèces de souris porteuses de séquences d’ADNmt qui diffèrent par quelques polymorphismes, mais sans pathologie associée, peuvent développer de l’hypertension artérielle, des modifications cardiaques en rapport avec une hypertension pulmonaire, une augmentation de la masse et de la graisse corporelles, et présentent des anomalies électrolytiques et hématologiques [19]. Une étude plus récente a montré que des souris hétéroplasmiques présentent une réduction de leur consommation alimentaire et des échanges respiratoires, une réponse accentuée au stress, une réduction de leur activité et même, une déficience cognitive par rapport à leur contrôle homoplasmique [20].
Ces risques pourraient être considérés comme faibles comparés au bénéfice apporté par l’application du don de cytoplasme en terme de prévention des maladies graves résultant de mutations de l’ADNmt. Cependant, certaines équipes envisagent de proposer le transfert de fuseau méiotique (ovocyte) ou de pronoyaux (zygote) comme aide à la reproduction humaine, afin de pallier les effets de l’âge de la femme sur la qualité de l’ovocyte. En effet, plusieurs études ont montré l’importance de facteurs cytoplasmiques (dont la mitochondrie) dans la compétence ovocytaire [21]. Ces procédures pourraient ainsi être proposées à des femmes de plus de 38 ans, ou en échec de grossesse après fécondation in vitro. Une équipe a déjà réalisé un transfert nucléaire pour un couple qui avait pour antécédent un arrêt de développement embryonnaire précoce, au stade de 2 cellules. Le sperme du conjoint a été utilisé pour la fécondation des ovocytes de la mère et de la donneuse d’ovocytes. Le transfert nucléaire a été réalisé pour 7 zygotes et 5 embryons ont été « reconstruits ». La patiente a été enceinte d’une grossesse triple, mais des complications obstétricales n’ont pas permis d’aboutir à la naissance d’enfant vivant [22].