| |
| Med Sci (Paris). 33(5): 506–511. doi: 10.1051/medsci/20173305014.Les micro-ARN Nouveaux acteurs du contrôle hypothalamique de la fertilité Andrea Messina,1* Fanny Langlet,2 and Vincent Prevot3** 1Service d’Endocrinologie, Diabétologie et Métabolisme, Hôpital universitaire de Lausanne, Lausanne, Suisse 2Columbia University Medical Center and Berrie Diabetes Center, New York, États-Unis 3Laboratoire de Développement et de Plasticité du Cerveau Neuroendocrine, FHU 1000 days for health, Inserm U1172, Université de Lille, Lille, France |
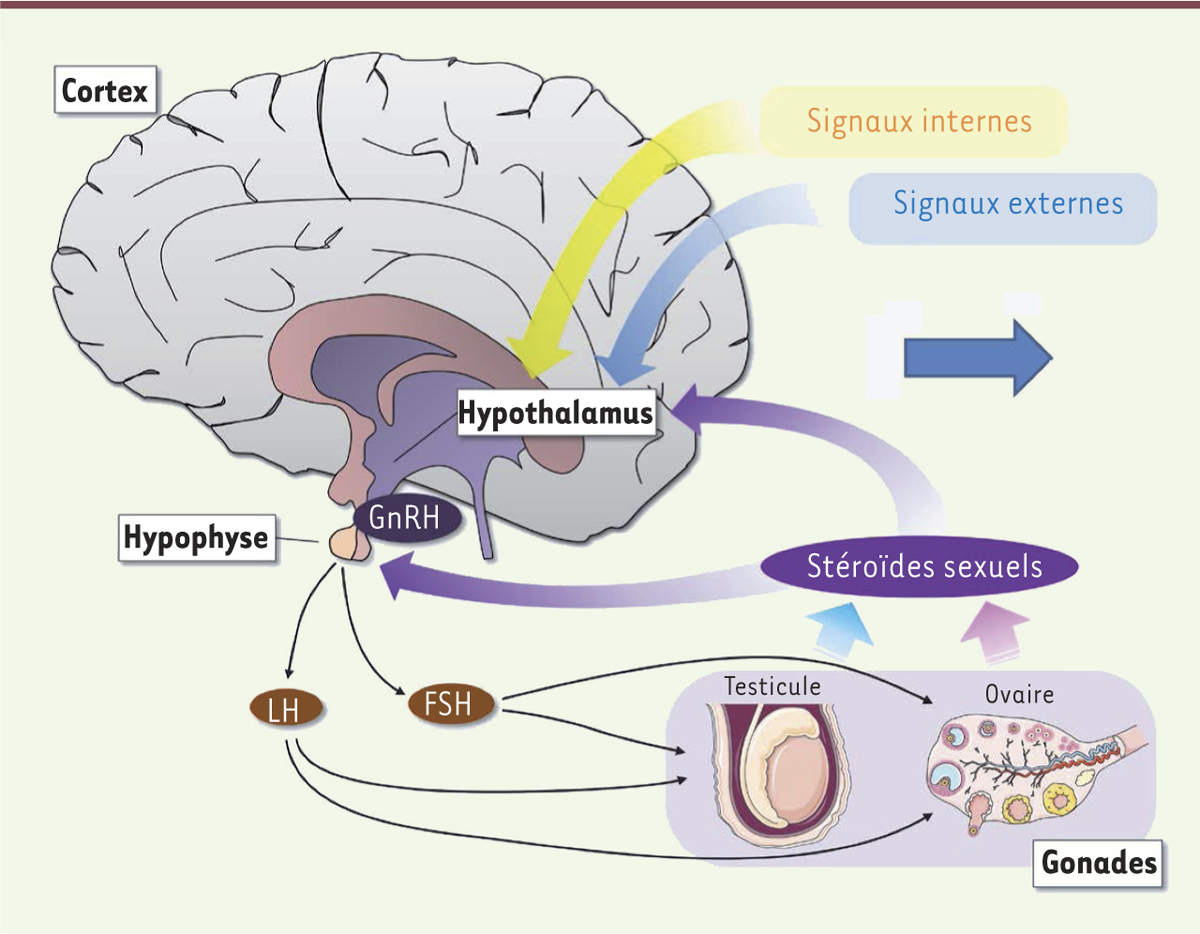
Vignette (Photo © Inserm – Pascal Heitzler). La complexité des mécanismes cellulaires et moléculaires qui participent à la physiologie des êtres vivants est le résultat d’un long processus d’évolution reposant sur la sélection naturelle et déterminé par le succès reproducteur des individus. En permettant la transmission des gènes à la génération suivante et la fixation de caractères avantageux à la survie des espèces, la reproduction sexuée joue un rôle prépondérant dans l’évolution. Chez les mammifères, la reproduction est un processus finement régulé par l’axe hypothalamo-hypophyso-gonadotrope (HPG) ; il s’adapte à la fois aux fluctuations des paramètres internes comme l’état énergétique ou l’horloge biologique, mais aussi environnementaux comme le cycle jour/nuit, les saisons, la présence d’un prédateur ou d’un partenaire potentiel. Le réseau de neurones hyper spécialisés capable d’intégrer efficacement toutes ces informations afin de coordonner la maturation sexuelle, de déclencher la puberté et de contrôler la fécondité à l’âge adulte, siège dans l’hypothalamus, une petite structure située sur la face ventrale du cerveau. Ce réseau de neurones hypothalamiques converge vers les neurones qui sécrétent, dans le sang du système porte hypothalamo-hypophysaire, la neurohormone GnRH (gonadotropin releasing hormone) ou gonadolibérine [1]. Dans l’hypophyse, la GnRH contrôle la synthèse et la sécrétion dans la circulation sanguine des gonadotrophines : l’hormone lutéinisante (LH) et l’hormone folliculo-stimulante (FSH). Ces deux gonadotrophines agissent au niveau des gonades que sont les ovaires et les testicules, en provoquant, entre autres, la libération des hormones stéroïdes sexuelles : respectivement l’œstradiol et la testostérone (Figure 1).
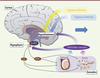 | Figure 1.
L’axe hypothalamo-hypophyso-gonadotrope (HPG). LH : hormone lutéinisante ; FSH : hormone folliculo-stimulante. |
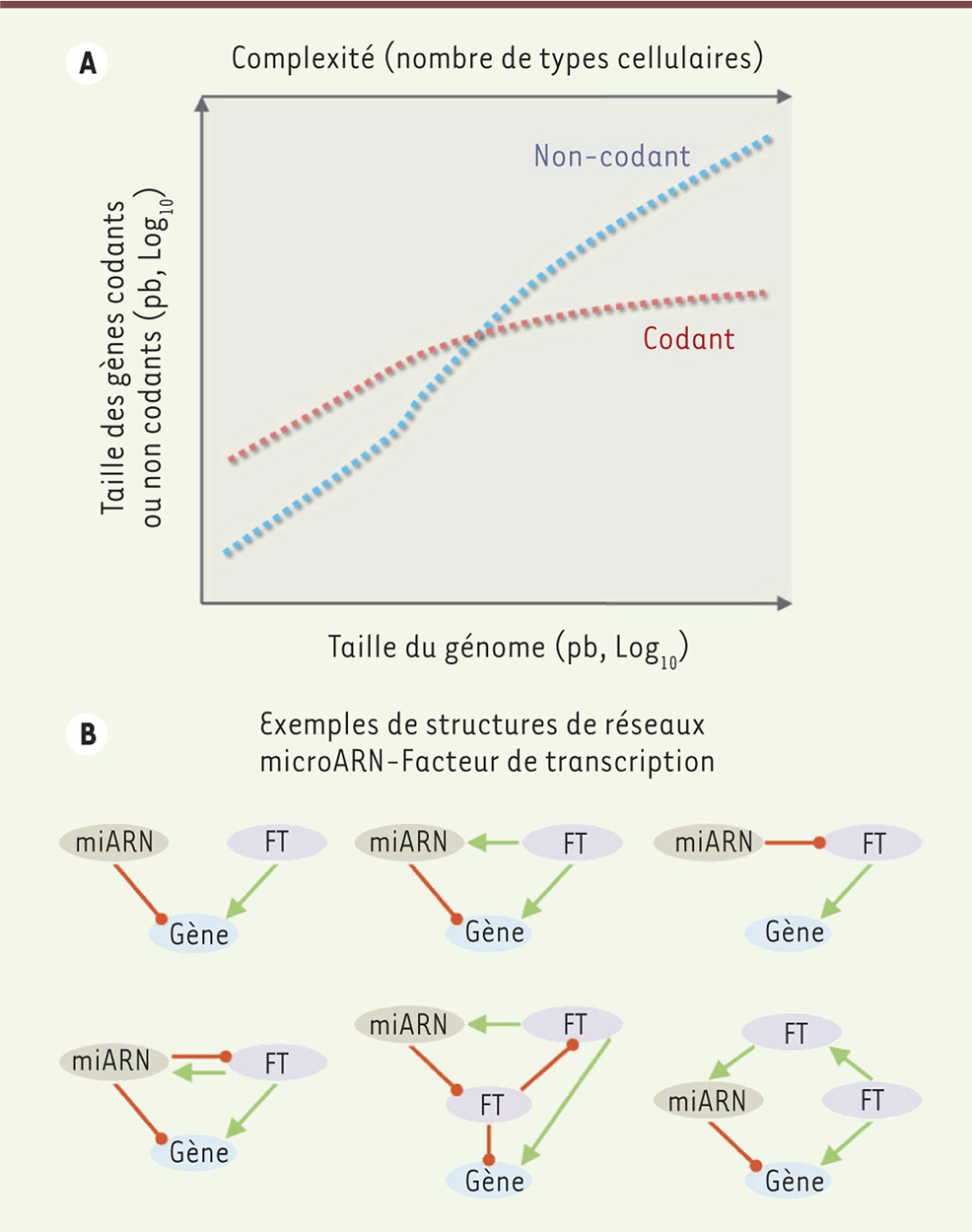
L’activité des neurones à GnRH est indispensable au contrôle de la fertilité et la GnRH est le principal neuropeptide régulateur de la reproduction. Toute altération congénitale ou fonctionnelle à l’origine d’un déficit ou d’une absence de sécrétion de GnRH entraîne des troubles de la fertilité, voire une infertilité. C’est notamment le cas pour l’hypogonadisme hypogonadotrope congénital (ou CHH), une maladie génétique rare où l’absence de signalisation de la GnRH hypothalamique provoque l’absence de puberté [2]. Au cours des dernières décennies, les efforts de la communauté scientifique pour comprendre les causes de cette maladie se sont focalisés sur des études génétiques chez des patients atteints de CHH et sur des études fonctionnelles à partir de modèles de rongeurs génétiquement modifiés. De nombreux gènes ont ainsi été identifiés mais la compréhension des mécanismes impliqués dans le contrôle hypothalamique de la puberté et de la reproduction demeure encore incomplète. L’une des raisons de cette méconnaissance est que ces études se sont focalisées sur les gènes codant pour une protéine et ont négligé une grande famille de gènes connue depuis plus d’un demi-siècle mais dont l’étendue et l’importance n’ont été découvertes que récemment : les gènes ne codant pas pour une protéine mais produisant un ARN non codant, les ARNnc. Les premiers ARNnc identifiés dans les années 1950 furent les ARN ribosomiaux (ARNr) et de transfert (ARNt), connus pour leur rôle essentiel dans la synthèse protéique. Trente ans plus tard furent découverts les petits ARN nucléaires (ARNsn, pour small nuclear), impliqués dans le processus de maturation des ARN messagers, initialement considérés comme des éléments structurels. Le monde des ARNnc a été bouleversé au début des années 2000 à la suite de la découverte de l’interférence par ARN1 pour laquelle Andrew Z. Fire et Craig C. Mello ont été récompensés d’un Prix Nobel en 2006 [3, 4]. Certains ARNnc, tels les micro-ARN, les longs ARN non codants (ARNlnc) ou encore les piARN (Piwi interacting RNA), ont montré qu’ils étaient d’importants régulateurs de l’expression génique. De nouveaux membres de ces familles ne cessent d’être identifiés grâce à l’avènement de nouvelles technologies comme le séquençage de l’ARN. Bien que toutes les fonctions des ARNnc ne soient pas encore connues, leur rôle dans le contrôle de différents mécanismes complexes ne fait plus aucun doute. Cette vocation « d’organisateurs de la complexité » des ARNnc a d’ailleurs été très bien illustrée par des études de génétique de l’évolution qui ont montré que la complexité des êtres vivants n’est pas corrélée au nombre de gènes codant pour une protéine mais au nombre de gènes non codants (Figure2A) [5]. |
Micro-ARN et système nerveux central Les micro-ARN (miARN) sont de courts ARN simple brin non codants de 21 à 25 nucléotides dont le rôle est de contrôler l’expression génique au niveau post-transcriptionnel. Ils sont désormais considérés comme des acteurs majeurs de l’épigénétique. Les miARN sont caractérisés par une biogenèse « atypique ». Transcrits à partir de l’ADN génomique sous la forme de longs précurseurs (les pri-miARN, pour primary-miRNA), ils subissent une première étape de maturation dans le noyau réalisée par l’enzyme Drosha (ribonucléase de type III)2,. Les précurseurs sont ensuite exportés dans le cytoplasme où ils subissent une deuxième et dernière transformation par l’enzyme Dicer (double-stranded RNA endoribonuclease)3,. Les miARN matures sont intégrés dans le complexe protéique RISC (RNA-induced silencing complex)4 où ils vont servir de guide pour le recrutement de l’ARN messager-cible conduisant ainsi à sa répression traductionnelle ou à sa dégradation. Ce dernier est donc ciblé par un micro-ARN uniquement s’il possède, dans sa séquence, un élément complémentaire spécifique de l’ARN messager appelé site de liaison (binding site). Un miARN peut réprimer des centaines de cibles différentes et un même ARN messager est en général la cible de plusieurs miARN qui agissent en synergie. Cette modalité d’action combinatoire illustre la capacité des miARN à « travailler » en réseaux extrêmement complexes. Viennent s’ajouter à cela les facteurs de transcription : des protéines spécialisées qui, en se liant à des cibles spécifiques de l’ADN génomique, activent ou répriment l’expression des gènes cibles en modulant l’activité de leur région promotrice. Ils créent ainsi un niveau supplémentaire de complexité. Ainsi, miARN et facteurs de transcription opèrent de concerve et constituent des réseaux génétiques capables de garantir le déroulement de processus biologiques complexes en coordonnant l’expression de gènes-clés (Figure 2B).
 | Figure 2.
Évolution de la complexité biologique des organismes et de la composition de leur génome, et réseaux génétiques impliquant micro-ARN et facteurs de transcription. (A) Relation entre le nombre de gènes codant pour une protéine (en rouge) et gènes non-codant (en bleu) dans des organismes de complexité biologique croissante. Le nombre de gènes ne codant pas pour une protéine croît de manière exponentielle avec le nombre de types cellulaires distincts dans un organisme alors que le nombre de gènes codant pour une protéine atteint une asymptote (adapté de [ 5]). (B) Exemples de réseaux génétiques impliquant les miARN et les facteurs de transcription (FT) dans la régulation de l’expression de gènes codant pour une protéine. Les traits rouges se terminant par un arrondi figurent une action inhibitrice sur l’expression de la cible ; les flèches vertes traduisent une action activatrice sur l’expression de la cible. |
Depuis leur découverte, de nombreux miARN ont été décrits comme des facteurs-clés dans le développement et le fonctionnement du système nerveux central [6] (→). Certains jouent un rôle essentiel dans la genèse et la différenciation des cellules neurales (neurones et cellules gliales). En effet, neurones, astrocytes et oligodendrocytes, les trois principaux types cellulaires présents dans le système nerveux central, dérivent d’un précurseur neural commun ayant subi un programme de différenciation séquentiel complexe. Le complexe transcriptionnel REST (RE1-silencing transcription factor) est essentiel à la répression des gènes neuronaux dans les cellules non neuronales (comme les astrocytes ou les oligodendrocytes). L’augmentation de miR-9 (miARN-9) et miR-124 pendant la différenciation neuronale, qui induit la répression des éléments de ce complexe répresseur, permet, à l’inverse, l’augmentation de l’expression des gènes neuronaux dans les futures cellules neuronales [7, 8] (→). Les miARN sont également impliqués dans le bon fonctionnement des neurones matures. Ils contrôlent, entre autres, la transmission de l’influx nerveux au niveau synaptique. Ainsi, miR-132, miR-134 et miR-138, plus récemment identifié, peuvent contrôler la morphologie des dendrites et des épines synaptiques, jouant ainsi un rôle très important dans l’apprentissage et la mémoire [9]. Certains miARN semblent également être exprimés dans des structures cérébrales spécifiques [10] et à des périodes particulières de la vie [11, 12].
(→) Voir la Nouvelle de M. Coolen et L. Bally-Cuif, m/s n° 10, octobre 2008, p. 787 (→) Voir la Synthèse de M. Coolen et L. Bally-Cuif, m/s n° 11, novembre 2013, p. 1010 |
Initialement, la participation des miARN dans l’axe hypothalamo-hypophyso-gonadotrope a été relaté au niveau des gonades et de l’hypophyse. En effet, l’analyse de différents modèles de souris modifiées pour que la maturation des miARN au niveau des gonades soit altérée, a montré qu’ils étaient essentiels pour le fonctionnement des testicules et des ovaires. Plus précisément, les miARN sont impliqués dans le contrôle de l’expression de gènes qui sont nécessaires à la division mitotique, à la division méiotique et la phase post-méiotique de la spermatogenèse dans le testicule, et dans les processus de stéroïdogenèse, d’ovulation, et dans le développement et le fonctionnement des corps jaunes, au niveau des ovaires [13, 14]. Les miARN contrôlent également l’expression et/ou la sécrétion des gonadotrophines (LH et FSH) au niveau de l’hypophyse. En agissant sur les cellules gonadotropes, la GnRH modifie l’expression de miARN qui seraient impliqués dans la régulation de sa signalisation et dans la sécrétion de FSH et de LH [15, 16]. Toujours au niveau de la glande pituitaire, l’expression de LH est en particulier contrôlée par le miR-200, le miR-429 [17] et le miR-7a2 [18]. Les miARN participeraient au contrôle central de la puberté. Des études d’association génomique (genome wide association study, GWAS) réalisées chez l’homme, ont montré un lien entre l’âge de puberté et le locus lin28, un gène responsable de la répression spécifique des miARN de la famille let-7
5 [19]. L’axe let-7/lin28, déjà connu pour son rôle dans les cellules souches et dans le développement embryonnaire, pourrait donc être impliqué dans le contrôle de la puberté : cette hypothèse a été corroborée par des études d’expression transcriptionnelle dans l’hypothalamus de rats au cours de la péri-puberté [20]. |
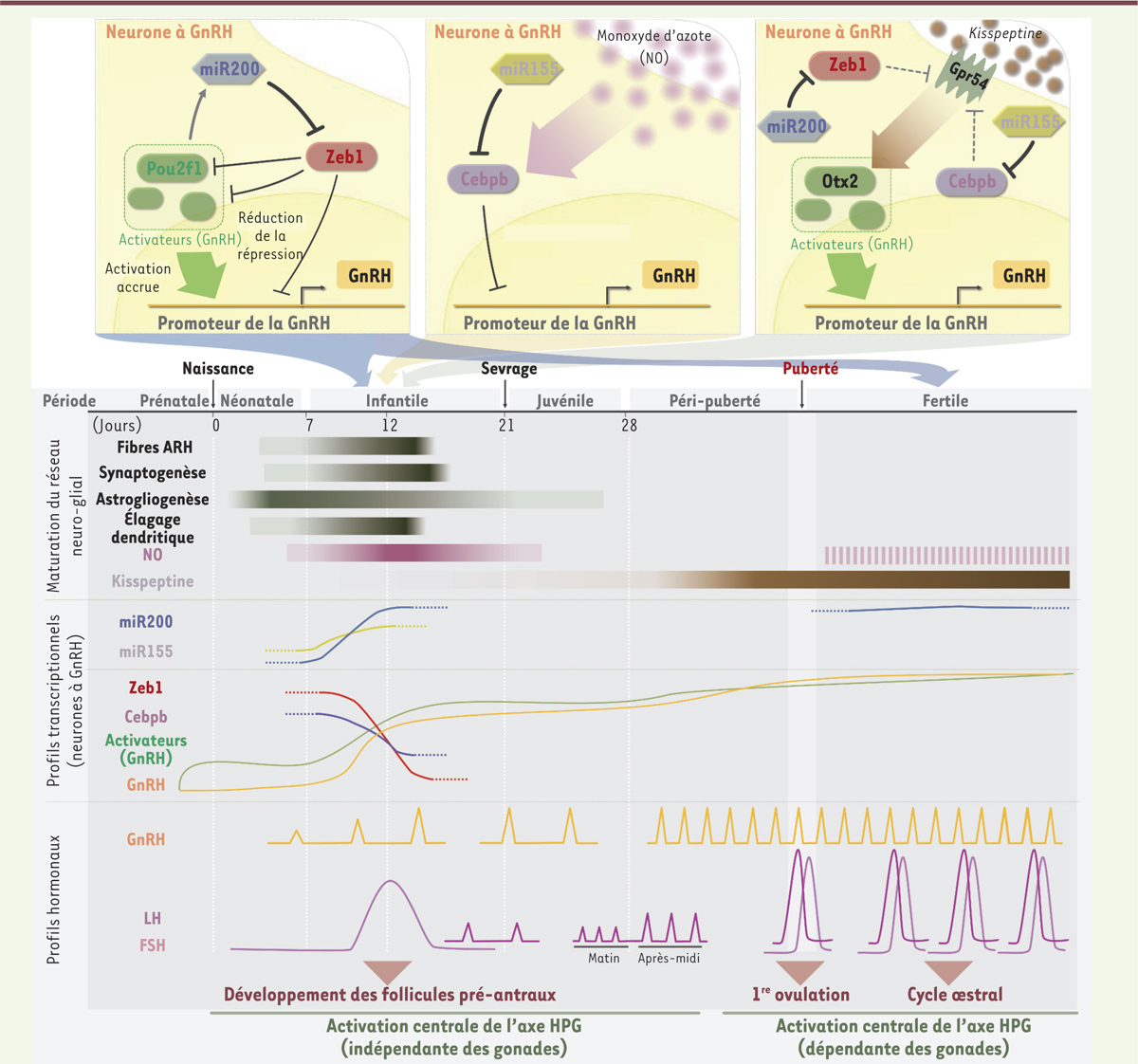
Rôle des miARN dans les neurones à GnRH La maturation sexuelle et la puberté nécessitent l’augmentation postnatale de l’expression de la GnRH et l’activation des neurones à GnRH, sous l’influence des neurones qui sécrétent la kisspeptine6, et de l’environnement métabolique [1, 21, 22]. Néanmoins, malgré les efforts de la communauté scientifique pour le comprendre, le processus extrêmement complexe et finement régulé de la puberté reste une énigme de la biologie moderne. Nous avons récemment exploré le rôle des miARN dans les neurones à GnRH en utilisant un modèle de souris génétiquement modifiées [23] dont les neurones à GnRH n’expriment pas l’enzyme Dicer et donc ne produisent pas de miARN matures (les souris gDiKO, GnRH specific Dicer KO [knock-out]). Nous avons ainsi pu démontrer que certains miARN constituent le noyau d’un réseau génétique complexe qui contrôle l’augmentation de l’expression de la GnRH post-natale et permettent le déclenchement de la puberté. Au cours de la période néonatale, les niveaux d’expression de GnRH sont très bas. Ils augmentent ensuite entre la première et la deuxième semaine de vie (entre P7 [jour 7 post-natal] et P12) ; cette période est celle de la mini-puberté qui constitue la première activation de l’axe HPG indispensable à l’initiation de la maturation des gonades chez les rongeurs mais aussi chez l’homme [21, 24]. Les souris génétiquement modifiées gDiKO présentent une diminution progressive de l’expression de l’ARNm de GnRH, une inactivation de son promoteur, et une perte totale de l’expression de la protéine dans le cerveau après le sevrage, à l’origine, chez ces souris mutantes, d’un hypogonadisme hypogonadotrope prononcé mimant les symptômes des patients atteints de CHH : arrêt du développement sexuel, absence de puberté, et infertilité. En étudiant l’expression des facteurs de transcription connus pour contrôler l’activité du promoteur de la GnRH pendant cette période critique (P7-P12), nous avons découvert que l’augmentation marquée de l’expression de facteurs activateurs observée dans les neurones à GnRH de souriceaux sauvages, n’était pas retrouvée chez les souris gDiKO. L’invalidation de l’expression de Dicer dans les neurones à GnRH augmentait, de plus, l’expression de facteurs réprimant l’activité du promoteur de la GnRH. Ces changements d’expression protéique étaient associés, au cours de cette même période critique, à une modification profonde du profil d’expression des miARN. En associant des analyses bioinformatiques et des expériences fonctionnelles in vivo et in vitro, nous avons pu identifier les acteurs principaux du réseau génétique essentiel au processus de maturation sexuelle postnatal. Le miR-200/429 et le miR-155 ainsi que leurs cibles respectives, Zeb1 (Zinc finger E-box-binding homeobox 1) et Cebpb (CCAAT/enhancer-binding protein beta), contrôlent l’équilibre entre les facteurs répresseurs et activateurs du promoteur du gène codant pour la GnRH. Le facteur de transcription Cebpb, cible du miR-155, se lie au promoteur de la GnRH et réprime l’expression du gène. Le facteur de transcription Zeb1, cible du miR-200/429, réprime, quant à lui, directement le gène de la GnRH mais également certains de ses activateurs. En réprimant ces répresseurs durant la phase de transition critique entre la période infantile et juvénile, le miR-200/429 et le miR-155 permettent une augmentation durable de l’expression de la GnRH qui est nécessaire à la maturation sexuelle et, au moment approprié, au déclenchement de la puberté (Figure 3).
 | Figure 3.
Micro-ARN et contrôle hypothalamique de la fertilité. Contribution possible de miR-155 (miARN-155), de la famille des miR-200 et de leurs gènes cibles à l’augmentation de l’expression génique de la GnRH en période infantile et à l’intégration des neurones à GnRH postmigratoires dans le réseau neuronal responsable du déclenchement de la puberté. Maturation du réseau neuroglial à GnRH (panneaux supérieurs). Bien que le développement morphologique de l’hypothalamus soit presque complet à la naissance, les axones des neurones situés dans le noyau arqué de l’hypothalamus (ARH) n’atteignent la région préoptique qu’au cours de la période infantile, en même temps que l’astrogliogenèse, la synaptogenèse et l’élagage dendritique. Ces événements de maturation pourraient être à l’origine du « switch » opéré par les miRNA dans le réseau de facteurs de transcription contrôlant l’activité du promoteur du gène de la GnRH pendant la période infantile. Profils hormonaux (panneau inférieur). Les profils hormonaux illustrés dans le schéma sont ceux d’une souris femelle. Chez les femelles, la première période d’activation postnatale de l’axe HPG (hypothalamo-hypophyso-gonadotrope) coïncide avec l’arrivée des fibres ARH dans la région préoptique, ce qui entraîne une production de l’hormone folliculo-stimulante (FSH) qui déclenche la croissance du premier groupe de follicules ovariens destinés à être libérés à la puberté, ainsi qu’une élévation sporadique des niveaux de l’hormone lutéinisante (LH) qui contribue à leur maturation. Cette période critique de maturation sexuelle rappelle fortement la «mini-puberté» chez l’homme [ 24]. La deuxième période d’activation survient au cours de la péripuberté, lorsqu’un rythme diurne de libération de la LH accélère le développement fonctionnel des ovaires. Une troisième et dernière période d’activation coïncide avec le moment où les follicules ovariens atteignent leur pleine maturité, le stade de De Graaf, et libèrent des quantités massives de stéroïdes ovariens ; ils exercent une rétroaction positive sur l’HPG, coordonnant l’apparition du premier pic préovulatoire de GnRH et de LH/FSH et déclenchant la première ovulation, conférant ainsi la fertilité à l’individu. Chez les mâles comme chez les femelles, les premiers événements de la maturation sexuelle sont également initiés par l’hypothalamus en période postnatale. GnRH : gonadotropin releasing hormone ; NO : monoxyde d’azote ; Zeb1 : zinc finger E-box-binding homeobox 1 ; Cebpb : CCAAT/enhancer-binding protein beta (voir pour revue [ 21]). |
Les effets de ce réseau génétique complexe ne semblent pas se limiter au contrôle de l’expression de GnRH. Zeb1 et Cebpb seraient aussi responsables de la répression du récepteur de la kisspeptine. Une interaction étroite existe également entre les neurones à GnRH, leurs réseaux miRNA-facteurs de transcription et les neurones hypothalamiques synthétisant le monoxyde d’azote (NO) qui relayent les informations métaboliques aux neurones à GnRH [25] et dont l’activité augmente au moment de la minipuberté [23]. La répression de l’activité du promoteur de la GnRH par Cebpb est directement régulée par le NO [26] (Figure 3). L’inhibition de l’enzyme de synthèse du NO (la NO synthase) chez les souris gDiKO, permet de restaurer partiellement l’expression de GnRH, en l’absence du miR-155 [23]. En inhibant ces répressions, les miR-200/429 et miR-155 permettraient donc aux neurones à GnRH de moduler leur sensibilité aux signaux externes au cours du développement postnatal. Ces réseaux de gènes jouent non seulement un rôle sur le déclenchement de la puberté mais également dans le maintien de la fertilité à l’âge adulte [23]. |
Nouvelles recherches et santé publique Nos résultats ont permis de découvrir le rôle-clé que jouent les miARN dans le contrôle hypothalamique de la puberté et de la fertilité. Ils permettent d’envisager désormais de nombreuses études visant à élucider les diverses fonctions des familles d’ARN non codants. De nouvelles recherches seront nécessaires pour identifier l’activité des autres miARN dans les neurones à GnRH et leur rôle dans les autres cellules composant le réseau hypothalamique qui contrôle la fertilité. Il sera ainsi très intéressant d’évaluer l’implication des miARN dans la coordination de ces différents types cellulaires essentiels à la maturation sexuelle et au maintien de la fertilité. L’environnement, interne et externe, d’un organisme influence les mécanismes de contrôles épigénétiques [27–32] (→), notamment ceux auxquels participent les miARN [33–35] (→). L’établissement des bases moléculaires de la modulation de l’expression des miARN en fonction de ces paramètres internes et externes (horloge biologique, hormones sexuelles, contexte métabolique, cycle circadien, exposition au stress, odeurs, etc.) représente donc un défi particulièrement important. (→) Voir la Synthèse de C. Delpierre et al., m/s n° 1, janvier 2016, p. 21, et la Synthèse de C. Junien et al., m/s n° 1, janvier 2016, p. 27 (→) Voir la Synthèse de C. Mauduit et al., m/s n° 1, janvier 2016, p. 45, et la Synthèse de C. Junien et al., m/s n° 1, janvier 2016, p. 35 L’identification de miR-200/429 et de miR-155 comme nouveaux acteurs essentiels dans le contrôle de l’expression de la GnRH et dans la survenue de la puberté [23], tout comme la découverte de l’importance de miR-7a [18], dont l’expression augmente aussi dans les neurones à GnRH au moment de la mini-puberté [23], dans la fonction de l’axe gonadotrope pourraient avoir des implications en santé humaine [36]. Dans cette perspective, de nouvelles études seront nécessaires afin de valider ces miARN comme des outils diagnostiques et thérapeutiques dans le cadre de déficience grave en GnRH hypothalamique congénitale ou fonctionnelle. Une meilleure connaissance des miARN chez l’homme pourrait donc aboutir à de nouvelles stratégies thérapeutiques pour la modulation de l’axe reproducteur dans des cas de déficits fonctionnels (puberté précoce ou retardée, aménorrhée d’origine hypothalamique) ou, éventuellement, pour l’obtention d’un effet contraceptif. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Herbison AE. Control of puberty onset and fertility by gonadotropin-releasing hormone neurons . Nat Rev Endocrinol. 2016; ; 12 : :452.–466. 2.
Boehm U, Bouloux PM, Dattani MT, et al. Expert consensus document: European Consensus Statement on congenital hypogonadotropic hypogonadism–pathogenesis, diagnosis and treatment . Nat Rev Endocrinol. 2015; ; 11 : :547.–564. 3.
Fire AZ. Gene silencing by double-stranded RNA (Nobel Lecture) . Angew Chem Int Ed Engl. 2007; ; 46 : :6966.–6984. 4.
Mello CC. Return to the RNAi world: rethinking gene expression and evolution (Nobel Lecture) . Angew Chem Int Ed Engl. 2007; ; 46 : :6985.–6994. 5.
Liu G, Mattick JS, Taft RJ. A meta-analysis of the genomic and transcriptomic composition of complex life . Cell Cycle. 2013; ; 12 : :2061.–2072. 6.
Coolen M, Bally-Cuif L. Microrégulation aux frontières (cérébrales) . Med Sci (Paris). 2008; ; 24 : :787.–789. 7.
Shenoy A, Blelloch RH. Regulation of microRNA function in somatic stem cell proliferation and differentiation . Nat Rev Mol Cell Biol. 2014; ; 15 : :565.–576. 8.
Coolen M, Bally-Cuif L. Les multiples facettes d’un petit régulateur . Med Sci (Paris). 2013; ; 29 : :1010.–1017. 9.
Bicker S, Lackinger M, Weiss K, Schratt G. MicroRNA-132, -134, and -138: a microRNA troika rules in neuronal dendrites . Cell Mol Life Sci. 2014; ; 71 : :3987.–4005. 10.
Bak M, Silahtaroglu A, Moller M, et al. MicroRNA expression in the adult mouse central nervous system . RNA. 2008; ; 14 : :432.–444. 11.
Ziats MN, Rennert OM. Identification of differentially expressed microRNAs across the developing human brain . Mol Psychiatry. 2014; ; 19 : :848.–852. 12.
Miska EA, Alvarez-Saavedra E, Townsend M, et al. Microarray analysis of microRNA expression in the developing mammalian brain . Genome Biol. 2004; ; 5 : :R68.. 13.
Imbar T, Eisenberg I. Regulatory role of microRNAs in ovarian function . Fertil Steril. 2014; ; 101 : :1524.–1530. 14.
Papaioannou MD, Nef S. microRNAs in the testis: building up male fertility . J Androl. 2010; ; 31 : :26.–33. 15.
Lannes J, L’Hote D, Garrel G, et al. Rapid communication: A microRNA-132/212 pathway mediates GnRH activation of FSH expression . Mol Endocrinol. 2015; ; 29 : :364.–372. 16.
Lannes J, L’Hote D, Fernandez-Vega A, et al. A regulatory loop between miR-132 and miR-125b involved in gonadotrope cells desensitization to GnRH . Sci Rep. 2016; ; 6 : :31563.. 17.
Hasuwa H, Ueda J, Ikawa M, Okabe M. miR-200b and miR-429 function in mouse ovulation and are essential for female fertility . Science. 2013; ; 341 : :71.–73. 18.
Ahmed K, LaPierre MP, Gasser E, et al. Loss of microRNA-7a2 induces hypogonadotropic hypogonadism and infertility . J Clin Invest. 2017; ; 127 : :1061.–1074. 19.
Elks CE, Perry JR, Sulem P, et al. Thirty new loci for age at menarche identified by a meta-analysis of genome-wide association studies . Nat Genet. 2010; ; 42 : :1077.–1085. 20.
Sangiao-Alvarellos S, Manfredi-Lozano M, Ruiz-Pino F, et al. Changes in hypothalamic expression of the Lin28/let-7 system and related microRNAs during postnatal maturation and after experimental manipulations of puberty . Endocrinology. 2013; ; 154 : :942.–955. 21.
Prevot V. Puberty in mice and rats . In Plant TM, Zeleznik J, eds. Knobil and Neill’s Physiology of Reproduction . New York: : Elsevier; , 2015 : pp :1395.–1439. 22.
Tena-Sempere M. Physiological Mechanisms for the Metabolic Control of Reproduction . In : Plant TM, Zeleznik J, eds. Knobil and Neill’s Physiology of Reproduction . New York: : Elsevier; , 2015 : pp :1605.–1636. 23.
Messina A, Langlet F, Chachlaki K, et al. A microRNA switch regulates the rise in hypothalamic GnRH production before puberty . Nat Neurosci. 2016; ; 19 : :835.–844. 24.
Kuiri-Hanninen T, Sankilampi U, Dunkel L. Activation of the hypothalamic-pituitary-gonadal axis in infancy: minipuberty . Horm Res Paediatr. 2014; ; 82 : :73.–80. 25.
Bellefontaine N, Chachlaki K, Parkash J, et al. Leptin-dependent neuronal NO signaling in the preoptic hypothalamus facilitates reproduction . J Clin Invest. 2014; ; 124 : :2550.–2559. 26.
Belsham DD, Mellon PL. Transcription factors Oct-1 and C/EBPbeta (CCAAT/enhancer-binding protein-beta) are involved in the glutamate/nitric oxide/cyclic-guanosine 5’-monophosphate-mediated repression of mediated repression of gonadotropin-releasing hormone gene expression . Mol Endocrinol. 2000; ; 14 : :212.–228. 27.
Delpierre C, Lepeule J, Cordier S, et al. DOHaD - Les apports récents de l’épidémiologie . Med Sci (Paris). 2016; ; 32 : :21.–26. 28.
Junien C, Panchenko P, Pirola L, et al. Le nouveau paradigme de l’origine développementale de la santé et des maladies (DOHaD): épigénétique, environnement : preuves et chaînons manquants . Med Sci (Paris). 2016; ; 32 : :27.–34. 29.
Lomniczi A, Loche A, Castellano JM, et al. Epigenetic control of female puberty . Nat Neurosci. 2013; ; 16 : :281.–289. 30.
Lomniczi A, Wright H, Castellano JM, et al. Epigenetic regulation of puberty via zinc finger protein-mediated transcriptional repression . Nat Commun. 2015; ; 6 : :10195.. 31.
Mauduit C, Siddeek B, Benahmed M. Origine développementale et environnementale de l’infertilité masculine : rôle des perturbateurs hormonaux . Med Sci (Paris). 2016; ; 32 : :45.–50. 32.
Parent AS, Franssen D, Fudvoye J, et al. Developmental variations in environmental influences including endocrine disruptors on pubertal timing and neuroendocrine control: Revision of human observations and mechanistic insight from rodents . Front Neuroendocrinol. 2015; ; 38 : :12.–36. 33.
Romani M, Pistillo MP, Banelli B. Environmental Epigenetics: Crossroad between Public Health, Lifestyle, and Cancer Prevention . Biomed Res Int. 2015; ; 2015 : :587983.. 34.
Derghal A, Djelloul M, Trouslard J, Mounien L. An Emerging Role of micro-RNA in the Effect of the Endocrine Disruptors . Front Neurosci. 2016; ; 10 : :318.. 35.
Junien C, Panchenko P, Fneich S, et al. Épigénétique et réponses transgénérationnelles aux impacts de l’environnement : des faits aux lacunes . Med Sci (Paris). 2016; ; 32 : :35.–44. 36.
Crowley WF, Balasubramanian R. MicroRNA-7a2 suppression causes hypogonadotropism and uncovers signaling pathways in gonadotropes . J Clin Invest. 2017; ; 127 : :796.–797. |