| |
| Med Sci (Paris). 33(5): 494–497. doi: 10.1051/medsci/20173305012.Un nouveau lien entre des taux élevés d’homocystéine, les cancers et les maladies neurodégénératives Dominique Padovani1* 1UMR 8601, laboratoire de chimie et biochimie pharmacologiques et toxicologiques, CNRS-Université Paris Descartes, Sorbonne Paris Cité, 45, rue des Saints Pères, 75006Paris, France |
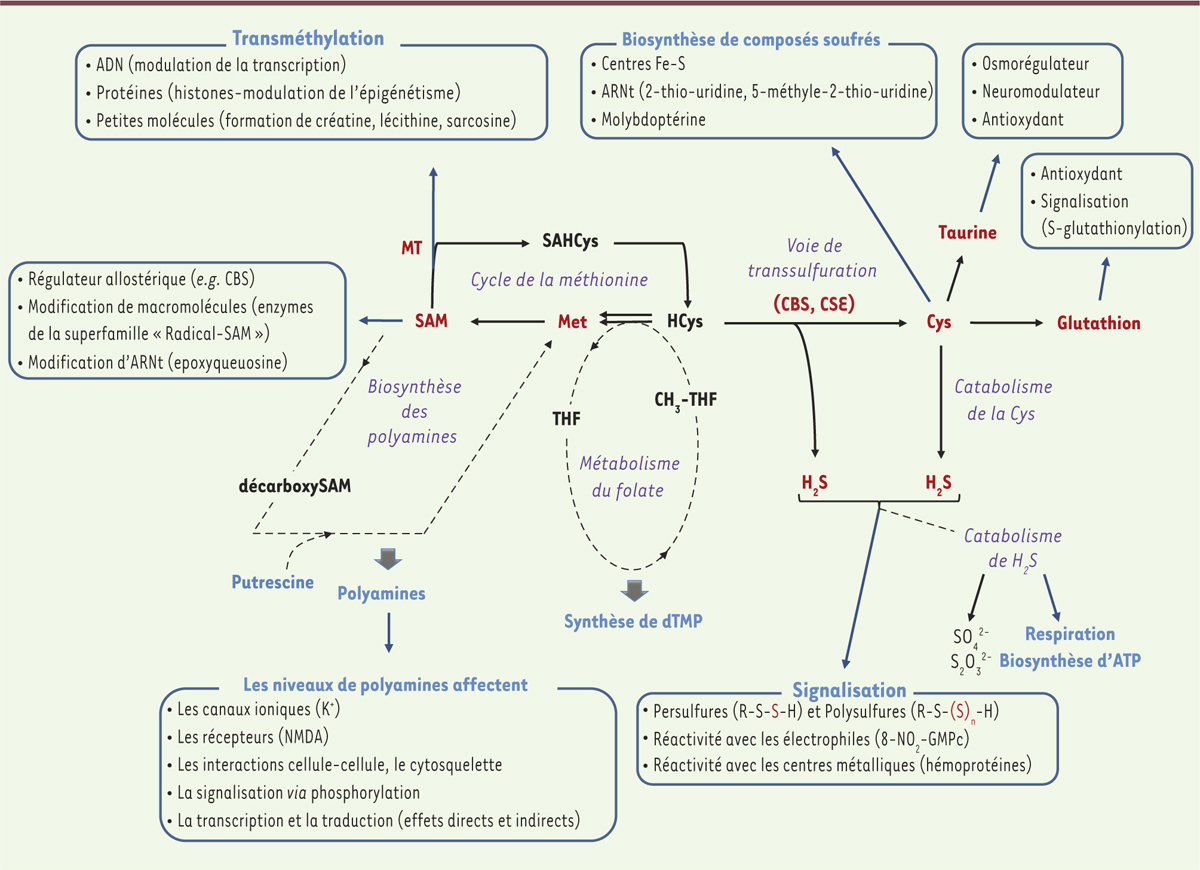
Cycle de la méthionine et métabolisme des composés soufrés Les cellules de mammifères dépendent, pour leur fonctionnement, de nombreux composés métaboliques soufrés issus du métabolisme de la méthionine, un acide aminé essentiel [1] (Figure 1). La méthionine (Met) est le précurseur de la S-adénosylméthionine ou SAM, un métabolite synthétisé par la méthionine adénosyltransférase. L’activation du soufre en sulfonium permet à la SAM de participer à des réactions de transfert de méthyle (CH3) sur de nombreuses molécules (ADN, ARN, protéines, composés organiques). De ce fait, la SAM participe à la modulation de la transcription des gènes, au code épigénétique des protéines histones, à la biosynthèse de certaines macromolécules telles que la créatine ou la phosphatidylcholine, un constituant majeur des membranes lipidiques. Outre son rôle de donneur universel de groupements méthyles, la SAM intervient aussi dans la biosynthèse des polyamines (spermine et spermidine), composés organiques régulant de nombreux processus biologiques. La SAM est, de plus, impliquée dans la modification et la biosynthèse de certaines macromolécules (ARN ribosomaux [ARNr] et ARN de transfert [ARNt], lipoate) via l’insertion de groupements chimiques par voie radicalaire ou par le biais d’ylures1 de soufre [2, 3] (Figure 1).
 | Figure 1.
Cycle de la méthionine et métabolisme des composés soufrés. Le métabolisme de certains composés soufrés dépend de l’apport en vitamines et/ou métaux. C’est notamment le cas du métabolisme de l’homocystéine (HCys), dont l’apport en vitamine B9, vitamine B12 et/ou zinc est essentiel à sa méthylation en méthionine (Met) et dont la conversion en cystéine (Cys) dépend de l’apport en vitamine B6 et en hème. L’utilisation de la Met et de la Cys pour la biosynthèse des protéines n’est pas représentée. SAM : S-adénosylméthionine ; SAHCys : S-adénosylhomocystéine ; THF : tétrahydrofolate ; CH3-THF : 5-méthyl-tétrahydrofolate ; dTMP : désoxythymidine monophosphate ; MT : méthyltransférases ; CBS : cystathionine-β-synthase ; CSE : cystathionine-γ-lyase ; NMDA : acide N-méthyl-D-aspartique. |
Après transfert de son groupement méthyle, la SAM est transformée en homocystéine (HCys) via la formation de la S-adénosylhomocystéine (SAHCys), un inhibiteur compétitif des réactions de transméthylation. En fonction des demandes métaboliques, l’HCys est soit recyclée en méthionine, en conjonction avec le métabolisme du folate ou par l’action de la bétaine-homocystéine S-méthyltransférase, soit catabolisée en cystéine (Cys), un acide aminé semi-essentiel précurseur du glutathion (GSH) et de la taurine, via la voie dite de transsulfuration [1, 4] (→) (Figure 1). Cette dernière, qui comprend deux enzymes dépendantes de la vitamine B6, la cystathionine-β-synthase (CBS) et la cystathionine-γ-lyase (CSE), est une source importante de Cys chez les mammifères, son inhibition entraînant une diminution d’environ 50 % des taux de GSH dans les tissus. La Cys participe aussi à la biosynthèse de nombreux cofacteurs soufrés (centres FeS, molybdoptérine, coenzyme A) et à la modification de certains ARNt au niveau de la position de « wobble
2, » (Figure 1). Enfin, des études récentes ont révélé que la voie de transsulfuration et le catabolisme mitochondrial de la cystéine prennent part à la biosynthèse du sulfure d’hydrogène (H2S), un médiateur gazeux récemment identifié. Son catabolisme est directement couplé à la respiration cellulaire et il exerce diverses fonctions de signalisation dans les systèmes vasculaires et neuronaux, et dans la régulation de la réponse inflammatoire [1, 5-7] (Figure 1).
(→) Voir la Synthèse de P. Kamoun, m/s n° 6-7, juin-juillet 2004, page 697
|
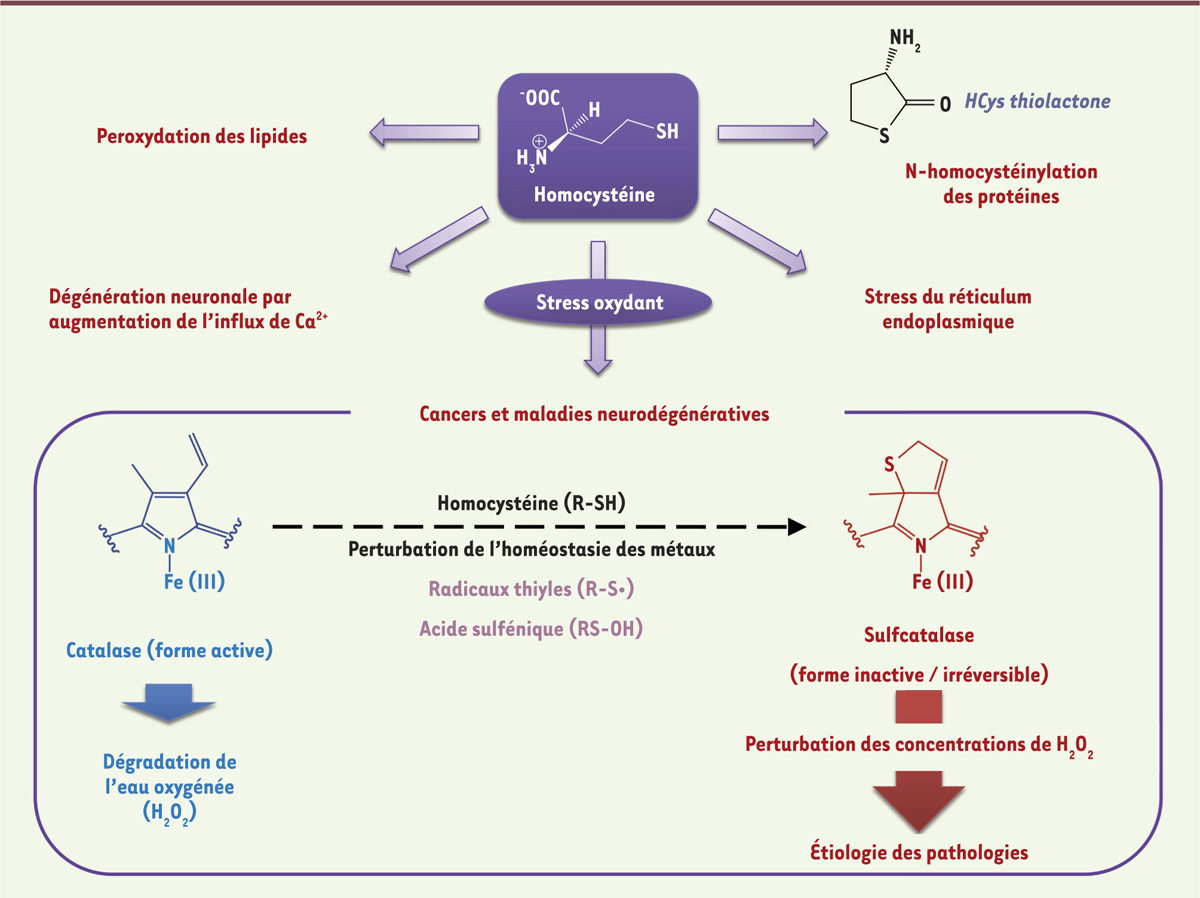
Dérégulation du métabolisme des composés soufrés et hyperhomocystéinémie En raison de leurs rôles essentiels dans la physiologie cellulaire, le métabolisme de ces composés soufrés est finement régulé en réponse aux variations de l’environnement cellulaire [1]. Cette régulation s’effectue non seulement au niveau transcriptionel (par exemple une méthylation/déméthylation de l’ADN codant certaines isoformes de la Met adénosyltransférase, impliquée dans la biosynthèse de SAM) et traductionnel (comme une déméthylation de la protéine de liaison à l’ARN de la famille ELAV/HuR [embryonic lethal, abnormal vision/human antigen R] en réponse à différents types de stress cellulaires), mais aussi au niveau post-traductionnel (comme la S-glutathionylation de la cystathionine-β-synthase CBS). De plus, certaines des enzymes qui interviennent dans le métabolisme des composés soufrés sont soumises à une régulation par la SAM, ce qui participe à la diversion du flux du métabolisme de la Met entre les modes d’élimination (voie de transsulfuration) et de conservation (cycle de la méthionine) [1]. Ainsi, dans un régime alimentaire normal, le flux de Met absorbée par les hépatocytes est réparti de manière égale entre le cycle de la méthionine et la voie de transsulfuration. À l’opposé, un apport alimentaire riche en Met active son élimination par une augmentation marquée de son taux de conversion en Cys par la voie de transsulfuration. Cette diversion du flux de Met est favorisée en partie par une régulation de l’activité d’enzymes telles la CBS et la méthylène-tétrahydrofolate réductase par la SAM. Compte tenu des rôles essentiels précités des composés soufrés, une dérégulation de leurs concentrations cellulaires et de leurs voies de signalisation est souvent associée à des pathologies graves. Par exemple, des déficiences dans le métabolisme de la Met sont responsables de l’hyperhomocystéinémie, une maladie métabolique caractérisée par des niveaux élevés d’homocystéine et associée entre autre à un retard mental et un risque majeur d’accidents vasculaires tels que l’ischémie myocardique et des accidents vasculaires cérébraux [8]. Les effets toxiques de l’HCys (Figure 2) [8, 9] résultent, par exemple, de sa capacité à être oxydée en acide homocystéique, un composé qui active les récepteurs NMDA (acide N-méthyl-D-aspartique) et entraîne une augmentation des concentrations intracellulaires d’ions calciques et d’espèces activées de l’oxygène. L’HCys peut également être transformée en HCys-thiolactone (HTL) au cours d’une erreur d’édition dans laquelle l’HCys est sélectionnée à tort à la place de la Met par la méthionyl-ARNt synthétase. L’HTL, un thioester cyclique, réagit avec les résidus lysine de certaines protéines dans un processus appelé N-homocystéinylation, qui altère la fonction biologique des protéines modifiées [9] (Figure 2).
 | Figure 2.
Certaines bases moléculaires de la toxicité cellulaire de l’homocystéine. Certains effets toxiques induits par des taux élevés d’homocystéine (R-SH) sont décrits dans cette figure. L’homocystéine (HCys) peut être oxydée en acide homocystéique (R-SO 3H), un composé qui participe à la dégénérescence neuronale et à la production d’espèces activées de l’oxygène. L’HCys est le précurseur de l’HCys-thiolactone qui réagit avec les résidus Lys de certaines protéines (fibrinogène, lipoprotéines de basse ou haute densité, albumine, hémoglobine, ferritine), ce qui réduit ou altère leurs fonctions. L’HCys provoque aussi un stress du réticulum endoplasmique (mauvais repliement des protéines) qui est associé à une dérégulation des voies de biosynthèse du cholestérol et des triglycérides. Enfin, comme nous l’avons montré [ 11], des taux élevés d’HCys, en combinaison avec une perturbation de l’homéostasie des métaux de transition, participent à la modification du groupement prosthétique de la catalase en sulfhème. Cette modification de l’hème induit une inhibition irréversible de la bioactivité de la catalase et peut participer à l’étiologie de certaines formes de cancer et de maladies neurodégénératives. |
|
Un lien entre homocystéine, cancers et maladies neurodégénératives ? Le cancer et les maladies neurodégénératives sont des pathologies qui résultent de dérégulations dans l’homéostasie des systèmes biologiques. Ces pathologies présentent une altération, en partie similaire, des concentrations intracellulaires de nombreux métabolites, de certaines voies de signalisation et de diverses fonctions biologiques. Par exemple, l’eau oxygénée (H2O2), qui module, dans des conditions normales, des voies de signalisation cellulaire, peut aussi perturber le fonctionnement cellulaire et participer à l’éclosion et/ou la progression des cancers et des maladies neurodégénératives [10, 11]. Ainsi, H2O2 et les espèces activées de l’oxygène produites à la suite de divers stimulus (carcinogènes, inflammation, vieillissement, etc.) provoquent des dommages au matériel génétique de la cellule qui induisent une activation de voies oncogéniques. Lorsqu’ils ne sont pas maîtrisés, ceux-ci peuvent aboutir à la transformation des cellules « normales » en cellules cancéreuses qui peuvent à leur tour produire et libérer du H2O2, favorisant l’induction d’un stress oxydant dans les cellules adjacentes. Dans le cas des maladies neurodégénératives, H2O2 contribue au vieillissement prématuré de la cellule qui se caractérise, entre autre, par une agrégation anormale des protéines dans le système nerveux. Une altération des concentrations intracellulaires de H2O2 participe donc à l’étiologie des cancers et des maladies neurodégénératives. Différents travaux suggèrent aussi que des taux anormaux d’HCys sont associés à la prolifération des cellules cancéreuses et à diverses maladies neurodégénératives. Dans ces pathologies, une perturbation de l’homéostasie des métaux de transition (fer et cuivre par exemple) et une modification de l’activité des systèmes antioxydants ont été rapportées [10, 11]. C’est en particulier le cas pour la catalase, une enzyme qui présente un hème comme groupement prosthétique et joue un rôle essentiel dans la protection des cellules aux dommages oxydatifs liés à des concentrations élevées de H2O2. Au vu de ces observations, nous avons émis l’hypothèse que des taux anormaux d’HCys, associés à une perturbation de l’homéostasie des métaux de transition, pourraient jouer un rôle central dans l’étiologie des cancers et des maladies neurodégénératives via l’inactivation de la catalase, conduisant ainsi à une augmentation des concentrations cellulaires de H2O2 et à une modification de ses voies de signalisation [11]. Nos études in vitro et ex cellulo, publiées dans la revue Nature Communications [11], rapportent certaines bases moléculaires de la toxicité cellulaire de l’homocystéine (Figure 2). Elles démontrent que, dans les conditions pathologiques précitées, c’est-à-dire des taux anormaux d’HCys et une perturbation de l’homéostasie des métaux de transition, l’HCys participe à l’inhibition irréversible de la catalase via la formation d’un sulfhème (incorporation d’un atome de soufre à la périphérie de l’hème prosthétique). La formation de cet état inactif est initiée par la production de radicaux libres homocystéinyles (R-S•) par réaction de l’HCys (R-SH) avec l’hème de la catalase native et/ou les métaux de transition. Ensuite, se forme l’acide sulfénique (R-SOH), issu d’une réaction de S-oxygénation jusqu’alors inconnue dans de tels systèmes, qui participe à la modification du groupement prosthétique de la catalase en sulfhème (Figure 2). Nos études, effectuées sur divers modèles cellulaires de pathologies, ont permis de corroborer l’existence d’un tel processus d’inhibition dans des lignées cancéreuses et dans un modèle de la maladie de Parkinson. Ces résultats présentent un intérêt pour les chercheurs en chimie, en biochimie et en biologie médicale. Dans différentes pathologies, ils établissent clairement un nouveau lien entre des taux élevés d’homocystéine et une dérégulation de l’homéostasie des métaux de transition pour inhiber de manière originale un système antioxydant. Ils soulignent également un autre trait délétère des niveaux élevés d’homocystéine qui participent à l’étiologie de certaines maladies via une modification des voies de signalisation de H2O2. Enfin, ils pointent l’importance de développer des agents thérapeutiques ciblant l’homocystéine et les métaux de transition pour prévenir les effets pernicieux résultant de leur combinaison. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Kabil O, Vitvitsky V, Banerjee R. Sulfur as a signaling nutrient through hydrogen sulfide . Annu Rev Nutr. 2014; ; 34 : :171.–205. 2.
Fontecave M, Atta M, Mulliez E. S-adenosylmethionine: nothing goes to waste . Trends Biochem Sci. 2004; ; 29 : :243.–249. 3.
Etchegaray JP, Mostoslavsky R. Interplay between metabolism and epigenetics: A nuclear adaptation to environmental changes . Mol Cell. 2016; ; 62 : :695.–711. 4.
Kamoun P. H2S, un nouveau neuromodulateur . Med Sci (Paris). 2004; ; 20 : :697.–700. 5.
Mueller EG. Trafficking in persulfides: delivering sulfur in biosynthetic pathways . Nat Chem Biol. 2006; ; 2 : :185.–194. 6.
Paul BD, Snyder SH. H2S: A novel gasotransmitter that signals by sulfhydration . Trends Biochem Sci. 2015; ; 40 : :687.–700. 7.
Szabo C, Ransy C, Módis K, et al. Regulation of mitochondrial bioenergetic function by hydrogen sulfide. Part I. Biochemical and physiological mechanisms . Br J Pharmacol. 2014; ; 171 : :2099.–2122. 8.
Zou CG, Banerjee R. Homocysteine and redox signaling . Antioxid Redox Signal. 2005; ; 7 : :547.–559. 9.
Perła-Kaján J, Twardowski T, Jakubowski H. Mechanisms of homocysteine toxicity in humans . Amino Acids. 2007; ; 32 : :561.–572. 10.
Lisanti MP, Martinez-Outschoorn UE, Lin Z, et al. Hydrogen peroxide fuels aging, inflammation, cancer metabolism and metastasis: the seed and soil also needs “fertilizer” . Cell Cycle. 2011; ; 10 : :2440.–2449. 11.
Padovani D, Hessani A, Castillo FT, et al. Sulfheme formation during homocysteine S-oxygenation by catalase in cancers and neurodegenerative diseases . Nat Commun. 2016; ; 7 : :13386.. |