L’hétérogénéité intra-tumorale est une notion familière dans le domaine de la cancérologie. Au sein d’une même tumeur, les cellules cancéreuses se caractérisent souvent par une diversité morphologique et une variabilité moléculaire. Cette hétérogénéité est due à la présence de sous-populations aux altérations génétiques et épigénétiques distinctes et qui évoluent différemment selon des programmes intrinsèques ou dictés par l’environnement. Le récepteur membranaire à tyrosine kinase ERBB21, aussi appelé HER2 (human epidermal growth factor receptor-2), est un acteur clé de l’oncogenèse mammaire dont l’expression peut être extrêmement variable au sein d’une même tumeur [1]. Dans un sous-groupe de cancers du sein représentant de 15 à 20 % des cas, le gène ERBB2 est amplifié, résultant en la surexpression, plus ou moins importante, du récepteur HER2. Ces patientes atteintes d’un cancer du sein dit HER2 positif (HER2+) sont traitées par trastuzumab, un anticorps humanisé ciblant ce récepteur. La plasticité des cellules tumorales HER2 positives a été mise en évidence dans les cas de développement de résistances au trastuzumab [2]. Les tumeurs qui ne répondent plus au traitement présentent alors une perte d’expression du récepteur HER2. Les cellules tumorales ont donc la capacité de modifier leur profil d’expression protéique afin de devenir insensibles au traitement. Le processus inverse, c’est-à-dire les cas de patientes avec des tumeurs HER2 négatives (HER2-) développant des métastases HER2 positives, est moins documenté mais est de plus en plus étudié, principalement afin d’approfondir la compréhension biologique de l’oncogenèse tumorale naturelle [3, 4]. C’est notamment avec l’introduction de l’analyse phénotypique des cellules tumorales circulantes (CTC) que de nombreux auteurs ont pu mettre en évidence ce phénomène. Par exemple, l’expression de HER2 a été comparée dans les tumeurs primaires, les métastases et les CTC correspondantes de 107 patientes atteintes de cancer du sein. Les trois-quarts de ces patientes avaient des CTC positives pour HER2 alors que la tumeur primaire était négative [4]. Dans ce cas, c’est la présence de la protéine HER2 qui a été évaluée sur les CTC et non l’amplification génique qui, elle, est détectable par hybridation sur chromosomes (FISH, fluorescent in situ hybridization). Lorsque que l’on s’intéresse aux amplifications de ERBB2, 32 % seulement de CTC sont positives pour HER2, chez des patientes dont la tumeur primaire était négative pour HER2 [5].
L’étude récente de Jordan et al., publiée dans Nature, confirme la plasticité du marqueur protéique HER2 chez des patientes atteintes de cancer du sein initialement détecté négatif pour HER2 [6]. Cette information est de plus complétée par une donnée moins connue : l’expression de HER2 peut être transitoire. Pour isoler les CTC, les auteurs ont utilisé le système microfluidique CTC-iChip2 permettant d’éliminer les leucocytes de l’échantillon sanguin grâce à l’utilisation d’un cocktail d’anticorps reconnaissant CD45, CD66b et CD16 [7]. Une sélection positive grâce au marqueur épithélial EpCAM (epithelial cell adhesion molecule) est ensuite effectuée, permettant d’isoler les CTC. Le statut HER2+ ou HER2- de ces CTC est alors déterminé par marquage du récepteur HER2. Grâce à cette purification non invasive des cellules tumorales, les auteurs capturent les CTC vivantes afin de les mettre en culture. Ils établissent ainsi des lignées cellulaires de CTC initialement positives ou négatives pour le récepteur HER2. L’étude précise de ces populations montre des différences de comportements biologiques, alors que rien ne les différencie au niveau génomique. Les CTC HER2+ trouvées chez des patientes dont la tumeur était initialement négative n’avaient pas d’amplification du gène ERBB2. Le ou les mécanismes impliqués dans la surexpression d’HER2, autres que l’amplification d’ERBB2, ont été assez peu étudiés, mais impliquent très probablement des éléments régulateurs de la voie de l’œstrogène, tels que les membres de la famille des récepteurs nucléaires co-activateurs (NCOA3 [nuclear receptor coactivator 3], AIB1 [amplified in breast cancer 1], etc.) [8].
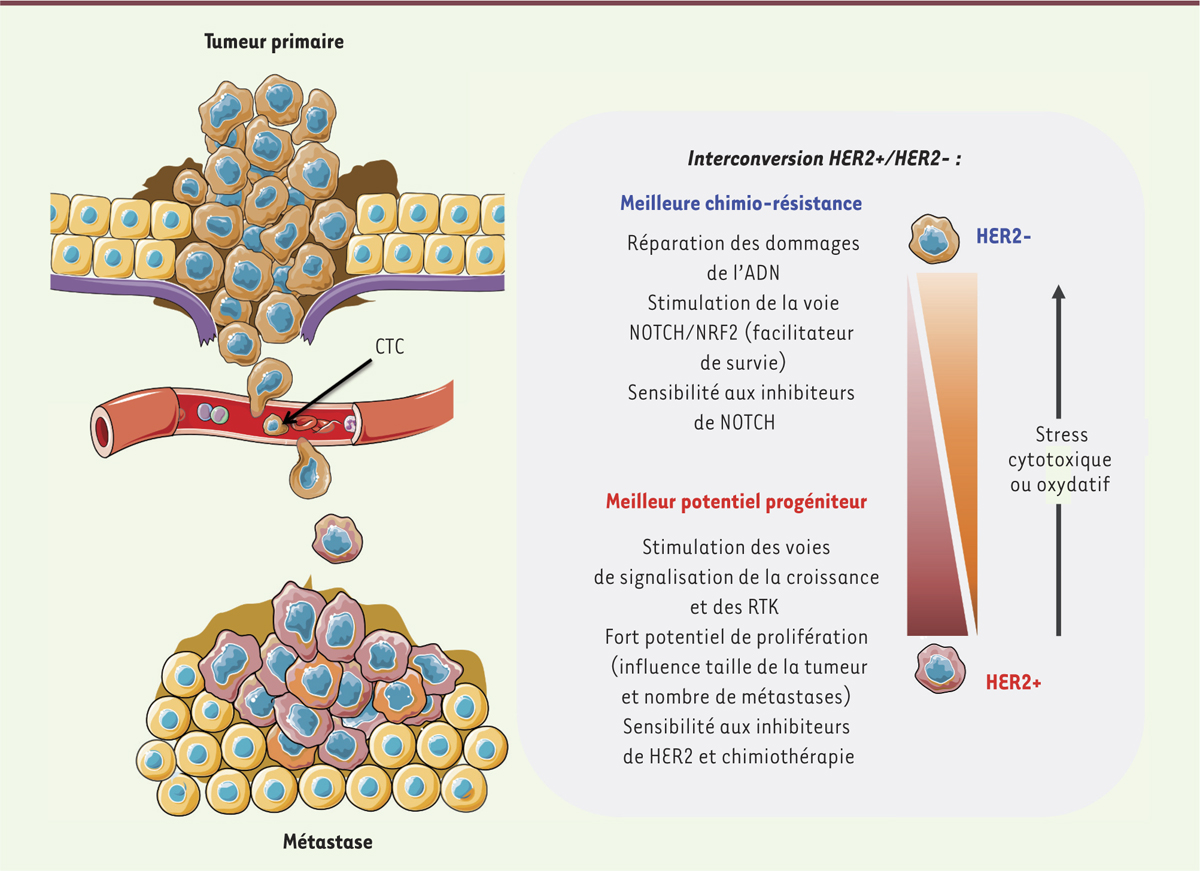
L’étude de Jordan et al. permet d’analyser des cas où la surexpression du récepteur HER2 est due à une modification transcriptionnelle. Fonctionnellement, cette surexpression confère aux cellules tumorales un taux de prolifération plus élevé. Contrairement aux CTC HER2+, les CTC HER2- prolifèrent moins. Toutefois, elles présentent une sur-activation de la voie Notch3, ainsi que des molécules impliquées dans les voies de réparation de l’ADN, ce qui suggère qu’elles présentent un avantage sélectif en conditions de stress. L’expression de HER2 dans ces cellules modulerait l’activation de l’axe NOTCH1/NRF2 (nuclear factor [erythroid-derived 2]-like 2)4, en leur permettant d’évoluer d’un phénotype prolifératif à un phénotype « pro-survie » (Figure 1). Cette stratégie, adoptée par la cellule tumorale pour résister à des conditions de stress, avait déjà été mise en évidence par D’angelo et al. [9]. Cette dernière étude a notamment établi comment les cellules souches tumorales étaient capables de contrôler la voie Notch afin de devenir résistantes à la chimiothérapie.
| Figure 1.
Mécanisme d’interconversion du récepteur HER2 à la surface des cellules tumorales circulantes. Les cellules tumorales circulantes (CTC) issues d’une tumeur primaire sont capables de donner naissance à des métastases. Les CTC à l’origine des métastases peuvent être de même phénotype que les cellules de la tumeur primaire, mais peuvent également avoir subi une modification de leur statut HER2 (human epidermal growth factor receptor-2), nommée interconversion. Ce changement peut avoir lieu de façon spontanée, mais peut surtout être le résultat d’une stratégie d’échappement/survie des cellules tumorales face aux traitements. Les cellules positives HER2+ ont un phénotype pro-prolifératif et favorisent l’apparition de métastases. Cependant, ces cellules sont sensibles aux inhibiteurs de récepteurs tyrosine kinase (RTK) qui ciblent HER2, ce qui confère un avantage sélectif aux cellules négatives HER2- au cours d’un traitement. Les traitements par des chimiothérapies associées induisent des stress cytotoxiques ou oxydatifs qui favorisent une transition des CTC vers un phénotype HER2-. En effet, la population de cellules HER2- prolifère peu mais est résistante aux thérapies. La plasticité des cellules tumorales entre ces deux états, HER2+ et HER2-, leur permet donc de s’adapter aux modifications de l’environnement et favorise leur survie ainsi qu’une meilleure croissance. NRF2 : nuclear factor (erythroid-derived 2)-like 2. |
Malgré ces différences, les CTC HER2 négatives ou positives ont un potentiel de cellules progénitrices équivalent [6]. Cette dernière observation, et le fait que les tumeurs obtenues à partir d’une des sous-populations présentaient finalement un phénotype mixte HER2+/-, a mis les auteurs sur la piste de la plasticité des cellules tumorales. Ils ont ainsi montré que les cellules HER2+ et HER2- pouvaient changer de phénotype pour devenir respectivement HER2- et HER2+ (phénomène d’interconversion). Un équilibre entre les deux populations s’installerait sur le long terme, avec un ratio HER2+/HER2- variable selon les conditions. Les cellules tumorales seraient ainsi capables de s’adapter en fonction de leurs besoins et de leur environnement, pouvant être cytotoxique en cas de traitement ou « pro-prolifératif » en absence de traitement. Si cette observation est intéressante d’un point de vue biologique, elle met cependant en évidence que détecter des CTC HER2+, chez des patientes dont la tumeur primaire est HER2-, n’apporterait pas de nouvelles solutions thérapeutiques, à cause d’une possible interconversion. Selon ces travaux, traiter ces patientes avec du trastuzumab favoriserait le développement des CTC HER2-, donc plus résistantes au stress, mais permettrait peut-être de ralentir le développement des métastases. Les combinaisons thérapeutiques permettant de cibler plusieurs populations tumorales en même temps prennent alors tout leur sens.
Cette étude s’est focalisée sur le récepteur HER2, mais les résultats obtenus sont possiblement transposables à d’autres récepteurs ou oncogènes majeurs tels que les récepteurs de l’EGF (epidermal growth factor receptor, EGFR) par exemple. En effet, le rôle oncogénique de l’EGFR repose, tout comme pour HER2, sur la surexpression d’une protéine normale qui peut être ciblée par des thérapies spécifiques. En revanche, ce phénomène d’interconversion ne peut pas être impliqué lorsque la résistance induite au cours du traitement est due à des mutations, comme par exemple pour le récepteur des œstrogènes.
Cette étude, par le suivi des CTC, apporte une nouvelle dimension à l’analyse et au suivi tumoral. Si la notion de plasticité et d’adaptation des cellules tumorales à un environnement/traitement avait déjà été proposée [10] (→), l’étude des CTC permet maintenant de visualiser ces évènements en temps réel. Cette approche permet donc d’aller plus loin que l’étude de l’ADN tumoral circulant, qui donne des informations sur le statut mutationnel à un temps « t », mais ne permet cependant pas d’avoir des informations sur la plasticité des cellules en absence d’anomalies génomiques.
(→) Voir la Synthèse de C. Moyret-Lalle et al., m/s n° 8-9, août-septembre 2016, page 725
L’idée d’un suivi des patients à l’aide des CTC, et surtout de l’adaptation du traitement ou de combinaisons de traitements en fonction du phénotype des cellules à cibler, prend donc tout son sens à l’ère de la médecine personnalisée. C’est ce qui est évalué en ce moment dans une étude prospective multicentrique, le programme DETECT [11]. Une partie de cet essai clinique concerne les patientes atteintes de cancer du sein métastatique dont la tumeur primitive est HER2- et qui présentent des CTC HER2+. Les patientes sont réparties en 2 groupes équivalents et sont traitées de façon conventionnelle ou en association avec du lapatinib, un inhibiteur de HER2.