| |
| Med Sci (Paris). 33(5): 478–480. doi: 10.1051/medsci/20173305006.Différenciation des cellules à mucus et régulation de la mucine gélifiante Muc5b : un nouvel outil pour des études ex vivo et précliniques in vivo
Jean-Luc Desseyn,1* Céline Portal,1 Frédéric Gottrand,1 and Valérie Gouyer1 1LIRIC - UMR 995 Inserm/Université de Lille/CHU Lille, Lille, France |
Les épithéliums sécrétoires des tractus digestif (de la bouche à l’anus), respiratoire (des fosses nasales au poumon) ou encore génital sont protégés de l’environnement extérieur par des gels de mucus semi-perméables. Les principales fonctions du mucus sont la lubrification et l’hydratation des épithéliums sous-jacents. Il joue aussi un rôle primordial dans l’élimination de particules étrangères à l’organisme. En effet, il piège, par exemple, à la surface de l’œil les bactéries, poussières et pollens qui sont ensuite éliminés lors de clignements de la paupière. Dans le poumon, les battements des cils à la surface de l’épithélium font remonter au pharynx/larynx le mucus avec les bactéries engluées, qui sont ensuite évacuées par déglutition. Ce mucus est également une niche indispensable qui offre un support nutritif aux bactéries de la flore commensale, particulièrement dans l’intestin et le vagin. Les gels de mucus sont essentiellement constitués d’eau et des mucines gélifiantes. Ces mucines sont des macromolécules de très grande masse moléculaire (plusieurs millions de Da) fortement O-glycosylées et donc difficiles à étudier [1,2] (→). Les mucines gélifiantes, au nombre de 5 chez l’homme, sont très conservées dans l’évolution. Elles sont sécrétées sous forme d’oligomères à la surface des épithéliums. Une fois dans la lumière des organes, elles forment au contact de l’eau un gel et lui confèrent ses propriétés physiques et chimiques [3]. Les mucines sont produites et stockées par des cellules spécialisées, comme les cellules caliciformes. Elles sont sécrétées en petite quantité de manière constitutive et de manière massive suite à une stimulation. Des modifications de densité de cellules à mucus et de production de mucines sont décrites dans de nombreuses maladies touchant les muqueuses sécrétoires (cancers solides, fibrose, maladies pulmonaires chroniques obstructives, syndrome de l’œil sec, ulcères, maladies inflammatoires chroniques de l’intestin, etc.). De plus, de nombreux épithéliums sécrétoires sont naturellement accessibles, comme dans la bouche, la trachée, le nez, la cavité vaginale ou encore le rectum. En conséquence, les mucines et les cellules à mucus peuvent représenter d’excellents marqueurs biologiques.
(→) Voir la Nouvelle de J.L. Desseyn, m/s n° 12, décembre 2015, page 1063
|
Mucine gélifiante Muc5b fluorescente MUC5B est l’une des 5 mucines humaines gélifiantes. Elle est principalement présente dans le tractus respiratoire, mais elle est également produite dans la vésicule biliaire et par le cervix. Afin de tester si la mucine Muc5b de souris peut être un outil préclinique intéressant, et pour suivre sa production in vivo, nous avons couplé génétiquement la mucine de souris Muc5b à la molécule fluorescente de la méduse (green fluorescent protein, GFP). La souris « fluorescente » transgénique Muc5b-GFP a été créée par recombinaison homologue pour remplacer l’unique codon stop du gène Muc5b par une séquence optimisée de la GFP [4]. Le profil d’expression de Muc5b-GFP a tout d’abord été déterminé, par immunohistochimie, à l’aide d’anticorps anti-GFP, sur des tissus fixés. Cette expression a été confirmée ex vivo sur tissus frais par microscopie à épifluorescence, et in vivo chez la souris anesthésiée par microscopie confocale laser endofibrée (MCLE)1. |
Muc5b-GFP, un outil d’étude de la régulation de Muc5b et un modèle préclinique L’analyse de la souris transgénique Muc5b-GFP permet de montrer que cette mucine est produite dans l’oreille moyenne, la conjonctive de l’œil, la cavité nasale, la trachée (Figure 1), la vésicule biliaire, le cervix et le vagin. Elle est également présente très précocement dans le poumon puisque la mucine fluorescente est visualisée dès le jour embryonnaire (E) 12,5 sachant que le temps de gestation d’une souris de laboratoire est compris entre 18 et 21 jours. La parfaite superposition des profils d’expression de Muc5b murin et MUC5B humain valide la souris comme modèle pour les pathologies où des anomalies de production de la mucine sont connues : cancer mammaire [6,7], otites, sinusites, rhinites allergiques, fibroses pulmonaire et trachéale, mucoviscidose, asthme, sécheresses oculaires [4]. Afin d’apporter la preuve de concept que la souris transgénique Muc5b-GFP peut être un modèle ex vivo et préclinique, nous avons, d’une part, stimulé par l’interleukine (IL) 13 des poumons embryonnaires murins en culture. D’autre part, nous avons mesuré, par MCLE chez des souris anesthésiées, la fluorescence émise par Muc5b-GFP dans la cavité vaginale au cours du cycle œstrale et chez des souris gestantes [4]. Nos expériences pharmacologiques sur les cultures d’explants du complexe poumons/trachée d’embryon au stade E12,5 montrent qu’une unique application d’IL-13 suffit pour stimuler la croissance pulmonaire et la différenciation de cellules caliciformes fluorescentes visualisée par stéréomicroscopie à fluorescence. Dans la cavité vaginale de la souris anesthésiée, la production de Muc5b est facilement évaluée par MCLE. On note une régulation hormonale de la production de la mucine puisqu’elle varie durant le cycle œstral atteignant un niveau maximal en pro-oestrus et chez la souris gestante. Un pic de production pré-ovulatoire de MUC5B était connu chez la femme, mais aucune donnée n’avait été publiée chez la souris.
 | Figure 1.
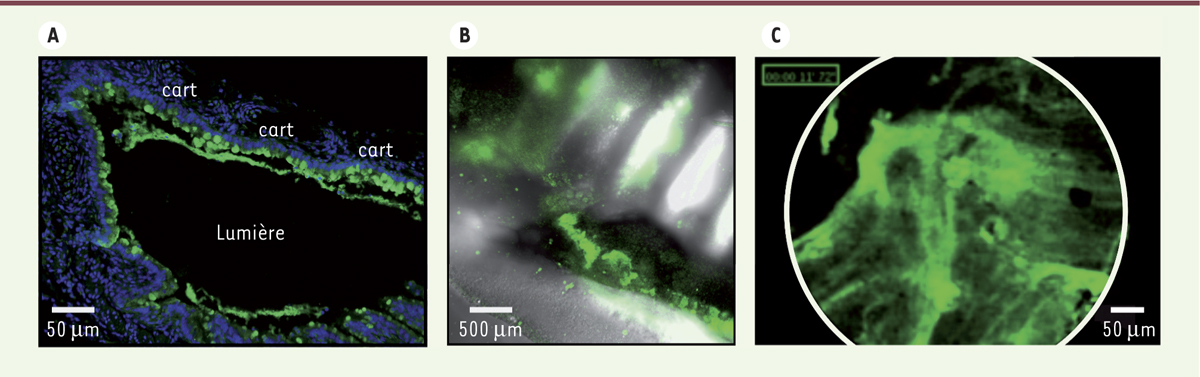
Exemple de visualisation de la production de Muc5b dans la trachée. (A) En immunohistochimie, Muc5b est visualisé en vert. Les noyaux cellulaires sont contre-colorés en bleu. Barre d’échelle, 50 µm ; cart : cartilage. (B) En microscopie sur trachée fraîche, les anneaux cartilagineux sont visualisés en lumière blanche et Muc5b en fluorescence. Barre d’échelle, 500 µm. (C) Par microscopie confocale laser endofibrée (MCLE, appareil Cellvizio, Mauna Kea Technologies), Muc5b apparaît formant des fils de mucus plus ou moins épais (en vert). Barre d’échelle, 50 µm. |
 | Figure 2.
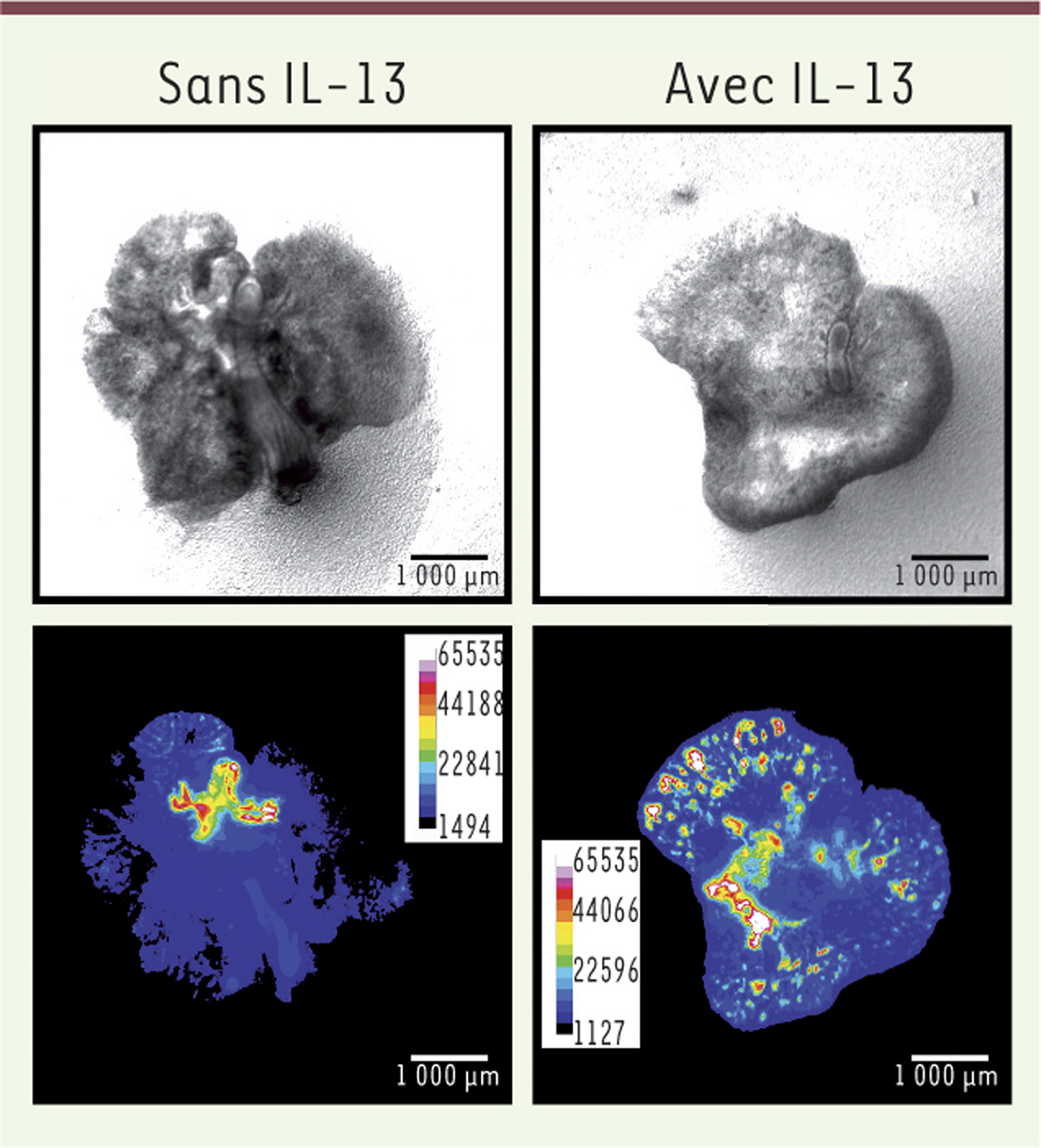
Stimulation de la production de Muc5b par l’IL-13. Des poumons embryonnaires de souris en culture sont visualisés en lumière blanche (partie haute) et en fluorescence (partie basse), 11 jours après ajout d’IL-13 (à droite) et en son absence (à gauche). Les images ont été acquises à l’aide d’un stéréomicroscope à épifluorescence Leica M205 équipé d’une caméra cMOS Flash4.0 (Hamamatsu) au grossissement x 30,3. Les images en fluorescence ont été « pseudo-colorées » en 16 couleurs à l’aide du logiciel ImageJ. Les couleurs froides signifient une fluorescence faible et les couleurs chaudes (vers le rouge) une fluorescente forte reflétant une stimulation de la production de la mucine gélifiante Muc5b par l’IL-13. Barre d’échelle, 1 mm. |
|
La souris transgénique permet d’étudier la régulation de la production/sécrétion de cette mucine in vivo, sous le contrôle de tous les éléments régulateurs naturels du gène. Elle représente un modèle pertinent pour étudier la régulation et la sécrétion de cette mucine chez l’animal vivant ou par des explants, mais également pour isoler des cellules à mucus des voies respiratoires, de l’ectocervix et de la conjonctive. Ce modèle rapporteur rend possible l’étude, chez la souris vivante, de la différenciation en cellules à mucus produisant Muc5b, d’en quantifier leur densité, tout en suivant longitudinalement l’expression de Muc5b, limitant ainsi grandement le nombre d’animaux requis par expérience. La preuve de concept de l’intérêt en recherche préclinique du suivi des modifications chez la souris anesthésiée de la densité de cellules à mucus produisant cette mucine gélifiante vient d’être apportée dans un modèle de sécheresse oculaire, où la diminution de densité de cellules à mucus est contrebalancée par l’application topique d’IL-13 [8]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Gouyer V, Gottrand F, Desseyn JL The extraordinarily complex but highly structured organization of intestinal mucus-gel unveiled in multicolor images . PLoS One. 2011; ; 6 : :e18761.. 2.
Desseyn JL, Gouyer V, Gottrand F Modification à façon des propriétés physiques du mucus . Med Sci (Paris). 2015; ; 31 : :1063.–1066. 3.
Desseyn JL, Gouyer V, Gottrand F Biological modeling of mucus to modulate mucus barriers . Am J Physiol Gastrointest Liver Physiol. 2016; ; 310 : :G225.–G2G7. 4.
Portal C, Gouyer V, Magnien M, et al. In vivo imaging of the Muc5b gel-forming mucin . Sci Rep. 2017; ; 7 : :44591.. 5.
Salaün M, Bourg-Heckly G, Thiberville L Confocal endomicroscopy of the lung: from the bronchus to the alveolus . Rev Mal Respir. 2010; ; 27 : :579.–588. 6.
Valque H, Gouyer V, Husson MO, et al. Abnormal expression of Muc5b in Cftr-null mice and in mammary tumors of MMTV-ras mice . Histochem Cell Biol. 2011; ; 136 : :699.–708. 7.
Valque H, Gouyer V, Gottrand F, et al. MUC5B leads to aggressive behavior of breast cancer MCF7 cells . PLoS One. 2012; ; 7 : :e46699.. 8.
Portal C, Gouyer V, Gottrand F, et al. Preclinical mouse model to monitor live Muc5b-producing conjunctival goblet cell density under pharmacological treatments . PLoS One. 2017; ; 12 : :e0174764.. |