| |
| Med Sci (Paris). 33(4): 441–444. doi: 10.1051/medsci/20173304015.Les chimères du dépistage Chroniques Génomiques Bertrand Jordan1* 1UMR 7268 ADÉS, Aix-Marseille, Université/EFS/CNRS, Espace éthique méditerranéen, hôpital d’adultes la Timone, 264, rue Saint-Pierre, 13385Marseille Cedex 05, France ; CoReBio PACA, case 901, parc scientifique de Luminy, 13288Marseille Cedex 09, France MeSH keywords: Biopsie, Analyse chimique du sang, Analyse de mutations d'ADN, ADN tumoral, Détection précoce de cancer, France, Humains, Dépistage systématique, Inutilité des soins, Tumeurs, États précancéreux, Broncho-pneumopathie chronique obstructive, Sensibilité et spécificité, méthodes, analyse, sang, diagnostic, anatomopathologie, complications |

L’analyse de l’ADN plasmatique contenu dans un prélèvement sanguin devient de plus en plus courante en cancérologie [1] (→) et de nombreuses études montrent que cette approche donne en général des résultats cohérents avec ceux d’une biopsie et, parfois, renseigne mieux qu’elle sur la structure génétique des métastases. Elle est en passe de devenir une méthode confirmée pour le suivi de certains cancers en cours de traitement [2]. N’oublions pas, dans le même ordre d’idées, la révolution que représente le diagnostic non invasif de la trisomie 21, largement pratiqué aujourd’hui par analyse de l’ADN fœtal retrouvé dans le sang maternel (même si dans ce cas un résultat positif doit être confirmé par amniocentèse ou prélèvement de villosités choriales). Il est tentant d’extrapoler à partir de ces avancées pour envisager un dépistage précoce de cancers encore asymptomatiques, permettant ainsi d’intervenir à un stade très précoce et d’appliquer un traitement avec les meilleures chances de succès. Plusieurs entreprises ont déjà annoncé leurs intentions dans ce domaine ; l’une d’elle, Pathway Genomics, a même lancé sur le marché un test qui, en l’absence de preuves de sa fiabilité, s’est attiré les foudres de la Food and Drug Administration (FDA) [3] (→).
(→) Voir la Chronique génomique de B. Jordan, m/s n° 8-9, août-septembre 2015, page 805
(→) Voir la Chronique génomique de B. Jordan, m/s n° 12, décembre 2015, page 1137
Plus sérieusement, le géant Illumina – champion incontesté du séquençage de nouvelle génération – a lancé début 2016 une entreprise, Grail, dont l’objectif est de mettre au point et de commercialiser un tel test [4] (→). D’autres ont suivi, notamment Guardant Health qui commercialise déjà un test non invasif (Guardant360) assez largement utilisé pour le suivi des traitements : cette firme a entamé en juin 2016 un essai multi-site portant sur le diagnostic précoce et dont les premiers résultats sont attendus fin 2017. Plus récemment, une entreprise Taiwanaise, CellMax Life, a débuté la commercialisation d’un test appelé CRC-Protect, fondé sur l’analyse de cellules tumorales circulantes isolées grâce à un système microfluidique1, et censé, lui aussi, permettre une détection précoce de certains cancers. Mentionnons encore le test français ISET2, fondé sur l’isolement et l’analyse cytologique de cellules tumorales circulantes selon le procédé mis au point par l’équipe de P. Paterlini-Bréchot, récemment utilisé pour la détection précoce de cancers chez des malades atteints de bronchopneumopathie chronique obstructive, facteur de risque important pour le cancer du poumon [5]. Ce test est disponible en France mais n’est pas pris en charge par l’Assurance Maladie.
(→) Voir la Chronique génomique de B. Jordan, m/s n° 4, avril 2016, page 417
|
L’importance de la spécificité pour un dépistage J’ai déjà exposé les doutes que l’on peut nourrir sur le bien-fondé de ces projets [4] (→) et nous verrons que l’actualité, en ce qui concerne Grail, apporte quelque soutien à ces critiques. Le problème central que pose ce type de test est celui de la sensibilité et surtout de la spécificité. Un exemple montre clairement l’importance de ces notions, celui d’un éventuel dépistage du cancer du poumon par scanner (tomodensitométrie à faible dose). Une étude à très grande échelle pratiquée aux États-Unis sur une population de gros fumeurs [6] montre une sensibilité de 94 % et une spécificité de 73 %. Ces valeurs peuvent sembler satisfaisantes, mais elles correspondent, sur un groupe de 26 000 personnes, à un peu plus de 7 000 résultats positifs dont 270 seulement s’avèrent être de véritables cancers.… On détecte bien la grande majorité des cancers (il y en a en fait 288 dans cet effectif), mais au prix de près de 7 000 faux positifs, correspondant à des personnes qui vont subir des examens complémentaires allant éventuellement jusqu’à la biopsie3,. Encore s’agit-il ici d’une population « à risque » (gros fumeurs) ; sur un échantillon standard, la proportion de faux positifs serait encore plus élevée. Il est donc essentiel, pour qu’un tel test présente une véritable utilité clinique et que ses inconvénients ne l’emportent pas sur les avantages, que non seulement la sensibilité soit élevée mais que la spécificité le soit également. Rappelons que selon l’annonce initiale de janvier 2016 [4], Grail devait commercialiser dès 2019 un test « pan-cancer » capable de dépister un cancer chez des personnes asymptomatiques – à un tarif ne dépassant pas mille dollars. Cet objectif ne semblait réellement pas tenable, compte tenu des difficultés techniques à surmonter pour atteindre les performances requises mais aussi du recul nécessaire à l’évaluation d’un tel test : comment savoir si un résultat négatif est réellement négatif sans suivre la personne sur au moins une ou deux années ? Je terminais cette chronique [4] en prévoyant que le projet de Grail allait sans doute « subir des réorientations notables au cours de son développement ».
(→) Voir la Chronique génomique de B. Jordan, m/s n° 4, avril 2016, page 417
|
Une étude à très grande échelle… et une « rallonge » d’un milliard de dollars De fait, Grail a annoncé en décembre 2016 [7] le lancement d’un projet appelé Circulating Cell-free Genome Atlas (CCGA)4 qui vise à recruter 3 000 sujets en bonne santé et 7 000 atteints de divers cancers, dont l’ADN sanguin sera analysé en détail (avec un large panel comprenant plusieurs centaines de gènes, et un séquençage à très forte redondance, ultra-deep sequencing) ; ces personnes seront étudiées durant cinq années avec un suivi du niveau et de la nature de leur ADN circulant. Il est prévu d’accumuler de l’ordre d’un To (téraoctet, soit 1 000 Go) de données pour chaque individu, et l’objectif est de caractériser la diversité et les variations des spectres d’ADN circulant en présence et en absence de cancer. Ce n’est là que la première phase du projet, qui devra ensuite définir à partir de ces données un test et l’étudier sur des centaines de milliers de personnes pour valider sa capacité à identifier les signes très précoces de cancer.… Il est clair que l’on s’est sérieusement éloigné de l’idée d’un test à commercialiser dès 2019, et aussi que l’investissement initial réalisé lors de la fondation de Grail (100 millions de dollars) n’y suffira pas. Il n’est donc pas très surprenant d’apprendre, début janvier 2017, que Grail lance une levée de fonds avec pour objectif de décupler la mise [8]. La perspective a donc changé, et l’entreprise s’engage dans une étude très approfondie de l’ADN circulant associé à différentes tumeurs, de sa présence chez des individus asymptomatiques et de la possibilité, grâce à des séquençages à très haute redondance et à des analyses sophistiquées, d’en dériver un test de dépistage qu’il lui faudra valider par des essais à grande échelle et sur une longue durée. |
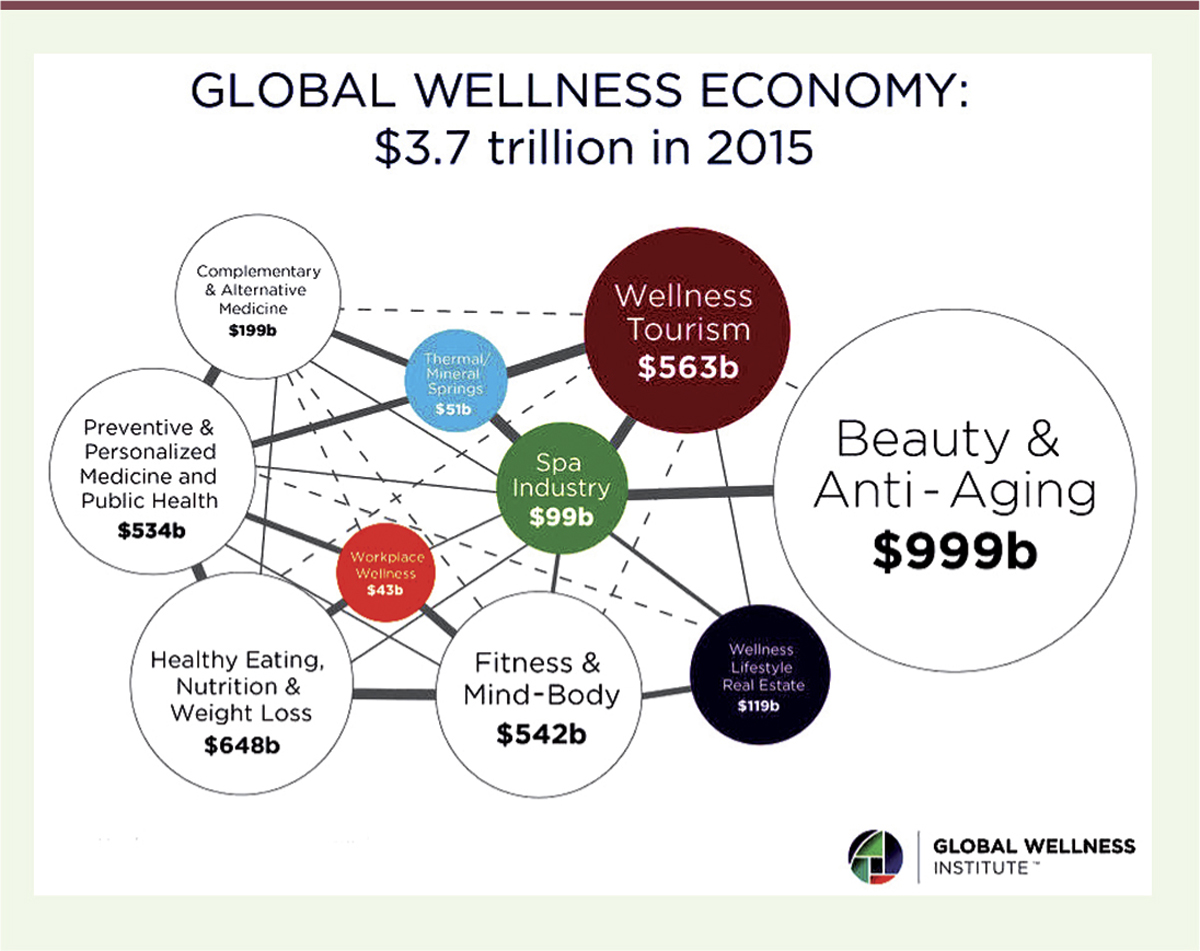
Les tenants et aboutissants d’une stratégie à long terme Malgré son apparente démesure, ce projet doit être pris au sérieux. Les scientifiques impliqués dans Grail sont de toute première catégorie (citons par exemple José Baselga et Richard Klausner5), et ils ne sous-estiment pas les difficultés de la tâche, bien présentées par eux dans un récent article de la revue Cell [9]. Il semble aussi que leur levée de fonds soit bien partie, ce qui peut être attribué à l’ambiance technophile qui règne actuellement dans le secteur de la santé aux États-Unis (avec le lancement de Human Longevity ou de Calico) et au succès médiatique de la Wellness Industry (Figure 1). Il s’agit de l’idée qu’en suivant en détail les paramètres biologiques d’une personne et en accumulant des Go de données traités par des programmes sophistiqués faisant une grande part à l’intelligence artificielle, on va pouvoir détecter très tôt les anomalies et les rectifier par un traitement adapté : le projet annoncé par Grail s’inscrit tout à fait dans cette optique.
 | Figure 1.
Une vision de la Wellness Economy. b : billion (milliard) ; trillion : mille milliards. Source : Global Wellness Institute (https://www.globalwellnessinstitute.org/). |
Il s’accompagne d’une modification, qui n’est pas anodine, des rapports entre Illumina et Grail. Rappelons qu’au départ cette dernière était une émanation d’Illumina, qui détenait près de la moitié de son capital, et que les liens entre les deux firmes étaient très étroits : un des avantages compétitifs avancés lors de la création de Grail était l’accès à bas coût aux dernières avancées technologiques d’Illumina, lui permettant de réaliser des analyses très poussées à un coût abordable – rappelons aussi que l’on annonçait un test coûtant moins de mille dollars. La levée de fonds en cours s’accompagne d’une dissociation entre les deux firmes, qui restent certes amies mais dont la relation devient plus proche d’un rapport fournisseur/client classique. C’est tout bénéfice pour Illumina qui gagne dans l’affaire (si la levée de fonds réussit, ce qui est probable) un client qui va faire l’achat de nombreuses machines, tout en prenant à sa charge le risque d’échec dans le développement du test de dépistage. Cette séparation a une autre conséquence, moins évidente mais tout aussi importante. Lors du lancement de Grail, il avait été très clairement indiqué que l’objectif était la mise au point et la commercialisation d’un test de dépistage, et que l’entreprise ne s’impliquerait pas dans le suivi des cancers [4]. Affirmation un peu étonnante, dans la mesure où ce suivi représente une application prometteuse, en voie d’application clinique, et techniquement bien plus facile qu’un dépistage chez des personnes asymptotiques [2] ; mais les firmes déjà présentes dans ce domaine, comme Guardant Health, sont clientes d’Illumina pour leurs séquenceurs : Illumina évitait ainsi de leur faire concurrence via sa filiale Grail. Avec la séparation des deux entreprises, cette restriction n’est plus indispensable… On peut effectivement noter qu’elle n’apparaît plus explicitement sur le site de Grail, alors qu’elle y figurait auparavant en bonne place (Figure 2). Il serait bien étonnant que Grail, qui va investir des centaines de millions de dollars dans une étude très approfondie de l’ADN tumoral circulant poursuivie durant cinq ans sur des milliers de patients et de témoins, n’utilise pas ces résultats pour accéder au seul marché actuellement prouvé de cette technique, le suivi non invasif des cancers en cours de traitement ! Il y a donc fort à parier que l’entreprise développera une activité dans ce secteur certes concurrentiel mais promis à un important développement.
 | Figure 2.
Limitation des objectifs de Grail, figurant à l’origine sur le site de l’entreprise mais aujourd’hui disparus (figure déjà présentée dans la précédente Chronique génomique sur Grail [ 4]). |
|
Une utilité clinique qui reste à prouver Au-delà des obstacles techniques, qui sont importants mais pour lesquels Grail est sans doute l’une des entreprises les mieux placées, et en supposant que ces travaux aboutissent à un test permettant un dépistage du cancer chez des sujets asymptomatiques, il restera à s’assurer que ce dépistage ne fait pas plus de mal que de bien. Les programmes de dépistage du cancer font actuellement l’objet d’intenses discussions, notamment aux États-Unis [10, 11] ; sans aller, comme certains, jusqu’à affirmer que « la preuve n’a jamais été faite que le dépistage sauve des vies »6, [11], on doit noter que les faux positifs sont source d’angoisse et déclenchent des procédures complémentaires (imagerie, biopsie, etc.) coûteuses et génératrices d’une morbidité non négligeable. Il faudrait donc que le test de Grail présente des performances réellement excellentes au niveau de sa spécificité, ce qui va être bien difficile sachant qu’il s’adresse à tout type de cancer et doit donc pouvoir détecter une très large gamme d’anomalies sans pour autant donner trop de fausses alertes, le tout dans une population « tout venant » dans laquelle la proportion attendue de patients (qui s’ignorent) est de l’ordre de 1 à 2 % (incidence totale des cancers par année). Comme le disent les auteurs de l’article de Cell [9], il faudra que la spécificité soit réellement excellente (exquisite specificity). Je ne serais pas étonné si, d’ici un ou deux ans, Grail se positionnait sur le suivi des tumeurs en cours de traitement, et si le lancement d’un test de dépistage « tout venant » se faisait attendre bien au-delà de la fin de la décennie… Le 1er mars 2017, Grail a annoncé avoir déjà levé 900 millions de dollars sur le milliard espéré, confirmant ainsi l’appétence des investisseurs pour ce type de projet. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jordan B. Biopsies liquides, une révolution en cancérologie ? Med Sci (Paris). 2015; ; 31 : :805.–807. 2.
Ignatiadis M, Lee M, Jeffrey SS Circulating tumor cells and circulating tumor DNA: challenges and opportunities on the path to clinical utility . Clin Cancer Res. 2015; ; 21 : :4786.–4800. 3.
Jordan B. Dépistage du cancer : les promesses illusoires de Pathway Genomics . Med Sci (Paris). 2015; ; 31 : :1137.–1139. 4.
Le Jordan B. Graal de Grail est-il un mirage ? Med Sci (Paris). 2016; ; 32 : :417.–420. 5.
Ilie M, Hofman V, Long-Mira E, et al. Sentinel circulating tumor cells allow early diagnosis of lung cancer in patients with chronic obstructive pulmonary disease . PLoS One. 2014; ; 9 : :e111597.. 6.
Church TR, Black WC, Aberle DR, et al. Results of initial low-dose computed tomographic screening for lung cancer . N Engl J Med. 2013; ; 368 : :1980.–1991. 8.
Reilly, M. Liquid biopsies are about to get a billion dollar boost . MIT Tech Review. , January 6., 2017. 9.
Aravanis AM, Lee M, Klausner RD Next-generation sequencing of circulating tumor DNA for early cancer detection . Cell. 2017; ; 168 : :571.–574. 10.
Esserman LJ, Thompson IM, Reid B, et al. Addressing overdiagnosis and overtreatment in cancer: a prescription for change . Lancet Oncol. 2014; ; 15 : :e234.–e242. 11.
Prasad V, Lenzer J, Newman DH Why cancer screening has never been shown to save lives and what we can do about it . Br Med J. 2016; ; 352 : :h6080.. |