| |
| Med Sci (Paris). 33(3): 351–354. doi: 10.1051/medsci/20173303026.Un mécanisme d’activation cystéine-dépendant pour les ligands pro-inflammatoires de RAGE ? Laure Yatime1* 1Laboratoire de dynamique des interactions membranaires normales et pathologiques (DIMNP) - UMR5235, CNRS, Inserm, université de Montpellier, place Eugène Bataillon, bâtiment 24 cc.107, 34095, Montpellier Cedex 5, France |
RAGE, un récepteur multi-ligands spécialisé dans la reconnaissance de dangers endogènes Notre système immunitaire inné possède une machinerie complexe et diversifiée pour détecter le non-soi et le soi altéré, enclenchant une réponse appropriée qui permettra leur élimination de notre organisme et le retour à l’homéostasie. Cette machinerie repose entre autres sur des récepteurs spécifiques appelés PRR (pattern recognition receptors) capables de reconnaître des motifs moléculaires associés à un danger d’origine pathogène (PAMP pour pathogen-associated molecular patterns) ou endogène (DAMP pour damage-associated molecular patterns) [1] (→).
(→) Voir la Nouvelle de J. Claverie et al., m/s n° 4, avril 2016, page 335
Parmi ces PRR, RAGE (receptor for advanced glycation end-products) est un récepteur transmembranaire exprimé à la surface de nos cellules qui reconnaît des molécules de danger exclusivement endogènes (DAMP) libérées dans le milieu extracellulaire dans un contexte pathologique précis. Les premières recherches qui ont conduit à la découverte de RAGE, au début des années 1990, l’ont identifié comme le récepteur des produits de glycation avancée (AGE, advanced glycation end-products) [2]. Les AGE correspondent à des protéines modifiées par glycation [12] (→), cette modification entraînant l’altération des fonctions cellulaires qu’elles orchestrent. Ce phénomène survient irréversiblement avec l’âge mais il est également renforcé par la présence d’un fort taux de glucose dans le sang. Il favorise ainsi l’apparition de complications sévères, notamment chez les personnes atteintes de la maladie d’Alzheimer ou chez les diabétiques. Au cours des vingt dernières années, un large répertoire de ligands de RAGE a été caractérisé incluant la protéine HMGB1 (high mobility group box 1), plusieurs membres de la famille des protéines S1001 ou encore les peptides amyloïdes β [3]. Le trait commun à tous ces ligands est que leur présence dans le fluide extracellulaire est conditionnée par la pathologie qui sous-tend leur formation et/ou leur surexpression (cancers pour les protéines S100, septicémie ou cancer pour HMGB1, maladies neurodégénératives pour les peptides amyloïdes β, diabète pour les AGE). RAGE est ainsi capable de détecter des signaux de danger multiples associés à des pathologies humaines très variées [3].
(→) Voir la Synthèse de S. Jaisson et al., m/s n° 2, février 2017, page 176
|
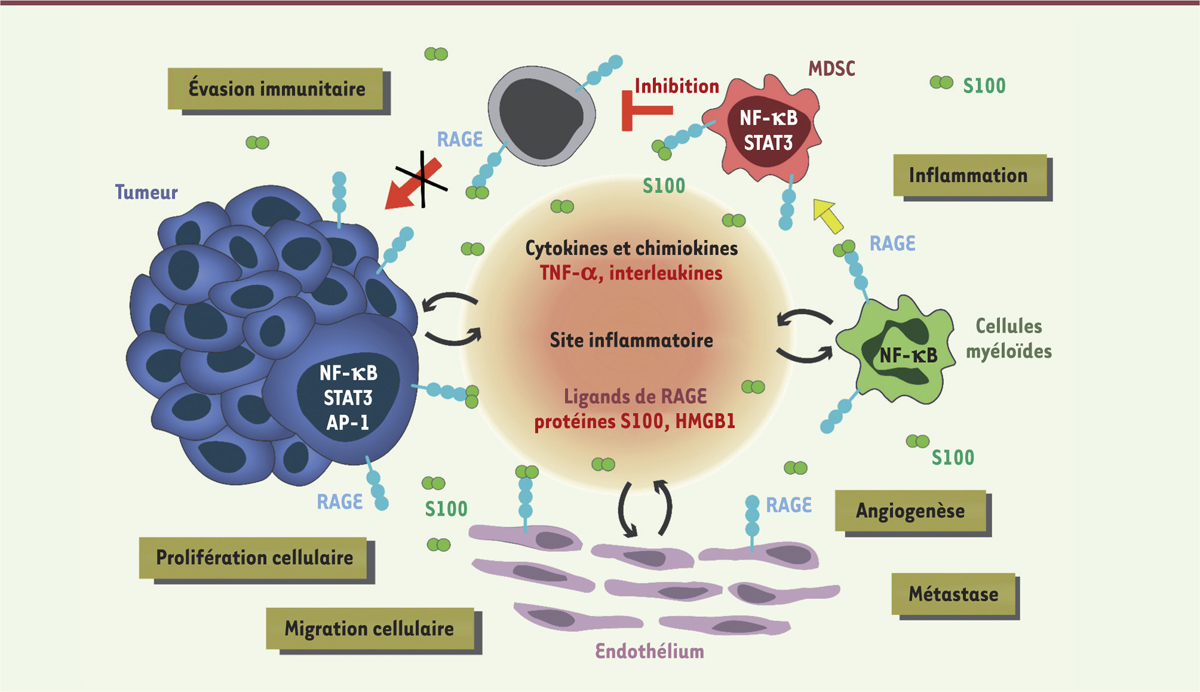
RAGE, le « Dr Jekyll et M. Hyde » de l’inflammation La reconnaissance de ces DAMP par RAGE enclenche des cascades de signalisation intracellulaires liées à différentes kinases, le résultat final étant l’activation de facteurs de transcription et la surexpression de gènes codant des cytokines pro-inflammatoires [4]. Loin de conduire à une réponse immunitaire salvatrice, ce phénomène inflammatoire se retrouve exacerbé par la surexpression à la fois de RAGE et de ses ligands. Une boucle d’amplification est ainsi créée et la multiplication des interactions entre RAGE et ses ligands permet de maintenir un état inflammatoire soutenu qui peut conduire à une inflammation chronique et qui, dans tous les cas, favorise la progression pathologique [3, 4]. Les interactions entre RAGE et S100 sont ainsi particulièrement néfastes dans le microenvironnement tumoral (Figure 1). La surexpression d’une dizaine de membres de la famille des protéines S100 a été mise en évidence dans différents types de cancers (côlon, prostate, poumons, sein, etc.) [5]. Cette surexpression est associée à des phénotypes incluant la croissance tumorale, l’angiogenèse, la métastase ou encore l’évasion immunitaire, par des mécanismes dépendant de RAGE [5, 6]. RAGE et les protéines S100 sont par conséquent considérés comme des cibles prometteuses pour le développement de nouvelles thérapies anti-cancéreuses [5].
 | Figure 1.
Effet délétère des interactions RAGE:S100 dans le microenvironnement tumoral. RAGE (receptor for advanced glycation end-products) est présent sur les différents types de cellules recrutées dans le microenvironnement tumoral (cellules tumorales, immunitaires et endothéliales). Les protéines S100, surexprimées en contexte cancéreux et libérées dans le milieu extracellulaire, interagissent alors avec leur récepteur, déclenchant des voies de signalisation intracellulaires qui activent plusieurs facteurs de transcription (NF-κB : nuclear factor-kappa B ; STAT3 : signal transducer and activator of transcription 3 ; AP1 : activator protein 1). Cette signalisation conduit à la production de molécules pro-inflammatoires et/ou pro-tumorigènes et contribue ainsi au maintien de l’inflammation et au développement de la tumeur. Les propriétés chimiotactiques des protéines S100 favorisent également l’angiogenèse, la migration tumorale et, finalement, l’apparition de métastases dans des organes distants. Enfin, certaines protéines S100 induisent la différenciation des cellules myéloïdes en MDSC (myeloid-derived suppressor cells). Ces dernières inhibent les lymphocytes T et NK (natural killer), permettant à la tumeur d’échapper au système immunitaire. TNF-α : tumor necrosis factor α ; HMGB1 : high mobility group box 1. |
Toutefois, plusieurs études récentes ont montré un rôle potentiellement bénéfique des interactions RAGE:S100 dans certains contextes cellulaires [4]. La signalisation en aval de RAGE semble ainsi atténuer la progression tumorale dans certains cancers des poumons ou de l’œsophage [4]. De même, RAGE a un effet protecteur dans les cellules neuronales ou dans les cardiomyocytes [4]. L’effet pro- ou anti-inflammatoire des interactions RAGE:S100 semble donc dépendre à la fois de la protéine S100 considérée, de l’intensité du signal transmis et du type de cellules activées. Un modèle beaucoup plus complexe se dessine désormais dans lequel l’axe RAGE:S100 intervient à la fois dans la propagation et la résolution de l’inflammation sans que les mécanismes gouvernant l’une ou l’autre de ces fonctions ne soient encore compris à ce jour. La mise en place de stratégies de ciblage thérapeutique efficaces nécessite donc d’élucider les mécanismes moléculaires précis qui induisent une activité pro-inflammatoire pour les complexes RAGE:S100. |
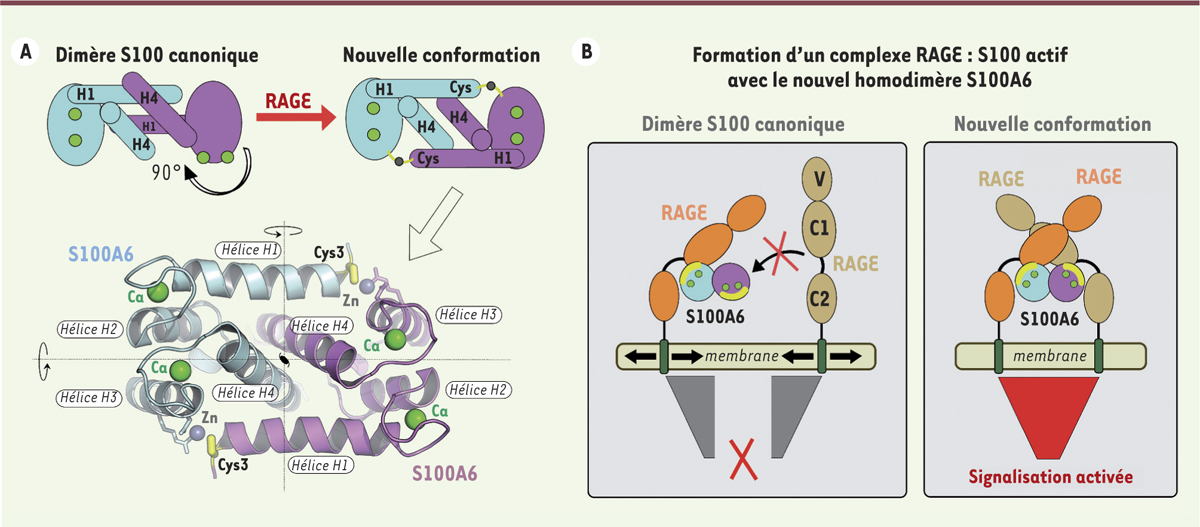
Une forme homodimérique atypique des protéines S100 responsable de l’interaction avec RAGE L’une des approches possibles pour appréhender cette question est de tenter d’identifier des différences à l’échelle moléculaire entre les complexes RAGE:S100 qui présentent des activités pro- et anti-inflammatoires. Plusieurs études de caractérisation structurale ont été conduites sur ces complexes. Ces études ont cependant été limitées, jusqu’à présent, à des domaines isolés du récepteur, notamment le domaine N-terminal qui est le plus éloigné de la membrane. Ces études ne permettent donc pas de comprendre comment le signal est relayé à la membrane et d’extrapoler un mécanisme de signalisation précis en l’absence d’un ectodomaine2 entier. Nous avons récemment déterminé la première structure cristallographique d’un complexe RAGE:S100 englobant le domaine extracellulaire entier du récepteur [7]. Cette structure a révélé un complexe de stœchiométrie 2 : 23 au sein duquel deux molécules de RAGE interagissent de manière symétrique avec la protéine S100A6, un membre de la famille S100, présente sous forme homodimérique. On sait depuis longtemps que l’unité fonctionnelle minimale des protéines S100 est un homodimère et que la liaison aux ligands/récepteurs spécifiques de ces protéines dépend du calcium, chaque monomère S100 devant fixer deux ions Ca2+ pour être en conformation active [8]. Plus de 160 structures de protéines S100 sont actuellement disponibles à la PDB (Protein data bank)4 et elles contiennent toutes le même arrangement homodimérique dans lequel les hélices H1 et H4 de chaque monomère s’organisent de manière antiparallèle avec l’hélice équivalente du monomère opposé (Figure 2A, en haut à gauche). Cet homodimère canonique a été observé dans toutes les structures de protéines S100 obtenues à ce jour, que ce soit par cristallographie ou par résonance magnétique nucléaire, que la protéine soit libre ou complexée à des ions divalents et/ou des fragments de ligands. De manière surprenante, la structure du complexe RAGE:S100A6 que nous avons obtenue révèle une organisation tridimensionnelle de l’homodimère S100A6 radicalement différente de celle du dimère canonique et dans laquelle l’entrelacement des hélices N- et C-terminales de chaque monomère a été modifié de manière à obtenir un homodimère présentant une symétrie d’ordre 2 (Figure 2A, en haut à droite). Cette nouvelle conformation est stabilisée par deux ions Zn2+ qui sont coordonnés de manière symétrique par la cystéine N-terminale de chaque monomère et deux autres acides aminés du monomère opposé (Figure 2A, en bas). Ces deux sites zinc jouent ainsi le rôle de loquets et permettent de fixer le nouvel homodimère dans une conformation rigide.
 | Figure 2.
Une nouvelle conformation pour l’homodimère S100A6 stabilisée par un mécanisme cystéine-dépendant. A. Représentation schématique de la conformation homodimérique canonique des protéines S100 (à gauche) et de la nouvelle conformation obtenue pour l’homodimère S100A6 en présence de RAGE (à droite). Les ronds verts indiquent la position des sites de liaison du calcium. La nouvelle conformation homodimérique pour la protéine S100A6 humaine, observée dans la structure cristallographique du complexe RAGE:S100A6 déterminée à 2,4 Å de résolution [ 7], est représentée en-dessous du schéma. Cette conformation est stabilisée par la présence de deux ions Zn 2+ qui sont coordonnés de manière symétrique par la cystéine (Cys) N-terminale de l’un des monomères et par une arginine et un aspartate du monomère opposé. B. Modèle illustrant comment la nouvelle conformation du dimère S100A6 permet de recruter deux molécules de récepteur parallèlement à la membrane et de bloquer la position relative de leurs régions transmembranaires à une distance qui semble compatible avec le recrutement de molécules effectrices à l’intérieur des cellules. Le site de liaison à RAGE sur chaque monomère S100A6 est indiqué par un arc jaune tandis que les ions calcium sont représentés par des ronds verts. RAGE : receptor for advanced glycation end-products. |
Cette nouvelle conformation de S100A6 semble cruciale pour former un complexe RAGE:S100 actif pour la transmission du signal à travers la membrane, c’est-à-dire capable d’activer la signalisation intracellulaire RAGE-dépendante. En effet, la nouvelle conformation homodimérique de S100A6 permet d’exposer les deux sites de liaison à RAGE présents sur chaque monomère sur une même surface de l’homodimère, contrairement au dimère canonique (Figure 2B). Ceci permet de recruter deux molécules de RAGE présentes sur une même cellule et orientées similairement par rapport à la membrane plasmique. RAGE adopte ainsi une organisation quaternaire distincte de celle observée pour le récepteur libre qui s’auto-associe via son domaine N-terminal, un domaine immunoglobuline de type variable (domaine V) [9]. Ce réarrangement permet de rapprocher les régions proximales à la membrane des deux molécules de récepteur et de fixer leur distance respective à 60 Å. Nous avons proposé que cette distance, qui coïncide avec la largeur de plusieurs des protéines adaptatrices recrutées par le domaine cytoplasmique de RAGE, soit la distance clé qui permette de positionner correctement les domaines cytoplasmiques de deux molécules de RAGE, assurant ainsi la transmission effective du signal dans la cellule [7]. |
Vers un mécanisme général d’activation cystéine-dépendant ? Notre étude a montré que la forme de S100A6 qui semble capable de former un complexe de signalisation actif avec RAGE est stabilisée par un mécanisme cystéine-dépendant. De manière intéressante, un autre ligand de RAGE, la protéine HMGB1, peut adopter différentes formes selon que ses deux cystéines intramoléculaires sont réduites ou associées via un pont disulfure. Pour HMGB1, seule la forme stabilisée par une liaison entre deux cystéines intramoléculaires (pont disulfure) est capable d’induire une réponse neuro-inflammatoire après stimulation de cellules microgliales par le LPS (lipopolysaccharide) bactérien [10]. D’autres protéines S100 sont également capables de former des homodimères stabilisés par des ponts disulfures, notamment S100A4, avec des propriétés inflammatoires distinctes des formes réduites [11]. Ces formes pourraient être favorisées dans l’environnement extracellulaire, plus oxydatif et plus riche en ions divalents que le milieu intracellulaire. D’autres études seront nécessaires pour déterminer si ce mécanisme d’activation est un phénomène généralisé permettant d’induire des propriétés pro-inflammatoires pour les ligands de RAGE. S’il était avéré, ce mécanisme pourrait permettre de développer des stratégies de ciblage des interactions RAGE:ligands limitées aux seuls complexes pro-inflammatoires et donc beaucoup plus efficaces. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Claverie J, Teyssier L, Brulé D, et al. Lutter contre les infections bactériennes : le système immunitaire des plantes est aussi très efficace ! Med Sci (Paris). 2016; ; 32 : :335.–339. 2.
Neeper M, Schmidt AM, Brett J, et al. Cloning and expression of a cell surface receptor for advanced glycosylation end products of proteins . J Biol Chem. 1992; ; 267 : :14998.–15004. 3.
Stern D, Yan SD, Yan SF, et al. Receptor for advanced glycation endproducts: a multiligand receptor magnifying cell stress in diverse pathologic settings . Adv Drug Deliv Rev. 2002; ; 54 : :1615.–1625. 4.
Sorci G, Riuzzi F, Giambanco I, et al. RAGE in tissue homeostasis, repair and regeneration . Biochim Biophys Acta. 2013; ; 1833 : :101.–109. 5.
Bresnick AR, Weber DJ, Zimmer DB. S100 proteins in cancer . Nat Rev Cancer. 2015; ; 15 : :96.–109. 6.
Chen H, Xu C, Jin Q, et al. S100 protein family in human cancer . Am J Cancer Res. 2014; ; 4 : :89.–115. 7.
Yatime L, Betzer C, Jensen RK, et al. The structure of the RAGE:S100A6 complex reveals a unique mode of homodimerization for S100 proteins . Structure. 2016; ; 24 : :2043.–2052. 8.
Donato R, Cannon BR, Sorci G, et al. Functions of S100 proteins . Curr Mol Med. 2013; ; 13 : :24.–57. 9.
Yatime L, Andersen GR. Structural insights into the oligomerization mode of the human receptor for advanced glycation end-products . FEBS J. 2013; ; 280 : :6556.–6568. 10.
Frank MG, Weber MD, Fonken LK, et al. The redox state of the alarmin HMGB1 is a pivotal factor in neuroinflammatory and microglial priming: a role for the NLRP3 inflammasome . Brain Behav Immun. 2016; ; 55 : :215.–224. 11.
Haase-Kohn C, Wolf S, Lenk J, et al. Copper-mediated cross-linking of S100A4, but not of S100A2, results in proinflammatory effects in melanoma cells . Biochem Biophys Res Commun. 2011; ; 413 : :494.–498. 12.
Jaisson S, Desmons A, Gorisse L, Gillery P. Vieillissement moléculaire des protéines : quel rôle en physiopathologie ? Med Sci (Paris). 2017; ; 33 : :176.–182. |